蓝靛果果渣花色苷胶束的制备及其稳定性研究
李 山,张彦龙,曾伟民,刘 洋,赵丹丹, ,贾向前,2,
(1.黑龙江大学生命科学学院,农业微生物技术教育部工程研究中心,黑龙江省寒地生态修复与资源利用重点实验室,黑龙江省普通高校微生物重点实验室,黑龙江哈尔滨 150080;2.黑龙江勃利经济开发区管理委员会博士后科研工作站,黑龙江七台河 154500)
蓝靛果(Lonicera caeruleaL.var.edulis)又名蓝果忍冬、山茄子、黑瞎子果等,属忍冬科、忍冬属、忍冬亚属,被称为“新兴的第三代小浆果之王”[1]。蓝靛果具有多种生物活性物质,包括花色苷[2]、多酚类[3]、黄酮类[4]、维生素、氨基酸、矿物质[5]等。蓝靛果的营养价值[6-8]研究始于20 世纪80 年代,研究表明其果实中含有丰富的花色苷。
作为一种水溶性色素,花色苷还具有抗肿瘤[9-10]、抗氧化[11]、抑菌[12]等多种生理活性。但花色苷易受光照、温度、pH 等因素的影响[13],稳定性较差,限制了其在食品保健以及医药领域的应用[14]。纳米胶束作为药物的载体[15],能够提高花色苷稳定性[16],并通过EPR(Enhanced permeability and retention effect)效应提高抗肿瘤效果[17]。
壳聚糖是一种阳离子多糖,以它为药物递送载体的材料,易于被细胞内吞。同时,壳聚糖能通过活化免疫系统促进人体抗肿瘤作用[18],可与抗肿瘤药发挥协同效果[19]。而将壳聚糖改造后的衍生物拥有着更好的溶解性、生物相容性和稳定性。羧甲基壳聚糖是一种重要的水溶性壳聚糖衍生物,具备良好的生物相容性和生物降解性,相较于壳聚糖而言,羧甲基壳聚糖还具有良好的抗菌性以及水溶性等诸多生理活性和功能特性[20]。Jiang 等[21]研究设计了pH 以及缺氧敏感性对硝基氯甲酸芐酯(NBCF)-羧甲基壳聚糖胶束,该胶束可以缓解肿瘤中HIF-1α和PDL1 的过表达,还可以与H2O2通过Feton 反应释放活性氧,诱导肿瘤细胞毒性。Yan 等[22]制备了一种负载阿霉素(DOX)和脱镁叶绿素A(PHA)的氧化还原反应胶束,通过甘草次酸和聚合物胶束的电荷转换特性延长其在肿瘤部位的停留时间,为图像引导的癌症治疗提供了新的思路。
本研究从蓝靛果果渣中提取、纯化花色苷并通过合成一种新型的组氨酸-硬脂酸-羧甲基壳聚糖(His-SA-CMCS)两亲性纳米胶束载体,以期提高花色苷稳定性及抗肿瘤效果,使果渣废物利用,为后续蓝靛果食药用价值以及纳米载体的研究提供了一定的基础。
1 材料与方法
1.1 材料与仪器
蓝靛果果渣 黑龙江省勃利县野生蓝靛果基地提供;肝癌细胞HepG2 上海中科院细胞库;硬脂酸(SA)、L-组氨酸(L-His)、N-羟基琥珀酰亚胺(NHS)、N,N'-二环己基碳二亚胺(DCC)、4-二甲氨基吡啶(DMAP)、碳二亚胺盐酸盐(EDC)(上述药品均为国产分析纯)、羧甲基壳聚糖(CMCS)(分子量240 kDa,脱乙酰度>90%,取代度90%)上海麦克林生化科技股份有限公司;DMEM培养基 美国Hyclone 公司。
KQ-100DE 型数控超声波清洗器 昆山超声仪器有限公司;BCM-1000 型生物净化工作台 上海玻璃仪器厂;imark-1681130 酶标仪 美国Biorad 公司;DU530 紫外-可见分光光度计 美国Beckman公司;Thermo-3111CO2培养箱 美国Thermo 公司;DP10 型倒置显微镜 日本Olympus 公司;DDS-11A 电导率仪 上海越平科学仪器制造有限公司。
1.2 实验方法
1.2.1 蓝靛果果渣花色苷的提取、纯化 将冷冻的蓝靛果果渣解冻后,粉碎,称取匀浆80 g,参考张聪等[23]方法,进行一定调整,采用料液比1:10,乙醇浓度85%,超声时间40 min,进行超声辅助提取。重复浸提3 次,合并抽滤后的提取液,为花色苷粗提液,随后用聚酰胺树脂进行纯化。
1.2.2 花色苷提取量的测定 采用pH 示差法[24],配制pH1.0 和pH4.5 的缓冲液,分别取1 mL 经稀释后的花色苷提取液加入缓冲液中,室温黑暗条件下混匀静置20 min 后,分别测定在510 和700 nm 处的吸光值,并按如下公式(1)计算含量:
式中:A:pH1.0 条件下510 nm 与700 nm 吸光度之差减去pH4.5 条件下510 nm 与700 nm 吸光度之差;Mw:矢车菊-3-葡萄糖苷的摩尔质量,449.2 g/mol;DF:稀释倍数;V:提取液总体积,mL;ε:矢车菊-3-葡萄糖苷的摩尔消光系数,26900 L·mol/cm;m:称取的蓝靛果质量,g;L:比色皿的光距长度,1 cm。
1.2.3 负载花色苷胶束的制备
1.2.3.1 His-CMCS 的制备 将100 mg 羧甲基壳聚糖溶于15 mL 去离子水中,加入14.3 mg N-羟基琥珀酰亚胺和49.4 mg 碳二亚胺盐酸盐,搅拌1 h 后,再向其中加入14.3 mg L-His,30 ℃条件下,搅拌24 h,随后将样品装入透析袋(截留分子量大于3500 Da)用去离子水透析24 h,所得产物进行真空干燥[25]。
1.2.3.2 His-SA-CMCS 的制备 将真空干燥后的His-CMCS 样品100 mg 溶于20 mL 二甲基亚砜为溶液A,将284.5 mg 的硬脂酸溶于5 mL 二甲基亚砜中,随后加入206.3 mg 的N,N'-二环己基碳二亚胺和146.6 mg 4-二甲氨基吡啶,搅拌2 h 后所得溶液为溶液B。将溶液B 加入到溶液A 中,室温搅拌24 h,随后将样品装入透析袋(截留分子量3500 Da),用去离子水透析24 h。透析后的样品用乙酸乙酯萃取3 次,然后用旋转蒸发仪除去多余的乙酸乙酯,所得产物进行真空干燥。
1.2.3.3 负载花色苷胶束的制备 将His-SA-CMCS溶解在甲醇/二氯甲烷(v/v 2:1)的混合溶液中,将混合物装入圆底烧瓶内,用旋转蒸发仪形成均匀的薄膜,然后放置在通风橱内干燥1 h,随后将用磷酸缓冲盐溶液(PBS)溶解的1 mg/mL 的花色苷溶液加入到圆底烧瓶中,60 ℃水浴震荡水化、超声后,将样品过0.45 和0.22 μm 水系滤膜两次后,即可得到负载花色苷的胶束[26]。
1.2.3.4 花色苷标准曲线的绘制 精确称量纯化后的花色苷溶解在PBS 中配制成1 mg/mL 溶液,用PBS 分别稀释成1 mg/mL、500、250、125、62.5 μg/mL 的溶液,以PBS 为对照,在520 nm 处测定吸光值,得到回归方程:Y=0.001494X+0.05313,决定系数R2=0.9991,表明花色苷在62.5 μg/mL~1 mg/mL 的浓度范围内,花色苷的浓度与吸光度具有良好的线性关系。
1.2.4 负载花色苷胶束制备的单因素实验 选取水浴时间(5、10、15、20、25 min),超声时间15 min,超声温度60 ℃;超声时间(5、10、15、20、25 min),水浴时间10 min,超声温度60 ℃;超声温度(50、55、60、65、70 ℃),水浴时间10 min,超声时间15 min;对负载花色苷胶束的包封率进行研究,包封率测定方法为紫外分光光度法[27]。具体计算公式如下:
1.2.5 响应面试验 在单因素实验结果的基础上,使用Box-Behnken 软件设计响应面试验。将水浴时间(A)、超声时间(B)、超声温度(C)对胶束制备工艺的参数进行优化,每组试验重复3 次,响应值为负载花色苷胶束包封率的平均值。响应面设计因素水平见表1。
1.2.6 负载花色苷胶束的体外释放 称量两份制备好的载花色苷胶束1 mL,分别与1 mL pH5.0 和1 mL pH7.4 的PBS 缓冲液混合后装入透析袋(3500 Da)内,然后在15 mL pH5.0 和pH7.4 的PBS缓冲液内透析并振荡,在预先设计的每个时间点内,吸取3 mL 释放液测定其在520 nm 处的吸光值,对照花色苷标准曲线,计算释放量,然后补入相同体积和pH 的PBS 缓冲液,绘制释放曲线[28]。
1.2.7 临界胶束浓度(CMC)的测定 由于羧甲基壳聚糖在溶液中是带正电荷的多聚电解质,因此采用电导率法测定临界胶束浓度,配制不同浓度薄膜分散法制备的His-SA-CMCS 空白胶束溶液,室温下用电导率仪测定其电导率并记录[29]。
1.2.8 花色苷稳定性的测定
1.2.8.1 光照对花色苷稳定性的影响 用薄膜分散法制备载花色苷胶束,将花色苷溶解于PBS 中,浓度与负载花色苷胶束浓度相同,分别设置避光组和不避光组,每天采用公式(3)测定花色苷含量,共5 d。
式中:C0为样品起始花色苷含量,μg/mL;Ct为处理后t 时花色苷含量,μg/mL。
1.2.8.2 温度对花色苷稳定性的影响 用薄膜分散法制备载花色苷胶束,将花色苷溶解于PBS 中,浓度与负载花色苷胶束浓度相同,在黑暗条件下,将样品置于40、50、60、70、80 ℃下水浴4 h,每小时测定花色苷含量[30]。
1.2.8.3 pH 对花色苷稳定性的影响 用薄膜分散法制备载花色苷胶束,将花色苷溶解于PBS 中,浓度与负载花色苷胶束浓度相同,在黑暗条件下,用1 mol/L 盐酸将样品pH 分别调为2、4、6、8、10,在室温条件下,每小时测定花色苷含量。
1.2.8.4 氧化剂对花色苷稳定性的影响 用薄膜分散法制备载花色苷胶束,将花色苷溶解于PBS 中,浓度与负载花色苷胶束浓度相同,分别向花色苷和载花色苷胶束中加入1% H2O2在黑暗条件下,每15 min测定花色苷含量[31]。
1.2.8.5 还原剂对花色苷稳定性的影响 用薄膜分散法制备载花色苷胶束,将花色苷溶解于PBS 中,浓度与负载花色苷胶束浓度相同,分别向花色苷和载花色苷胶束中加入0.1% Na2SO3,每2 h 测定花色苷含量。
1.2.9 负载花色苷胶束抗肺癌活性的研究 肝癌HepG2 细胞用DMEM 培养基培养到对数期后,用移液枪将细胞接种到96 孔板内,每孔的细胞密度为104个/mL,然后放在培养箱内,37 ℃,5%的CO2条件下培养24 h 后去掉上清液。将用薄膜分散法制备的载花色苷胶束、纯化后的花色苷和DOX 用PBS配制成1 mg/mL 的溶液过0.22 μm 滤膜,然后分别用培养基稀释成50、100、200、400、800 μg/mL 的溶液,空白组为只含培养基的肝癌HepG2 细胞,药物对照组为10 μg/mL 的DOX,每组各重复3 次,在37 ℃,5%的CO2条件下培养24 h,每孔加入10 μL的刃天青钠盐,最后用酶标仪测定在570 nm 处的吸光值。
式中:OD样品为样品组在570 nm 处的吸光值;OD调零为不含细胞只含DMEM 培养基在570 nm 处的吸光值。
1.3 数据处理
所有试验均重复三次,实验数据均以平均值±标准差(means±SD)表示,利用t检验检测各组之间的差异显著性;当P<0.05 时即认为数据之间有显著性差异,当P<0.01 时即认为数据之间有极显著性差异,使用GraphPad Prism 8.3.0 进行回归分析,使用GraphPad Prism 8.3.0 及Origin 2022 对数据分析和作图。
2 结果与分析
2.1 蓝靛果果渣花色苷提取物中花色苷含量测定
按照公式(1),通过紫外分光光度计测量510 nm和700 nm 处的吸光值,计算出花色苷粗提物中的含量为0.942±0.031 g/100 g,纯化后花色苷的含量为4.702±0.037 g/100 g。
2.2 负载花色苷胶束制备的单因素实验
由图1a 可知,水浴时间10 min 前,包封率呈上升趋势,在10 min 后,包封率逐渐下降;由图1b 可知,超声时间在5 和25 min 时包封率相对较低。由图1c 可知,超声温度在50~60 ℃时,包封率随着温度的升高而升高,在60 ℃后,包封率逐渐降低;因此,最佳负载花色苷胶束的制备工艺为水浴时间5~15 min、超声时间10~20 min、超声温度55~65 ℃,并选取以上条件进行响应面优化试验。

图1 负载花色苷胶束制备的单因素实验Fig.1 Single factor test results
2.3 响应面优化花色苷胶束制备工艺
为了确定花色苷胶束薄膜分散法制备的各因素的最佳工艺参数,通过Design Expert 10.0.7 设计响应面优化试验,响应值为花色苷胶束包封率的平均值,共17 组实验,结果见表2。
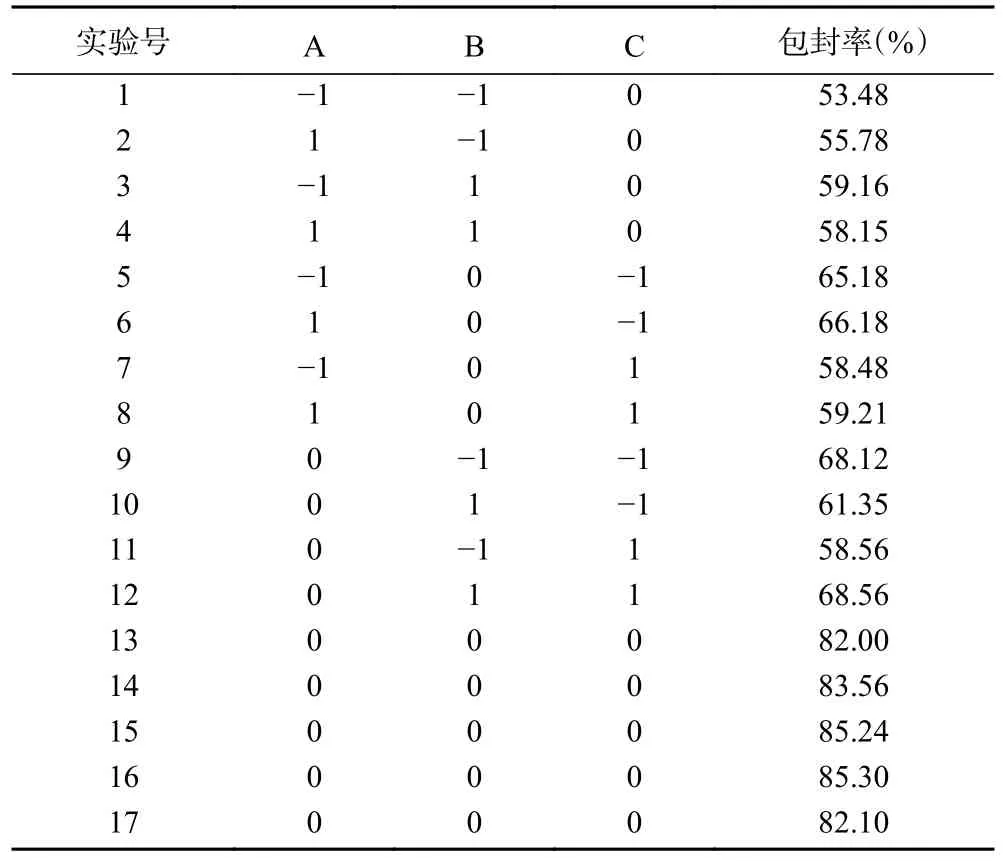
表2 响应面分析试验方案及试验结果Table 2 Response surface analysis test scheme and test results
2.3.1 回归模型的建立及方差分析 通过Box-Behnken 设计响应面优化试验,选择最优的花色苷胶束的制备工艺。使用Design Expert 10.0.7 软件对试验结果进行回归拟合,花色苷胶束包封率对水浴时间(A)、超声时间(B)、超声温度(C)的回归模型方程为:
包封率(%)=83.64+0.3775A+1.41B-2C-0.8257AB-0.0675AC+4.19BC-14.44A2-12.56B2-6.94C2,R2=0.9859,对其二次回归方程的分析及显著性结果见表3。

表3 Box-Behnken 试验设计及回归分析结果Table 3 Box-Behnken experiment design and regression analysis results
从表3 可知,采用Design Expert 10.0.7 软件所建立的数据模型结果的P<0.0001,说明所建立的模型显著性较好,从失拟项的P值为0.25>0.05,结果表明本响应面试验的数据模型拟合度较好,可用于负载蓝靛果果渣花色苷的制备。
2.3.2 响应曲面分析及优化 图2 说明水浴时间、超声时间和超声温度与响应值蓝靛果花色苷包封率之间的关系。使用Design Expert 10.0.7 软件绘制响应面三维曲面图,从图中可以看出每个因素的最佳制备参数及每个参数之间的相互关系,各因素对花色苷胶束的包封率影响程度为:超声温度(C)>超声时间(B)>水浴时间(A)。
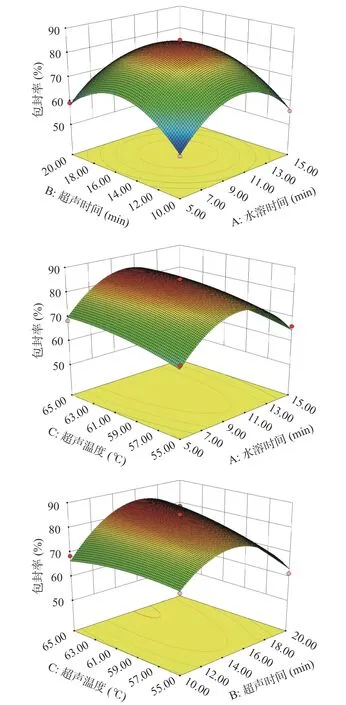
图2 因素A 和B,A 和C,B 和C 响应面分析和等高线图Fig.2 Factors A and B,A and C,B and C response surface analysis and contour map
2.3.3 Box-Behnken 回归模型验证 在使用Box-Behnken 响应面设计和Design Expert 10.0.7 软件数据分析后,得出负载蓝靛果果渣花色苷胶束制备的最佳工艺参数:水浴时间为10.061 min,超声时间15.165 min,超声温度59.329 ℃,在此条件下,通过薄膜分散法制备的胶束的包封率为83.8%。实际工艺条件为:水浴时间10 min,超声时间15 min,超声温度60 ℃,在此工艺条件下,制备的花色苷胶束的包封率为85.3% ±0.31%,与响应面模型的预测值相吻合。
2.4 His-SA-CMCS 空白胶束和负载花色苷胶束的表征
2.4.1 临界胶束浓度(CMC)的测定 通过电导率仪对不同浓度的His-SA-CMCS 胶束溶液的电导率进行测定,以电导率σ和浓度C 作图,拟合得到两个回归方程σ=0.01210C+10.87 和σ=0.002333C+11.55(图3),交点所对应的浓度69.62 μg·mL-1为临界胶束浓度,易形成胶束。
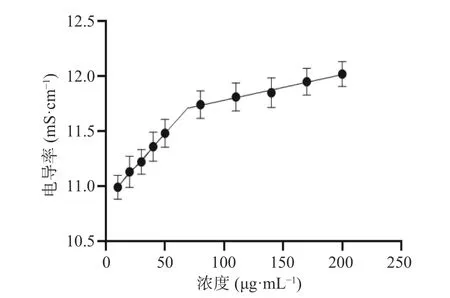
图3 His-SA-CMCS 混合溶液的电导率Fig.3 Conductivity of His-SA-CMCS mixed solution
2.4.2 载花色苷胶束的不同pH 条件下的体外释放率 如图4 所示,在pH5.0 条件下24 h 后,载花色苷胶束的释放液中花色苷释放率达到80.53 %,但在pH7.4 条件下,载花色苷胶束的释放率较低,释放速度较为缓慢。由此可见本研究制备的胶束缓释作用较好,持续释放时间长。
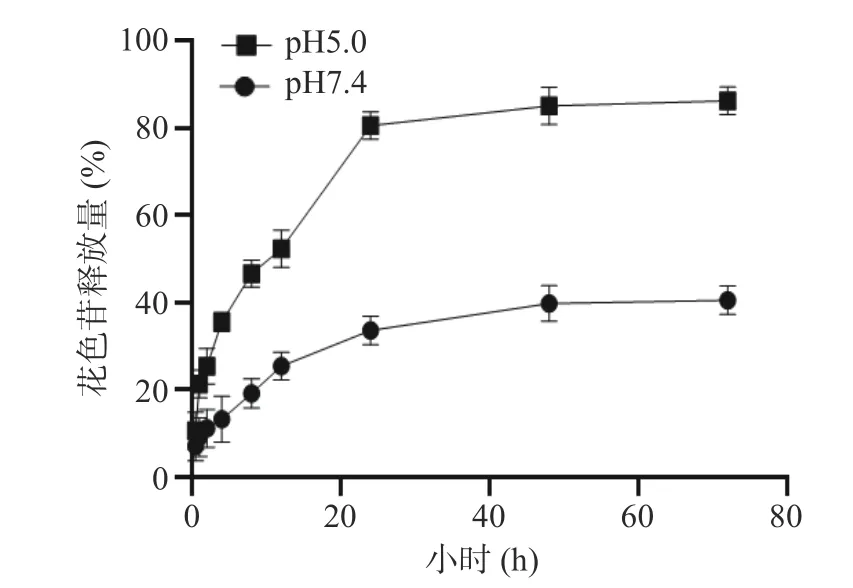
图4 不同pH 条件下载花色苷胶束的体外释药动力曲线Fig.4 In vitro release kinetics of anthocyanin micelles at different pH
2.4.3 花色苷和载花色苷胶束稳定性研究 如图5所示,图5a~图5e 为花色苷和载花色苷胶束在不同温度下1、2、3、4、5 h 花色苷的保存率,随着温度和时间的变化,花色苷保存率不断降低,在70 ℃加热5 h 后,胶束中花色苷保存率比花色苷保存率高25.6%,花色苷胶束较花色苷的保存率为极显著(P<0.01);如图6~图7 所示,在pH、光照、氧化剂和还原剂条件下的实验结果表明,花色苷保存率随着时间的变化逐渐降低;如图7a 所示,在室温光照条件下,5 d 后,载花色苷胶束比花色苷保存率高9.29%,花色苷胶束较花色苷的保存率为极显著(P<0.01);如图7c 所示,在室温条件经氧化剂处理45 min 后,花色苷保存率差值最大,载花色苷胶束比花色苷保存率高12.31%,花色苷胶束较花色苷的保存率存在显著性差异(P<0.05);如图7d 所示,在室温条件经还原剂处理9 h 后,保存率差值最大,载花色苷胶束比花色苷保存率高38.45%,花色苷胶束较花色苷的保存率为极显著(P<0.01)。以上结果说明载花色苷胶束因其特殊的“核-壳”结构,能够使花色苷稳定性显著增加。
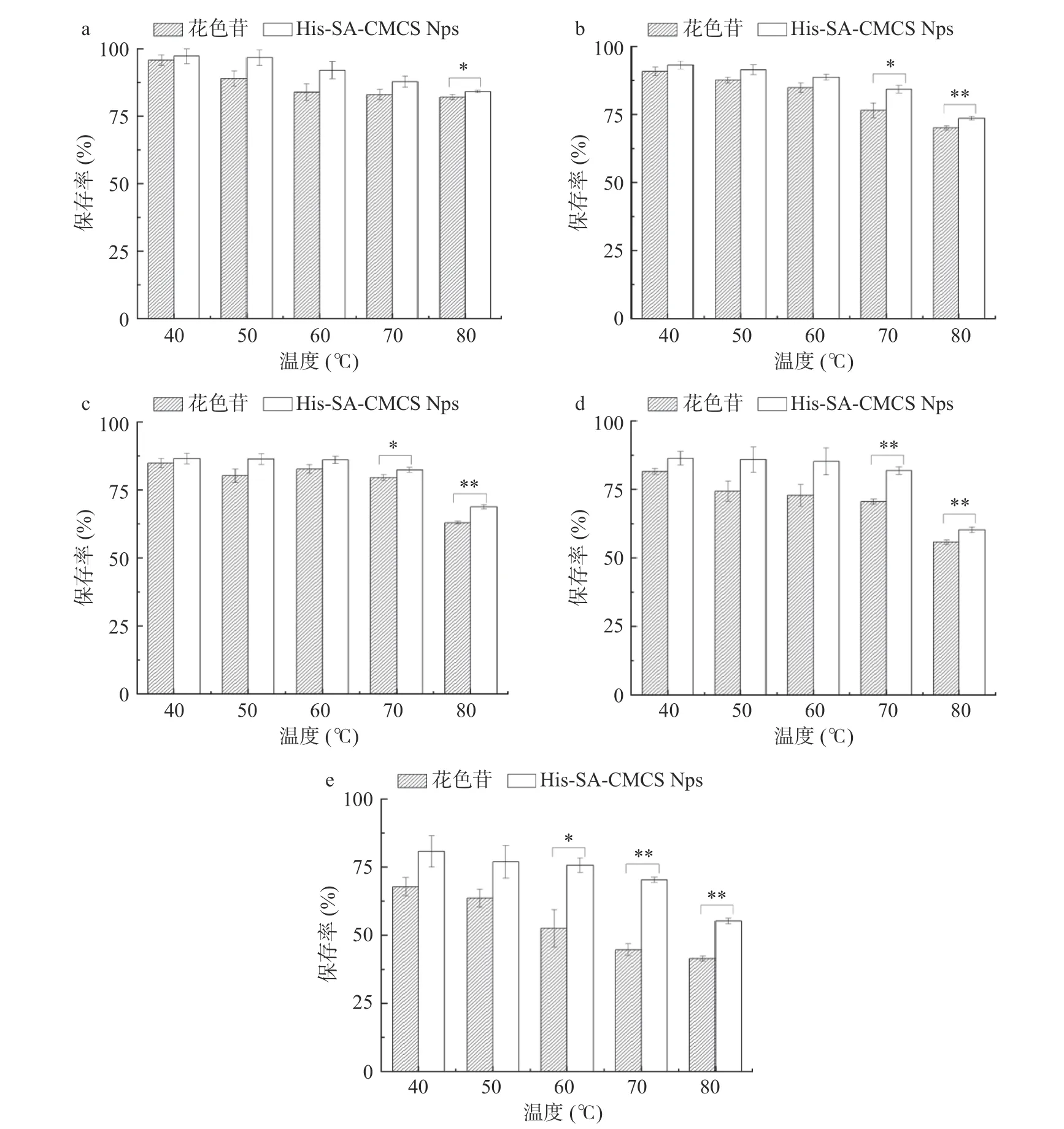
图5 载花色苷胶束和花色苷在40~80 ℃水浴条件下1 h(a)、2 h(b)、3 h(c)、4 h(d)、5 h(e)的花色苷保存率Fig.5 Anthocyanin retention rate of 1 h (a),2 h (b),3 h (c),4 h (d),5 h (e) under 40~80 °C water bath conditions

图6 载花色苷胶束和花色苷在pH2~10 条件下1 h(a)、2 h(b)、3 h(c)、4 h(d)的花色苷保存率Fig.6 Anthocyanin-loaded micelles and anthocyanin preservation rate of 1 h (a),2 h (b),3 h (c),4 h (d) under pH2~10 conditions
2.5 负载花色苷胶束对肝癌HepG2 细胞的杀伤效果
在上药24 h 后,负载花色苷胶束和花色苷对肝癌细胞的杀伤效果如图8 所示,负载花色苷胶束在800 μg/mL 浓度时对肝癌细胞抑制率为55.98%±1.46%,IC50为696.5 μg/mL;同浓度花色苷对肝癌细胞的抑制率为50.76%±0.67%,IC50为1078 μg/mL。相对于花色苷而言,负载花色苷胶束对肝癌细胞有着更好的杀伤效果,并且随着浓度的增加杀伤效果也随之增加。
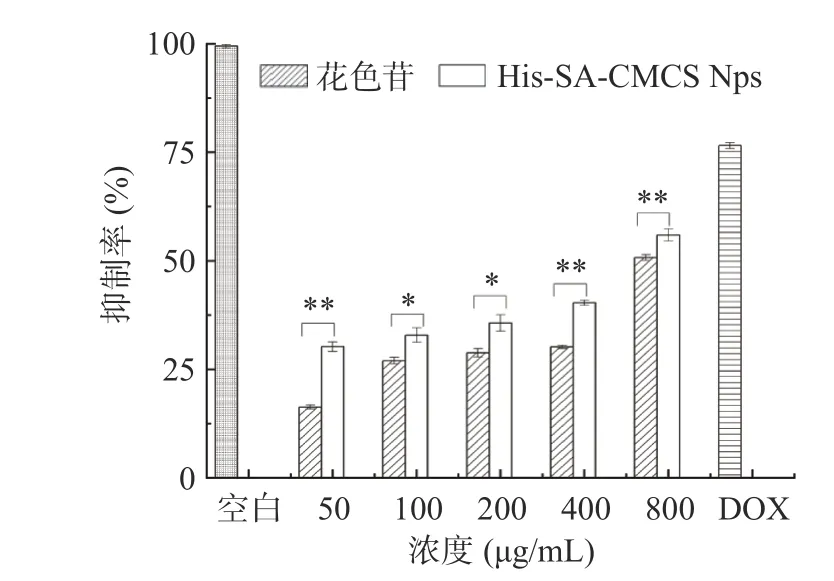
图8 载花色苷胶束和花色苷对肝癌HepG2 细胞杀伤Fig.8 Killing effect of anthocyanin loaded micelles and anthocyanins on HepG2 cells
3 结论
本研究采用超声辅助提取法和聚酰胺树脂层析法对蓝靛果果渣中的花色苷进行提取和纯化,纯化后花色苷含量为4.702±0.037 g/100 g。在薄膜分散法制备载花色苷胶束单因素实验的基础上,使用响应面优化确定水浴时间为10 min,超声时间15 min,超声温度60 ℃为负载花色苷胶束的最优制备工艺,在此工艺下制备的载花色苷胶束包封率为85.3%±0.31%。本研究得到的花色苷纯度较高,制备的负载花色苷胶束具有较高的包封率,从药物释放率结果中可以得出,该聚合物胶束在酸性环境下释放率比中性环境下释放的更快,具有pH 响应性,因此可以靶向肿瘤微环境,并在肿瘤微环境下释放更多的花色苷。从在不同条件下对花色苷和载花色苷胶束稳定性的研究结果中可以得出蓝靛果花色苷共聚物胶束的保存率更好,具有更高的稳定性。并且,载花色苷胶束相较于花色苷而言,具有更好的抗肝癌效果,对蓝靛果的药用价值发掘及研究具有重要意义。

