基于高分辨质谱和网络药理学探究南昆山毛叶红茶的抗炎机理
鲁 森,王 瑞,高 雄,林慧纯,陈忠正,张媛媛,陈旭洁,黄秋颜,李 斌,,林晓蓉,
(1.华南农业大学食品学院,广东广州 510642;2.深圳市质量安全检验检测研究院,广东深圳 518000;3.广东省科学院微生物研究所,广东广州 510070)
茶叶是世界三大无酒精饮料之一,富含茶多酚、咖啡碱、茶氨酸等特殊次生代谢组分,具有“安心、益气、聪察、少卧、轻身、耐老”等保健功效[1]。20 世纪80 年代,中山大学山茶科分类权威张宏达教授在广东省龙门县发现了天然低咖啡碱茶树资源—南昆山毛叶茶(Camellia ptilophyllaChang)[2],不同于普通茶树(Camellia sinensisL.O.Kuntze)以咖啡碱为主要嘌呤生物碱,南昆山毛叶茶不含或仅含少量咖啡碱,但可可碱含量高达3%~7%;而儿茶素类物质以没食子儿茶素没食子酸酯(Gallocatechin gallate,GCG)等反式构象为主[3-4],花青素含量高[5],具有较强的抗炎[6]、抗氧化[7-8]、抗癌[9-10]、降血脂[5]等活性,特别是其红茶、绿茶的抗炎活性均显著强于普通茶树[11-12]。本团队前期研究发现,GCG 等儿茶素是南昆山毛叶绿茶主要的抗炎活性组分,能够有效抑制一氧化氮合成酶和TNF-α、IL-6 等促炎因子的表达,降低炎性介质NO 的产生[12]。但其红茶的抗炎活性组分及其作用机制尚未系统研究。南昆山毛叶红茶通过全发酵工艺加工而成,由于酶促氧化等生化作用,其理化组成明显改变,且多种活性组分间存在复杂的相互作用,因而其抗炎等功能活性的发挥可能存在多靶点、多通路等特点[13-14],仅通过传统的理化分析、细胞模型和分子生物学研究技术,难以全面分析其理化组分,系统揭示其功能特性及相关机制。
超高效液相色谱-高分辨质谱联用技术具有高分离效能、高灵敏度和高分辨率等优势,近年来已成为食品、医药、生物等复杂体系化合物组成分析的有效手段。网络药理学借助计算机和数据库,通过对现有基因、靶点、疾病和药物等信息的分析和模拟,预测药物、靶点、疾病之间的关系,为进一步采用细胞、动物模型及分子生物学等技术,靶向验证药物的作用机制提供依据。基于此,本研究以南昆山毛叶红茶醇提物为研究材料,利用UPLC-Q-Orbitrap HRMS 技术更全面地鉴定其活性组分,通过网络药理学等方法预测其抗炎活性组分、作用靶点及相关信号通路,借助分子对接技术验证主要抗炎活性组分与靶点的结合能力,最后通过脂多糖(Lipopolysaccharides,LPS)诱导的小鼠巨噬细胞RAW264.7 细胞模型验证核心活性组分的抗炎特性,为深入阐释这一珍稀茶树资源的抗炎等功能特性提供前期理论研究基础,为利用高分辨质谱结合网络药理学技术预测茶叶功能特性及作用机制提供借鉴和参考。
1 材料与方法
1.1 材料与仪器
南昆山毛叶茶春梢 1 芽2~3 叶,采自广东省龙门县南昆山同一年份的3~4 月,按全发酵加工工艺制成红茶,磨碎后筛取20~30 目,备用;小鼠巨噬细胞系RAW264.7 美国模式培养物集存库(American Type Culture Collection,ATCC);表儿茶素、表儿茶素没食子酸酯、表没食子儿茶素(Epigallocatechin gallate,EGC)、表没食子儿茶素没食子酸酯、儿茶素、儿茶素没食子酸酯、没食子儿茶素、GCG、没食子酸、可可碱、咖啡碱、茶碱、茶氨酸、茶黄素、茶黄素双没食子酸酯、茶黄素-3’-没食子酸酯、茶黄素-3-没食子酸酯、染料木素、大豆苷、山柰酚、圣草酚、花旗松素、虫草素、芹黄素、高良姜素、杨梅素、白杨素、木犀草素 上海源叶生物技术有限公司;槲皮素、芦丁、半乳糖醇、原花青素 上海麦克林生化有限公司;乙酰丁香酮、3-羟基黄酮、5-羟基黄酮、7-羟基黄酮碱(以上试剂均为色谱纯)、LPS、磺胺、N-(1-萘基)乙二胺二盐碱 Sigma 公司;L-谷氨酰胺 广州昂飞生物科技有限公司;DMEM高糖培养基(含酚红)、青霉素(100 U/mL)/链霉素(100 μg/mL)美国Hyclone 公司;胎牛血清 美国Gibco 公司。
Milli-Q Integral 3 纯水机 德国Merck-Millipore公司;AL204 电子分析天平 梅特勒托利多仪器有限公司;HWS-24 电热恒温水浴锅 上海一恒科学仪器有限公司;Centrifuge 5804R 冷冻高速离心机 德国Eppendorf 公司;Q-Exactive-Ultimate 3000 超高效液相色谱-四极杆-静电场轨道阱高分辨质谱、HERAcell 150i CO2细胞培养箱 美国Thermo Scientific 公司;VersaMax 酶标仪 美国Molecular Devices 公司。
1.2 实验方法
1.2.1 南昆山毛叶红茶活性组分的UPLC-Q-Orbitrap HRMS 分析 参考Zhang 等[15]的方法制备南昆山毛叶红茶醇提物。称取磨碎茶样0.2 g,放入10 mL EP 管中,加入70 ℃的70%甲醇水溶液5 mL,立即移入70 ℃水浴中,浸提10 min(隔5 min 搅拌一次),取出。以转速3500 r/min 离心10 min,用注射器吸取上清液至10 mL 容量瓶。残渣用70%甲醇水溶液重复提取一次。合并上清液,用一级水定容至10 mL,摇匀,用0.22 μm 微孔滤膜过滤,待用。
参考林家正[16]的方法,通过UPLC-Q-Orbitrap HRMS 分析南昆山毛叶红茶醇提物代谢组分。色谱条件:色谱柱为Acquity UPLC T3 柱1.8 μm,2.1×100 mm,Waters,USA。流动相A 为0.1% 甲酸-水,流动相B 为0.1% 甲酸-乙腈,流速:0.4 mL/min;温度:50 ℃;流动相线性梯度洗脱为:0 min,5% B;0.5 min,5% B;18 min,40% B;20 min,90% B;20.9 min,90% B;21 min,5% B;25 min,5% B。进样量体积为3 μL。质谱条件:扫描模式为正离子和负离子电喷雾模式,毛细管电压为3500 V,毛细管温度为300 ℃,鞘气流速设置为45 psi,辅助气温度和流速分别为350 ℃和10 L/min,质谱质荷比扫描范围:70~1000 m/z。
利用Xcalibur 软件和Amdis 软件对原始数据进行处理,将得到的一级质谱数据和二级质谱数据分别与1.1 中标准化合物以及NIST 数据库、mzCloud数据库和HMDB 数据库中的化合物数据进行对比,鉴定南昆山毛叶红茶醇提物的活性组分。
1.2.2 南昆山毛叶红茶抗炎机制的网络药理学预测
利用PubChem 数据库(https://pubchem.ncbi.nlm.nih.gov/)收集已鉴定活性组分的SMILES 号,并导入到Swiss Target Prediction 数据库(http://swisstargetprediction.ch/)预测各组分的潜在作用靶点,合并、去除重复,收集南昆山毛叶红茶的潜在作用靶点。
以“inflammation”为关键词,分别通过人类基因数据库(GeneCards,https://www.genecards.org/),孟德尔遗传代谢数据库(OMIM,https://omim.org/),DisGeNET 数据库(https://www.disgenet.org/)和TTD数据库(http://bid.nus.edu.sg/group/cjttd/)筛选炎症相关的靶点,并将GeneCards 数据库中相关靶点的relevance score 大于平均值的相关靶点和其他3 个数据库的相关靶点合并,去除重复,收集炎症的作用靶点。进而利用Venny 2.1.0 在线网站(https://bioinfogp.cnb.csic.es/tools/venny/index.html)绘制南昆山毛叶红茶潜在作用靶点和炎症靶点的韦恩图,根据交集筛选南昆山毛叶红茶的潜在抗炎靶点。
利用STRING 数据库(https://string-db.org/)对潜在抗炎靶点基因做蛋白相互作用(Protein-protein interaction,PPI)分析,物种选择为“Homo sapiens”,设置置信度(confidence)>0.4,得到蛋白相互作用网络,并将网络导入Cytoscape 3.8.0 软件,利用拓扑学参数确定南昆山毛叶红茶的关键抗炎靶点。
利用计算机R 语言中“ClusterProfiler”、“enrichplot”和“org.s.eg.db”等程序包对交集靶点进行基因注释(Gene Ontology,GO)功能富集和基因组数据库(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路富集。筛选P<0.05 的富集结果,根据富集条目数可视化显示GO 排名前10 的功能和KEGG 排名前20 的通路,预测南昆山毛叶红茶抗炎靶点相关的分子功能和信号通路。
将上述代谢组分、作用靶点、信号通路,导入Cytoscape 3.8.0 软件,建立南昆山毛叶红茶抗炎的“组分-靶点-通路”网络,根据Degree、平均最短路径、介值大小,筛选南昆山毛叶红茶的核心抗炎活性组分。
1.2.3 南昆山毛叶红茶抗炎机制的分子对接验证通过PubChem(https://pubchem.ncbi.nlm.nih.gov/)数据库获得上述核心抗炎组分的2D 结构,导入Chem3D 软件,进行能量最小化处理,得到优化后的3D 结构,作为配体;同时利用RCSB PDB(https://www.rcsb.org/)数据库获得上述关键靶点的3D 蛋白结构,通过PyMOL 软件去除水分子和配体,作为受体;利用AutoDock 软件中的Grid box 功能,设置蛋白原配体为对接盒子中心,并对配体小分子可能发生的区域进行设定;利用AutoDock Vina 分子模拟软件对活性组分配体和蛋白受体进行分子对接分析;利用PyMOL 软件对分子对接进行可视化处理,根据对接结合能评估核心抗炎组分与关键靶点的结合能力,初步验证南昆山毛叶红茶的抗炎分子机制。
1.2.4 南昆山毛叶红茶活性组分体外细胞模型抗炎作用验证
1.2.4.1 细胞培养 RAW264.7 细胞经解冻复苏后,置于含5%的CO2培养箱(37 ℃)中培养,培养液成分为88%的DMEN 高糖培养基(含酚红)、1%的青霉素(100 U/mL)/链霉素(100 μg/mL)溶液、10%的胎牛血清与1%的L-谷氨酰胺(4 mmol/L)。用细胞刮刀刮取细胞继代,每次间隔2~3 d。
1.2.4.2 实验处理及加样 RAW264.7 细胞以5×105个/mL 的浓度接种到96 孔培养板中,每孔细胞液体积为200 μL,于5%的CO2培养箱(37 ℃)中培养24 h。弃去旧培养液,添加100 μL 不同浓度的木犀草素、槲皮素、GCG 和EGC 溶液及100 μL LPS 溶液(终浓度为100 ng/mL),混匀,于37 ℃、5%的CO2培养箱中培养24 h。
1.2.4.3 NO 含量检测 取100 μL 细胞上清液与100 μL Griess 试剂(磺胺:N-(1-萘基)乙二胺二盐碱=1:1)混合,避光放置10 min 后,在542 nm 波长下用酶标仪测定NO 含量。
1.3 数据处理
利用 Excel 及 GraphPad prism 9.0 软件对数据进行统计处理,并利用GraphPad prism 9.0 软件作图,以P<0.05 为差异统计学意义。
2 结果与分析
2.1 南昆山毛叶红茶活性组分鉴定
本研究采用UPLC-Q-Orbitrap HRMS 技术,分别在正、负离子模式下分析南昆山毛叶红茶醇提物组成,其总离子流图如图1 所示。通过与标准品和公开数据库的一级和二级质谱数据比对,共鉴定出活性组分213 种,其中正离子模式下鉴定出160 种,负离子模式下鉴定出53 种。进一步按多酚类、有机酸、黄酮糖苷、生物碱、氨基酸、核苷酸及其他类对活性组分进行分类(表1),多酚类组分占比最高,总数多达76 种。除普通茶树中常见的表没食子儿茶素没食子酸酯等8 种儿茶素和槲皮素、杨梅素、花青素等多酚类组分外,还鉴定出普通茶树不含或含量极低的儿茶素-3,5-二没食子酸酯(gallocatechin-3,5-digallate,GC-3,5-diGA)和1,2,4,6-四没食子酰葡萄糖(1,2,4,6-tetragalloyl glucose,1,2,4,6-GA-glc),以及由GCG 和儿茶素合成的茶黄素-3-没食子酸酯的新型同分异构体[11]。本团队前期研究发现,南昆山毛叶茶多酚总量显著高于云南大叶种,但其儿茶素总量却低于后者,显示南昆山毛叶茶含有更多非儿茶素的多酚类物质[6]。此结果表明,利用高分辨质谱技术,在更全面鉴定出南昆山毛叶红茶醇提物化学组分数量的同时,还鉴定出其特殊组分,为进一步利用网络药理学预测其抗炎活性组分及作用机制提供了物质组成的基础数据。
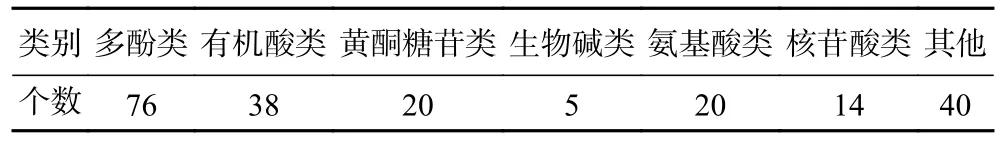
表1 南昆山毛叶红茶醇提物主要活性组分类别Table 1 Categories of metabolic compounds in the methanol extracts of black tea from Camellia ptilophylla

图1 南昆山毛叶红茶醇提物的总离子流图Fig.1 Total ion flow diagram for the methanol extracts of black tea from Camellia ptilophylla
2.2 南昆山毛叶红茶抗炎靶点预测
为初步收集南昆山毛叶红茶的抗炎靶点,首先将上述213 种活性组分的SMILES 号上传至Swiss Target Prediction 数据库,预测其作用靶点并去除重复,共得到920 个潜在作用靶点;同时利用Gene-Cards、TTD、OMIM 和DisGeNET 等4 个数据库收集炎症靶点,共得到3092 个炎症靶点,如图2a 所示。进而利用韦恩图分析炎症靶点与南昆山毛叶红茶活性组分作用靶点的交集靶点,结果如图2b 所示,共获得南昆山毛叶红茶潜在抗炎靶点493 个。
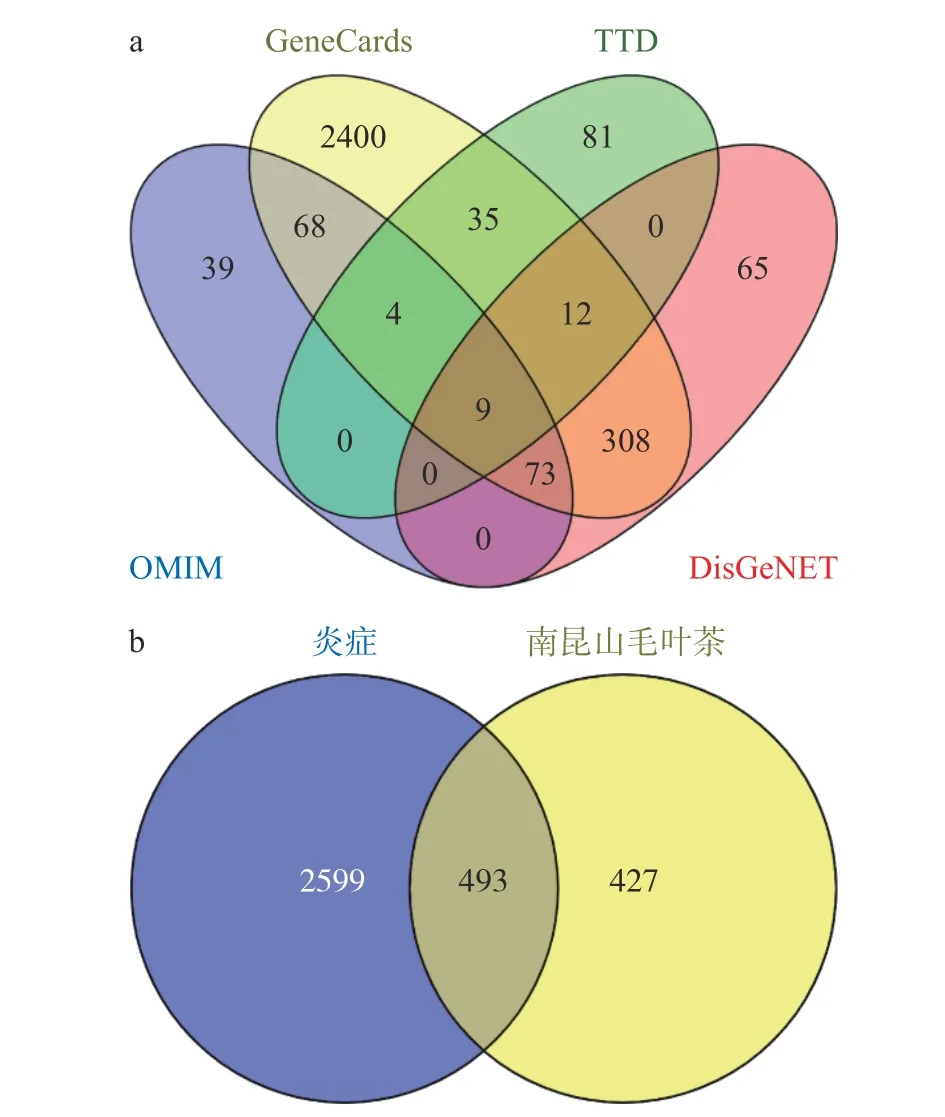
图2 南昆山毛叶红茶抗炎靶点收集Fig.2 Target collection of anti-inflammatory effects of black tea from Camellia ptilophylla
将上述493 个潜在抗炎靶点输入String 平台,得到PPI 网络,将其导入Cytoscape 3.8.0 软件进行网络可视化处理。将连线多、Degree 高的靶点作为关键靶点[17],筛选出排名前30 的靶点作图,结果如图3 所示。进一步筛选Degree>200 的靶点作为南昆山毛叶红茶核心抗炎靶点,共筛选出TNF、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)、苏氨酸蛋白激酶(serine/threonine kinase1,AKT1)、IL-6、白蛋白(albumin,ALB)、肿瘤蛋白p53(Tumor Protein p53,TP53)、血管内皮生长因子A(vascular endothelial growth factor A,VEGFA)、表皮生长因子受体基因(epidermal growth factor receptor,EGFR)、连环蛋白β1(catenin beta 1,CTNNB1)等9 个关键抗炎靶点。
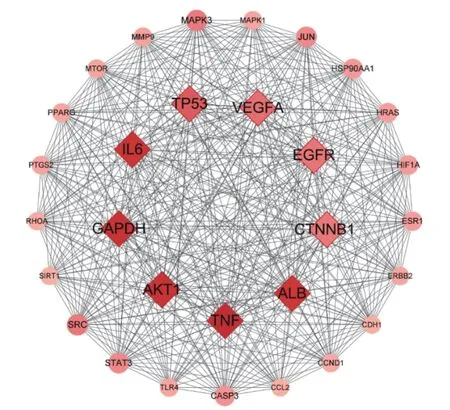
图3 南昆山毛叶红茶抗炎靶点的PPI 网络Fig.3 PPI network for the anti-inflammatory targets of black tea from Camellia ptilophylla
本团队前期利用LPS 诱导的RAW264.7 小鼠巨噬细胞炎症模型研究发现,500 μg/mL 的南昆山毛叶红茶水提物和乙醇/乙酸乙酯提取物对TNF-α产生的抑制率分别为50.63%和81.01%,对IL-6 产生的抑制率高达84.18%和96.75%;在基因转录水平上,南昆山毛叶红茶两种提取物均可下调TNF-α和IL-6 的mRNA 表达,减少促炎介质产生[11,14];抑制LPS 诱导的核转录因子κB(nuclear factor kappaB,NF-κB)信号通路激活[11],说明TNF-α和IL-6 是南昆山毛叶红茶发挥抗炎作用的主要靶点。这与本研究基于网络药理学的预测结果相互印证。此外,已有研究表明,AKT1[18]、GAPDH[19]、ALB[20]、VEGFA[21]、EGFR[22]、CTNNB1[23]、TP53[24]等靶点也是炎症反应的相关作用靶点。这一预测结果表明,南昆山毛叶红茶可能通过多个作用靶点发挥抗炎功能活性。
2.3 南昆山毛叶红茶抗炎靶点的功能与通路分析
为进一步预测南昆山毛叶红茶抗炎活性发挥的分子机制,本研究利用R 语言软件对上述收集的493 个潜在抗炎靶点进行GO 和KEGG 富集分析。GO 分析一共富集了3465 个生物过程、162 个细胞组分和318 个分子功能的相关条目,选取富集结果前10 的相关条目进行可视化处理,结果如图4 所示。由图可知,南昆山毛叶红茶潜在抗炎靶点主要参与丝裂原活化蛋白激酶(mitogenactivated protein kinase,MAPK)级联反应调节、应对肽、氧化应激反应等生物过程,存在于膜筏、膜微结构域、神经元细胞体等细胞组分,主要行使丝氨酸/苏氨酸特异性蛋白激酶活性、肽链内切酶活性、酰胺结合活性等分子功能。表明南昆山毛叶红茶的活性组分可能通过上述途径发挥抗炎活性。富集的生物过程中,MAPK级联反应包括MAPK 激酶激酶、MAPK 激酶和MAPK 3 个顺序激活的蛋白激酶,可通过激活靶因子控制炎症反应,并且MAPK 家族的p38 MAPK 和NF-κB 激酶亚单位β抑制剂磷酸化后可启动炎症因子的转录[25]。氧化应激和蛋白质氧化可由过多的活性氧簇(reactive oxygen species,ROS)引起,而蛋白质氧化会导致过氧化物酶的释放,后者可作为一种炎症信号[26]。另外,由糖尿病引发的氧化应激会提高促炎细胞因子以及NF-κB 水平[27],说明氧化应激与炎症反应密切相关。这些生物过程参与炎症反应,可为后续南昆山毛叶红茶进行抗炎分子机制研究提供理论依据。

图4 南昆山毛叶红茶潜在抗炎靶点的GO 富集分析Fig.4 GO enrichment analysis of the potential anti-inflammatory targets of black tea from Camellia ptilophylla
KEGG 通路分析一共富集了193 条相关通路(图5),显示排名前20 的富集通路包括磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)信号通路、MAPK 信号通路、神经活性配体-受体相互作用通路、脂质和动脉粥样硬化通路、癌症中的蛋白聚糖通路等。本团队前期利用LPS 诱导的RAW264.7 小鼠巨噬细胞炎症模型研究发现,南昆山毛叶红茶提取物可通过下调PI3K-Akt 和MAPK 信号通路抑制炎症反应[11],与本研究利用网络药理学预测的抗炎活性相关分子机制一致。此外,神经疾病和癌症相关通路也被富集为南昆山毛叶红茶抗炎的主要相关通路,已有研究证明,神经疾病患者的血液中炎症因子TNF-α、IL-6 的水平升高[28],并且炎症反应过程中产生的TNF-α等细胞因子可诱导正常细胞癌变,并促进肿瘤细胞增殖和转移[29-30],说明神经疾病和癌症与炎症反应有关,可作为后续深入研究南昆山毛叶红茶抗炎功效的切入点。
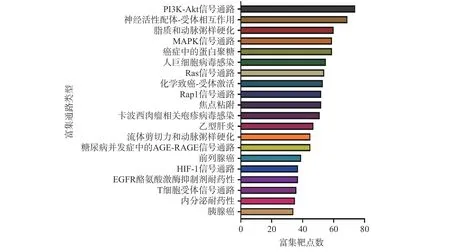
图5 南昆山毛叶红茶潜在抗炎靶点的KEGG 通路富集分析Fig.5 KEGG pathway enrichment analysis of the potential anti-inflammatory targets of black tea from Camellia ptilophylla
2.4 南昆山毛叶红茶核心抗炎活性组分筛选
为进一步预测南昆山毛叶红茶醇提物中对其抗炎功效起作用的关键活性组分,将上述鉴定的213 种活性组分和收集的493 个潜在抗炎靶点,以及KEGG 通路富集分析的前20 条通路导入Cytoscape 3.8.0 软件,建立南昆山毛叶红茶抗炎的“组分-靶点-通路”网络(图6)。该网络包括712 个节点和5777 条边,绿色、红色、紫色节点分别表示组分、靶点、通路,节点的大小显示Degree 的大小。由图6可知,每个节点平均有8.11 条连线,表明组分、靶点和通路之间有较强的联系;以Degree、平均最短路径及介值等拓扑学参数综合评价节点的关键程度,结果如表2 所示。筛选Degree>60 的活性组分作为南昆山毛叶红茶核心抗炎活性组分,排名前16 的有邻苯二甲酸二丁酯、辣椒素、L-茶氨酸、柚皮素、锦葵素、花青素、诺米林、大黄酚、杜鹃素、木犀草素、二氢杨梅素、3-羟基黄酮、芹菜素、异鼠李素、杨梅素、槲皮素,其中14 种为多酚类物质。这一研究结果提示,多酚类物质是南昆山毛叶红茶的核心抗炎组分。
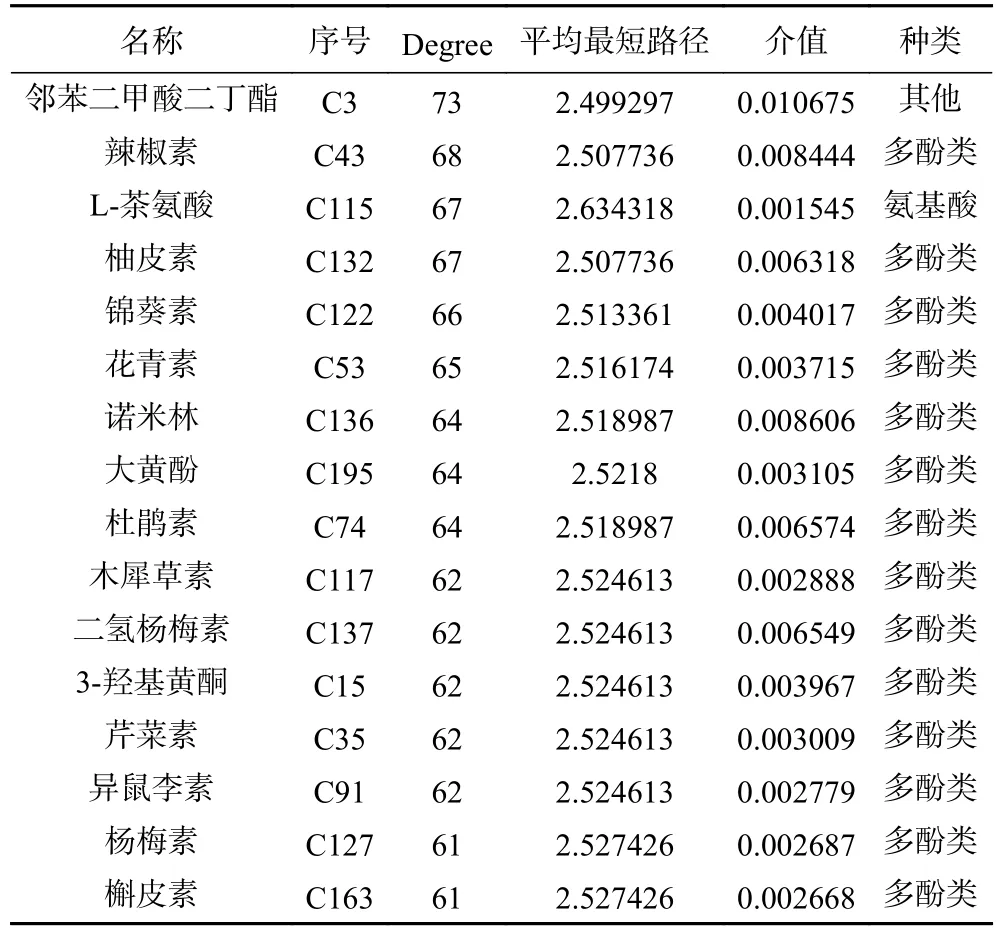
表2 南昆山毛叶红茶关键抗炎活性组分的拓扑学参数Table 2 Topological parameters of the key anti-inflammatory components of black tea from Camellia ptilophylla
多酚类物质广泛存在于各类药用、食用植物中,其可通过抑制参与炎症相关的转录因子和调节酶,在抗炎作用中发挥重要作用[31]。本研究预测的南昆山毛叶红茶核心抗炎组分如木犀草素、槲皮素、花青素等已证明具有抗炎特性[32-34],但这些多酚类物质对南昆山毛叶红茶抗炎活性的“构效”及其“量效”作用还有待进一步研究。
2.5 南昆山毛叶红茶抗炎机制分子对接验证
为初步验证南昆山毛叶红茶的抗炎分子机制,利用分子对接技术评估上述9 个关键抗炎靶点和Degree 排名前9 的抗炎活性组分,以及木犀草素、槲皮素的对接结合能,以非甾体类抗炎药物阿司匹林[35-37]为对照。核心靶点TNF、GAPDH、AKT1、IL6、ALB、TP53、VEGFA、EGFR、CTNNB1 在RCSB PDB数据库的编号分别为5UUI、1U8F、1UNQ、1ALU、6YG9、4MZI、4KZN、5UG8、7AFW。结果由图7 可见,85%以上的活性组分与靶点间的对接结合能都小于-5 kcal/mol;9 种多酚类物质与关键靶点的对接结合能均小于阿司匹林,说明南昆山毛叶红茶的核心抗炎活性组分与关键靶点间亲和力较强[38]。进而,利用PyMOL 软件对AKT1-大黄酚、ALB-杜鹃素、EGFR-辣椒素等8 组对接结合能较低的靶点与组分间的分子对接结果进行可视化处理,从图8 结果可知,大黄酚与AKT1 的LYS-8 和HIS-13 形成氢键,杜鹃素与ALB 的LYS-199 形成氢键,辣椒素与EGFR的MET-793 和CYS-797 形成氢键。说明这些多酚类核心抗炎组分均能通过氢键与关键抗炎靶点的不同氨基酸残基稳定结合。
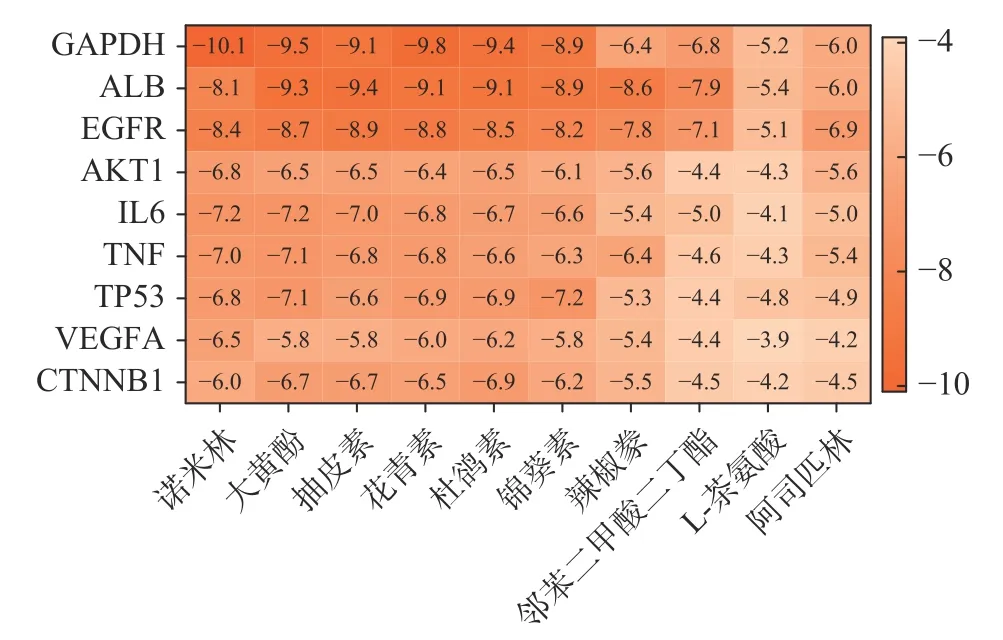
图7 南昆山毛叶红茶核心抗炎活性组分和关键抗炎靶点的对接结合能热图Fig.7 Heat map of the docking binding energy between the key anti-inflammatory components and the key targets of black tea from Camellia ptilophylla
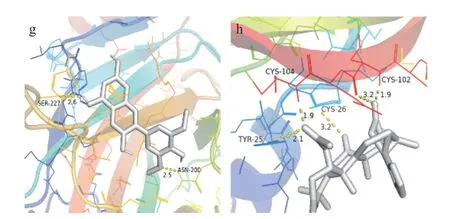
图8 南昆山毛叶红茶核心抗炎活性组分和关键抗炎靶点的分子对接图Fig.8 Molecular docking diagram of the key anti-inflammatory components and the key targets of black tea from Camellia ptilophylla
2.6 南昆山毛叶红茶主要抗炎活性组分的体外细胞模型验证
本研究选取网络药理学预测Degree 值较高的木犀草素(Degree=62)、槲皮素(Degree=61),南昆山毛叶红茶中含量最高的GCG(Degree=29)[6],以及Degree 值较低的EGC(Degree=6)作为验证组分,以LPS 诱导的RAW264.7 体外炎症细胞模型,比较活性组分处理后炎性介质NO 的产生量,以评价其抗炎活力,结果如图9 所示。这四种组分均能抑制NO 的生成,具有抗炎活力,但其抑制NO 生成的IC50值差异较大,木犀草素为18.91 μmol/L、槲皮素为43.76 μmol/L、GCG 为365.6 μmol/L、EGC 为519.4 μmol/L。木犀草素、槲皮素显示了较强的抗炎活性,GCG、EGC 的抗炎活性相对较弱。这一体外细胞系验证结果与网络药理学预测显示了一致的抗炎活力强弱变化趋势。研究表明,木犀草素通过下调p-STAT3 抑制RAW264.7 细胞中IL-6、TNF-α的分泌和炎症因子iNOS、IL-1β的表达,发挥抗炎作用[39];槲皮素通过PTEN/PI3K/JNK 信号通路减轻小鼠巨噬细胞RAW264.7 的炎症[40],但关于GCG 和EGC 对RAW264.7 细胞炎症的影响研究较少。
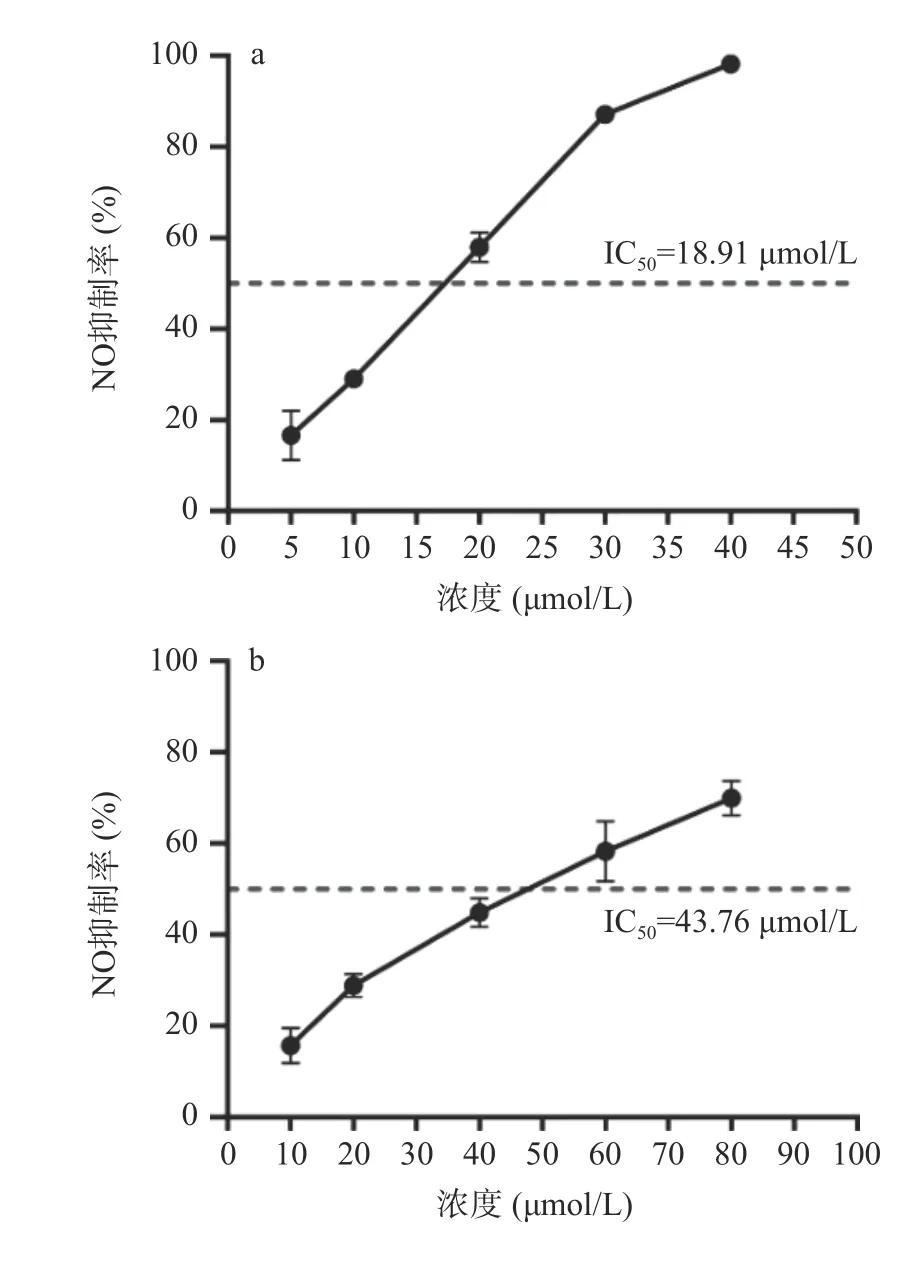
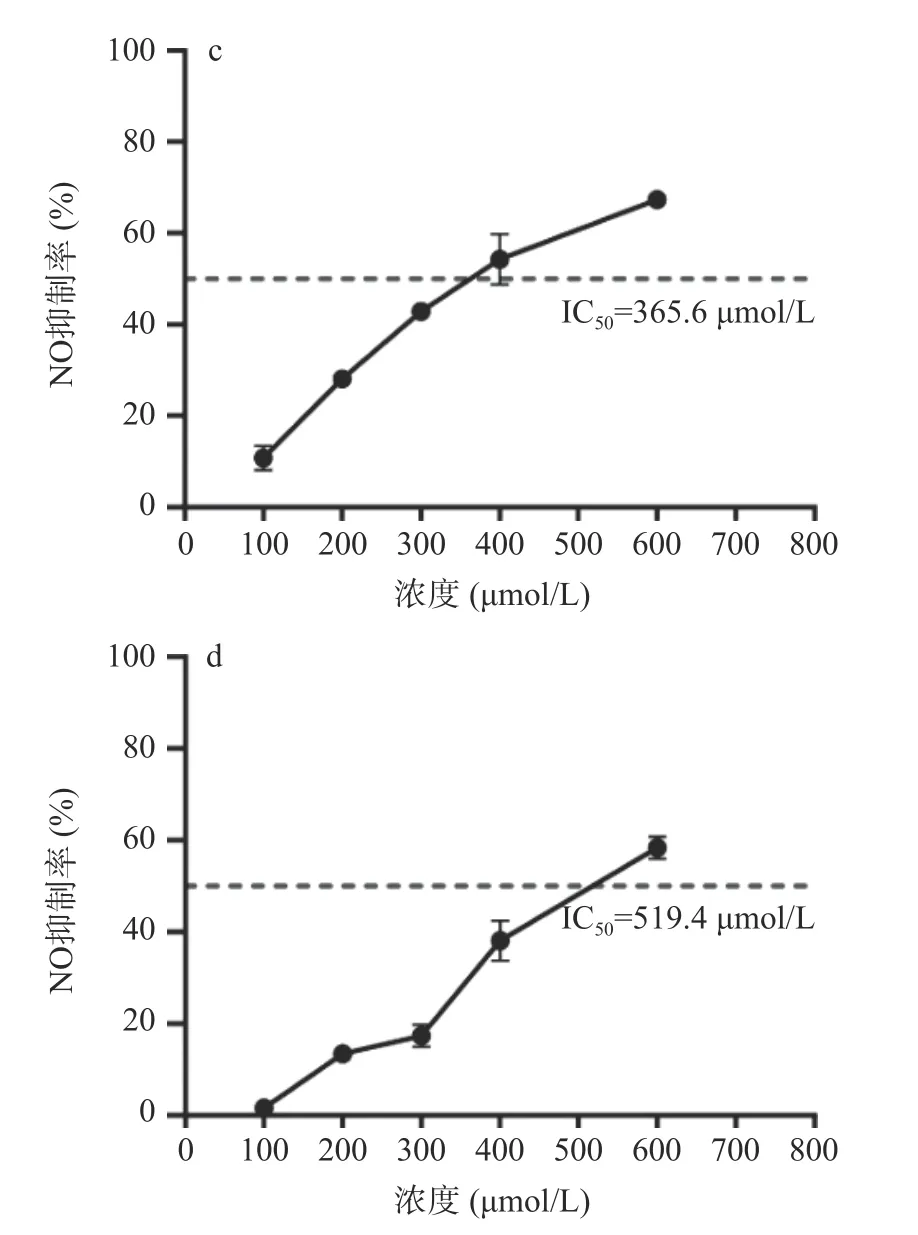
图9 南昆山毛叶红茶核心抗炎活性组分抑制NO 生成效果Fig.9 Inhibitory effects on NO production of the key anti-inflammatory components of black tea from Camellia ptilophylla.
3 结论
本研究利用UPLC-Q-Obitrap HRMS 技术结合网络药理学、分子对接、体外细胞模型等方法,探究了南昆山毛叶红茶发挥抗炎功能的活性组分及分子机制:从南昆山毛叶红茶醇提物中鉴定出213 种活性组分,其中76 种为多酚类组分;预测出TNF、GAPDH、AKT1、IL6、ALB、TP53、VEGFA、EGFR、CTNNB1 等9 个关键抗炎靶点和PI3K-AKT、MAPK等主要抗炎信号通路;构建了南昆山毛叶红茶抗炎“组分-靶点-通路”网络,筛选出木犀草素、槲皮素、邻苯二甲酸二丁酯、辣椒素、L-茶氨酸、柚皮素、锦葵素、花青素、诺米林、大黄酚、杜鹃素等16 种抗炎活性组分;利用分子对接技术验证了木犀草素、辣椒素、柚皮素、槲皮素等9 种多酚组分与关键靶点具有较好的结合力;RAW264.7 体外细胞模型验证了核心活性组分具有较强的抗炎特性。这些研究结果为靶向揭示南昆山毛叶红茶抗炎等功能特性的活性组分和分子机制,深入挖掘这一珍稀茶树资源的健康功效提供了理论研究基础。未来可在南昆山毛叶红茶醇提物的基础上,利用UPLC-Q-Obitrap HRMS 等技术,更全面地鉴定这一特殊资源的活性组分;在构效组分鉴定的基础上,深入开展量效关系的研究,并更全面地对网络药理学预测的南昆山毛叶红茶等茶类的抗炎等功能活性的相关分子机制进行深入的验证研究。

