基于文献计量分析药食同源物质缓解酒精性肝损伤研究进展
向 琴,张国泰,芦润青,唐菁雯,贺思桥,闵 聪,耿敬章
(陕西理工大学生物科学与工程学院,陕西省资料生物重点实验室,陕南秦巴山区生物资源综合开发协同创新中心,秦巴生物资源与生态环境重点实验室,陕西汉中 723000)
酒精性肝损伤(Alcoholic Liver Injury,ALI)是由于长期或大量饮酒所致。研究显示,男性乙醇摄入量≥40 g/d,女性乙醇摄入量≥20 g/ d,超过5 年,或2 周内有暴饮史(乙醇量>80 g/d)即可引起酒精性肝损伤[1]。根据世界卫生组织的报道,全球有20 亿人饮酒,其中超过750 万人存在滥用酒精的现象。长期过量饮酒危害人体健康[2],从全球来看,超过50%的肝硬化相关死亡率可归因于酒精,通常ALI 治疗方式包括酒精戒断、营养补充剂及药物辅助治疗等[3],但长期服用药物会产生一定的副作用,且价格昂贵,治疗范围有限[4]。因此ALI 引发的一系列健康问题已引起人们的重视。
研究发现,药食同源物质具有抗氧化、抗炎、抗衰老等多种活性功能,且毒副作用小[5-6]。目前,药食同源物质对ALI 的研究主要在保肝、治疗、护肝产品开发等方面,且已有多种药食同源制剂或复方制剂、饮料等应用于临床,如葛根饮料[5]、复方轮叶党参[7]、葛根甘草复合制剂[8]等。与西药相比,药食同源物质能通过多靶点、多途径发挥效用,尤其在改善肝脏功能、抗氧化、抗炎保肝和促进乙醇及脂质代谢等方面疗效显著[6],且其安全性较好。因此,从天然物品中提取并探究有效成分来缓解ALI 已成为一个亟待研究的课题。为更好地了解国内外有关药食同源物质缓解ALI 领域的研究热点和研究动态,本文采用文献计量学方法,以CNKI、WOS、PubMed 数据库为基础,利用VOSviewer 及Endnote 等工具,对自建库起至2022 年的中、英文文献进行定量分析。分析发文量随年份的变化,同时通过关键词聚类方法分析药食同源物质缓解ALI 的研究热点,从而系统性整理、综述部分药食同源物质缓解ALI 的研究现状。
1 数据来源及研究方法
1.1 数据收集
文献数据来源途径如表1 所示。文章基于CNKI、WOS、PubMed 数据库,并结合人工逐一检查,以“酒精肝损伤”、“Alcoholic Liver Injury”为主题检索到论文共计2528 篇,以“酒精肝损伤”为主题检索到国内外专利申请为599 项,其中筛选出对ALI 具有缓解作用的药食同源物质及其提取物与相关成分方面的文献,共计中英文文献418 篇,中英文专利276 项。

表1 文献数据来源Table 1 Sources of bibliographic data
1.2 研究方法
运用文献计量法。文献收集后,用Endnote 建立数据库对文献进行信息整理[9];使用VOSviewer进行可视化图谱制作。从发文量随年份变化、研究热点对药食同源物质缓解ALI 相关文献进行梳理,分析其研究现状、热点及趋势。
2 结果与分析
2.1 药食同源物质缓解酒精性肝损伤研究文献量的年代分布
2000~2022 年药食同源物质缓解ALI 的研究文献量随年份分布趋势如图1 所示,中文文献量显著高于英文文献量。就宏观视角而言,中文文献量随年份分布呈指数型上升趋势,而英文文献量随年份分布的态势较为缓慢;就微观视角而言,2000~2006 年间的发文量表现出缓慢增加的态势;随着经济、科研技术的发展,人们对药食同源物质及ALI 的关注提升,发文量于2007~2022 年显著增长,总发文量329 篇,年均发文量达21.93 篇,较之前有质的提升。
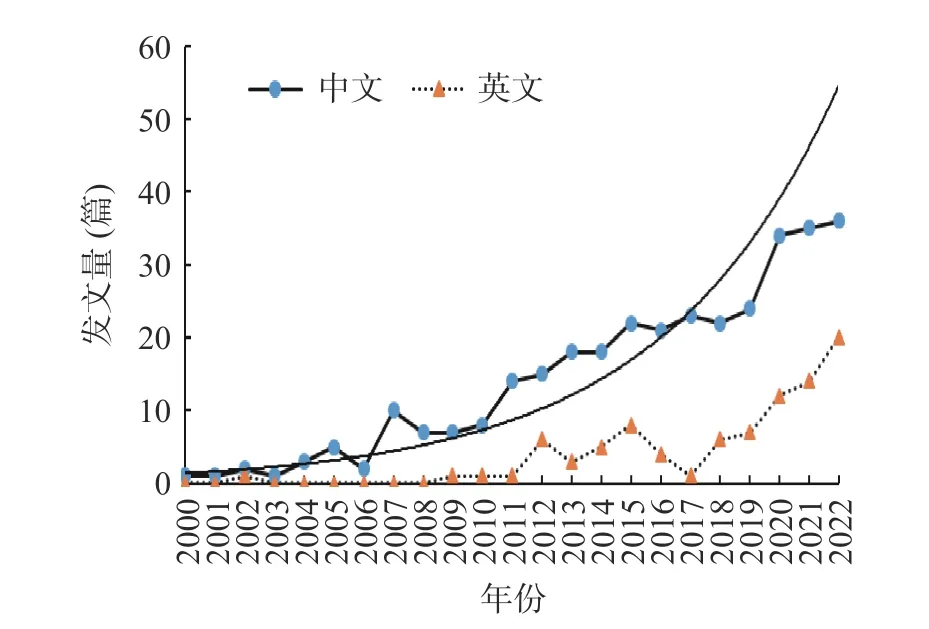
图1 有关药食同源物质缓解酒精性肝损伤研究文献量年代分布Fig.1 Chronological list of research literature on the alleviation of alcoholic liver injury by medicinal and food homologous substances
2.2 药食同源物质缓解酒精性肝损伤研究专利量的年代分布
1994~2022 年关于药食同源物质缓解ALI 专利申请的年代分布如图2 所示,国内专利量共213 项,国外专利量共63 项。总体而言,国内专利量显著高于国外。国内专利量的发展可大致分为两个阶段。第一阶段为2002~2006 年,第二阶段为2007 年后,该阶段的专利量快速增长,呈线性上升趋势。此外,专利申请量快速增长的同时,其所涉及研究领域和内容随年代也更加多元化,包括药食同源物质缓解ALI 的保肝颗粒[10]、护肝片[11]、保肝胶囊[12]、饮料类[13-14](复合饮料/保健饮料)、复方制剂[15]等。
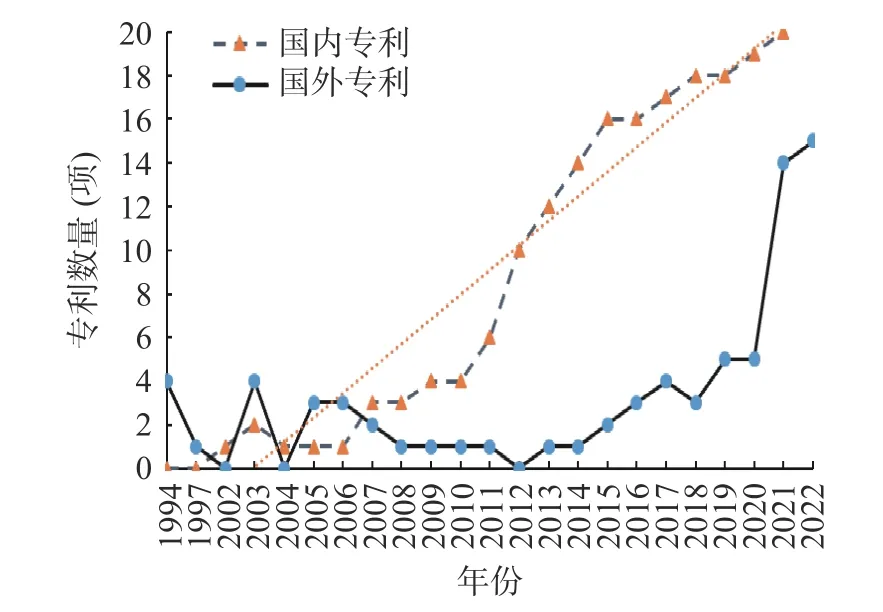
图2 有关药食同源物质缓解酒精性肝损伤研究专利量年代分布Fig.2 Chronological list of research patents on the alleviation of alcoholic liver injury by medicinal and food homologous substances
2.3 研究热点分析及其相关综述
2.3.1 药食同源物质缓解酒精性肝损伤的研究热点分析 将检索的中英文期刊,以Endnote 的格式导入VOSviewer 软件中,对关键词进行共现分析,得到关于“药食同源物质缓解ALI 研究”相关文献的可视化分析图。
聚类视图表示研究主题之间的联系密切程度、热点关键词,其中关键词字号越大代表聚类程度越强,出现频次越高;圆圈的颜色代表其所属的聚类,不同的聚类用不同的颜色表示。由图3 可知,药食同源物质缓解ALI 的研究相关文献中出现频次较高的关键词有酒精性肝损伤、葛根、枳椇子、甘草、枸杞、姜黄、山楂、保护作用、作用机制(氧化应激、脂质过氧化、炎症反应)。研究以葛根、枳椇子、枸杞、甘草、姜黄、山楂等药食同源物质缓解ALI 为主要内容。
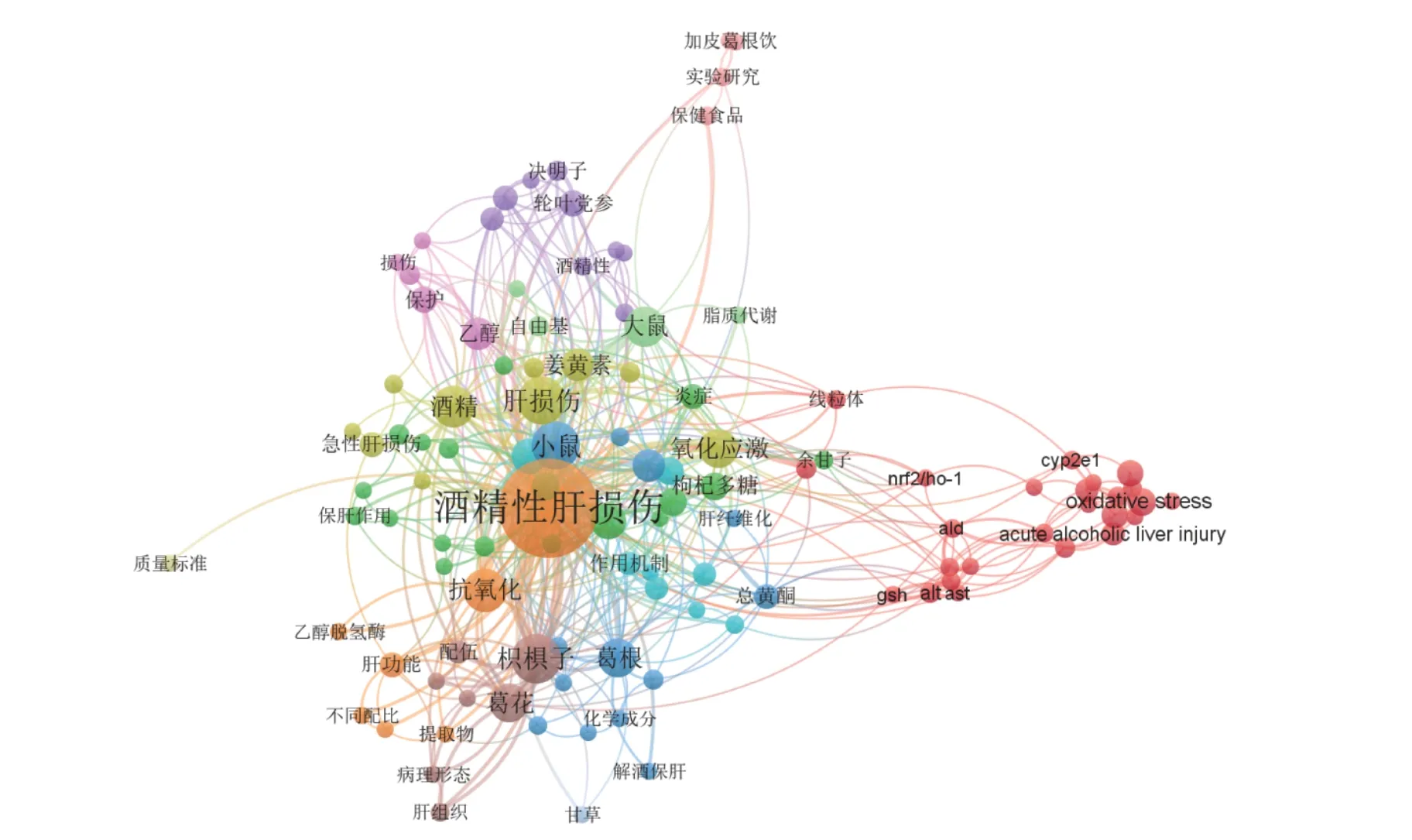
图3 有关药食同源物质缓解酒精性肝损伤研究相关文献关键词密度可视化聚类视图Fig.3 Visual clustering view of keyword density based on literature on the alleviation of alcoholic liver injury by medicinal and food homologous
2.3.2 酒精性肝损伤的发病机制分析 目前国内外学者对ALI 的发病机制尚未有较为明确的认识,同时也缺乏靶向治疗的方法手段及药物,因此充分了解ALI 的发病机制,深入探索药食同源物质缓解ALI 的作用机制,有助于科学预防及治疗ALI。根据相关研究发现ALI 的发病机制主要与乙醇代谢、氧化应激、炎症反应、肠道菌群与肠道屏障功能相关[3,6],各发病机制之间存在相关性。
2.3.2.1 乙醇代谢 乙醇代谢与ALI 的发病机制共有两方面的关联:一方面,酒精代谢主要依靠乙醇脱氢酶(Alcohol Dehydrogenase,ADH)和乙醇氧化酶系统进行氧化代谢[16]。当酒精含量较低时,主要通过ADH 进行代谢,而当酒精含量相对较高时,主要通过乙醇氧化酶系统进行代谢,经这两途径代谢会产生高活性物质乙醛,其会在线粒体乙醛脱氢酶作用下生成乙酸并进入三羧酸循环,最终被氧化生成水和二氧化碳;另一方面,酒精在肝脏内代谢时,可将氧化型辅酶I 转化为还原型辅酶I,二者比值被改变,会破化细胞正常的氧化还原状态[6],加快脂肪酸的形成,阻止其氧化,并导致脂肪变性[17]。当大量或长期摄入酒精时,可能会减少乙醛的反应,并降低乙醛脱氢酶活力,从而使其不能正常进行氧化反应代谢,造成乙醛在肝脏内积累,影响乙醇代谢。进一步研究发现,乙醛与ALI 的形成有密切关系[18]:a.乙醛含量过多会影响线粒体功能,进而影响三羧酸循环[6,16];b.乙醛会影响肝脏的维管系统,抑制微粒蛋白的分泌,导致蛋白和脂质在肝脏中积累[6,16];c.乙醛能够刺激胶原蛋白的形成,造成肝纤维化[6,16];d.乙醛进入血液后,在黄嘌呤氧化酶作用下转为超氧化物,自由基水平增加会导致脂质过氧化,进而破坏细胞膜的流动性和通透性,影响酶和受体的功能,造成细胞内膜性结构的破坏[16];e.乙醛可通过阻碍受损脱氧核糖核酸修复及其胞嘧啶的甲基化,限制细胞分化及受损组织的再生和修复[16,19-20]。
2.3.2.2 氧化应激 氧化应激与ALI 的关联主要体现在机体氧化与抗氧化体系的动态失衡。现代药理学研究表明,氧化应激可能是引发ALI 的主要因素[21]。氧化应激是指机体受到某些有害条件影响时,比如人体多次或一次过量饮酒,就会导致体内氧化剂和抗氧化剂的动态平衡被打破,导致氧化水平升高从而对肝脏造成损伤[6]。摄入大量酒精,机体内抗氧化剂活性受到抑制,体内自由基(Robot Operating System,ROS)过量积累[22],并与不饱和脂肪酸相互作用,产生脂质过氧化物和蛋白质加合物,导致肝细胞坏死,最终造成严重的酒精相关肝损伤[21]。除了ROS积累导致的氧化应激之外,酒精摄入导致的谷胱甘肽(Glutathione,GSH)减少也会加剧线粒体损伤,干预细胞正常功能[23];此外,铁离子可催化低活性氧化物转化为高活性氧化物,过量酒精会提高铁离子含量,加速肝细胞对铁离子的吸收,进而增强氧化应激作用[24]。酒精本身是一种羟自由基清除剂,其反应产物会影响线粒体通透性并改变膜电势,若长期摄入酒精,其会与抗氧化剂反应,使其失去抗氧化能力,进而加剧酒精性肝损伤[25]。
2.3.2.3 免疫炎症反应 免疫炎症反应与ALI 的产生主要与炎症因子(如Tumor nccrosis factor-α(TNFα)、Human Interleukin-1β(IL-1β)、Interleukin(IL-6))的大量释放有关。当机体发生过度或失控性炎症反应时,能加速ALI 恶化;饮酒会引起肠道菌群失调并改变肠道屏障功能,机体内乙醇含量过高会促进肠道部分微生物过度生长,从而使肠粘膜通透性增加,肠道内衍生的内毒素脂多糖(Lipopolysaccharide,LPS)等会通过上皮组织进入血液循环,进而引发一系列炎症反应[7,26]。LPS、ROS 等均可与CD14 和Toll 样受体4(Toll Like Receptor 4,TLR4)发生相互作用,触发信号级联反应,从而刺激Kupffer 细胞,分泌促炎细胞因子(如Nuclear Factor Kappa B(NFκB)、TNF-α、IL-1β、IL-6 等)[6,27],TNF-α是炎症反应中的重要媒介,可激活NF-κB 和JNK 通路,使肝脏内NF-κB 基因促进各种细胞因子的基因转录,进而释放大量的细胞因子和炎症介质,肝脏内的多种细胞因子和炎症介质则会加速肝细胞的炎症浸润、纤维化、肝细胞坏死或凋亡[6,16]。因此,炎症反应在ALI 的诱发过程中主要表现为Toll 样受体和NOD样受体的活化和炎症因子的大量释放[4]。
2.3.2.4 肠道屏障受损和菌群失调 与肠道相关的ALI 发病机制主要包括肠道菌群失调、肠道源性LPS 增加、肠道屏障完整性破坏及功能紊乱。酒精的过量摄入影响肠道微生物的数量与组成,造成“菌群失调”,如导致小肠细菌过度生长[28],进而引发机体疾病;酒精还会影响肠屏障,酒精及其代谢物通过影响肠道屏障上的黏液层和紧密连接蛋白的表达[29],对肠屏障完整性产生直接的损害作用。某些微生物代谢物发生改变后也会影响肠道屏障多种防御功能,进而破坏肠道屏障的完整性[30],增加肠道通透性,导致肠道屏障功能受损,造成LPS、活性致病菌和肠内具有促炎作用的代谢物进入体循环,而当这些致病抗原通过门静脉到达肝脏时,便可激活炎症反应等相关病症[31],引发肝损伤恶化,最终形成肝脏相关疾病;另外酒精还可减少短链脂肪酸、小肠上皮粘蛋白和紧密连接蛋白的表达,破坏肠道屏障[31]。此外,饮酒者体内的胆汁酸浓度较高,也会改变肠道通透性[32]。
通过总结ALI 主要发病机制,发现各机制之间存在相互影响。目前已有ALI 发病机制的综述报道[6,16],但尚不够系统,还需要深入研究其作用机制和预防及治疗方法。
2.3.3 药食同源物质缓解酒精性肝损伤的作用机制分析 通过图4 可视化标签视图分析发现,缓解ALI 的药食同源物质主要为葛根、枳椇子、枸杞、甘草、姜黄、山楂、栀子、轮叶党参、肉苁蓉、菊花等,研究方法从简单数据分析到结合组学技术、网络药理学和分子对接等高新技术进行分析研究,作用机制主要与其抗脂质过氧化、抗氧化应激反应、抗炎作用、清除自由基及调节肠道菌群等有关。

图4 有关药食同源物质缓解酒精性肝损伤研究相关文献关键词密度可视化标签视图Fig.4 Visual label view of keyword density based on literature on the alleviation of alcoholic liver injury by medicinal and food homologous
2.3.3.1 葛根 葛根可通过主要功效成分异黄酮类化合物及其与其它生物活性物质互作发挥缓解ALI 作用[33-35],同时还具有解酒、抗炎、抗氧化及保护心脑血管等功效[26,36]。
以葛根总黄酮对ALI 大鼠进行干预,其肝组织脂肪变性明显减轻,谷氨酰转肽酶活性降低,血清谷草转氨酶(Aspartate Transaminase,AST)、谷丙转氨酶(Alanine Transaminase,ALT)活性下降,展现缓解ALI 的作用,保护机制研究归因于葛根总黄酮对LPS刺激KC 细胞活化产生炎症因子的途径有抑制作用[37]。此外,葛根总黄酮可通过降低大鼠血清高、低密度脂蛋白胆固醇缓解大鼠ALI[38]。
葛根黄酮类化合物的单体成分葛根素对ALI 大鼠、小鼠的肝功能、生化、氧化应激、炎症因子指标等均有调控作用,其研究较多。卢雯雯等[39]发现葛根素(1.5 g·kg-1·d-1)能够降低ALI 大鼠血清转氨酶和肝纤维化指标,从而发挥其对酒精性肝细胞损伤的保护作用。葛根素还可显著降低大鼠血清中AST、ALT 含量,预防大鼠急性ALI,进而保护肝脏[40]。
综上,葛根中的葛根素及葛根黄酮可通过抑制自由基释放、抗脂质过氧化、抗氧化应激反应及抗炎症反应等机制缓解ALI。研究发现葛根多肽同样具有缓解小鼠ALI 的作用[41],但目前相关研究较少。
2.3.3.2 枳椇子 枳椇子发挥缓解酒精性肝损伤的主要活性成分为黄酮类化合物[42],其通过与其他物质配伍可更好发挥对ALI 的缓解作用[13,41,43-44],枳椇子还具有解酒保肝、醒酒、治疗各种肝病、抗炎抗氧化及抗脂质过氧化等功效[45-47]。张洪等[48]发现枳椇子提取物可通过增强GSH 结合反应和超氧化物歧化酶(Superoxide Dismutase,SOD)活性显著缓解小鼠急性肝损伤。枳椇子提取物可通过调节肠-肝轴异常,显著抑制TLR4 通路及其下游炎症介质,上调肠组织zo-1 和occludin 的表达发挥保肝作用,可显著逆转乙醇诱导的肠道菌群变化,减少肠源性内毒素的产生,进而缓解大鼠慢性ALI[49]。张永昕等[50]发现枳椇子总黄酮能显著降低大鼠血清中AST、ALT、TNF-α、透明质酸、层粘连蛋白LN 含量,减少肝组织产生丙二醛(Malondialdehyde,MDA)、提高白细胞介素10(Interleukin,IL-10)水平,减轻酒精引起的炎症反应,进而对酒精引致的肝损伤有良好的防治作用;枳椇子柄多糖表现出相似功效[51],可显著降低ALI 小鼠血清AST、ALT 与肝脏MDA 水平,同时恢复肝脏SOD 和谷胱甘肽过氧化物酶活性,对急性ALI 的缓解作用机制可能与其抗氧化活性有关。
综上,枳椇子可通过抗脂质过氧化、抗氧化应激反应、抗炎反应及调节肠道菌群等机制缓解ALI。虽然已有较多研究表明枳椇子具有缓解ALI 的作用,但其发挥保护作用的具体药效物质基础尚不明确。后续可通过网络药理学、分子对接和代谢组学技术深入探究其黄酮类、多糖类、皂苷等生物活性成分发挥缓解ALI 作用及其机制。
2.3.3.3 枸杞 枸杞具有抗氧化、保肝、抗脂质过氧化等功效[52-54],相关研究集中于枸杞多糖和黑枸杞黄酮缓解ALI,同时以枸杞为原料制作的饮料、酒及酵素等产品也具有缓解作用[53,55-56]。
红枸杞多糖(Lycium barnarumpolysaccharide,LBP)属蛋白多糖、功能性杂多糖[57],具有抗氧化、肝脏保护、免疫调节等功能[58-59]。研究发现,LBP 是一种具有潜力的抗ALI 药物,可通过清除自由基、抗氧化应激反应、抗炎反应等途径干预ALI[60]。魏芬芬等[52]研究得出LBP 能显著降低血清氧化指标,同时提升肝脏MDA、TNF-α、IL-1β、GSH、SOD,从而缓解ALI,可能与清除体内多余自由基、增强体内抗氧化能力及减轻炎症反应相关。LBP 可通过调控Nrf2/HO-1 信号通路、清除ROS 和活性氮的水平及抗凋亡缓解ALI[59]。配伍是提升中成药药效的常用手段之一,任洁[57]与Yan 等[61]研究表明,枸杞多糖与硫酸锌复配具有协同作用,可通过促进脂质代谢、抑制氧化应激、炎症反应和调节酒精代谢途径,展现出缓解大鼠ALI 的能力。黑枸杞黄酮类化合物具有免疫调节、抗氧化等作用,黑枸杞黄酮可通过NFκB 信号通路减少与TNF-α、IL-6 有关的炎症因子,进一步提高IL-10 抗炎细胞因子表达量缓解小鼠ALI[62]。
综上,枸杞可通过抑制氧化应激反应、抗炎症反应、调节酒精代谢等途径缓解ALI。其中,红枸杞多糖和黑枸杞黄酮研究较广,但黑枸杞黄酮针对抗炎反应缓解ALI 的研究较少。
2.3.3.4 甘草 甘草主要活性成分为三萜类和黄酮类[63],具有保肝、抗氧化、抗炎等功效[34],主要通过甘草酸对ALI 起缓解作用,也可利用甘草酸苷与其他物质配伍制成复方制剂[64-65]等起保护作用。
甘草酸是甘草的主要成分之一,又称甘草甜素,为三萜衍生物,其在一定条件下能特异性结合到肝脏,具有抗炎、保肝解毒、减轻肝细胞的损伤、增强免疫等功能[66-68]。甘草酸有两种差向异构体,即18α-甘草酸(18α-Gly)和18β-甘草酸(18β-Gly)。孙晓可等[67,69]研究这两种不同配比的甘草酸对ALI 大鼠的影响,发现18α-Gly 与18β-Gly 在4:6 和2:8 配比下能显著降低血清ALT、AST、γ-谷氨酰转移酶、乳酸脱氢酶活性和总胆红素、总胆汁酸水平,且此比例下缓解ALI 的作用效果更佳。研究发现甘草酸缓解大鼠ALI 的作用机制与乙醇分解代谢、肝星状细胞活化、氧化还原酶活性、氨基酸合成代谢、脂肪酸的生物合成、Notch 信号通路等功能或通路有关,可通过调节多基因可变剪切缓解ALI 病变[68]。
甘草苷是甘草中的主要黄酮类化合物,具有保护心脏系统等功效[63]。但甘草苷缓解ALI 的作用研究较少,张芬芬等[63]研究其对急性灌胃小鼠肝损伤的防治作用,发现甘草苷可有效提高小鼠血清ADH水平和肝脏ADH、SOD 水平,并推测这可能与甘草苷可一定程度上改善脂质过氧化、增强受损肝脏抗氧化能力、减少炎症反应有关,但机制还需要进一步研究。
综上,甘草缓解ALI 的研究主要集中于甘草酸与甘草苷,与抗脂质过氧化、抗氧化应激反应及抗炎反应等机制有关。其中以甘草酸苷为原料之一制成甘草酸苷复方制剂及以甘草酸为原料的研究较多,甘草苷缓解ALI 的研究较少且作用机制不明确,探究其作用机制对预防和治疗ALI 具有重要意义。
2.3.3.5 姜黄 姜黄素是姜黄的主要生物活性成分,可作为抗氧化剂及消炎药在中草药治疗中使用[70]。主要通过抑制内质网应激、抗氧化应激反应、抗炎及抗脂质过氧化等方式缓解ALI。尹蓉[71]发现姜黄素能通过抑制酒精中毒大鼠脂质过氧化和肝组织中NF-κB 的表达,从而减轻或防治酒精诱导的肝损伤;郑修齐等[72]发现姜黄素可抑制ALI 小鼠肝脏中ROS的表达,减少相关炎症反应的发生,判断其通过抑制内质网应激缓解ALI。曾瑜等[73]发现姜黄素能增强急性酒精中毒小鼠的体内抗氧化能力从而发挥对ALI 的保护作用。原海忠等[74]和韩刚等[75-76]制备姜黄素固体分散体,发现其对ALI 大鼠具有保护作用。
2.3.3.6 山楂 山楂中对ALI 起缓解作用的功效成分主要是山楂黄酮类化合物及山楂酸。山楂黄酮具有抗氧化、调节脂质代谢、护肝等多种药理活性[77]。研究发现,山楂叶总黄酮主要通过清除自由基及抗脂质过氧化等缓解ALI。李素婷等[78-81]研究发现山楂黄酮可降低小鼠血清指标,提高SOD、GSH 含量并改善肝组织脂肪变性和炎症坏死,对酒精所导致的急性肝损伤有一定的保护作用,机制与清除自由基,抑制脂质过氧化反应有关。常陆林[82]发现山楂黄酮可降低ALT、AST、MDA、TNF-α水平,增加SOD,缓解ALI,其机制与降低小鼠血清自由基水平、抑制脂质过氧化有关;潘莹等[83]发现山楂总黄酮缓解ALI机制与其对自由基的拮抗作用、脂质代谢有关。
山楂酸是一种抗氧化剂,具有抗氧化、抗炎等广泛的生物活性[84]。研究发现,山楂酸主要通过抗氧化应激反应缓解ALI。魏蕾等[84]研究发现山楂酸可降低急性ALI 小鼠体内MDA 含量、提高GSH 含量,增强机体自身的抗氧化能力来缓解肝损伤;Yan等[85]发现山楂酸可通过抑制CYP2E1、NF-κB 通路降低酒精引起的急性肝脏氧化应激反应和炎症应激反应缓解ALI。
综上,山楂缓解ALI 的研究主要集中于山楂黄酮与山楂酸,与清除自由基、抗脂质过氧化、抗氧化应激反应等机制有关。
2.3.3.7 其他药食同源物质 根据药食同源物质缓解ALI 文献分析,还有灵芝、人参、黄芪、铁皮石斛等具有缓解ALI 作用。
灵芝具有保肝护肝、预防乙醇性肝损伤、抗氧化等功能[86]。灵芝的子实体和菌丝体对ALI 大鼠、小鼠肝损伤模型具有良好的保护作用,其重要的药理活性成分为灵芝多糖和灵芝三萜类化合物[86]。灵芝多糖具有抗炎、调节免疫、抗氧化、保护肝脏等药理作用[87],主要通过抗炎、抗氧化应激反应及抗脂质过氧化等方式缓解ALI。叶丽云等[88]建立了小鼠急性ALI 模型研究发现灵芝多糖能够有效预防急性ALI,作用机制可能与调节GSH 代谢、细胞色素P450、视黄醇代谢相关基因的表达有关;赵婷婷等[89]研究发现,灵芝菌丝体多糖可通过改善小鼠肝脏氧化应激水平和脂质代谢水平、降低小鼠肝脏细胞炎症因子含量,发挥其对ALI 的缓解作用。灵芝三萜类化合物对ALI 保护作用的活性成分主要为灵芝三萜(GLA)及灵芝酸,其通过抗自由基作用、抗氧化应激反应抗炎、抗脂质过氧化及调节肠道菌群等缓解ALI。魏晓霞[90]发现GLA 能降低急性ALI 小鼠血清中ALT、AST 含量及肝指数,降低肝组织MDA 含量、提高SOD 活性,具有保护肝细胞膜、抗自由基作用,表明其对肝损伤小鼠有明显的保护作用;Lü等[91]和Cao 等[92]均发现灵芝酸可通过调节肠道菌群紊乱或肠道微生物组成缓解小鼠ALI。另有研究发现灵芝酸A 对小鼠急性ALI 的作用机制可能与调控脂代谢、抑制氧化应激、减轻炎症反应、抑制Toll/NFκB 信号通路和凋亡信号通路相关蛋白表达有关[93]。综上,灵芝中的多糖、三萜组分及灵芝酸A 主要通过抗氧化、抗炎、抗脂质过氧化、清除自由基及调节肠道菌群等作用缓解ALI,但其发挥效果的具体作用机制尚不清楚,且鲜有利用组学技术研究其作用机制,后续可从该方面深入探索。
人参具有抗氧化、提高免疫力、保肝等作用[94],其主要活性成分为人参皂苷类化合物[95],包括人参皂苷Re、Rh1、Rg1 等。张宇等[96]发现高浓度(40 mg/kg)人参皂苷CK 可明显改善ALI 大鼠肝脏组织病理病变,通过抑制内质网应激反应、酒精刺激大鼠肝脏引起的细胞凋亡及线粒体结构损伤及脂肪病变程度缓解ALI;李明珂等[97]发现人参皂苷Rh1 及CK 可降低肝酶水平、延缓肝细胞病理改变、减轻肝细胞脂肪变性程度及改善线粒体结构与功能;尹春金[98]和Gao 等[99]发现人参皂苷Re、Rg1 缓解ALI 作用机制可能与其增强Nrf2-ARE 通路的氧化防御系统有关。综上,人参皂苷缓解酒精诱导的大小鼠肝损伤,作用机制主要与改善肝组织病变及脂肪堆积、保护线粒体结构与功能、抗氧化应激反应等有关。
3 结论与展望
通过对CNKI、WOS、PubMed 自建库起至2022年主题为“酒精肝损伤”的研究文献进行检索,筛选得到418 篇文献、276 项专利,分析发现:国内文献量及专利申请量显著高于国外,说明我国在药食同源物质缓解ALI 方面的研究具有显著优势,国外文献量增长缓慢,2012 年开始稍有增长;药食同源物质缓解ALI 领域的研究热点、关键词聚类分析等表明,其研究物质热点集中于葛根、枳椇子、枸杞、甘草、姜黄等,研究内容热点为药食同源物质缓解ALI 的保护作用机制。通过综述ALI 的发病机制和葛根、枳椇子、枸杞、甘草、姜黄等药食同源物质及其有效成分缓解ALI 的作用机制研究,得其发病机制主要与乙醇代谢、氧化应激、炎症反应、肠道相关,药食两用物质作用机制主要与降酶、抗脂质过氧化、抗氧化应激反应、抗炎作用、清除自由基及调节肠道菌群有关,且药食同源物质有效成分中的多糖类、黄酮类及三萜类化合物对该领域的研究较多,多肽类化合物鲜少关注。
总之,该领域的研究还需要更深入的探索,如特定药食同源物质缓解ALI 的具体有效成分、靶向作用机制尚不清楚;大部分研究为体内实验证明药食同源物质可缓解ALI,但相关的体外细胞实验、毒理学研究较少;目前仅少量文献从分子水平进行研究验证,未来可从代谢、转录、基因及结合新的分析方法(如组学技术、网络药理学和分子对接)等方面进行深入研究;未来将发掘更多药食同源物质及其有效成分来缓解ALI,并研究出更多安全健康药食同源复方制剂、保健饮料等用于预防及缓解肝损伤。

