褪黑素调控MEG3/miR-223/NLRP3 轴对流感病毒感染小鼠模型肺损伤的影响①
靳 莉 徐 超 张 华 李振华 (郑州大学附属郑州中心医院呼吸与危重症医学科,郑州 450000)
甲型流感病毒一般感染禽类,部分亚型会感染猪、海豹、马和人等哺乳动物,且变异性强,可实现跨种感染,感染最常见和多发的是急性呼吸系统传染病,若不及时干预极易引起重症肺炎[1]。甲型流感病毒引起的肺炎患者肺部表现为弥漫性损伤,如甲型H1N1和H3N2流感病毒传染性强,且其发病迅速、治疗难度大、病死率高[2]。目前甲型流感病毒引起的肺损伤治疗方法包括抗炎、抗感染、祛痰、机械通气等,但效果均不理想[3],发现新的治疗方法迫在眉睫。褪黑素(melatonin,MT)是松果体中发现的激素,可作为免疫缓冲物质发挥作用,可以减轻炎症、减少氧化应激,从而防止脂多糖诱导的抑郁样行为[4];在新型冠状病毒感染疾病(corona virus disease 2019,COVID-19)中能够抑制病毒入侵引起的肺部炎症损伤,可减轻患者症状,实现对疾病的缓解,但在甲型流感病毒中尚未发现相关研究[5]。MT 能够调控长链非编码RNA(long non-coding RNA,lncRNA)母体表达基因3(maternally expressed gene 3,MEG3)/微小RNA-223(microRNA-223,miR-223)/核苷酸结合寡聚化结构域样受体蛋白3(nucleotide-binding oligomerization domain-like receptor protein 3,NLRP3)轴实现对内皮功能障碍相关炎症疾病的治疗作用,在肺损伤中可能发挥类似功效[6]。世界卫生组织专家表示,在中国,H7N9 流感病毒为最致命的流感病毒之一。基于此,本研究以H7N9 流感病毒为研究对象,探讨MT 对H7N9流感病毒感染小鼠肺损伤的影响,并初步探讨其机制,为MT 对H7N9 流感病毒感染患者肺损伤的治疗提供一定理论依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 50 只雄性C57BL/6 小鼠购自北京维通利华实验动物技术有限公司,生产许可证号:SCXK(京)2016-0011,体质量(20.5±0.5)g,6~8周龄,普通动物饲料饲养、自由饮水,12 h 光照昼夜循环。本研究经郑州大学附属郑州中心医院伦理委员会审核并通过(伦理审批号:20201135),实验动物符合3R原则。
1.1.2 病毒 H7N9 低致病性病毒株购自武汉金开瑞生物工程有限公司,病毒接种10 日龄鸡胚,37 ℃温箱中孵育48 h,收取鸡胚尿囊液,离心后病毒上清制备成5×107半数鸡胚感染量(egg 50% infective dose,EID50)/ml病毒悬液备用。
1.1.3 试剂与仪器 MT购自美国Sigma-Aldrich公司;苏木精-伊红(hematoxylin-eosin,HE)试剂盒购自北京Solarbio 公司;引物由上海生工生物科技有限公司合成;小鼠IL-1β、IL-18、IL-6、TNF-α、IFN-β ELISA 试剂盒、一抗NLRP3、凋亡相关斑点样蛋白(apoptosis associated speck-like protein containing CARD,ASC)、半胱氨酸天冬氨酸蛋白水解酶1(cysteinyl aspartate specific proteinase1,caspase-1)、procaspase-1、内参β-actin、二抗羊抗兔均购自英国Abcam 公司;pcDNA3.1-NLRP3-WT 质粒、pcDNA3.1-NLRP3-MUT 质粒、pcDNA3.1-MEG3-WT 质粒、pcDNA3.1-MEG3-MUT 质粒、miR-223 模拟物(miR-223 mimics)、miR-223 模拟物阴性对照(mimics NC)均由上海生工生物有限公司构建;HEK293 细胞购自美国ATCC;Lipofectamine 2000 转染试剂和双荧光素酶试剂盒均购自Invitrogen。Leica DCM8 显微镜购自德国Leica 公司;QuantStudio 3 实时荧光定量PCR(real-time quantitative PCR,RT-qPCR)仪购自美国ABI 公司;ChemiDoc XRS+蛋白凝胶成像系统购自美国Bio-Bad公司。
1.2 方法
1.2.1 动物分组及造模给药 小鼠随机分为对照组、模型组、MT(低、中、高)剂量组,每组10只。除对照组外,其余各组小鼠参考文献[7],使用5×105EID50剂量H7N9 病毒悬浮液滴鼻,对照组等体积磷酸缓冲液滴鼻。造模当天MT(低、中、高)剂量组腹腔注射(15、30、60)mg/kg MT,对照组、模型组腹腔注射等体积生理盐水,1次/d,连续7 d。末次给药24 h处死小鼠,进行后续实验。
1.2.2 肺指数检测 立即处死小鼠,解剖肺组织,生理盐水冲洗,吸干表面水分,计算肺指数。肺指数=小鼠肺质量/体质量。
1.2.3 HE 染色观察肺组织形态 每组小鼠左肺固定在10%甲醛中,预冷的磷酸缓冲液漂洗,梯度乙醇溶液脱水,二甲苯透明、石蜡浸蜡,凝固切片,厚度5 μm。切片经二甲苯脱蜡、梯度乙醇处理,苏木精染色、伊红复染,梯度乙醇脱水、二甲苯透明,封片后显微镜下观察肺组织形态。
1.2.4 ELISA 检 测 肺 组 织 中IL-1β、IL-18、IL-6、TNF-α、IFN-β 水平 取每组小鼠右肺部分肺组织,加入含蛋白酶抑制剂的磷酸缓冲液对肺组织进行匀浆,3 000 r/min 4 ℃离心15 min,上清为肺组织匀浆,严格按照小鼠试剂盒操作说明检测肺组织中IL-1β、IL-18、IL-6、TNF-α、IFN-β水平。
1.2.5 RT-qPCR 检测肺组织中MEG3、miR-223 水平 取每组小鼠右肺部分肺组织,剪碎,Trizol 法提取总RNA,cDNA 第一条链合成试剂盒合成cDNA,RT-qPCR 仪 检 测 肺 组 织 中MEG3、miR-223 水 平。MEG3 正 向 引 物:5'-GTGAAGGTCGGAGTGAACG-3',反向引物:5'-CTCGCTCCTGGAAGATGGTG-3';β-actin 正向引物:5'-TGGAATCCTGTGGCATCCATGAAAC-3',反向引物:5'-TAAAACGCAGCTCAGTAACAGTCCG-3',miR-223 正 向 引 物:5'-TGGCTGTCAGTTTGTCAAAT-3',反向引物:5'-CTGCAGGGTCCGAGGT-3';U6 正向引物:5'-CTCGCTTCGGCAGCACA-3',反向引物:5'-AACGCTTCACGAATTTGCGT-3'。上样体系:2×Mix 10 μl、cDNA(200 ng/μl)1 μl、正向引物/反向引物(10 μmol/L)各0.5 μl、ddH2O 8 μl。反应条件:95 ℃ 120 s;94℃ 5 s、60℃ 30 s、40个循环。2-∆∆CT法计算MEG3、miR-223相对表达量。
1.2.6 蛋白免疫印迹检测肺组织中NLRP3、ASC、caspase-1、pro-caspase-1 蛋白水平 取每组小鼠右肺部分肺组织,剪碎,加入含蛋白酶抑制剂的蛋白裂解液冰上研磨,12 000 r/min 4 ℃离心20 min,上清为总蛋白。20 ng 蛋白凝胶电泳、PVDF 转膜,5%脱脂奶粉室温封闭2 h,TBST 冲洗,分别添加对应一抗NLRP3、ASC、caspase-1、pro-caspase-1、β-actin,4 ℃孵育过夜;TBST 冲洗,添加二抗,室温孵育2 h。DAB 显色液避光显色,蛋白凝胶成像系统拍照和定量分析。
1.2.7 生物信息学预测和双荧光素酶实验验证MEG3 与miR-223,miR-223 与NLRP3 的调控关系采用生物信息学在线软件查询MEG3 与miR-223 的结合位点、miR-223 与NLRP3 的结合位点。使用Lipofectamine 2000 转染试剂,将含有pcDNA3.1-NLRP3-WT 质 粒、pcDNA3.1-NLRP3-MUT 质 粒、pc-DNA3.1-MEG3-WT 质粒、pcDNA3.1-MEG3-MUT 质粒的荧光素酶载体分别与miR-223 mimics、mimics NC 共转染至HEK293 细胞中,培养48 h 后,收集细胞裂解液,根据双荧光素酶试剂盒说明书,检测荧光素酶活性。
1.3 统计学分析 采用GraphPad Prism8.0 软件对所有数据进行统计学分析,计量数据均采用±s表示,单因素方差分析多组间比较,SNK-q检验进一步两两比较。P<0.05表示差异有统计学意义。
2 结果
2.1 MT 对小鼠肺指数的影响 与对照组相比,模型组、MT(低、中)剂量组肺指数升高(P<0.05);与模型组相比,MT(低、中、高)剂量组肺指数降低(P<0.05);与MT低剂量组相比,MT(中、高)剂量组肺指数降低(P<0.05)。见表1。
表1 各组小鼠肺指数比较(±s,n=10,mg/g)Tab.1 Comparison of lung index of mice in each group(±s,n=10,mg/g)
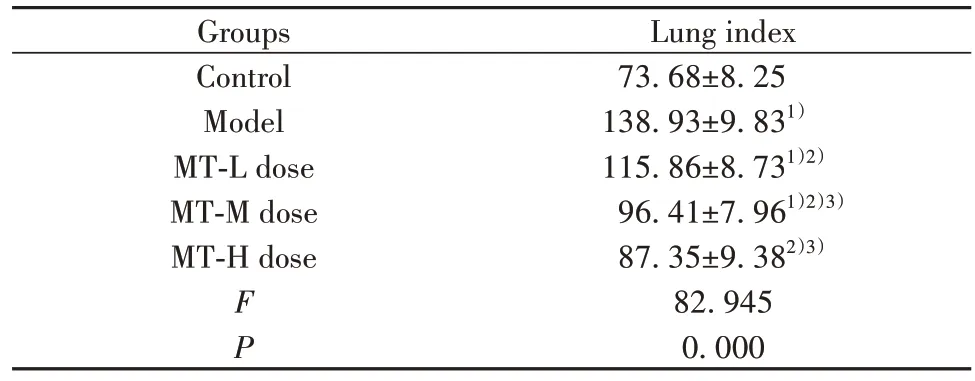
表1 各组小鼠肺指数比较(±s,n=10,mg/g)Tab.1 Comparison of lung index of mice in each group(±s,n=10,mg/g)
Note:Compared with control group, 1)P<0.05; compared with model group, 2)P<0.05; compared with MT-L dose group, 3)P<0.05.
Lung index 73.68±8.25 138.93±9.831)115.86±8.731)2)96.41±7.961)2)3)87.35±9.382)3)82.945 0.000 Groups Control Model MT-L dose MT-M dose MT-H dose FP
2.2 MT 对小鼠肺组织的影响 对照组小鼠肺组织肺泡、支气管形态结构完整,腔内无渗出现象;模型组小鼠肺组织肺泡壁充血明显、腔内出现明显的炎症渗出及炎症细胞浸润;MT(低、中、高)剂量组随着MT 剂量的升高,小鼠肺组织肺泡壁充血现象、腔内炎症渗出及炎症细胞浸润现象均得到改善。见图1。
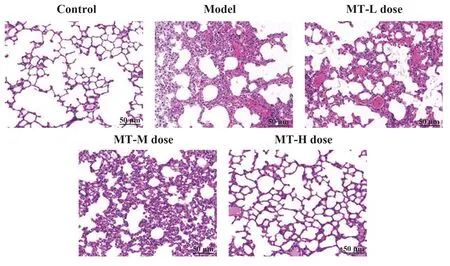
图1 各组肺组织形态(×200)Fig.1 Lung tissue morphology of each group(×200)
2.3 MT 对 肺 组 织 中IL-1β、IL-18、IL-6、TNF-α、IFN-β 水平的影响 与对照组相比,模型组、MT(低、中)剂量组肺组织中IL-1β、IL-18、IL-6、TNF-α、IFN-β水平,MT高剂量组肺组织中IL-1β、IL-18、IL-6、IFN-β 水平升高(P<0.05);与模型组相比,MT(低、中、高)剂量组肺组织中IL-1β、IL-18、IL-6、TNF-α 水平降低(P<0.05),IFN-β 水平升高(P<0.05);与MT低剂量组相比,MT 高剂量组肺组织中IL-1β、IL-18、IL-6、TNF-α 水平,MT 中 剂 量 组 肺 组 织 中IL-1β、IL-18、IL-6 水平降低(P<0.05),MT(中、高)剂量组肺组织中IFN-β 水平升高(P<0.05);与MT 中剂量组相比,MT 高剂量组肺组织中IL-1β、IL-18、IL-6、TNF-α 水平降低(P<0.05),IFN-β 水平升高(P<0.05)。见表2。
表2 各组肺组织中IL-1β、IL-18、IL-6、TNF-α、IFN-β水平比较(±s,n=10,pg/mg·prot)Tab.2 Comparison of IL-1β, IL-18, IL-6, TNF-α and IFN-β levels in lung tissues of each group (±s,n=10,pg/mg·prot)
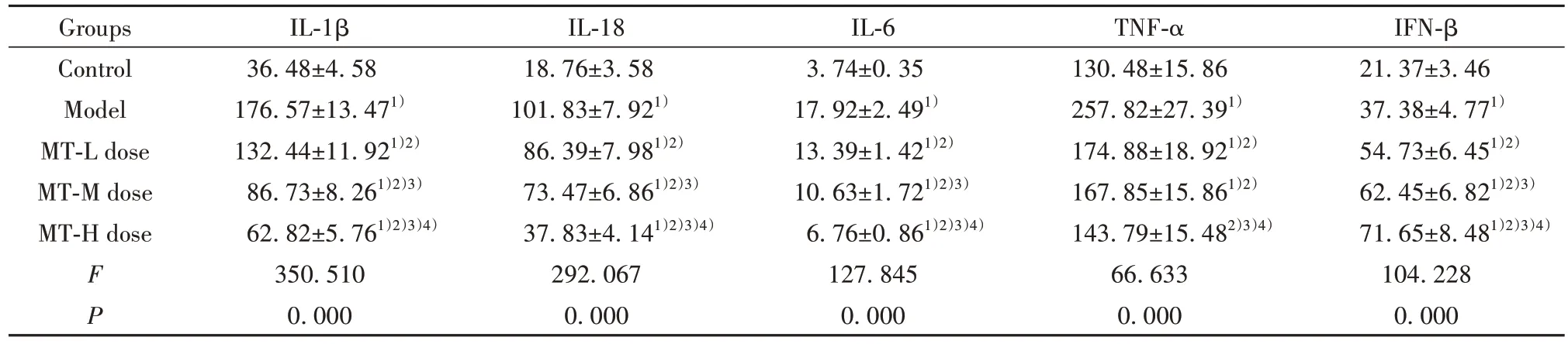
表2 各组肺组织中IL-1β、IL-18、IL-6、TNF-α、IFN-β水平比较(±s,n=10,pg/mg·prot)Tab.2 Comparison of IL-1β, IL-18, IL-6, TNF-α and IFN-β levels in lung tissues of each group (±s,n=10,pg/mg·prot)
Note:Compared with control group, 1)P<0.05; compared with model group, 2)P<0.05; compared with MT-L dose group, 3)P<0.05; compared with MT-M dose group, 4)P<0.05.
Groups Control Model MT-L dose MT-M dose MT-H dose IL-1β IL-18 IL-6 TNF-α IFN-β 21.37±3.46 37.38±4.771)54.73±6.451)2)62.45±6.821)2)3)71.65±8.481)2)3)4)104.228 0.000 FP 36.48±4.58 176.57±13.471)132.44±11.921)2)86.73±8.261)2)3)62.82±5.761)2)3)4)350.510 0.000 18.76±3.58 101.83±7.921)86.39±7.981)2)73.47±6.861)2)3)37.83±4.141)2)3)4)292.067 0.000 3.74±0.35 17.92±2.491)13.39±1.421)2)10.63±1.721)2)3)6.76±0.861)2)3)4)127.845 0.000 130.48±15.86 257.82±27.391)174.88±18.921)2)167.85±15.861)2)143.79±15.482)3)4)66.633 0.000
2.4 MT 对肺组织中MEG3、miR-223 水平的影响与对照组相比,模型组、MT(低、中、高)剂量组肺组织中MEG3 水平升高(P<0.05),miR-223 水平降低(P<0.05);与模型组相比,MT(低、中、高)剂量组肺组织中MEG3 水平降低(P<0.05),miR-223 水平升高(P<0.05);与MT 低剂量组相比,MT(中、高)剂量组肺组织中MEG3 水平降低(P<0.05),miR-223 水平升高(P<0.05);与MT 中剂量组相比,MT 高剂量组肺组织中MEG3 水平降低(P<0.05),miR-223 水平升高(P<0.05)。见表3。
表3 各组小鼠肺组织中MEG3、miR-223 水平比较(±s,n=10)Tab.3 Comparison of MEG3 and miR-223 levels in lung tissues of mice in each group (±s, n=10)
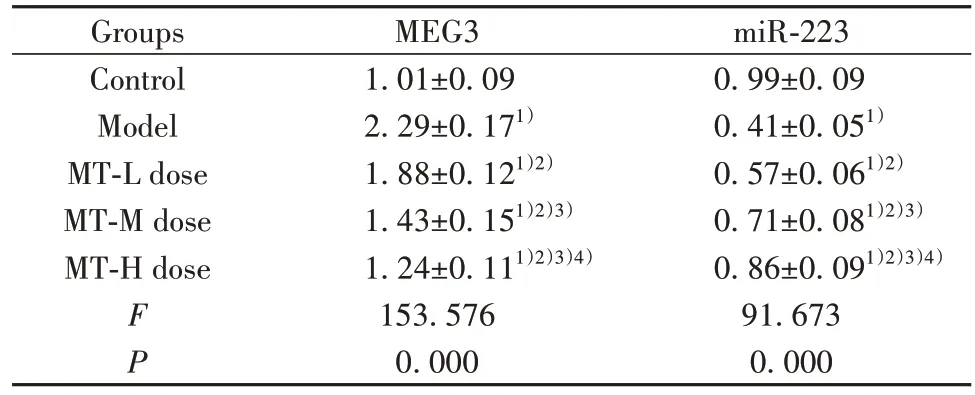
表3 各组小鼠肺组织中MEG3、miR-223 水平比较(±s,n=10)Tab.3 Comparison of MEG3 and miR-223 levels in lung tissues of mice in each group (±s, n=10)
Note:Compared with control group, 1)P<0.05; compared with model group, 2)P<0.05; compared with MT-L dose group, 3)P<0.05;compared with MT-M dose group, 4)P<0.05.
Groups Control Model MT-L dose MT-M dose MT-H dose MEG3 miR-223 0.99±0.09 0.41±0.051)0.57±0.061)2)0.71±0.081)2)3)0.86±0.091)2)3)4)91.673 0.000 FP 1.01±0.09 2.29±0.171)1.88±0.121)2)1.43±0.151)2)3)1.24±0.111)2)3)4)153.576 0.000
2.5 MT 对肺组织中NLRP3、ASC、caspase-1、procaspase-1 蛋白水平的影响 与对照组相比,模型组、MT(低、中)剂量组肺组织中NLRP3、ASC、caspase-1/pro-caspase-1 蛋白水平,MT 高剂量组肺组织中ASC、caspase-1/pro-caspase-1 蛋白水平升高(P<0.05);与模型组相比,MT(低、中、高)剂量组肺组织中NLRP3、ASC、caspase-1/pro-caspase-1 蛋白水平降低(P<0.05);与MT 低剂量组相比,MT(中、高)剂量组肺组织中NLRP3、ASC、caspase-1/pro-caspase-1 蛋白水平降低(P<0.05);与MT 中剂量组相比,MT 高剂量组肺组织中NLRP3、ASC、caspase-1/pro-caspase-1蛋白水平降低(P<0.05)。见图2。
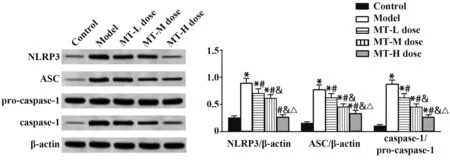
图2 各组小鼠肺组织中NLRP3、ASC、caspase-1、pro-caspase-1蛋白水平比较Fig.2 Comparison of protein levels of NLRP3, ASC, caspase-1, and pro-caspase-1 in lung tissue of each group of mice
2.6 MEG3 与miR-223,miR-223 与NLRP3 的靶向关系 MEG3与miR-223之间存在靶向结合位点,共转染miR-223 mimics 和pcDNA3.1-MEG3-WT 质粒时,细胞荧光素酶活性明显受到抑制(P<0.05),而共转染miR-223 mimics 和pcDNA3.1-MEG3-MUT时,细胞荧光素酶活性差异无统计学意义(P>0.05),见图3 和表4。miR-223 与NLRP3 之间存在靶向结合位点,共转染miR-223 mimics 和pc-DNA3.1-NLRP3-WT 质粒时,细胞荧光素酶活性明显受到抑制(P<0.05),而共转染miR-223 mimics 和pcDNA3.1-NLRP3-MUT 时,细胞荧光素酶活性差异无统计学意义(P>0.05),见图4和表5。
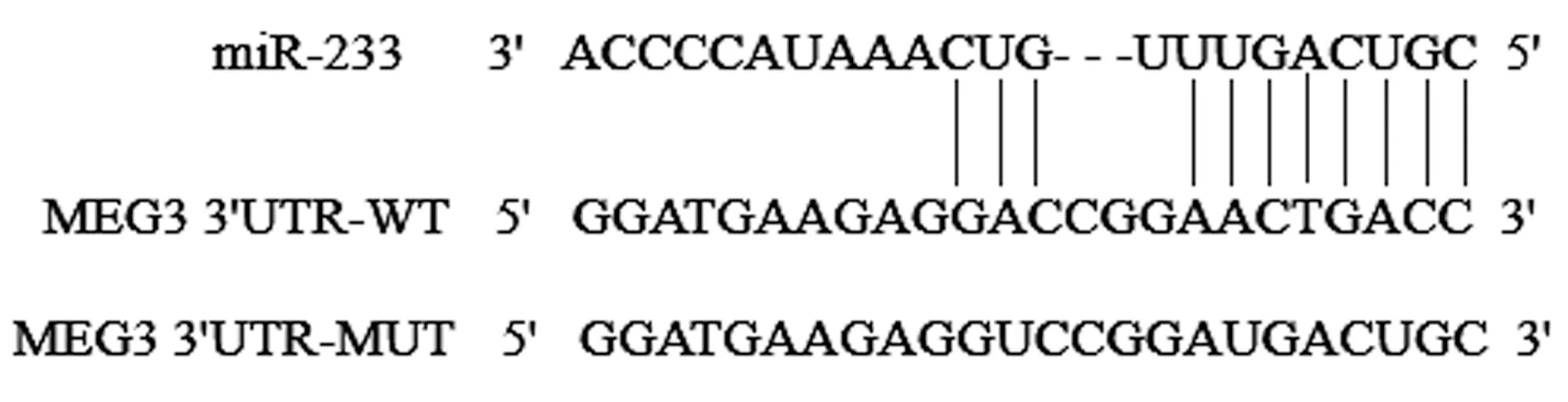
图3 MEG3与miR-223之间的结合位点Fig.3 Binding site between MEG3 and miR-223

图4 NLRP3与miR-223之间的结合位点Fig.4 Binding site between NLRP3 and miR-223
表4 各组细胞荧光素酶活性(±s, n=6)Tab.4 Cell luciferase activity in each group (±s, n=6)
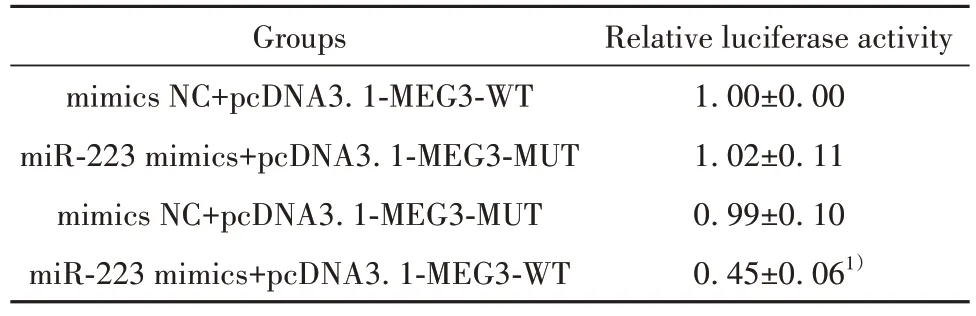
表4 各组细胞荧光素酶活性(±s, n=6)Tab.4 Cell luciferase activity in each group (±s, n=6)
Note:Compared with mimics NC+pcDNA3.1-MEG3-WT group,1)P<0.05.
Relative luciferase activity 1.00±0.00 1.02±0.11 0.99±0.10 0.45±0.061)Groups mimics NC+pcDNA3.1-MEG3-WT miR-223 mimics+pcDNA3.1-MEG3-MUT mimics NC+pcDNA3.1-MEG3-MUT miR-223 mimics+pcDNA3.1-MEG3-WT
表5 各组细胞荧光素酶活性(±s, n=6)Tab.5 Cell luciferase activity in each group (±s, n=6)

表5 各组细胞荧光素酶活性(±s, n=6)Tab.5 Cell luciferase activity in each group (±s, n=6)
Note:Compared with mimics NC+pcDNA3.1-NLRP3-WT group,1)P<0.05.
Relative luciferase activity 1.00±0.00 1.04±0.11 1.06±0.12 0.58±0.071)Groups mimics NC+pcDNA3.1-NLRP3-WT miR-223 mimics+pcDNA3.1-NLRP3-MUT mimics NC+pcDNA3.1-NLRP3-MUT miR-223 mimics+pcDNA3.1-NLRP3-WT
3 讨论
本研究以H7N9 禽流感病毒为研究对象,H7N9禽流感病毒可引起急性呼吸道传染病,经呼吸道传播、引起肺损伤,临床病死率较高,尤其是老年患者,常伴有严重的低氧血症、休克和多器官衰竭[8]。本研究中模型组出现肺组织肺泡壁充血、腔内出现明显的炎症渗出及炎症细胞浸润,导致肺指数升高,肺损伤严重。有效的治疗对于疾病意义重大,近年来,随着药物治疗的发展,抗炎通路及分子机制研究的日益成熟,从抗炎方面延缓或治疗该病引起科学家和临床医师的关注。MT 作为内源性吲哚胺类物质,由松果体分泌,具有多种临床用途,在不同病理条件下调控天然免疫细胞及生成抗炎细胞因子发挥抗炎作用[9]。在本研究中不同剂量MT 处理均可减轻流感病毒感染小鼠模型肺组织病理损伤,缓解肺指数升高现象,提示MT 能够使肺组织中炎症渗出及炎症细胞浸润现象得到明显缓解;另有研究发现,MT 作为抗病毒药物,对流感引起的肺炎具有治疗潜力,能显著降低TNF-α、IL-6 和IFN-γ 的表达,增加IL-10 和TGF-β 的产生,且与单纯使用利巴韦林相比,MT 和利巴韦林联合治疗可显著提高病毒感染小鼠的存活率[10],与本研究结果具有一致性,但具体机制尚需进一步研究。
H7N9 型流感病毒感染可促进趋化因子IL-18,促炎因子IL-1β、IL-6、TNF-α 等和抗病毒因子IFN-β的产生[11]。禽流感的非结构蛋白1能诱导树突状细胞分泌IL-6 和IFN-β,进而影响宿主固有免疫反应,参与疾病进程[12];中性粒细胞在固有免疫中介导抗病毒和免疫损伤的重要免疫细胞,能够抑制免疫因子IL-1β、IL-18、TNF-α 的释放进而发挥作用,其中IL-6 为病毒感染后,免疫阶段大量释放的促炎细胞因子[13-14]。在本研究中H7N9 禽流感感染后小鼠肺组织中IL-1β、IL-18、IL-6、TNF-α、IFN-β 均处于高表达状态,提示H7N9 禽流感感染后机体中趋化因子、促炎因子、抗病毒因子均处于高表达状态,机体紊乱,最终导致炎症加重、机体组织损伤。添加MT 后趋化因子、促炎因子水平均降低,抗病毒因子IFN-β水平继续升高,从而抑制病毒感染、减轻炎症,减轻机体损伤。
lncRNA 与乙型病毒性肝炎关系密切,可直接抑制病毒基因复制的关键蛋白表达,准确杀伤肝炎病毒[15]。在病毒感染的乙型肝炎中MEG3与肝纤维化程度关系密切,对诊断乙型肝炎具有较高价值,可成为病毒性乙型肝炎的诊断生物标志物[16];MEG3在呼吸道合胞病毒感染鼻咽样本和BEAS-2B 细胞中均低表达,且能抑制炎症因子TNF-α 和趋化因子IL-18 的表达,对呼吸道合胞病毒感染具有保护作用[17]。在本研究中MEG3 在模型组中高表达,高表达MEG3 在H7N9 禽流感病毒感染的肺损伤中可能发挥作用。lncRNA 可调控miRNA 的表达,从而影响其功能。miR-223 作为MEG3 下游miRNA 之一,通过与MEG3作用影响人视网膜微血管内皮细胞的增殖和迁移[18]。本研究发现,miR-223和MEG3存在靶向调控关系。随着研究深入,发现miR-223 的作用主要为抑制炎症反应,可防止感染及并发症发生,在病毒感染的天然免疫中发挥作用[19]。促进miR-223 表达使NLRP3 炎症体失活,从而减轻甲型流感病毒诱导的肺上皮细胞炎症损伤[20]。本研究进一步发现,miR-223与NLRP3存在靶向调控关系,且miR-223 可调控NLRP3 表达。NLRP3 炎症小体对多种信号通路发挥作用,包括环境刺激、内源性信号、病原体、机体内线粒体损伤等,可促进IL-1β、IL-18 的活化并诱导分泌,导致炎症相关性损伤[21],其中ASC、caspase-1 均为NLRP3 炎症小体的组成。本研究模型组miR-223 处于低表达,可能低表达的miR-223 对炎症的抑制作用不足,NLRP3 炎症小体蛋白处于高表达,H7N9 禽流感病毒感染的肺损伤炎症明显。添加MT 后,随着剂量的升高,miR-223水平升高,NLRP3、ASC、caspase-1/pro-caspase-1 蛋白水平降低;提示MT能够促进miR-223的表达并抑制NLRP3 炎症小体,从而减轻H7N9 禽流感病毒感染的肺损伤。
综上所述,MT 能够缓解H7N9 禽流感病毒感染小鼠引起的肺损伤,可能与MEG3/miR-223/NLRP3轴关系密切。本研究探讨MT 在流感病毒感染引起的肺损伤,为该类疾病实验动物研究提供一定参考。但MT 与MEG3 之间的具体关系尚需进行细胞实验进一步研究。

