疏风解毒胶囊经miR-155/JAK1-STAT1信号通路发挥对甲型流感病毒H1N1肺炎模型小鼠的保护作用*
李振华, 张 华△, 陈建丽, 徐 超, 谢林森, 张 艺, 张 倩
(1郑州大学附属郑州中心医院呼吸与危重症医学科,河南 郑州 450007;2郑州大学附属郑州中心医院检验科,河南 郑州 450007)
甲型流感病毒H1N1 肺炎是由单股RNA 病毒引起的急性呼吸道传播疾病,可通过飞沫、气溶胶、接触传染,传染性强,感染后患者重症转归不良的风险较高,部分患者恶化后造成呼吸窘迫或衰竭,危及生命[1],及时有效的干预对于患者至关重要。以往研究主要以西药治疗为主,奥司他韦作为其中一种西药,由于广泛使用,患者体内往往产生了耐药性,造成效果不佳[2],而中药药效持久且副作用小,为甲型流感病毒H1N1 肺炎提供了新的治疗方向。疏风解毒胶囊(Shufeng-Jiedu capsule,SFJDC)中有虎杖、连翘等多种中药成分,对病原菌具有广泛抑制作用[3-5],能够减轻感染导致的局部炎症,增强组织抵抗力和修复能力[6],但鲜有关于甲型流感病毒H1N1 肺炎的研究。微小RNA(microRNA,miR)-155 参与肺部损伤过程[7],可通过调控 Janus 激酶(Janus kinase,JAK)-信号转导及转录激活因子(signal transducer and activator of transcription,STAT)通路介导炎症反应,影响牙周炎发生[8]。本研究探讨SFJDC对甲型流感病毒H1N1肺炎模型小鼠的影响,并初步探讨其作用机制。
材料和方法
1 动物及病毒株
50 只 SPF 级雄性 BALB/c 小鼠,6~7 周龄,体重(20±2)g,购自北京维通利华实验动物有限公司,生产许可证号:SCXK(京)2016-0006。在温度(26±1)℃、湿度(55±5)%、12 h 光照12 h 黑暗环境中饲养。本实验经本院伦理委员会审核并通过。甲型流感病毒鼠肺适应株(A/FM/1/47-MA)由中国预防医学科学院病毒研究所提供。
2 主要药品及试剂
SFJDC 由天津药物研究所有限公司提供,每粒0.52 g,由虎杖、连翘、板蓝根、马鞭草、败酱草、柴胡、芦根和甘草组成,各药材均符合2015 年版《中国药典》相关标准。miR-155 siRNA及miR-155和U6引物由上海生工生物有限公司合成;苏木素-伊红(hematoxylin-eosin,HE)染色试剂盒(北京索莱宝科技有限公司);小鼠转化生长因子β(transforming growth factor-β,TGF-β)、白细胞介素6(interleukin-6,IL-6)和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒,抗 JAK1、p-JAK1、STAT1 和 p-STAT1抗体,羊抗兔Ⅱ抗,BCA蛋白试剂盒(Abcam);cDNA 第一条链合成试剂盒(上海佰易聚生物有限公司);2× SYBR qPCR Mix(北京庄盟国际生物有限公司);DAB 工作液(杭州浩克生物科技有限公司)。QuantStudio 3 实时荧光定量PCR 仪(ABI);UVP Gel-Solo蛋白凝胶成像仪(Jenapharm)。
3 主要方法
3.1 分组及建模 小鼠按随机数字法分为对照组、模型组、低剂量SFJDC 组、高剂量SFJDC 组和SFJDC+miR-155 siRNA 组,每组10 只。除对照组外,其余各组参考文献[9]将小鼠用乙醚轻度麻醉,以15×LD50流感病毒液鼻滴感染小鼠,每只0.035 mL,对照组鼻滴等体积蒸馏水。从感染当天起,低、高剂量SFJDC 组分别灌胃0.1 和0.5 g/(kg·d)SFJDC[10],SFJDC+miR-155 siRNA 组灌胃0.5 g/(kg·d)SFJDC并尾静脉注射miR-155 siRNA,对照组和模型组灌胃等体积蒸馏水,每天1次,连续5 d。
3.2 肺指数检测 立即处死小鼠,迅速解剖摘取肺,生理盐水清洗干净,吸干表面水分,称重,参考文献[11]检测各组小鼠肺指数。肺指数=小鼠肺质量(mg)/体质量(g)。
3.3 HE 检测肺组织病理情况 部分肺组织置于4%多聚甲醛中固定,经脱水、二甲苯透明后,石蜡包埋,切片机切片,切片厚度4 μm。切片经染色,依次进入二甲苯和乙醇中脱蜡,苏木精染色、1%盐酸乙醇分化、伊红复染,二甲苯透明、中性树胶封片,显微镜下观察肺组织情况。
3.4 ELISA 检测肺组织中 TGF-β、IL-6 和 TNF-α 水平 部分肺组织添加蛋白裂解液,冰上匀浆并充分裂解20 min,11 180×g、4 ℃离心20 min,上清液为总蛋白。参考小鼠TGF-β、IL-6和TNF-α ELISA 试剂盒检测肺组织中TGF-β、IL-6和TNF-α水平。
3.5 实时荧光定量PCR 检测肺组织中miR-155 水平 部分肺组织手术剪在冰上剪碎、添加Trizol冰上研磨,提取总RNA,cDNA 第一条链合成试剂盒合成cDNA,实时荧光定量PCR 检测肺组织中miR-155 水平。miR-155的上游引物序列为5'-CGGCGGTTAATGCTAATTGTGAT-3',下游引物序列为5'-GTGCAGGGTCCGAGGT-3';U6 的上游引物序列为5'-CGCTTCGGCAGCACATATAC-3',下游引物序列为5'-AAATATGGAACGCTTCACGA-3'。20 μL 反应体系:2 μL cDNA,10 μL 2×SYBR qPCR Mix,上、下游引物(均为 10 μmol/L)各 1 μL,6 μL ddH2O。反应条件:94 ℃ 20 s;95 ℃ 10 s,60 ℃ 20 s,40个循环。2-ΔΔCt法计算miR-155相对表达水平。
3.6 蛋白免疫印迹检测肺组织中JAK1、p-JAK1、STAT1 和p-STAT1 蛋白水平 部分肺组织手术剪剪碎,添加蛋白裂解液冰上研磨并裂解,11 180×g、4 ℃离心20 min,上清为总蛋白,BCA 蛋白试剂盒检测蛋白浓度,20 μg 上样量经凝胶电泳分离蛋白,硝酸纤维素膜280 mA转膜,5%脱脂奶粉室温封闭2 h,对应加入 JAK1、p-JAK1、STAT1、p-STAT1 和 GAPDH 抗体,4 ℃孵育过夜;加入对应Ⅱ抗,室温孵育1 h。DAB 工作液避光显色,蛋白凝胶成像仪拍照和灰度分析。
4 统计学处理
采用GraphPad Prism 7 软件进行统计学分析。计量数据均采用均数±标准差(mean±SD)表示。多组间比较行单因素方差分析,进一步两两比较行SNK-q检验。以P<0.05为差异有统计学意义。
结 果
1 SFJDC对肺指数的影响
与对照组相比,模型组肺指数显著升高(P<0.05);与模型组相比,低、高剂量SFJDC 组肺指数显著降低(P<0.05);与SFJDC 低剂量组相比,SFJDC 高剂量组肺指数显著降低(P<0.05);与SFJDC 高剂量组相比,SFJDC+miR-155 siRNA 组肺指数显著升高(P<0.05),见图1。

Figure 1. Comparison of lung index in the 5 groups. Mean±SD.n=10.*P<0.05 vs control group;#P<0.05 vs model group;△P<0.05 vs low-dose SFJDC group;▲P<0.05 vs high-dose SFJDC group.图1 5组肺指数水平比较
2 SFJDC对肺组织的影响
对照组小鼠肺组织肺泡结构完整、清晰,间质间无充血、坏死、炎症浸润等病理现象;模型组小鼠肺结构消失,肺泡出现明显断裂、融合、渗出,肺间质出现明显炎症浸润、水肿、充血现象;随着SFJDC 剂量的升高,肺泡断裂现象减少,肺泡融合及肺间质炎症浸润现象减轻,组织水肿缓解;在高剂量SFJDC 基础上使用miR-155 siRNA 后,大鼠肺组织病变较SFJDC高剂量组加重,见图2。
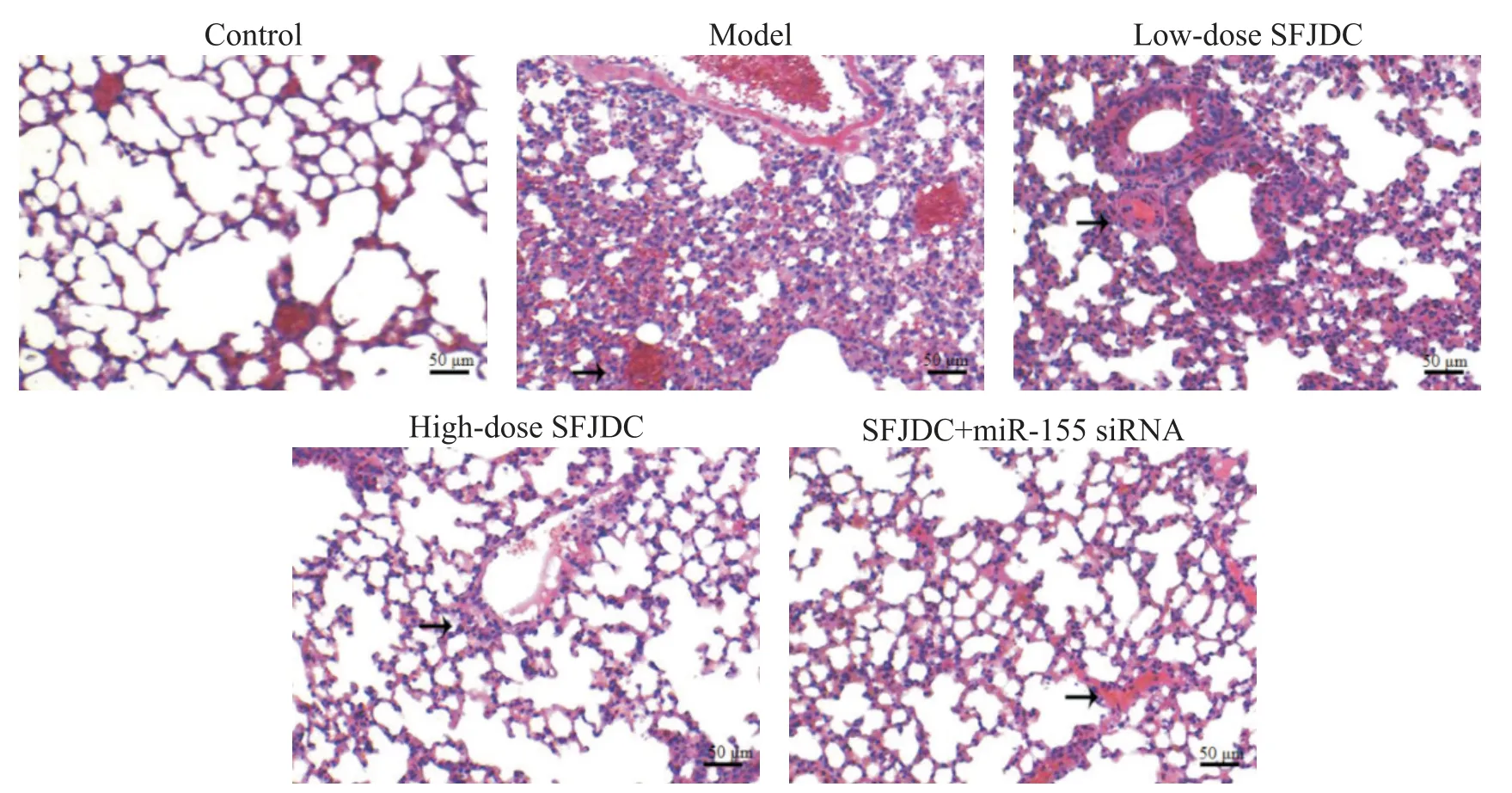
Figure 2. Morphological changes of lung tissues of the mice in the 5 groups. The scale bar=50 μm. Control group:the structure was complete without pathological phenomenon;model group:lungs showed destruction of the structure,and the arrow showed generous phenomenon of inflammatory infiltration and congestion;low-dose SFJDC group:alveolus pulmonis appeared,and arrow showed that phenomena of inflammatory infiltration and congestion were reduced;high-dose SFJDC group:the phenomenon of alveolar rupture was basically disappeared,and arrow showed there was almost no phenomenon of inflammatory infiltration and congestion,and the bronchial wall became significantly thinner than that in low-dose SFJDC group;SFJDC+miR-155 siRNA group:arrow showed that inflammatory infiltration and congestion increased compared with highdose SFJDC group.图2 5组小鼠肺组织形态
3 SFJDC 对肺组织中 TGF-β、IL-6 和 TNF-α 水平的影响
与对照组相比,模型组肺组织中TGF-β、IL-6 和TNF-α 水平显著升高(P<0.05);与模型组相比,低、高剂量SFJDC 组肺组织中TGF-β、IL-6和TNF-α水平显著降低(P<0.05);与低剂量SFJDC 组相比,高剂量SFJDC 组肺组织中 TGF-β、IL-6 和 TNF-α 水平显著降低(P<0.05);与高剂量SFJDC 组相比,SFJDC+miR-155 siRNA 组肺组织中 TGF-β、IL-6 和 TNF-α 水平显著升高(P<0.05),见图3。
4 SFJDC 对肺组织中 miR-155 及 JAK1、p-JAK1、STAT1和p-STAT1蛋白水平的影响
与对照相比,模型组肺组织中miR-155 水平显著降低(P<0.05),p-JAK1/JAK1 和 p-STAT1/STAT1比值显著升高(P<0.05);与模型组相比,低、高剂量SFJDC 组肺组织中miR-155 水平显著升高(P<0.05),p-JAK1/JAK1 和 p-STAT1/STAT1 比值显著降低(P<0.05);与低剂量SFJDC 组相比,高剂量SFJDC组肺组织中 miR-155 水平显著升高(P<0.05),p-JAK1/JAK1 和 p-STAT1/STAT1 比值显著降低(P<0.05);与高剂量SFJDC 组相比,SFJDC+miR-155 siRNA 组肺组织中miR-155 水平显著降低(P<0.05),p-JAK1/JAK1 和 p-STAT1/STAT1 比值显著升高(P<0.05),见图4。
讨 论
甲型流感病毒H1N1 肺炎在2009 年全球爆发,患者表现为发热、咳嗽、恶心、呕吐等流感样症状。中医认为这属于“寒毒疫”,邪毒侵入人体,正邪相争而发热,故发热而口微渴或不渴,饮水少,后期高热耗伤而出现口渴喜饮;吴又可《温病条辨》指出:“世多言寒疫者,究其病状,则憎寒状热,头痛骨节烦疼,虽发热而不甚渴……”[12]。为探索治疗甲型流感病毒H1N1 肺炎的有效药物,本研究利用H1N1 流感病毒建立该疾病的小鼠模型,显示小鼠肺部肺泡出现明显断裂、融合、渗出,肺间质出现明显炎症浸润、充血、水肿,这些病理改变导致肺部重量增加,导致肺指数升高,提示模型中小鼠肺组织出现明显的病理损伤,模型建立成功。

Figure 3. The levels of TGF-β(A),IL-6(B)and TNF-α(C)in lung tissues of the mice in the 5 groups. Mean±SD. n=10.*P<0.05 vs control group;#P<0.05 vs model group;△P<0.05 vs low-dose SFJDC group;▲P<0.05 vs high-dose SFJDC group.图3 5组肺组织中TGF-β、IL-6和TNF-α水平比较
中医在治疗甲型流感病毒H1N1 肺炎中表现出独特优势,中药SFJDC 以虎杖和连翘为君药,虎杖具有祛风、利湿、破淤、清肝凉血之功效,连翘可清热解毒、散结、凉血清肿;诸药配伍,板蓝根清热解毒、清血利咽,马鞭草活血化瘀,败酱草祛瘀止痛、除痈肿结热,柴胡结表,芦根清降肺胃、生津止渴;甘草为使,调和诸药[13]。本研究检测显示,经 SFJDC 治疗后,模型小鼠肺组织炎症浸润、充血、水肿现象减少,肺指数降低,提示SFJDC 能够减轻肺组织损伤,实现对甲型流感病毒H1N1肺炎小鼠肺损伤的缓解,具体机制尚需进一步研究。
TGF-β、IL-6 和 TNF-α 与甲型 H1N1 流感病毒关系密切,甲型H1N1流感病毒侵入机体后募集多种免疫细胞,免疫细胞中单核巨噬细胞可产生TGF-β、IL-6 和TNF-α,逐步入侵肺部,刺激内皮细胞和白细胞释放一系列炎症因子,引起免疫损伤[14-15]。本研究结果亦显示,模型组肺组织中炎症因子TGF-β、IL-6 和TNF-α均处于高表达状态,SFJDC能够降低以上因子水平,起到抑炎作用。有研究观察到miR-155 作为多功能miRNA,可参与天然免疫、特异性免疫过程,可调控小胶质 BV-2 细胞炎症因子分泌[16];JAK1-STAT1 通路是众多细胞因子信号转导中的共同途径,参与细胞增殖、分化、凋亡、炎症等多种过程,参与炎症因子的传导与调控[17],其激活在甲型流感病毒FM1 诱导肺炎发生过程中发挥促进作用[18]。此外,miR-155 可调控下游靶标SOCS1 表达,导致JAK1-STAT1 通路磷酸化激活,进而使巨噬细极化、释放炎症因子,促进动脉粥样硬化进展[19]。以上研究表明,miR-155/JAK1-STAT1 可是在甲型流感病毒FM1 诱导肺炎发生发展机制中发挥重要作用。本研究显示,模型组肺组织中miR-155 低表达,JAK1-STAT1 通路处于激活状态,提示miR-155/JAK1-STAT1 通路参与肺损伤炎症过程,与上述研究一致。另添加SFJDC 后,随着剂量的升高,小鼠肺组织中miR-155 水平逐渐升高,JAK1-STAT1 通路激活程度降低,提示SFJDC 可升高miR-155、抑制JAK1-STAT1通路,这可能是SFJDC 缓解甲型流感病毒H1N1肺炎小鼠体内炎症发应的调控途径。故本研究在高剂量SFJDC 基础上进一步使用miR-155 siRNA 下调miR-155,结果显示JAK1-STAT1通路激活程度升高,炎症因子水平升高,SFJDC 对甲型流感病毒H1N1 肺炎小鼠的肺组织损伤的缓解作用减弱,表明SFJDC 通过升高miR-155,进而抑制JAK1-STAT1通路激活,降低炎症反应,缓解甲型流感病毒H1N1肺炎。

Figure 4. The miR-155 level,and the JAK1,p-JAK1,STAT1 and p-STAT1 protein levels in lung tissues of the mice in the 5 groups. Mean±SD. n=10.*P<0.05 vs control group;#P<0.05 vs model group;△P<0.05 vs low-dose SFJDC group;▲P<0.05 vs high-dose SFJDC group.图4 5组肺组织中miR-155及JAK1、p-JAK1、STAT1和p-STAT1蛋白水平
综上所述,SFJDC 可缓解甲型流感病毒H1N1 肺炎小鼠炎症损伤,其机制与升高miR-155、抑制JAK1-STAT1通路有关。

