人类τ蛋白聚集可通过升高T细胞内抗原1促进神经炎症*
刘侃玲, 张 瑶
(1华中科技大学同济医学院附属梨园医院心血管临床医学中心,湖北 武汉 430077;2华中科技大学同济医学院附属梨园医院内分泌科,湖北 武汉 430077)
过度磷酸化并错误折叠的人类τ 蛋白(human tau protein,hTau)参与20多种神经退行性疾病,如阿尔茨海默病(Alzheimer disease,AD)、额颞叶痴呆(frontotemporal dementia,FTD)等,被统称为τ 蛋白病(tauopathies)[1-2]。依据hTau 累积程度描述疾病进程的Braak 分期方法是一种国际认可的神经退行性疾病的病理诊断方法[3]。此外,脑脊液中的hTau 含量也与记忆能力呈负相关[4]。
神经炎症是神经退行性疾病早期的一个重要病理特征[5]。促炎因子如白细胞介素 1β(interleukin-1β,IL-1β)、白细胞介素6(interleukin-6,IL-6)和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)主要由包括小胶质细胞和星型胶质细胞在内的免疫细胞分泌[6]。正常情况下胶质细胞主要起支持与营养神经元作用,并具备吞噬异物和清除有害物质的功能[7]。除胶质细胞外,神经元也可分泌促炎因子,引起胶质细胞激活从而分泌更多促炎因子。在6 月龄转基因hTau小鼠中观察到胶质细胞增多和促炎因子水平上升等神经炎症相关指标,但未出现明显hTau 聚集与行为学改变等病理症状[8],提示早期神经炎症参与hTau 引起的神经退变,但相关分子机制尚未阐明。
材料和方法
1 实验动物及材料
2 月龄 SPF 级 C57 小鼠 10 只,体重(25±2)g,购于华中科技大学同济医学院医学动物实验中心,许可证号为SYXK(鄂)2021-0057。小鼠神经母胶质瘤N2a 细胞购于中国典型培养物保藏中心。包含hTau基因和T 细胞内抗原1(T-cell intracellular antigen 1,TIA1)基因的质粒由北京奥科鼎盛合成并构建于pEGFP-N1 质粒载体上。抗 GFP、TIA1 和 GAPDH 抗体购于武汉三鹰生物技术有限公司;抗丝裂原活化蛋白激酶磷酸酶1(mitogen-activated protein kinase phosphatase 1,MKP1)抗体购于武汉爱博泰克生物科技有限公司;抗细胞外信号调节激酶1/2(extracellular signal-regulated kinase 1/2,ERK1/2)、P38、c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)、p-ERK1/2、p-P38和p-JNK抗体购于Cell Signaling Technology;抗HT7 抗体(特异性识别过表达的hTau 蛋白)购于Thermo Fisher;携带hTau的腺相关病毒(hTau-carrying adeno-associated virus,hTau-AAV)购于上海禾元生物;免疫组化显色试剂盒购于武汉博士德生物工程有限公司。
2 方法
2.1 细胞培养与处理 N2a细胞培养于T25 细胞培养瓶,每2~3 d 更换新鲜培养基(DMEM+10%胎牛血清+1%青/链霉素)。对于TIA1 或hTau 过表达,N2a细胞提前种植于6 孔板,并于细胞密度达到70%~80%时进行转染,分成空载体(vector,VEC)组(转染pPEGFP-N1 质粒)、hTau 过表达组(转染pEGFP-hTau质粒)和TIA1 过表达组(转染pECFP-TIA1 质粒)。转染步骤如下:用50 μL无血清培养基分别稀释空载体与 TIAI 质粒 2 μg 并轻轻混匀;在另外 50 μL 无血清培养基加入2 μL质粒转染试剂。室温孵育5 min,将前两步所稀释的质粒与质粒转染试剂混合并混匀,室温放置20 min,每孔细胞中加入100 μL混合后的转染液,轻轻摇匀。N2a细胞在转染48 h后检测相关因子的mRNA 和蛋白表达。对于siRNA 转染,将细胞分成VEC+正常对照(normal contol,NC)组(转染空载体pEGFP-N1和siRNA 对照)、VEC+si-TIA1组(转染空载体pEGFP-N1 和TIA1siRNA)、hTau+NC 组(转染pEGFP-hTau 质粒和siRNA 对照)和hTau+si-TIA1 组(转染pEGFP-hTau 质粒和TIA1siRNA)。转染步骤参考上述描述。
2.2 Western blot N2a 细胞进行质粒转染48 h 后收集,加入含1 mmol/L PMSF 的RIPA 裂解液后,置于冰上裂解15 min,4 ℃低温离心机中以13 000 r/min离心10 min,吸取上清液,采用BCA 法测定蛋白浓度,然后煮沸10 min 变性。每组加入等量蛋白样品进行电泳和转膜。采用5%脱脂奶粉溶液室温封闭1 h,分别加入对应Ⅰ抗抗体和内参照抗体孵育过夜;TBST 清洗5 min×3 次。加入山羊抗兔或鼠Ⅱ抗(1∶1 000),室温孵育1 h,TBST 清洗5 min×3 次,采用ECL 显影,凝胶成像系统(ChemiScope 6000 Pro)扫描拍照。采用ImageJ软件测量灰度并进行统计分析。
2.3 免疫组织化学 C57 小鼠小鼠随机分为VEC组和hTau过表达组(hTau组),每组5只,VEC组小鼠海马 CA1 区注射 AAV-vector 空载病毒,hTau 组小鼠海马CA1区注射注射AAV-hTau,1×1012滴度1 μL,其中CA1 区定位坐标为:AP 1.8 mm,ML ±1.2 mm,DV 1.2 mm。4 周后采用4%多聚甲醛灌流固定并用冰冻切片机切片,厚度30 μm。小鼠脑切片用PBS漂洗5 min×3 次,1% TritonX-100 破膜 15 min;再用 0.3%双氧水去除内源性过氧化物酶30 min;最后用5%BSA 室温封闭 30 min,加入抗 HT7 或 MKP1 抗体(1∶100)孵育过夜;次日回收抗体后 PBS 洗 5 min×3 次,生物素标记Ⅱ抗IgG,37 ℃孵育30 min。PBS 冲洗,5 min×3 次。滴加底物试剂 SABC,37 ℃孵育30 min。PBS 冲洗,5 min×3 次。镜下控制反应时间滴加显色剂DAB。显色结束后使用自来水充分冲洗,最后脱水透明并封片。用Nikon 显微镜(SV120)拍照并使用ImageJ软件分析。
2.4 PCR 扩增 N2a 细胞转染质粒 48 h 后,使用Trizo(lInvitrigen)试剂盒提取总RNA,利用紫外分光光度计检测样品A260 和A280,计算RNA 浓度和纯度,各取1 μg,利用逆转录试剂盒(Yeasen)生成互补DNA 链(cDNA)。各取1 μL cDNA 作为模板,应用进行实施 PCR 扩增(Heal Force T960)。MKP1 上游引物序列为 5′-CCGCCTTGATCAACGTCTCA-3′,下游引物序列为 5′-GGAGCTGATGTCTGCCTTGT-3′;内参ACTB 上游引物序列为5'-CCCCTGAACCCTAAGGCCA-3',下游引物序列为5'-CGGAGTCCATCACAATGCCT-3′。反应程序为:95 ℃ 5 min,94 ℃ 30 s,59 ℃ 60 s,循环 35 次。PCR 产物采用琼脂糖凝胶分离,条带采用ImageJ软件进行灰度分析。
2.5 免疫荧光染色 细胞爬片采用多聚赖氨酸包被后种植N2a 细胞,然后进行质粒转染与培养。培养结束后细胞爬片采用4%多聚甲醛室温固定30 min;1%Triton X-100破膜5 min;0.3%双氧水去除内源性过氧化物酶30 min;最后用5% BSA 室温封闭30 min,加入抗MKP1 抗体(1∶100)孵育过夜;次日回收抗体后 PBS 洗 5 min×3 次。加入 FITC 标记的山羊抗兔Ⅱ抗(1∶150),避光室温孵育1 h;PBS洗5 min×3次,滴加核染料DAPI 避光室温孵育10 min,PBS 洗5 min×3 次,封片。每张片子随机选取5 个视野进行拍照,荧光显微镜下观察,采用ImageJ软件进行分析。
2.6 RNA 免疫沉淀 N2a 细胞转染 hTau 质粒 48 h后,将细胞培养基去除并用PBS漂洗3次。将细胞培养板置于紫外灯10 cm 下照射15 min,以固定RNA/蛋白复合物。加入裂解液[24 mmol/L Tris-HCl(pH 7.5),150 mmol/L KCl,2 mmol/L EDTA,0.5%NP40,1 mmol/L NaF,1 mmol/L DTT,100 U/mL RNasin]裂解细胞,冰上裂解10 min,将细胞刮下,4 ℃、14 000 r/min 离心 10 min,取出上清,加入 Protein A/G 树脂和抗TIA1 抗体,4 ℃旋转过夜。次日将复合物于4 ℃、8 000 r/min 离心 10 min 后,弃上清,再采用 Trizol 方法提取RNA。最后加入30 μL DEPC 水溶解后,用MKP1引物进行PCR扩增,PCR产物采用琼脂糖凝胶分离,条带采用ImageJ软件进行灰度分析。
3 统计学处理
实验数据采用SPSS 22.0 软件进行分析。数据以均数±标准误(mean±SEM)表示。两组间均数比较采用Student-t检验,多组间均数比较采用单因素方差分析及LSD-t检验。以P<0.05为差异有统计学意义。
结 果
1 过表达hTau 激活丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)通路并促进炎症因子产生
为研究hTau 与炎症因子相关通路的关系,我们首先将包含hTau基因的质粒转染入N2a 细胞,48 h后将细胞收集并裂解。采用Western blot 验证与炎症通路相关的MAPK 通路,这条信号通路包括ERK1/2、P38 与 JNK 等因子。如图 1A 所示,与空载体对照组相比,过表达hTau 显著激活ERK1/2、P38和JNK 的磷酸化。此外,细胞内的促炎因子IL-1β、IL-6和TNF-α 表达水平显著上升(图1B)。以上结果提示,过表达hTau可能通过激活MAPK通路,促进炎症因子的产生。
2 过表达hTau下调MKP1蛋白水平
MAPK 通路的活性受上游MKP1 的调控。采用免疫组织化学染色发现,与空载体对照组相比,C57小鼠过表达hTau 蛋白4 周后(图2A),海马CA1(cornu ammonis 1)区和齿状回(dentate gyrus,DG)区MKP1 表达显著减少(图 2B)。N2a 细胞转染hTau 质粒后,MKP1 的免疫荧光强度比空载体对照组弱(图2C)。Western blot 也验证过表达 hTau 降低 N2a 细胞MKP1 的蛋白水平(图2D)。以上结果提示,在细胞和动物水平上过表达hTau 均可下调MKP1 的蛋白水平。
3 敲减TIA1 抑制hTau 诱导的MKP1 蛋白水平降低
TIA1 作为一个 RNA 结合蛋白,在 mRNA 水平调控多种蛋白因子的表达。研究表明,TIA1 受到hTau调控并影响其 RNA 结合与调控能力[9],但 TIA1 是否参与hTau 抑制MKP1 的过程尚未见报道。在N2a 细胞过表达hTau 质粒转染48 h 后发现,hTau 在诱导MKP1 下调时,上调TIA1 的蛋白水平(图3A)。为验证TIA1 是否介导hTau 对MKP1 的下调作用,我们在过表达hTau 的同时采用siRNA 下调TIA1,观察到敲减TIA1可恢复由hTau 诱导的MKP1 下降,同时抑制MAPK通路的激活(图3B)。
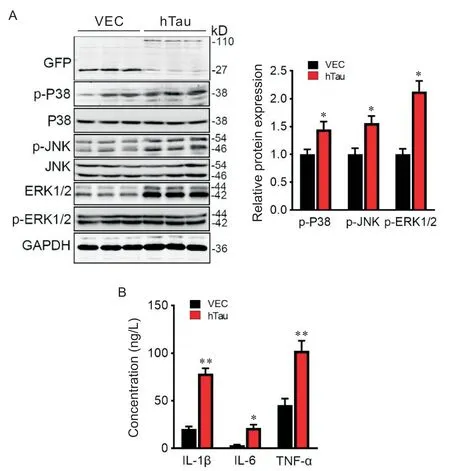
Figure 1. Overexpression of hTau activated MAPK pathway and increased proinflammatory factors. A:after transfection with hTau plasmid,N2a cells were collected and analyzed by Western blot using GFP(tagging hTau plasmid),p-P38,p-JNK and p-ERK1/2 antibodies,and the protein levels of p-P38,p-JNK and p-ERK1/2 in N2a cells were shown;B:the concentrations of IL-1β,IL-6 and TNF-α in N2a cells 48 h after transfection with hTau plasmid. Mean±SEM. n=3.*P<0.05,**P<0.01 vs vector(VEC)group.图1 过表达hTau激活MAPK通路并上调促炎因子水平
4 过表达TIA1下调MKP1蛋白水平
为进一步确认TIA1 为MKP1 的上游调控因子,我们在N2a 细胞内分别过表达hTau 和TIA1,观察到过表达TIA1 在下调MKP1 的同时激活MAPK 通路,上调相关炎症因子的表达,与过表达hTau 蛋白效果相似(图4A)。以上结果进一步确证了MKP1蛋白表达水平受到TIA1的调控。
5 TIA1 结合 MKP1 mRNA 并降低 MKP1 mRNA水平
TIA1 作为RNA 结合蛋白,其主要功能是结合RNA 序列调控基因的表达。通过PCR 检测发现,与空载体对照组相比,MKP1的mRNA 表达水平在过表达hTau和TIA1组均显著下降(图5A)。采用RNA 免疫沉淀方法,在过表达hTau 的N2a 细胞用TIA1 抗体将与之结合的RNA 沉淀,使用MKP1 特异性引物进行扩增发现,MKP1 mRNA 与TIA1 结合在过表达hTau 组明显上升(图5B)。这提示TIA1 可能与MKP1 mRNA结合并抑制其转录乃至翻译。
讨 论
hTau与神经退行性疾病的关联一直被不断的临床数据与动物实验证实,但其基本作用机制尚未被完全阐明。本研究发现,过表达hTau 通过上调TIA1降低MKP1的mRNA 和蛋白水平,激活MAPK 通路并促进炎症因子产生和释放。这为研究τ 蛋白病提供了一个潜在的治疗靶点。
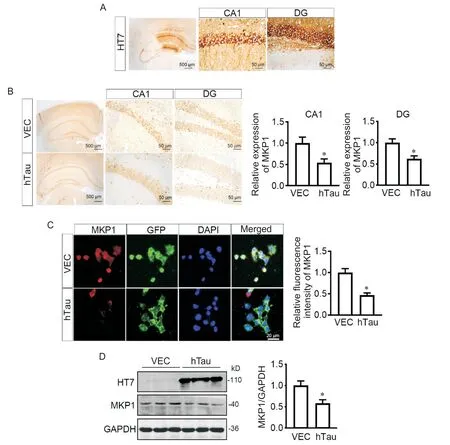
Figure 2. Overexpression of hTau decreased the protein level of MKP1 in mouse hippocampus. A:AAV-hTau was injected into hippocampal CA1 region of C57 mice,and the hippocampus was examined by immunohistochemistry using HT7 antibody(specific recognition epitope of hTau)4 weeks later;B:representative images of MKP1 stained in the hippocampus of C57 mice 4 weeks after injection of AAV-hTau,and relative expression of MKP1 in CA1 and DG regions;C:representative images of MKP1 stained in N2a cells 48 h after transfection with hTau plasmid,and the fluorescence intensity of MKP1;D:the protein level of MKP1 in N2a cells 48 h after transfection with hTau plasmid was detected by Western blot. Mean±SEM. n=3.*P<0.05 vs vector(VEC)group.图2 过表达hTau降低小鼠海马MKP1蛋白水平
神经炎症主要表现是小胶质细胞过度激活从而释放促炎因子[10]。虽然hTau 主要聚集在神经元,但可通过传播并激活小胶质细胞[11],表明神经元是激活小胶质细胞的关键因素。有研究者提出关于炎症与AD 病理的假说表明,炎症应激的神经元内过度磷酸化的hTau 与聚集hTau 在树突的错误定位可导致β-淀粉样蛋白前体(amyloid β-protein precursor,APP)生成增加[12-13]。在生理条件下,产生的APP聚集物被小胶质细胞清除。但在病理性衰老的背景下,随着促炎细胞因子释放增加,小胶质细胞吞噬功能失调并过度激活,这将导致暴露于促炎环境中的神经元没有小胶质细胞的保护而受到损伤。轴突细胞骨架的破坏和轴突运输的障碍,以及损伤神经突无法被过度反应小胶质细胞清除都表明神经元损伤[14]。在这过程中,促炎因子起着重要的介导作用[15]。因此,抑制促炎因子的产生与释放可有效减缓疾病的进程。MAPK 通路通过激活NF-κB 直接参与促炎因子的转录和翻译,抑制MAPK 通路也可在一定程度上改善与神经炎症相关的疾病模型[16]。本研究发现,细胞过表达hTau 可激活MAPK 通路,但未观察到APP 蛋白的表达增加(数据未展示),可能是体外细胞实验表达hTau时间短未观察到相关变化所致。
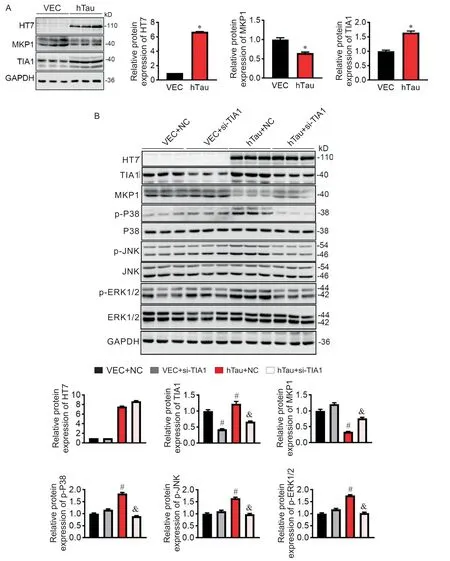
Figure 3. Knockdown of TIA1 inhibited hTau-induced decrease in MKP1 and activation of MAPK pathway. A:overexpression of hTau in N2a cells for 48 h induced decreased MKP1 along with increased TIA1;B:knockdown of TIA1 by siRNA in N2a cells transfected with hTau plasmid increased protein level of MKP1 and inhibited MAPK pathway. Mean±SEM. n=3.*P<0.05 vs vector(VEC)group;#P<0.05 vs VEC+normal control(NC)group;&P<0.05 vs hTau+NC group.图3 敲减TIA1抑制hTau诱导的MKP1下降及MAPK通路激活
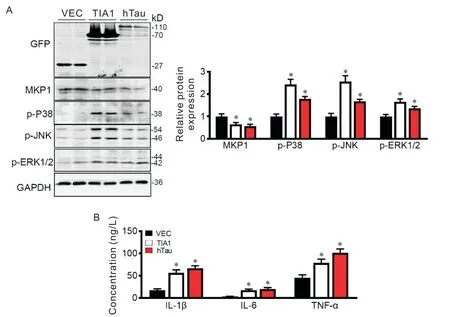
Figure 4. Overexpression of TIA1 induced decrease in MKP1 and activation of MAPK pathway in N2a cells. A:Western blot analysis of MKP1,p-P38,p-JNK and p-ERK1/2 in N2a cells 48 h after transfection with TIA1 or hTau plasmid;B:the concentrations of IL-1β,IL-6 and TNF-α in N2a cells 48 h after transfection with TIA1 or hTau plasmid. Mean±SEM. n=3.*P<0.05 vs vector(VEC)group.图4 过表达TIA1降低MKP1蛋白水平并激活MAPK通路
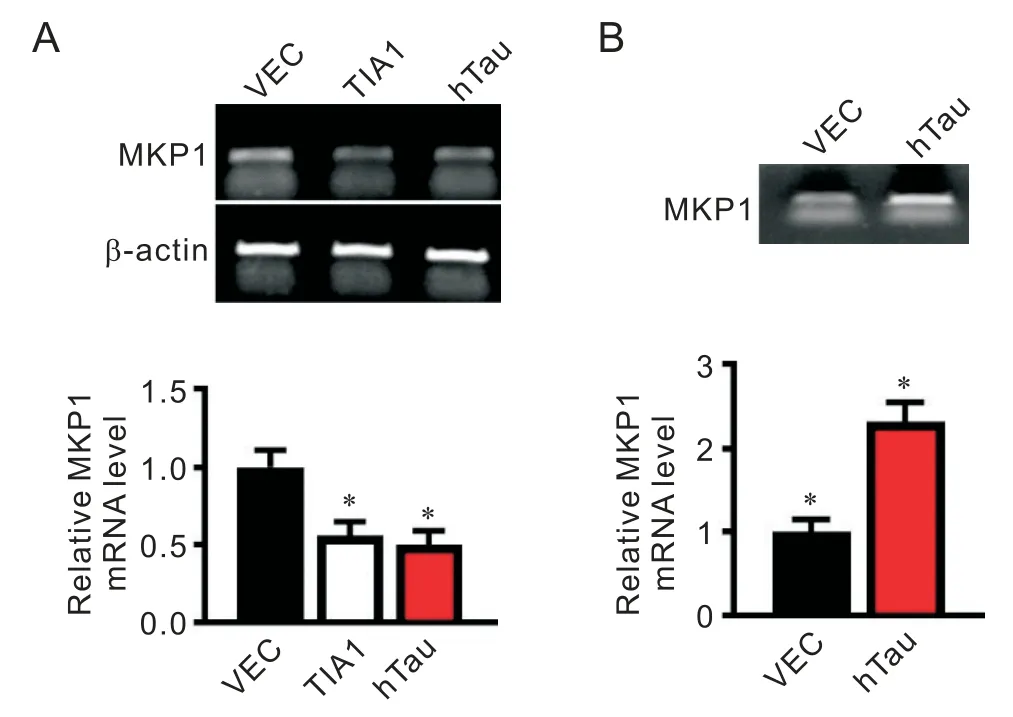
Figure 5. TIA1 bound to MKP1 mRNA and inhibited its expression. A:representative image of MKP1 mRNA expression after overexpression of TIA1 or hTau in N2a cells,and relative mRNA level of MKP1 in N2a cells;B:representative image of MKP1 mRNA after RNA immunoprecipitation in N2a cells transfected with hTau,and relative mRNA level of MKP1 in N2a cells. Mean±SEM. n=3.*P<0.05 vs vector(VEC)group.图5 过表达TIA1通过结合MKP1 mRNA抑制其转录
一项研究表明,MKP1在亨廷顿病患者脑组织中的表达下调[17];在APP转基因小鼠中也发现MKP1的表达呈下降趋势[18],表明MKP1 与神经退行性疾病有关联。MKP1 属于 MAPK 家族,是 P38、JNK 和ERK1/2 的主要负调控因子。MKP1 参与氧化应激、炎症反应和细胞凋亡,通过调节MAPK 信号通路来调节各种疾病,在许多疾病的发生和发展中起着关键作用。由于MAPK 通路在炎症的起始阶段必不可少,MKP1 被认为是炎症消退中的关键[19]。MKP1全敲除小鼠对内毒素血症、败血症和其他炎症性疾病模型非常敏感[20]。因此,调控MKP1 表达对于抗炎作用显得尤为重要。在本次实验中发现,过表达hTau 可抑制MKP1 表达,而这依赖于TIA1 作为RNA结合蛋白调控MKP1 mRNA 的翻译。降低TIA1 表达可显著减轻转基因hTau(P301S)小鼠模型的神经变性[9]。在外周组织细胞受到外界应激时,TIA1 起抗炎作用,是因为它可结合到细胞质应激颗粒中的促炎和促凋亡介质的mRNA 上并抑制其翻译[21]。但在中枢组织里,TIA1 的作用完全不一样。降低TIA1 含量起神经保护作用证明了其在传播τ 蛋白低聚物介导的神经退行性变中是必要的,TIA1 介导内源性和外源性τ 蛋白的神经退行性变。在本研究中也得到相似的实验结果。过表达TIA1抑制MKP1表达并激活MAPK 通路,RNA 免疫沉淀实验证明其与MKP1 mRNA 的结合增加,但MKP1 mRNA 的翻译减少,表明TIA1对MKP1起翻译抑制作用。
本研究发现,过表达hTau 通过TIA1 负向调控MKP1,进而激活MAPK 信号通路,促进下游炎症因子的产生与释放,最终导致神经炎症的发生。但本次实验主要在体外细胞模型进行,缺乏动物实验证据,下一步的探索将集中在动物水平进行。
——一道江苏高考题的奥秘解读和拓展

