异甘草酸镁对博来霉素诱导肺纤维化大鼠治疗作用及其机制
高 瑕,代文静,曾 军,冯 同,李万成
特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)是一种不可逆转的慢性、进行性、致命性肺部疾病,预后较差,中位生存期2~4年[1],5年生存率<30%[2],最终多因呼吸衰竭死亡。IPF发生的主要病理机制是因毒物、射线和环境等各种因素导致肺泡上皮细胞持续受到损伤,随后肺成纤维细胞不断增殖和凋亡造成大量促炎、促纤维化因子释放及大量细胞外基质沉积于肺,最后导致肺纤维化形成[3]。IPF的发病机制极其复杂,具体机制至今仍尚未完全明确,除了各种促纤维化因子异常表达外,有研究发现氧化-抗氧化失衡导致的氧化应激反应也参与了肺纤维化的形成[4]。近年,IPF发病率不断升高[5]。虽现临床对肺纤维化治疗的研究已广泛开展,但有效的治疗选择仍然有限[6],糖皮质激素仍是治疗IPF的主要药物。因此,探寻肺纤维化发病机制及寻找其他治疗肺纤维化有效药物已成为临床亟待解决的问题。
异甘草酸镁(MgIG)是从药用植物甘草根部提取的具有抗炎、抗凋亡、抗纤维化和抗肿瘤等多种生物活性的物质,是甘草酸第4代合成药物[7],在治疗肝炎和肝纤维化方面有较好的效果[8]。近年有研究发现,MgIG对百草枯中毒导致的肺部损伤和放射诱导的肺纤维化也有一定治疗作用[9-11]。然而,现MgIG应用于博来霉素(BLM)诱导的肺纤维化模型中的研究甚少,故本研究通过气管内注射BLM构建肺纤维化大鼠模型,分析MgIG对其血清中超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)含量和肺组织转化生长因子-β1(transforming growth factor-β1,TGF-β1)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、γ-干扰素(interferon-γ,IFN-γ)表达的影响,探讨MgIG对肺纤维化治疗作用及其可能机制。
1 材料与方法
1.1材料
1.1.1实验动物:清洁级成年健康雄性SD大鼠24只,体质量(220+20)g,由成都达硕实验动物有限公司提供[实验动物合格证号:SYXK(川)2019-189]。
1.1.2主要试剂:BLM粉剂购自成都梓诚奕博生物科技有限公司,MgIG注射液购自正大天晴药业集团股份有限公司,注射用甲泼尼龙琥珀酸钠(MTH)购自国药集团容生制药有限公司,Masson染色试剂盒购自北京索莱宝生物科技有限公司,SOD和MDA检测试剂盒均购自南京建成生物工程公司,TGF-β1、TNF-α和IFN-γ抗体购自英国Abcam公司,RIPA裂解液、广谱蛋白酶抑制剂、BCA蛋白测定试剂盒购自武汉BOSTER生物公司。
1.1.3主要仪器:生物组织包埋机、全自动切片机(金华市益迪医疗设备有限公司生产),荧光倒置显微镜(德国Leica公司生产),凝胶成像仪(上海天能科技有限公司生产)。
1.2方法
1.2.1动物模型制备及药物干预:将24只SD大鼠随机分为Control组、BLM组、BLM+MgIG组和BLM+MTH组4组,每组6只。每只大鼠腹腔注射10%水合氯醛(剂量0.3 ml/100 g)进行麻醉,消毒大鼠颈部皮肤,按无菌原则切开颈部皮肤,逐层分离组织,暴露气管。BLM组、BLM+MgIG组和BLM+MTH组向气管内缓慢注射BLM溶液(剂量5 mg/kg),Control组向气管内注入等量0.9%氯化钠注射液。注射后立即将大鼠旋转几分钟,使药物尽可能均匀分布于肺部。造模成功24 h后,BLM+MgIG组每日腹腔注射30 mg/kg MgIG注射液1次,BLM+MTH组每日腹腔注射4.5 mg/kg注射用MTH 1次,Control组和BLM组每日腹腔注射等量0.9%氯化钠注射液。
1.2.2取材及病理组织学观察:连续给药28 d后,处死所有大鼠,切开腹腔,取腹主动脉全血5 ml,吸取离心后的上清液保存于-80℃,待全部血清采集完后按照SOD及MDA检测试剂盒说明书步骤进行操作。取左肺下叶组织固定于4%多聚甲醛中,置于4℃冰箱过夜后进行组织脱水、包埋、切片,Masson染色进行病理组织学观察。参照Szapiel等[12]报道的方法对肺纤维化程度进行评分:无纤维化为0分,纤维化面积<20%为1分,纤维化面积20%~50%为2分,纤维化面积≥50%为3分。
1.2.3免疫组织化学检查:组织脱蜡、水化,3%过氧化氢孵育8 min消除内源性过氧化物酶活性,微波炉中火10 min修复抗原,滴加5% BSA封闭30 min,分别滴加TGF-β1(1∶200)、TNF-α(1∶400)和IFN-γ(1∶200)抗体,4℃冰箱过夜,滴加二抗37℃孵育30 min,滴加DAB显色剂显色,复染,乙醇脱水,二甲苯透明,封片,显微镜下观察。
1.2.4蛋白质印迹法检测:取150 mg肺组织,在液氮中不断研磨组织,裂解液和广谱蛋白酶抑制剂裂解组织,离心,提取组织蛋白,配置蛋白标准配置液和BCA工作液,按照说明书进行蛋白浓度测定,制备分离胶和浓缩胶,将聚合好的浓缩胶玻璃板放入电泳槽,加入样品,打开电泳仪跑胶,跑胶结束后准备PVDF膜、滤纸及海绵立即进行转膜,转膜结束后,将PVDF膜放入5%脱脂奶粉中进行封闭,滴加一抗GAPDH(1∶200)、TGF-β1(1∶800)、TNF-α(1∶800)和IFN-γ(1∶400),4℃冰箱过夜,加入二抗,洗膜,滴加发光液,凝胶扫描成像曝光成像。
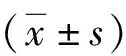
2 结果
2.1Masson染色及肺纤维化评分比较 Masson染色结果显示,Control组肺组织未出现病理改变,肺泡结构清晰,形态正常,未见胶原纤维沉积;BLM组肺组织出现明显病理改变,肺泡正常结构消失,肺组织重建,可见大量蓝色胶原纤维沉积,纤维化程度明显;BLM+MgIG组和BLM+MTH组肺泡结构破坏和纤维组织增生程度较BLM组均有所减轻,蓝色胶原纤维相较于BLM组也均有所减少,但BLM+MgIG组病变减轻程度较BLM+MTH组更明显,见图1。肺纤维化程度评分结果显示,Control组、BLM组、BLM+MgIG组和BLM+MTH组分别为(0.02±0.001)、(2.94±0.03)、(1.62±0.06)和(1.85±0.05)分,4组总体比较差异有统计学意义(P<0.05);Control组低于其他3组,BLM组高于BLM+MgIG组和BLM+MTH组,BLM+MgIG组低于BLM+MTH组,差异有统计学意义(P<0.05)。

图1 采用不同处理方式大鼠4组肺组织病理组织学检查结果(Masson×200)
2.2血清SOD和MDA含量比较 Control组、BLM组、BLM+MgIG组和BLM+MTH组4组血清SOD和MDA含量总体比较差异有统计学意义(P<0.05)。Control组血清SOD高于其他3组,血清MDA低于其他3组;BLM组血清SOD低于BLM+MgIG组和BLM+MTH组,血清MDA高于BLM+MgIG组和BLM+MTH组;BLM+MgIG组血清SOD高于BLM+MTH组,血清MDA低于BLM+MTH组,差异有统计学意义(P<0.05)。见表1。

表1 采用不同处理方式大鼠4组血清SOD和MDA含量比较
2.3免疫组织化学检查结果比较 TGF-β1:Control组肺泡结构正常,未见或极少有棕黄色TGF-β1表达;BLM组肺组织破坏明显,可见大量棕黄色TGF-β1表达;BLM+MgIG组和BLM+MTH组肺组织棕黄色表达区域较BLM组减少,见图2。TNF-α:Control组未见或有少许TNF-α表达;BLM组TNF-α表达较Control组明显增加;BLM+MgIG组和BLM+MTH组TNF-α棕黄色表达区域较BLM组减少,见图3。IFN-γ:Control组可见大量IFN-γ棕黄色表达;BLM组肺组织破坏明显,可见少许棕黄色IFN-γ表达;BLM+MgIG组和BLM+MTH组棕黄色表达区域较BLM组增加,见图4。Control组、BLM组、BLM+MgIG组和BLM+MTH组4组肺组织TGF-β1、TNF-α和IFN-γ表达总体比较差异有统计学意义(P<0.05)。Control组肺组织TGF-β1和TNF-α表达低于其他3组,肺组织IFN-γ表达高于其他3组;BLM组肺组织TGF-β1和TNF-α表达高于BLM+MgIG组和BLM+ MTH组,肺组织IFN-γ表达低于BLM+MgIG组和BLM+MTH组;BLM+MgIG组肺组织TGF-β1和TNF-α表达低于BLM+MTH组,肺组织IFN-γ表达高于BLM+MTH组,差异有统计学意义(P<0.05)。见表2。
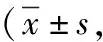
表2 采用不同处理方式大鼠4组肺组织TGF-β1、TNF-α和IFN-γ表达平均积分光密度)

图2 采用不同处理方式大鼠4组肺组织TGF-β1免疫组织化学检查结果(免疫组织化学×400)

图3 采用不同处理方式大鼠4组肺组织TNF-α免疫组织化学检查结果(免疫组织化学×400)

图4 采用不同处理方式大鼠4组肺组织IFN-γ免疫组织化学检查结果(免疫组织化学×400)
2.4蛋白质印迹法检测结果比较 大鼠肺组织TGF-β1和TNF-α蛋白Control组表达量较低,BLM组表达量升高,BLM+MgIG组和BLM+MTH组表达量低于BLM组;大鼠肺组织IFN-γ蛋白Control组表达量较高,BLM组表达量降低,BLM+MgIG组表达量较BLM组明显增加,BLM+MTH组和BLM组表达量比较无明显差异,见图5。
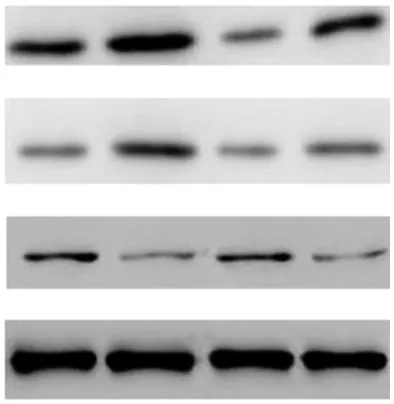
图5 采用不同处理方式大鼠4组肺组织TGF-β1、TNF-α和IFN-γ蛋白表达比较
3 讨论
IPF是一种以肺泡上皮细胞损伤、炎性细胞浸润、成纤维细胞增殖、细胞外基质异常积聚和肺组织重建异常为特征的致命性进展性肺部疾病[13]。气管内注射BLM诱导的肺纤维化动物模型与人类IPF的进程最为相似,这也是目前应用最经典的实验性肺纤维化动物模型[14]。本研究通过大鼠气管内注射BLM构建肺纤维化模型,Masson染色结果显示,Control组肺组织未出现病理改变,肺泡结构清晰,形态正常,未见胶原纤维沉积;BLM组肺组织出现明显病理改变,肺泡正常结构消失,肺组织重建,可见大量蓝色胶原纤维沉积,纤维化程度明显,表明本研究模型构建是成功的。
虽然肺纤维化的发病机制现尚未完全明确,但越来越多的研究表明,氧化应激在IPF中起着重要作用[15-16]。分析其原因主要是由于氧化剂和抗氧化蛋白功能不平衡,氧化应激通过激活氧化还原敏感信号通路、改变免疫细胞功能和激活成纤维细胞,进而参与肺纤维化形成。正常的肺内稳态需要细胞内和细胞外氧化剂和抗氧化剂之间的适当平衡。保护性抗氧化剂和抗氧化酶可保护肺免受氧化剂侵害[17]。SOD和MDA是反映机体抗氧化能力和细胞氧化剂对机体损伤的2个重要指标[18]。SOD是人体内重要的抗氧化金属酶。MDA是膜脂过氧化最重要的产物之一,可间接反映细胞损伤的程度。杨军[19]研究发现,在BLM诱导肺纤维化大鼠模型中,中药黄芪可通过增加SOD活性,降低MDA含量,达到治疗肺纤维化的作用。本研究结果显示,Control组血清SOD高于其他3组,血清MDA低于其他3组;BLM组血清SOD低于BLM+MgIG组和BLM+MTH组,血清MDA高于BLM+MgIG组和BLM+MTH组;BLM+MgIG组血清SOD高于BLM+MTH组,血清MDA低于BLM+MTH组,差异有统计学意义。表明BLM诱导肺纤维化大鼠模型血清SOD含量明显下降,血清MDA含量明显增加,且给予药物干预后血清SOD含量有所升高,MDA含量有所下降。进一步证明氧化应激参与了BLM致肺纤维化的形成,并提示MgIG可能通过减轻氧化应激缓解肺纤维化。
TGF-β1是肺纤维化进展过程中主要促纤维化细胞因子,诱导肺成纤维细胞向肌成纤维细胞分化,产生高水平胶原,导致肺弹性和功能的丧失[20]。黄坤等[21]研究发现,TGF-β1在BLM诱导的肺纤维化模型组中表达明显增加,甘草酸二胺联合骨髓间充质干细胞移植治疗后TGF-β1表达降低,且肺纤维化得到一定程度的缓解。此外,TNF-α也是参与肺纤维化形成的重要细胞因子。张兴和张炜[22]研究表明在肺间质纤维化模型中,TNF-α表达明显升高,给予生地提取物干预后TNF-α表达有所下降。本研究结果显示,Control组肺组织TGF-β1和TNF-α表达低于其他3组,BLM组肺组织TGF-β1和TNF-α表达高于BLM+MgIG组和BLM+MTH组,BLM+MgIG组肺组织TGF-β1和TNF-α表达低于BLM+MTH组,差异有统计学意义。说明BLM诱导的肺纤维化大鼠模型肺组织TGF-β1和TNF-α表达均升高,给予药物干预后肺组织TGF-β1和TNF-α表达有所下降。IFN-γ是一种抗纤维化细胞因子,殷宗宝等[23]实验发现,在肺纤维化大鼠模型中,大鼠肺组织IFN-γ染色较淡,表达水平显著下降,甘草酸二铵干预后IFN-γ染色反应增强且表达水平较模型组有所增加。本研究结果显示,Control组肺组织IFN-γ表达高于其他3组,BLM组肺组织IFN-γ表达低于BLM+MgIG组和BLM+MTH组,BLM+MgIG组肺组织IFN-γ表达高于BLM+MTH组,差异有统计学意义。说明BLM诱导的肺纤维化大鼠模型肺组织IFN-γ表达下降,经药物干预后肺组织IFN-γ表达上调。
总之,MgIG能改善BLM诱导肺纤维化大鼠肺纤维化,机制可能与减轻氧化应激,抑制炎性因子表达,促进抗纤维化因子分泌有关。

