人参皂苷Rg1 调节miR-144-3p/FPR2/p38 信号通路对实验性脑出血大鼠血脑屏障损伤和神经炎症的影响
白雅林 方占海 丁晨哲 兰彦平 刘带林 齐高洋 陈 磊 王军成
(宁夏回族自治区人民医院,银川 740001)
脑出血是脑实质血管破裂引起的出血,占脑卒中的20%~30%,病死率较高,脑出血后会继发严重的炎症反应及毒性损伤[1]。血脑屏障受损是脑继发损伤的重要原因,血脑屏障可阻碍血液中的一些有害物质进入大脑进而损伤大脑,对中枢神经系统维持具有重要生物学意义[2]。因此,保护血脑屏障并降低神经炎症是治疗脑出血的方向之一。目前脑出血治疗仍缺乏有效药物,寻找保护血脑屏障、降低神经炎症的治疗方法是有待研究课题。人参对中枢神经系统、内分泌系统、心血管系统具有广泛作用,可增强机体抵抗力,人参皂苷Rg1作为人参干燥根的提取物,具有抗炎、抗氧化应激等功效[3-4]。杜姝等[5]研究显示,人参皂苷Rg1 可减轻癫痫大鼠海马神经元损伤,但对脑出血患者作用的研究较少。甲酰基肽受体2(formyl peptide receptor 2,FPR2)是与神经炎症关系密切的因子之一,在外界刺激下可介导炎症作用,通过调控NF-κB、MAPK 等通路参与脑出血神经炎症进展[6-7]。生信网站分析显示miR-144-3p 与FPR2 存在靶向作用关系,且miR-144-3p 在脑出血中表达上调[8]。基于此,本研究探讨人参皂苷Rg1 对实验性脑出血大鼠血脑屏障、神经炎症的治疗作用及可能机制。
1 材料与方法
1.1 材料 90 只SD 大鼠购自常州卡文斯实验动物有限公司,许可证号:SCXK(苏)2021-0013;人参皂苷Rg1(B21057)、胶原酶Ⅱ(S10054)、伊文思蓝(EB)(R20616)购自上海源叶生物科技有限公司;ago-miR-144-3p 由上海生工生物工程技术有限公司构建;TNF-α ELISA 试剂盒(ml002953)、IL-6 ELISA试剂盒(ml102828)、IL-1β ELISA 试剂盒(ml003057)购自上海酶联生物科技有限公司;总RNA 抽提试剂盒(12183016)、逆转录试剂盒(4366597)、总蛋白提取试剂盒(89842)购自赛默飞世尔科技公司;兔源FPR2(ab203129)、p-p38(ab178867)、p38(ab170099)、GAPDH(ab9485)一抗、山羊抗兔二抗(ab6721)购自美国Abcam公司。
1.2 方法
1.2.1 脑出血模型大鼠构建及分组 90 只SD 大鼠随机分为对照组、脑出血组、人参皂苷Rg1低剂量组、人参皂苷Rg1 高剂量组、人参皂苷Rg1 高剂量+ago-miR-144-3p 组,每组18 只,除对照组外,其余各组均构建脑出血大鼠模型,即术前禁食12 h,禁水4 h,戊巴比妥钠麻醉,于右侧尾状核(前囟0.2 mm、中线右侧3 mm、深6 mm处)注射0.5 U胶原酶Ⅱ,注射完毕后留针5 min,对照组以等量生理盐水代替[9]。术后保温,大鼠麻醉苏醒后采用Longa 法评分,1~3 分代表造模成功。造模成功后,人参皂苷Rg1 低剂量组、人参皂苷Rg1 高剂量组、人参皂苷Rg1 高剂量+ago-miR-144-3p 组大鼠分别腹腔注射10 mg/kg、40 mg/kg、40 mg/kg 人参皂苷Rg1[10],人参皂苷Rg1高剂量+ago-miR-144-3p组脑内1次注射5 μl ago-miR-144-3p,注射完毕退针,对照组、脑出血组连续7 d注射等量生理盐水,1次/d,连续给药14 d。
1.2.2 大鼠神经功能损伤评分 给药前、末次给药后各组大鼠均进行Longa 评分,0 分:无神经功能损伤;1 分:大鼠不能完全伸直前肢;2 分:大鼠一侧瘫痪,存在追尾现象;3 分:大鼠不能打滚及站立;4分:大鼠无法进行自发性活动,存在意识障碍。
1.2.3 脑含水量测定 每组随机选取6只大鼠,戊巴比妥钠麻醉后断头取脑,电子天平测湿重,烘干后测干重,脑含水量(%)=(湿重-干重)/湿重×100%。
1.2.4 ELISA检测大鼠脑组织匀浆炎症因子TNF-α、IL-6、IL-1β水平 每组随机选取6只大鼠,戊巴比妥钠麻醉后断头取脑,取大鼠部分血肿周围组织,匀浆后按照TNF-α、IL-6、IL-1β试剂盒测定TNF-α、IL-6、IL-1β 水平。部分血肿周围组织修剪约1 mm3后戊二醛溶液中浸泡;部分血肿周围组织冷冻保存。
1.2.5 大鼠血脑屏障结构观察 选取1.2.4中戊二醛浸泡的脑组织,固定、脱水、包埋,切片(5 μm),醋酸铀和枸橼酸铅染色,透射电镜观察超微结构,每组设3个重复。
1.2.6 大鼠血脑屏障通透性观察 每组随机选取6 只大鼠,处死前尾静脉注射4 ml/kg EB,1 h 后戊巴比妥钠麻醉并断头处死大鼠,取右脑,称重后添加三氯乙酸匀浆过夜,添加至含5 ml 50%甲酰胺溶液试管,孵育24 h,离心(15 000 r/min、30 min)取上清,测定632 nm 处吸光度,绘制标准曲线,以EB 含量代表血脑屏障通透性,每组设3 个重复。EB 渗出率(μg/g 脑湿重)=EB 浓度(μg/ml)×甲酰胺容积(ml)/湿重(g)。
1.2.7 qRT-PCR 检 测miR-144-3p、FPR2 mRNA、p38 mRNA 水平 TRIzol 法提取各组大鼠脑组织RNA,逆转录为cDNA 后qRT-PCR 扩 增,2-∆∆Ct分析miR-144-3p、FPR2 mRNA、p38 mRNA 相对表达,分别以U6和GAPDH为内参,引物序列见表1。

表1 qRT-PCR引物Tab.1 qRT-PCR primers
1.2.8 Western blot 检测FPR2、p38 蛋白表达 裂解各组大鼠脑组织,15 000 r/min 离心5 min,收集上清,蛋白提取试剂盒提取总蛋白,BCA 试剂盒定量蛋白,行SDS-PAGE 电泳,转膜(PVDF)后封闭(5%脱脂奶粉),添加FPR2、p-p38、p38、GAPDH 一抗(稀释比均为1∶1 000),孵育过夜,添加HRP 标记的IgG山羊抗兔二抗孵育1 h,ECL试剂显色后凝胶成像仪曝光、观察,Image J 软件分析FPR2、p38 蛋白灰度值,并计算其含量,每组设3个重复。
1.3 统计学分析 采用SPSS22.0 软件分析数据,所有数据以±s表示,多组间比较采用单因素方差分析,进一步两两比较采用SNK-q检验,P<0.05 为差异有统计学意义。
2 结果
2.1 人参皂苷Rg1 对大鼠神经功能损伤评分的影响 给药前,与对照组相比,各组大鼠神经功能损伤评分均升高(P<0.05),各组间差异无统计学意义(P>0.05);末次给药后,与对照组相比,脑出血组大鼠神经功能损伤评分升高(P<0.05);与脑出血组相比,人参皂苷Rg1低剂量组、人参皂苷Rg1高剂量组大鼠神经功能损伤评分降低(P<0.05),组间差异有统计学意义(P<0.05);与人参皂苷Rg1 高剂量组相比,人参皂苷Rg1 高剂量+ago-miR-144-3p 组大鼠神经功能损伤评分升高(P<0.05,表2)。
表2 人参皂苷Rg1 对大鼠神经功能损伤评分的影响(±s,n=18)Tab.2 Effect of ginsenoside Rg1 on neurological injury score of rats (±s, n=18)
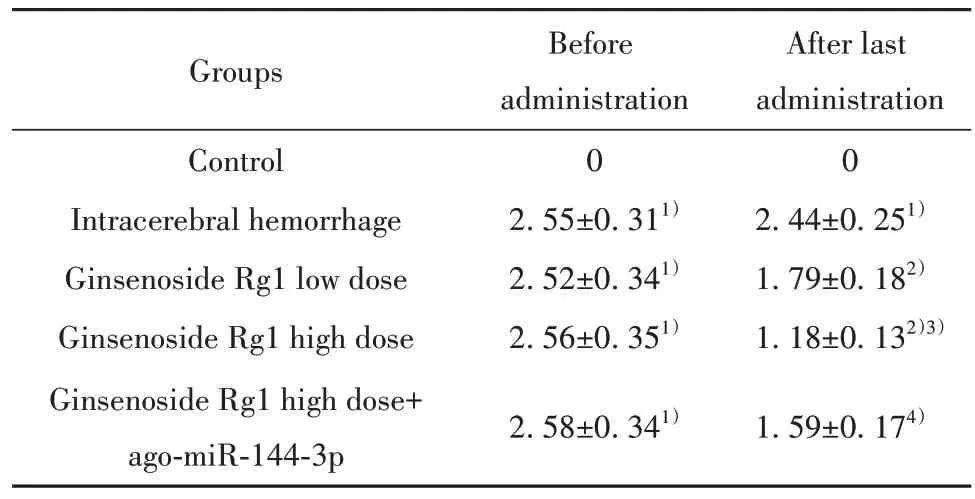
表2 人参皂苷Rg1 对大鼠神经功能损伤评分的影响(±s,n=18)Tab.2 Effect of ginsenoside Rg1 on neurological injury score of rats (±s, n=18)
Note:Compared with control group, 1)P<0.05; compared with intracerebral hemorrhage group, 2)P<0.05; compared with ginsenoside Rg1 low dose group, 3)P<0.05; compared with ginsenoside Rg1 high dose group, 4)P<0.05.
Groups Control Intracerebral hemorrhage Ginsenoside Rg1 low dose Ginsenoside Rg1 high dose Ginsenoside Rg1 high dose+ago-miR-144-3p Before administration 0 2.55±0.311)2.52±0.341)2.56±0.351)After last administration 0 2.44±0.251)1.79±0.182)1.18±0.132)3)2.58±0.341)1.59±0.174)
2.2 人参皂苷Rg1 对大鼠脑含水量的影响 与对照组相比,脑出血组大鼠脑含水量增加(P<0.05);与脑出血组相比,人参皂苷Rg1低剂量组、人参皂苷Rg1 高剂量组大鼠脑含水量降低(P<0.05),组间差异有统计学意义(P<0.05);与人参皂苷Rg1 高剂量组相比,人参皂苷Rg1 高剂量+ago-miR-144-3p 组大鼠脑含水量升高(P<0.05,表3)。
表3 人参皂苷Rg1对大鼠脑含水量的影响(±s, n=6)Tab.3 Effect of ginsenoside Rg1 on brain water content of rats (±s, n=6)
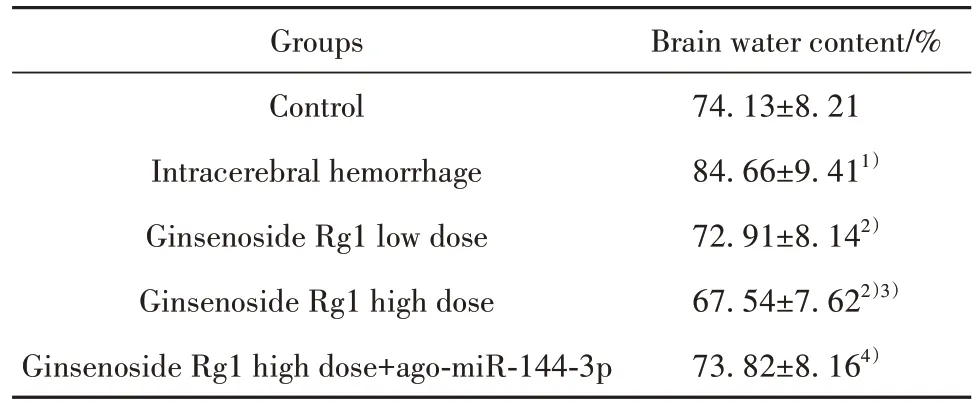
表3 人参皂苷Rg1对大鼠脑含水量的影响(±s, n=6)Tab.3 Effect of ginsenoside Rg1 on brain water content of rats (±s, n=6)
Note:Compared with control group, 1)P<0.05; compared with intracerebral hemorrhage group, 2)P<0.05; compared with ginsenoside Rg1 low dose group, 3)P<0.05; compared with ginsenoside Rg1 high dose group, 4)P<0.05.
Brain water content/%74.13±8.21 84.66±9.411)72.91±8.142)67.54±7.622)3)73.82±8.164)Groups Control Intracerebral hemorrhage Ginsenoside Rg1 low dose Ginsenoside Rg1 high dose Ginsenoside Rg1 high dose+ago-miR-144-3p
2.3 人参皂苷Rg1 对大鼠脑组织匀浆炎症因子TNF-α、IL-6、IL-1β 水平的影响 与对照组相比,脑出血组大鼠脑组织匀浆TNF-α、IL-6、IL-1β 水平升高(P<0.05);与脑出血组相比,人参皂苷Rg1 低剂量组、人参皂苷Rg1高剂量组大鼠脑组织匀浆TNF-α、IL-6、IL-1β 水平降低,组间差异有统计学意义(P<0.05);与人参皂苷Rg1 高剂量组相比,人参皂苷Rg1 高剂量+ago-miR-144-3p 组大鼠脑组织匀浆TNF-α、IL-1β水平升高(P<0.05,表4)。
表4 人参皂苷Rg1 对大鼠脑组织匀浆TNF-α、IL-6、IL-1β水平的影响(±s,n=6,pg/ml)Tab.4 Effect of ginsenoside Rg1 on TNF-α,IL-6,IL-1β levels in rat brain homogenate (±s,n=6,pg/ml)
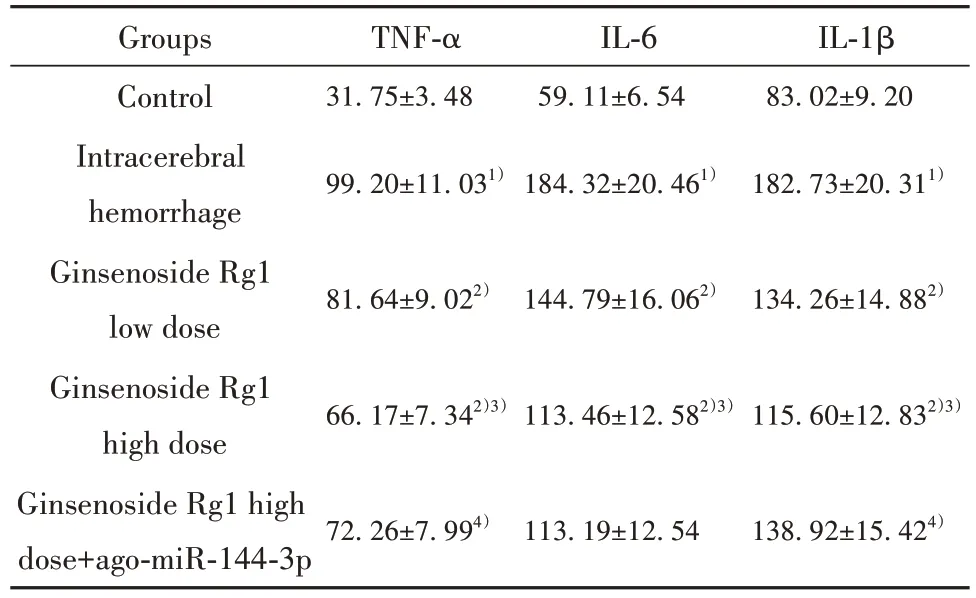
表4 人参皂苷Rg1 对大鼠脑组织匀浆TNF-α、IL-6、IL-1β水平的影响(±s,n=6,pg/ml)Tab.4 Effect of ginsenoside Rg1 on TNF-α,IL-6,IL-1β levels in rat brain homogenate (±s,n=6,pg/ml)
Note:Compared with control group, 1)P<0.05; compared with intracerebral hemorrhage group, 2)P<0.05; compared with ginsenoside Rg1 low dose group, 3)P<0.05; compared with ginsenoside Rg1 high dose group, 4)P<0.05.
Groups Control Intracerebral hemorrhage Ginsenoside Rg1 low dose Ginsenoside Rg1 high dose Ginsenoside Rg1 high dose+ago-miR-144-3p TNF-α 31.75±3.48 IL-6 59.11±6.54 IL-1β 83.02±9.20 99.20±11.031)184.32±20.461)182.73±20.311)81.64±9.022)144.79±16.062)134.26±14.882)66.17±7.342)3)113.46±12.582)3)115.60±12.832)3)72.26±7.994)113.19±12.54 138.92±15.424)
2.4 人参皂苷Rg1 对大鼠血管内皮细胞的影响对照组大鼠血管内皮结构完整、薄厚均匀、无明显水肿,内皮细胞连接紧密,吞饮小泡数量较少。脑出血组大鼠血管内皮薄厚不均多处呈水肿状态,内皮细胞连续性消失,吞饮小泡数量增多;与脑出血组相比,人参皂苷Rg1低剂量组、人参皂苷Rg1高剂量组血管内皮细胞逐渐连接紧密、薄厚较为均匀,水肿减少;与人参皂苷Rg1高剂量组相比,人参皂苷Rg1高剂量+ago-miR-144-3p组血管内皮细胞损伤加重(图1)。
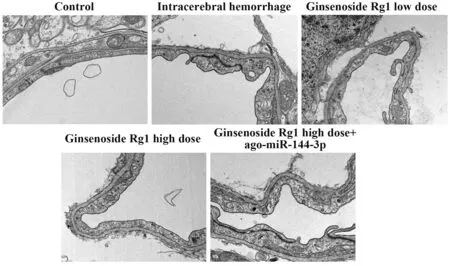
图1 人参皂苷Rg1对大鼠血脑屏障结构的影响(×15 000)Fig.1 Effect of ginsenoside Rg1 on structure of bloodbrain barrier in rats (×15 000)
2.5 人参皂苷Rg1 对大鼠血脑屏障通透性的影响 与对照组相比,脑出血组大鼠脑组织EB 渗出率升高(P<0.05);与脑出血组相比,人参皂苷Rg1低剂量组、人参皂苷Rg1高剂量组大鼠脑组织EB渗出率降低,组间差异有统计学意义(P<0.05);与人参皂苷Rg1 高剂量组相比,人参皂苷Rg1 高剂量+ago-miR-144-3p 组大鼠脑组织EB 渗出率升高(P<0.05,表5)。
表5 人参皂苷Rg1 对大鼠脑组织EB 渗出率的影响(±s,n=6)Tab.5 Effect of ginsenoside Rg1 on EB exudation rate of rat brain tissue (±s, n=6)
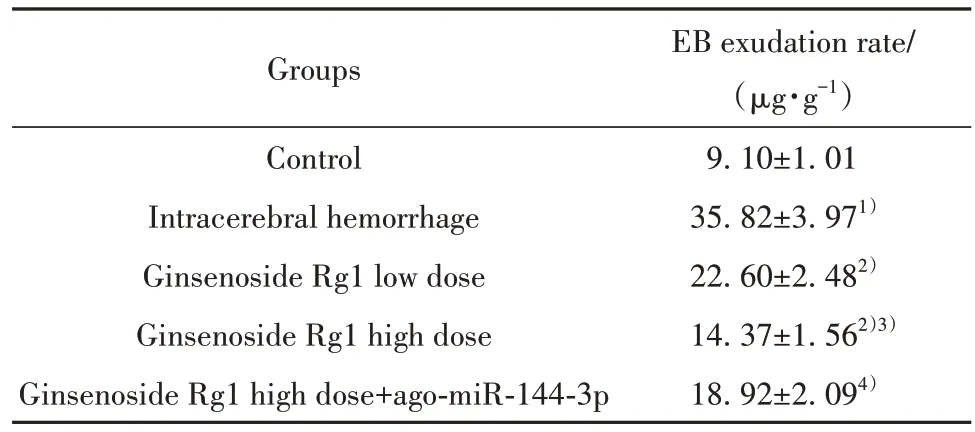
表5 人参皂苷Rg1 对大鼠脑组织EB 渗出率的影响(±s,n=6)Tab.5 Effect of ginsenoside Rg1 on EB exudation rate of rat brain tissue (±s, n=6)
Note:Compared with control group, 1)P<0.05; compared with intracerebral hemorrhage group, 2)P<0.05; compared with ginsenoside Rg1 low dose group, 3)P<0.05; compared with ginsenoside Rg1 high dose group, 4)P<0.05.
EB exudation rate/(μg·g-1)9.10±1.01 35.82±3.971)22.60±2.482)14.37±1.562)3)18.92±2.094)Groups Control Intracerebral hemorrhage Ginsenoside Rg1 low dose Ginsenoside Rg1 high dose Ginsenoside Rg1 high dose+ago-miR-144-3p
2.6 人参皂苷Rg1 对大鼠脑组织miR-144-3p、FPR2 mRNA、p38 mRNA 的影响 与对照组相比,脑出血组大鼠脑组织miR-144-3p、p38 mRNA 水平升高(P<0.05),FPR2 mRNA 水平降低(P<0.05);与脑出血组相比,人参皂苷Rg1 低剂量组、人参皂苷Rg1高剂量组大鼠脑组织miR-144-3p、p38 mRNA 水平降低(P<0.05),FPR2 mRNA 水平升高(P<0.05),组间差异有统计学意义(P<0.05);与人参皂苷Rg1 高剂量组相比,人参皂苷Rg1 高剂量+ago-miR-144-3p组大鼠脑组织miR-144-3p、p38 mRNA 水平升高(P<0.05),FPR2 mRNA水平降低(P<0.05,表6)。
表6 人参皂苷Rg1 对大鼠脑组织miR-144-3p、FPR2 mRNA、p38 mRNA的影响(±s, n=6)Tab.6 Effects of ginsenoside Rg1 on miR-144-3p, FPR2 mRNA and p38 mRNA in rat brain (±s, n=6)
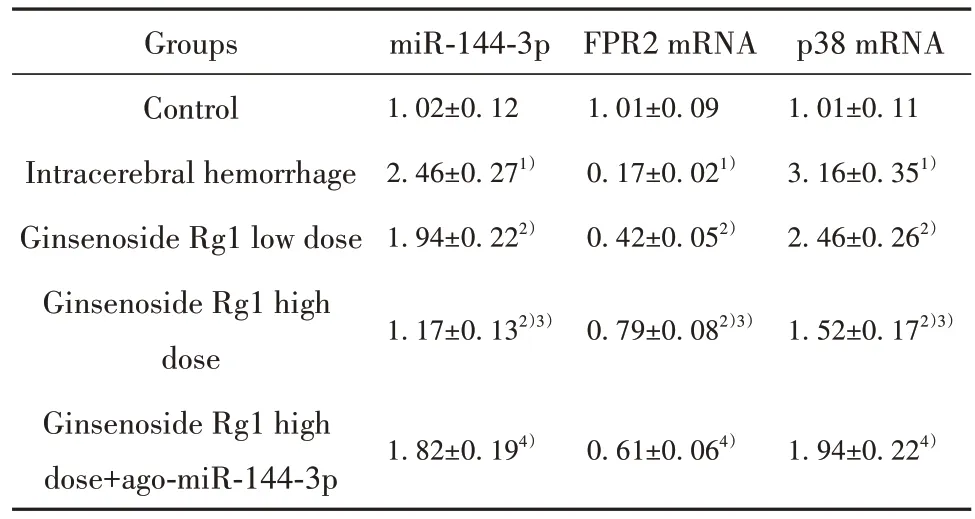
表6 人参皂苷Rg1 对大鼠脑组织miR-144-3p、FPR2 mRNA、p38 mRNA的影响(±s, n=6)Tab.6 Effects of ginsenoside Rg1 on miR-144-3p, FPR2 mRNA and p38 mRNA in rat brain (±s, n=6)
Note:Compared with control group, 1)P<0.05; compared with intracerebral hemorrhage group, 2)P<0.05; compared with ginsenoside Rg1 low dose group, 3)P<0.05; compared with ginsenoside Rg1 high dose group, 4)P<0.05.
Groups Control Intracerebral hemorrhage Ginsenoside Rg1 low dose Ginsenoside Rg1 high dose Ginsenoside Rg1 high dose+ago-miR-144-3p miR-144-3p 1.02±0.12 2.46±0.271)1.94±0.222)FPR2 mRNA 1.01±0.09 0.17±0.021)0.42±0.052)p38 mRNA 1.01±0.11 3.16±0.351)2.46±0.262)1.17±0.132)3)0.79±0.082)3)1.52±0.172)3)1.82±0.194)0.61±0.064)1.94±0.224)
2.7 人参皂苷Rg1对大鼠脑组织FPR2、p38蛋白的影响 与对照组相比,脑出血组大鼠脑组织p-p38/p38 水平升高(P<0.05),FPR2 水平降低(P<0.05);与脑出血组相比,人参皂苷Rg1低剂量组、人参皂苷Rg1 高剂量组大鼠脑组织p-p38/p38 水平降低(P<0.05),FPR2 水平升高(P<0.05),组间差异有统计学意义(P<0.05);与人参皂苷Rg1 高剂量组相比,人参皂苷Rg1 高剂量+ago-miR-144-3p 组大鼠脑组织p-p38/p38 水平升高(P<0.05),FPR2 水平降低(P<0.05,图2、表7)。
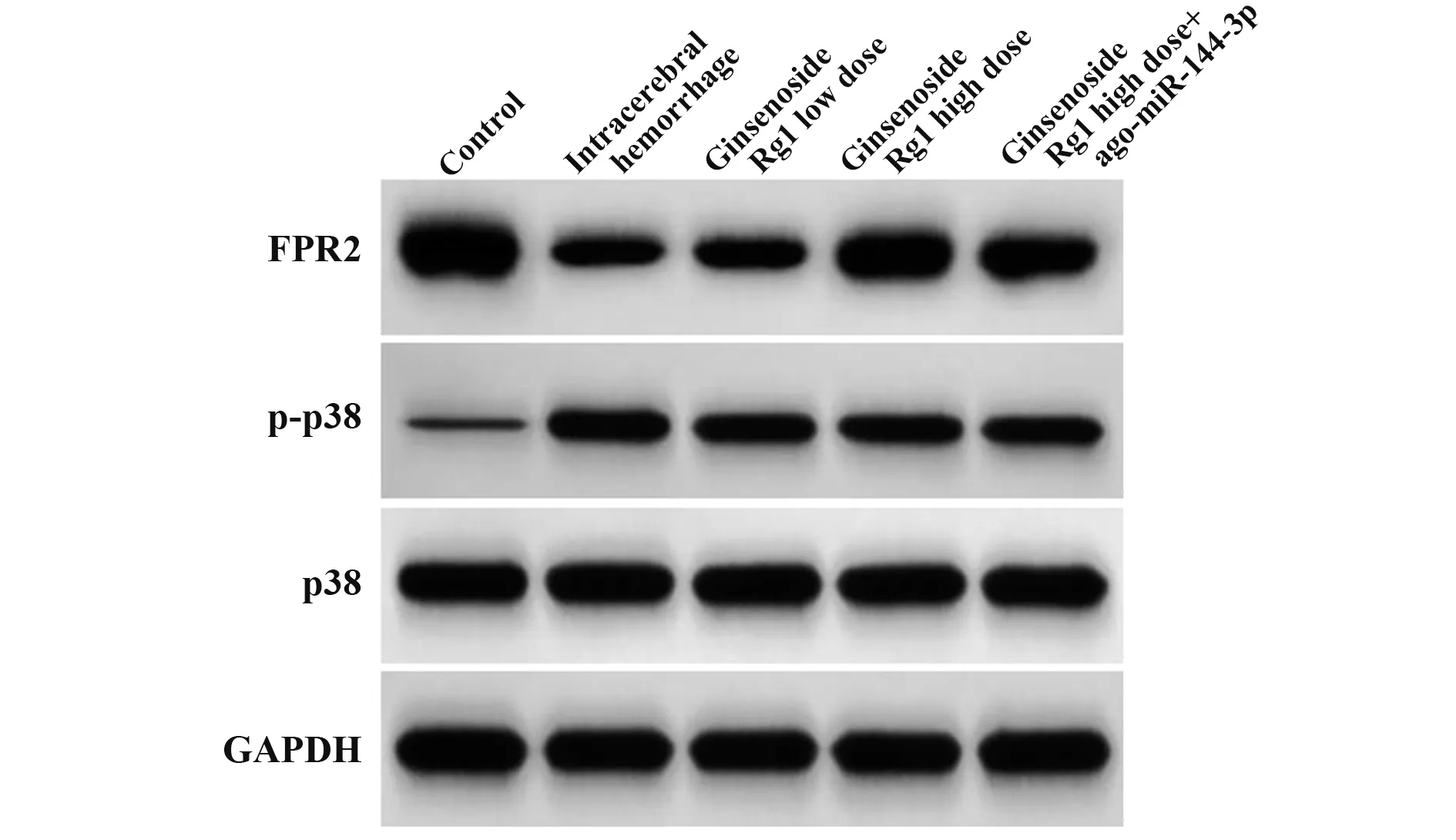
图2 人参皂苷Rg1对大鼠脑组织FPR2、p38蛋白的影响Fig.2 Effect of ginsenoside Rg1 on FPR2 and p38 proteins in rat brain
表7 人参皂苷Rg1 对大鼠脑组织FPR2、p38 蛋白的影响(±s, n=6)Tab.7 Effects of ginsenoside Rg1 on FPR2 and p38 proteins in rat brain (±s, n=6)
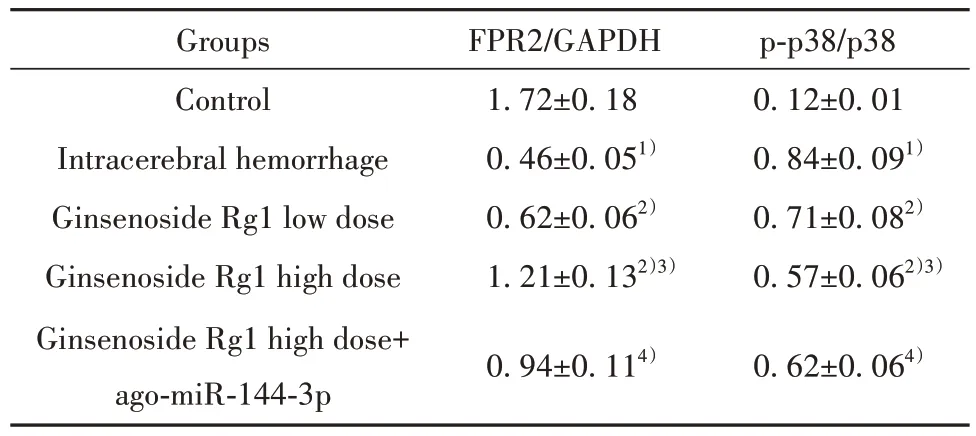
表7 人参皂苷Rg1 对大鼠脑组织FPR2、p38 蛋白的影响(±s, n=6)Tab.7 Effects of ginsenoside Rg1 on FPR2 and p38 proteins in rat brain (±s, n=6)
Note:Compared with control group, 1)P<0.05; compared with intracerebral hemorrhage group, 2)P<0.05; compared with ginsenoside Rg1 low dose group, 3)P<0.05; compared with ginsenoside Rg1 high dose group, 4)P<0.05.
Groups Control Intracerebral hemorrhage Ginsenoside Rg1 low dose Ginsenoside Rg1 high dose Ginsenoside Rg1 high dose+ago-miR-144-3p FPR2/GAPDH 1.72±0.18 0.46±0.051)0.62±0.062)1.21±0.132)3)p-p38/p38 0.12±0.01 0.84±0.091)0.71±0.082)0.57±0.062)3)0.94±0.114)0.62±0.064)
3 讨论
脑出血是脑卒中的一种,属于急性脑血管疾病,患者病死率高、预后差。血脑屏障是遍布于脑组织周围的脑毛细血管壁构成的脉络丛屏障,有效隔开血浆与脑脊液,可阻碍血液中的一些有害物质进入,在维护中枢神经系统生理功能方面发挥重要作用,脑出血后血液在脑实质中迅猛聚集,破坏血脑屏障稳定性,进而导致脑水肿、神经炎症等继发性损伤。基于血脑屏障在脑出血中的重要地位,探究有效保护血脑屏障及其损伤造成的神经炎症的药物对脑出血治疗十分重要。
人参皂苷Rg1是人参的关键成分,具有抗衰老、心肌保护、抗炎等作用[11-13]。王利等[14]研究显示,人参皂苷Rg1在新生儿缺血缺氧损伤后脑修复中起神经保护作用,HIF-1α 是干预靶点。向玥等[15]研究显示,人参皂苷Rg1 可降低D-半乳糖所致小鼠海马组织氧化应激及炎症水平,并调控p53-p21 通路,对海马神经元具有保护作用。TNF-α、IL-6、IL-1β与神经炎症相关的血管改变有关[16]。本研究发现人参皂苷Rg1能够显著降低实验性脑出血大鼠神经功能损伤评分、脑含水量、血脑屏障损伤程度、EB 渗出率、TNF-α、IL-6、IL-1β 水平,提示人参皂苷Rg1 可有效降低脑出血大鼠血脑屏障损伤程度及神经炎症。
FPR2 是趋化因子受体,定位于人染色体19q13.3~13.4,在血管内皮组织中广泛表达,在血管炎症损伤中发挥重要作用。薛盛丁等[17]研究显示,FPR2 基因敲除C57BL/6J 小鼠在氧诱导的视网膜病变后,视网膜中新生血管、IL-6、TNF-α 表达显著低于野生型C57BL/6J 小鼠,涉及ERK、p38 通路。张俊等[18]研究显示,阿司匹林可能通过激活FPR2抑制心肌缺血再灌注损伤小鼠心肌组织炎症反应。XIE 等[19]通过检索PubMed 数据库发现人参皂苷Rg1 的抗脑缺血再灌注机制涉及包括p38 通路在内的多种途径,可调节血脑屏障。DING 等[20]研究显示,FPR2/p38/COX2途径是膜联蛋白A1发挥抗雄性小鼠脑出血后神经炎症的关键途径,给予FPR2 拮抗剂后此作用消除。p38 是常见炎症通路,在血脑屏障中也发挥作用[21]。提示FPR2/p38 途径可能在脑出血造成的神经炎症及血脑屏障中发挥作用。本研究显示,人参皂苷Rg1 可增加FPR2 表达,抑制p38 活化,提示人参皂苷Rg1 可能通过促进FPR2 表达抑制p38降低脑出血大鼠血脑屏障损伤及神经炎症。生信网站分析显示miR-144-3p 与FPR2 有靶向作用关系,SUN 等[22]证实氧化血红素可通过miR-144-3p 依赖性下调FPR2,加重腹膜炎小鼠炎症损伤。miR-144-3p 在脑出血疾病中发挥重要作用,FAN 等[8]通过体内外实验证实miR-144-3p促进脑出血诱导的继发性脑损伤;血脑屏障损伤体外模型中miR-144呈高表达[23];人参皂苷Rg1可通过miR-144/Nrf2/ARE 途径保护缺血再灌注诱导的大鼠神经元损伤[24]。本研究发现人参皂苷Rg1 处理后,大鼠miR-144-3p 水平显著下调,猜测人参皂苷Rg1 可能通过下调miR-144-3p参与FPR2/p38调控,进而降低脑出血大鼠血脑屏障损伤及神经炎症。因此,本研究在高剂量人参皂苷Rg1处理大鼠基础上设置了恢复试验,过表达miR-144-3p,发现人参皂苷Rg1对脑出血大鼠血脑屏障损伤、神经炎症的抑制作用减弱,大鼠血脑屏障损伤、神经炎症再次加重,提示人参皂苷Rg1 可能通过下调miR-144-3p 表达激活FPR2,并抑制p38 通路活化,进而降低脑出血大鼠血脑屏障损伤及神经炎症。
综上,人参皂苷Rg1 可能通过调控miR-144-3p/FPR2/p38 轴参与对大鼠血脑屏障损伤及神经炎症的抑制作用。但本研究仍存在一定不足,仅研究了人参皂苷Rg1 对FPR2/p38 的影响,人参皂苷Rg1 调控miR-144-3p 是否通过影响FPR2/p38 通路发挥作用有待进一步探索。

