探讨黄芪甲苷对桥本甲状腺炎大鼠甲状腺细胞凋亡及RhoA/ROCK2通路的影响①
刘光霞 陈 芳 高 伟 王晓雅 卢亚敏 侯 瞻 赵连春
(河北省人民医院核医学科 ,石家庄050051)
桥本甲状腺炎(hashimoto thyroiditis,HT)是一种慢性炎症性疾病,属于自身免疫性疾病范畴,患者免疫系统异常激活,引发大量淋巴细胞浸润甲状腺组织,导致甲状腺细胞凋亡,造成甲状腺功能减退[1-2]。免疫细胞的活化,可促使炎症细胞因子过量表达释放,引发强烈的免疫炎症反应,导致甲状腺组织损伤,是HT 的主要致病机制。因此,调控免疫控制炎症是防治HT 的关键[3-4]。黄芪甲苷是中药黄芪的重要活性成分,可抑制核苷酸结合寡聚化结构 域 样 受 体 蛋 白3(NOD-like receptor protein 3,NLRP3)炎症小体活化,降低促炎因子IL-1β及TNF-α表达,减轻炎症,改善关节软骨损伤,还可抑制丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号激活,减少脂多糖诱导的炎症相关因子产生,发挥显著的抗炎作用,因而可推测黄芪甲苷可能通过抑制炎症治疗HT[5-6]。Ras 同源基因家族成员A(Ras homolog gene family member A,RhoA)/Rho 相关卷曲螺旋形成蛋白激酶2(Rho-associated coiled-coil containing kinase 2,ROCK2)是重要的炎症调控信号,参与介导脑卒中、阿尔茨海默病等炎症性疾病的发生及进展过程,抑制RhoA/ROCK 信号,可显著减少缺血再灌注诱导的促炎因子合成分泌,阻碍炎症发生发展,降低氧化应激水平,抑制神经细胞凋亡,改善认知功能,发挥明显的神经保护作用[7-9],因而RhoA/ROCK 信号能作为重要的HT 潜在治疗靶点。本文通过构建HT 大鼠模型,基于RhoA/ROCK2通路探讨黄芪甲苷对其甲状腺细胞凋亡的影响。
1 材料与方法
1.1 材料
1.1.1 实验动物 SD 雄性大鼠购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2016-0011,SPF 级,体质量180~220 g,严格参照动物饲养规范分笼饲养于以岭医药研究院动物房,温度:22~25 ℃,湿度:47%~55%,光照:12 h/12 h 明暗循环。本实验经河北省人民医院伦理委员会审批(202160)。
1.1.2 主要试剂及仪器 黄芪甲苷(纯度≥98%,84687-43-4)购自南京春秋生物工程有限公司;Rhosin(HY-12646)购自美国Med Chem Express 公司;甲状腺球蛋白(源于猪,QA052105)、无水碘化钠(AQ032244)购自安徽酷尔生物工程有限公司;弗氏不完全佐剂(F5506)、弗氏完全佐剂(F5881)购自美国Sigma 公司;抗甲状腺过氧化物酶抗体(TPOAb)ELISA 试剂盒(m1048720)、抗甲状腺球蛋白抗体(TGAb) ELISA 试剂盒(m1003044)购自上海酶联生物科技有限公司;原位末端标记法(TdT-mediated dUTP nick end labeling,TUNEL)细胞凋亡检测试剂盒(E607172-0001)、苏木精-伊红(hematoxylin-eosin,HE)染 色 试 剂 盒(E607318-0200)、二 喹 啉 甲 酸(bicinchoninic acid,BCA)蛋白质定量检测试剂盒(C503021-0500)、大 鼠 IL-17 ELISA 试 剂 盒(D731078-0096)、放射免疫沉淀测定(radio-immune precipitation assay,RIPA)裂解液(C500005-0050)购自上海生工生物工程股份有限公司;大鼠IL-1β 测试盒(H002)、大鼠IL-6测试盒(H007)购自南京建成生物工程研究所有限公司;兔源anti-RhoA 抗体(ab187027)、羊抗兔二抗(ab150077)、兔源anti-甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)一 抗(ab181602)、兔 源anti-ROCK2 抗体(ab125025)购自美国Abcam 公司;ECL发光试剂盒(PE0010)购自北京索莱宝生物科技有限公司。
M200 PRO 酶标仪购自TECAN 公司(瑞士);EM UC7 超薄切片机、EG1150 分体式包埋机购自Leica公司(德国);HPIAS 1000彩色病理图文分析系统购自武汉同济医科大学千屏影像工程公司(中国);Axiovert 200 光学显微镜购自ZEISS 公司(德国);1658033 垂直电泳转印系统购自Bio-Rad 公司(美国);GIS-500 型凝胶成像仪购自杭州米欧仪器有限公司(中国)。
1.2 方法
1.2.1 制备HT 模型大鼠及分组给药 参照文献[10]方法并加以改良制备HT 模型:将甲状腺球蛋白溶于0.9%NaCl 溶液,并将其与等体积完全弗氏佐剂混合,置于玻璃杯中,以小型搅拌机充分搅拌乳化后制成油包水制剂,因不稳定性用时制备,所得油包水制剂中甲状腺球蛋白浓度为2 mg/ml,于大鼠足垫和尾根皮下注射100 μg甲状腺球蛋白(50 μl油包水制剂)进行初次免疫,1 周后加强免疫,即第2 周将甲状腺球蛋白溶液与等体积不完全弗氏佐剂混合,制成油包水制剂,使甲状腺球蛋白浓度为2 mg/ml,以 同 样 方 法 注 射100 μg 甲 状 腺 球 蛋 白(50 μl 油包水制剂),每周注射1 次,连续注射6 次,第2 周至第7 周,大鼠以高碘水(0.64 g/L 碘化钠)喂养,在第8周检测大鼠血清TGAb、TPOAb水平,当血清TGAb、TPOAb 含量上升,提示模型制备成功,随机分为模型组、黄芪甲苷组、Rhosin 组、黄芪甲苷+Rhosin组,每组12只,另选出12只SD大鼠,正常饮水,并以同样方法皮下注射等剂量生理盐水,作为对照组。
将黄芪甲苷与Rhosin 溶于0.9%NaCl 溶液,制得8 mg/ml 黄芪甲苷药液(混悬液)、4 mg/ml Rhosin药液(混悬液)[11-12],黄芪甲苷+Rhosin 组大鼠以10 ml/kg剂量灌胃黄芪甲苷药液,同时以10 ml/kg剂量腹腔注射Rhosin药液;黄芪甲苷组大鼠以10 ml/kg剂量灌胃黄芪甲苷药液,同时以10 ml/kg 剂量腹腔注射0.9%NaCl 溶液;Rhosin 组大鼠以10 ml/kg 剂量灌胃0.9%NaCl溶液,同时以10 ml/kg剂量腹腔注射Rhosin 药液;对照组、模型组大鼠以10 ml/kg 剂量灌胃0.9%NaCl 溶液,同时以10 ml/kg 剂量腹腔注射0.9%NaCl溶液,每天给药干预1次,持续21 d。
1.2.2 收集标本 药物干预结束后24 h,将大鼠置于乙醚中麻醉,切开颈部,以2 ml 注射器刺入颈总动脉,吸出1.6 ml血液,转入离心管,4 ℃离心10 min,将上清置于-80 ℃备用。处死大鼠,剥离出甲状腺,剪下约0.4 g 组织置于液氮备用。剩余甲状腺组织漂洗后,以仪器脱水后,置于二甲苯中透明,再以EG1150 分体式包埋机及EM UC7 超薄切片机依次进行包埋、切片。
1.2.3 检测大鼠甲状腺组织病理形态、甲状腺细胞凋亡率 将1.2.2中完整的组织切片置于二甲苯中脱蜡,在水化后分别选出3 张切片做HE、TUNEL染色,经同样方法脱水、透明后,置于光学显微镜下观察着色情况,观察甲状腺组织病理形态,采用HPIAS 1000 彩色病理图文分析软件得出甲状腺细胞凋亡率。
1.2.4 检测大鼠血清TGAb、TPOAb、IL-6、IL-17、IL-1β 含量 取出1.2.2 制备的血清,置于冰水浴中解冻,采用ELISA 实验测定各组大鼠血清TGAb、TPOAb、IL-6、IL-17、IL-1β 含量,具体步骤按照其各自试剂盒说明书指导进行:包被微孔板后封闭,依次加入待测样品和酶标抗体孵育,接着加入底物液显色后终止反应,以酶标仪测出各孔吸光度后计算各因子含量。
1.2.5 检测各组大鼠甲状腺组织RhoA/ROCK2 通路蛋白表达 取出1.2.2 液氮中的甲状腺组织,加入RIPA 裂解液,匀浆后4 ℃离心20 min,采用试剂盒通过BCA 法测出上清中总蛋白浓度,调至各组浓度相等后,100 ℃煮沸变性,取20 μl 各组样品液以电泳将蛋白分离开,湿转将其移至硝酸纤维素膜上,通过孵育5%脱脂奶粉封闭后,将目的蛋白RhoA、ROCK2、GAPDH 自膜上裁下,孵育一抗、洗膜、孵育二抗、洗膜、显色、拍照,通过Quantity One软件定量各蛋白条带灰度值,获得各组蛋白相对表达量。
2 结果
2.1 各组大鼠血清TGAb、TPOAb 水平检测结果与对照组相比,模型组大鼠血清TGAb、TPOAb 水平明显升高(P<0.05);与模型组相比,黄芪甲苷组、Rhosin 组大鼠血清TGAb、TPOAb 水平均降低(P<0.05);与黄芪甲苷组、Rhosin组分别相比,黄芪甲苷+Rhosin 组大鼠血清TGAb、TPOAb 水平均降低(P<0.05)。见表1。
表1 各组大鼠血清TGAb、TPOAb水平(±s,n=12)Tab.1 Serum TGAb and TPOAb levels of rats in each group (±s, n=12)

表1 各组大鼠血清TGAb、TPOAb水平(±s,n=12)Tab.1 Serum TGAb and TPOAb levels of rats in each group (±s, n=12)
Note:Compared with control group, 1)P<0.05; compared with model group, 2)P<0.05; compared with Astragaloside Ⅳ group, 3)P<0.05; compared with Rhosin group, 4)P<0.05.
TPOAb/(U·ml-1)4.58±0.86 15.29±2.731)9.31±2.192)9.37±2.252)4.63±1.023)4)Groups Control Model Astragaloside ⅣRhosin Astragaloside Ⅳ+Rhosin TGAb/(U·ml-1)5.63±1.02 18.47±3.311)12.03±2.082)12.10±2.052)5.69±1.303)4)
2.2 各组大鼠甲状腺组织病理形态检测结果 对照组大鼠甲状腺组织形态结构正常,完好,无损伤;模型组大鼠甲状腺滤泡结构异常,部分萎缩或消失,排列紊乱,周围存在炎症细胞浸润,甲状腺组织有明显病理损伤;黄芪甲苷组、Rhosin组大鼠甲状腺组织上述病理损伤均减轻;黄芪甲苷+Rhosin 组大鼠甲状腺组织上述病理损伤减轻程度强于黄芪甲苷组、Rhosin组。见图1。
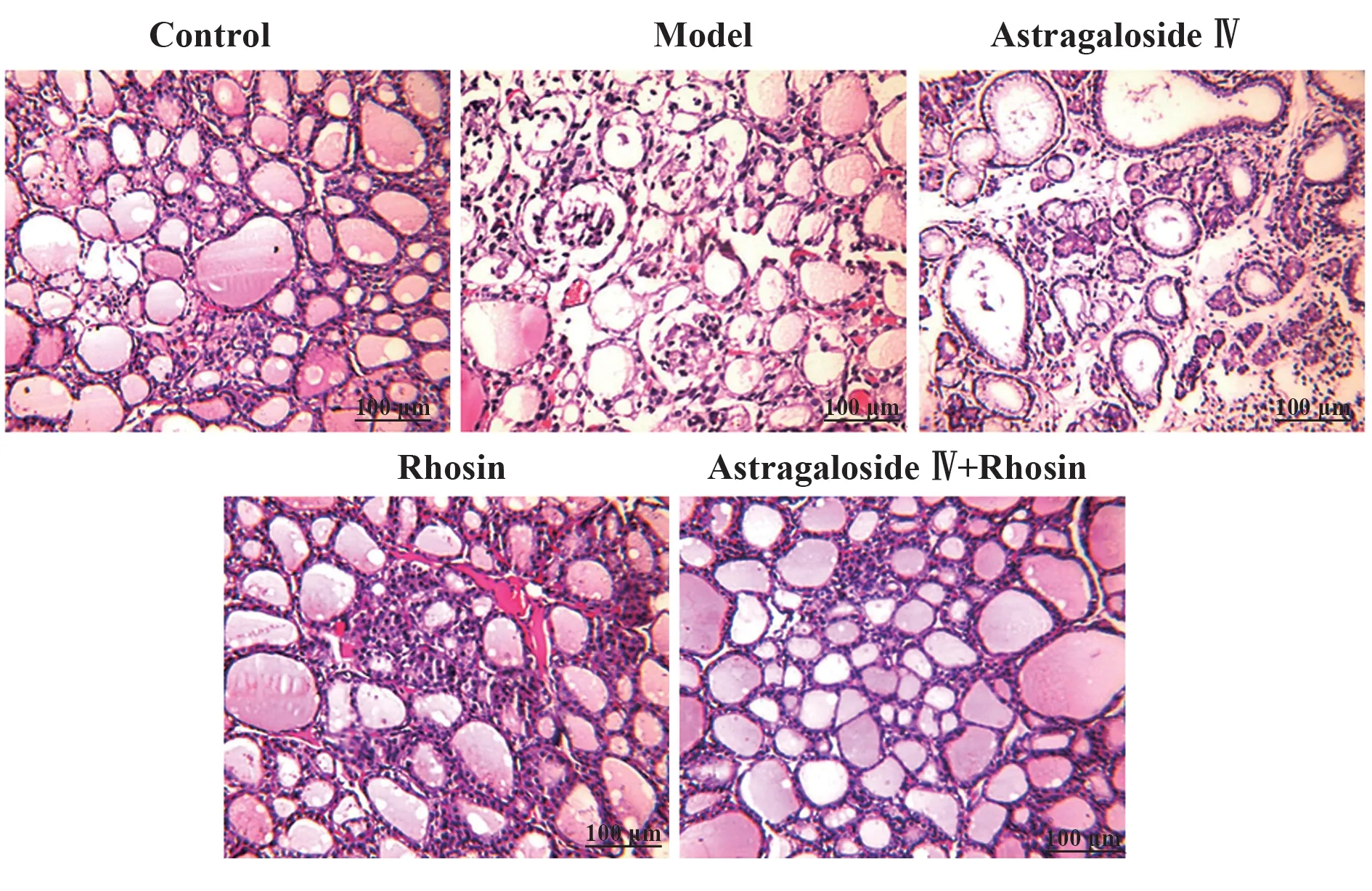
图1 HE染色观察各组大鼠甲状腺组织病理形态(×200)Fig.1 Pathological morphology of thyroid tissue of rats in each group was observed by HE staining (×200)
2.3 各组大鼠甲状腺细胞凋亡检测结果 与对照组相比,模型组大鼠甲状腺细胞凋亡率明显升高(P<0.05);与模型组相比,黄芪甲苷组、Rhosin 组大鼠甲状腺细胞凋亡率均降低(P<0.05);与黄芪甲苷组、Rhosin 组分别相比,黄芪甲苷+Rhosin 组大鼠甲状腺细胞凋亡率均降低(P<0.05)。见图2、表2。
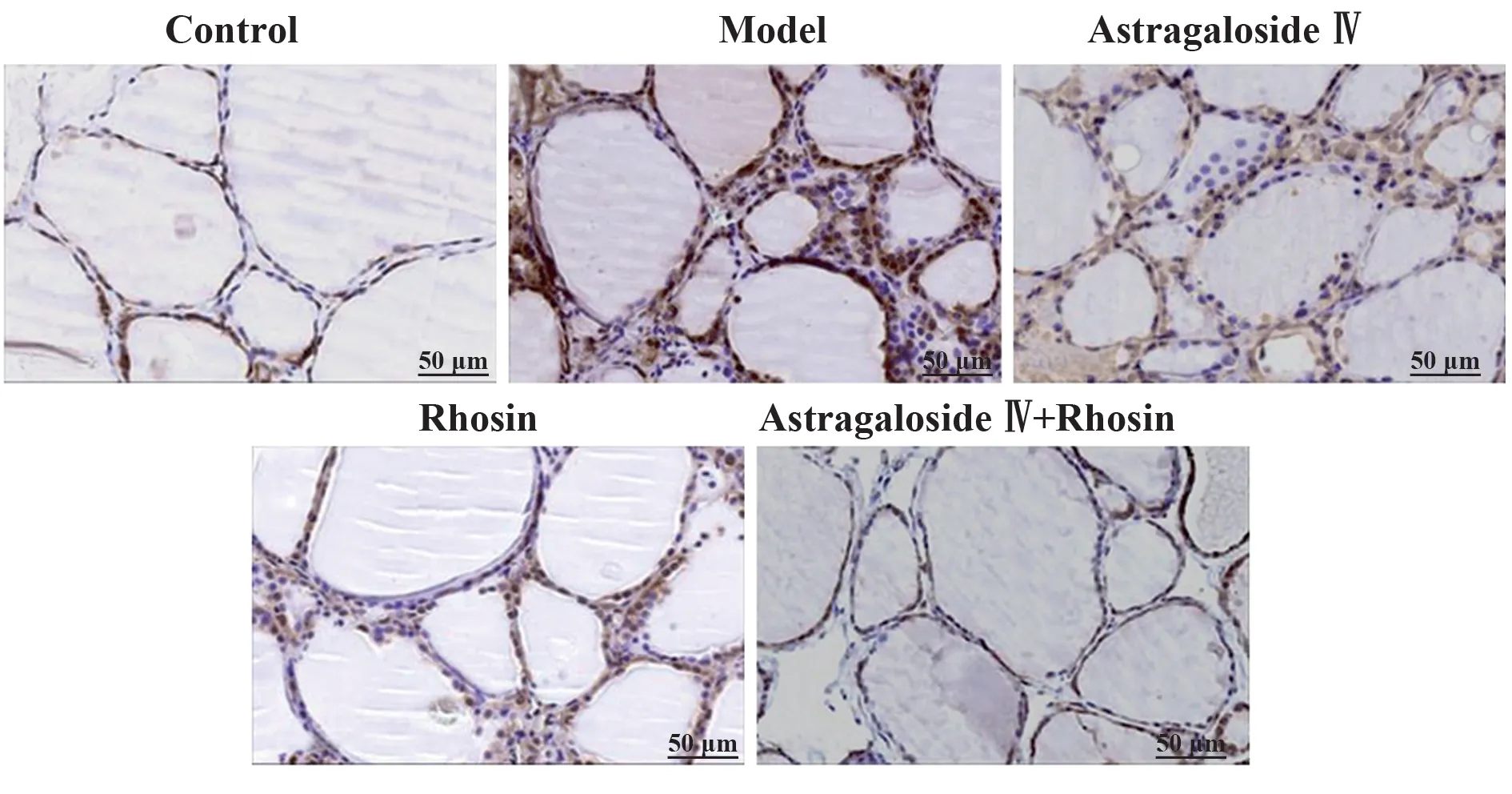
图2 TUNEL染色检测各组大鼠甲状腺细胞凋亡(×200)Fig.2 Apoptosis of thyroid cells in each group was detected by TUNEL staining (×200)
表2 各组大鼠甲状腺细胞凋亡率(±s,n=12)Tab.2 Apoptosis rate of thyroid cells in each group (±s,n=12)

表2 各组大鼠甲状腺细胞凋亡率(±s,n=12)Tab.2 Apoptosis rate of thyroid cells in each group (±s,n=12)
Note:Compared with control group, 1)P<0.05; compared with Model group, 2)P<0.05; compared with Astragaloside Ⅳ group, 3)P<0.05; compared with Rhosin group, 4)P<0.05.
Apoptosis rate/%1.05±0.27 38.94±5.231)19.52±4.842)19.66±4.652)1.31±0.323)4)Groups Control Model Astragaloside ⅣRhosin Astragaloside Ⅳ+Rhosin
2.4 各组大鼠血清炎症因子IL-6、IL-17、IL-1β 含量检测结果 与对照组相比,模型组大鼠血清炎症因子IL-6、IL-17、IL-1β 含量明显升高(P<0.05);与模型组相比,黄芪甲苷组、Rhosin组大鼠血清炎症因子IL-6、IL-17、IL-1β 含量均降低(P<0.05);与黄芪甲苷组、Rhosin 组分别相比,黄芪甲苷+Rhosin 组大鼠血清炎症因子IL-6、IL-17、IL-1β 含量均降低(P<0.05)。见表3。
表3 各组大鼠血清炎症因子IL-6、IL-17、IL-1β 含量(±s,n=12)Tab.3 Serum contents of inflammatory factors IL-6,IL-17 and IL-1β of rats in each group (±s, n=12)

表3 各组大鼠血清炎症因子IL-6、IL-17、IL-1β 含量(±s,n=12)Tab.3 Serum contents of inflammatory factors IL-6,IL-17 and IL-1β of rats in each group (±s, n=12)
Note:Compared with control group, 1)P<0.05; compared with Model group, 2)P<0.05; compared with Astragaloside Ⅳ group, 3)P<0.05; compared with Rhosin group, 4)P<0.05.
Groups Control Model Astragaloside ⅣRhosin Astragaloside Ⅳ+Rhosin IL-6/(pg·ml-1)54.33±5.62 185.04±23.121)120.02±18.402)120.29±20.562)IL-17/(pg·ml-1)9.75±1.06 41.39±4.181)21.31±3.342)21.42±3.422)IL-1β/(ng·ml-1)0.22±0.03 1.04±0.141)0.67±0.112)0.69±0.132)55.02±7.493)4)10.02±1.133)4)0.24±0.063)4)
2.5 各组大鼠甲状腺组织RhoA/ROCK2 通路蛋白表达检测结果 与对照组相比,模型组大鼠甲状腺组织RhoA、ROCK2蛋白表达明显升高(P<0.05);与模型组相比,黄芪甲苷组、Rhosin组大鼠甲状腺组织RhoA、ROCK2 蛋白表达均降低(P<0.05);与黄芪甲苷组、Rhosin 组分别相比,黄芪甲苷+Rhosin 组大鼠甲状腺组织RhoA、ROCK2 蛋白表达均降低(P<0.05)。见图3、表4。

图3 Western blot 检测各组大鼠甲状腺组织RhoA/ROCK2通路蛋白表达Fig.3 Expressions of RhoA/ROCK2 pathway protein in thyroid tissues of rats in each group detected by Western blot
表4 各组大鼠甲状腺组织RhoA/ROCK2 通路相关蛋白相对表达(±s,n=12)Tab.4 Relative expressions of RhoA/ROCK2 pathway related proteins in thyroid tissue of rats in each group (±s, n=12)

表4 各组大鼠甲状腺组织RhoA/ROCK2 通路相关蛋白相对表达(±s,n=12)Tab.4 Relative expressions of RhoA/ROCK2 pathway related proteins in thyroid tissue of rats in each group (±s, n=12)
Note:Compared with control group, 1)P<0.05; compared with Model group, 2)P<0.05; compared with Astragaloside Ⅳ group, 3)P<0.05; compared with Rhosin group, 4)P<0.05.
ROCK2/GAPDH 0.18±0.04 1.79±0.321)0.96±0.142)0.98±0.182)0.20±0.063)4)Groups Control Model Astragaloside ⅣRhosin Astragaloside Ⅳ+Rhosin RhoA/GAPDH 0.43±0.07 1.65±0.211)1.02±0.172)1.04±0.162)0.45±0.113)4)
3 讨论
HT 以TPOAb、TGAb 表达升高为主要特征,近年来,随着饮食结构的变化,发病率有一定升高,且起病隐匿,容易误诊,目前尚无有效的治愈手段,免疫疗法、甲状腺激素、糖皮质激素等是临床主要治疗药物,但长期应用副作用明显,因而探寻更安全有效的药物对HT 的临床治疗意义重大[13-14]。本文以高碘饮水联合皮下注射甲状腺球蛋白的方法诱导HT 大鼠模型,结果显示,造模大鼠免疫系统异常激活,血清炎症因子IL-6、IL-17及IL-1β 含量明显升高,引发强烈的炎症反应,损伤甲状腺组织,导致甲状腺细胞凋亡、甲状腺滤泡结构异常、部分萎缩或消失、排列紊乱、炎症细胞浸润甲状腺组织、促使TGAb、TPOAb水平升高,揭示HT模型构建成功。
免疫炎症反应引发的甲状腺组织损伤及甲状腺细胞凋亡是HT 的主要病理基础,抑制炎症发生及进展是防治HT 的有效策略[15-16]。黄芪甲苷是一种天然的抗炎化合物,可抑制炎症因子IL-1β 和IL-17 表达释放,阻止炎症产生及进展,改善系膜增生性肾小球肾炎小鼠肾功能,还可通过抑制炎症提高肠道黏膜屏障功能,进而改善溃疡性结肠炎大鼠症状[17-18],本文以黄芪甲苷处理HT 大鼠,可降低血清炎症细胞因子IL-6、IL-17及IL-1β 合成分泌,抑制炎症,减少甲状腺细胞凋亡,减轻甲状腺组织炎症损伤,表明黄芪甲苷可抑制甲状腺细胞凋亡,改善HT 大鼠甲状腺组织病理损伤,揭示黄芪甲苷对HT大鼠具有较好的治疗功效,在HT 的临床治疗中具有很好的发展前景。
Rho/ROCK 信号参与调控细胞损伤、凋亡及免疫炎症等多种病理生理过程,下调RhoA、ROCK2 表达,可降低IL-1β、TNF-α、IL-6 和IL-8 等炎症细胞因子表达,阻碍炎症发生发展,抑制细胞凋亡,减轻阿尔茨海默病大鼠脑组织损伤,延缓其病情进展[19-20],因而抑制Rho/ROCK 信号激活可能是黄芪甲苷治疗HT 的作用机制。本文结果显示,HT 模型大鼠甲状腺组织RhoA 与ROCK2蛋白表达水平升高,RhoA 抑制剂降低HT 大鼠甲状腺组织RhoA 与ROCK2 蛋白表达,可减轻其甲状腺组织损伤,抑制炎症,降低甲状腺细胞凋亡率,表明Rho/ROCK 信号参与介导HT的致病过程,本研究结果显示黄芪甲苷可降低HT大鼠甲状腺组织RhoA 与ROCK2 蛋白表达水平,且与Rhosin 联合应用时,可增强黄芪甲苷对HT 大鼠的治疗作用,表明黄芪甲苷抑制甲状腺细胞凋亡,改善HT 大鼠甲状腺组织炎症损伤,可能是通过下调RhoA/ROCK2通路表达实现的。
综上所述,黄芪甲苷可能通过抑制RhoA、ROCK2 蛋白表达,阻碍免疫炎症产生及进展,减轻HT 大鼠甲状腺组织损伤,降低甲状腺细胞凋亡率,改善大鼠临床症状,抑制RhoA/ROCK2 激活可能是其药理机制,为黄芪甲苷在HT 临床治疗上的应用提供了科学依据,但本文对其药理机制的探讨还存在一定不足,后续会通过恢复实验进行对照验证,进而深入阐述黄芪甲苷治疗HT的作用机制。

