LncRNA SNHG12 调控miR-138-5p/HIF-1α 轴改善缺氧/复氧人血管内皮细胞损伤的研究①
魏宗强 王琳茹 胡文贤 张娟子 黄贤明 李 林 李 强
(青岛大学附属青岛市海慈医院血管外科中心,青岛 266033)
缺血再灌注损伤是发生于脑卒中、心肌梗死、休克、器官移植等疾病中的病理现象,可引发强烈的过氧化及炎症级联反应,导致细胞变性、凋亡,造成器官功能衰竭,极大威胁患者生命安全[1-2]。在缺血再灌注病理损伤过程中,血管内皮细胞作为前沿细胞,可因缺氧/复氧(H/R)过程而造成损伤,促使凋亡发生,抑制血管内皮细胞凋亡对于缓解组织器官缺血再灌注损伤至关重要[3-4]。小核仁RNA 宿主基因12(small nucleolar RNA host gene 12,SNHG12)是一种长链非编码RNA(long non-coding RNA,Lnc-RNA),参与介导细胞H/R 病理过程,沉默SNHG12可促进H/R 引发的炎症细胞因子产生及细胞凋亡,上调SNHG12表达,抑制炎症发生及进展,提高脑缺血再灌注后微血管内皮细胞活力,减轻脑组织损伤,因此,LncRNA SNHG12 可作为改善H/R 人血管内皮细胞损伤的潜在作用靶点[5-6]。miR-138-5p 是调控细胞活力、凋亡、迁移和炎症损伤等生理病理过程的重要因子,下调其表达可增强细胞活力,阻碍炎症反应,进而抑制其凋亡[7]。低氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)是miR-138-5p的下游调控靶点,两者表达呈负相关[8]。HIF-1α 是一种缺氧诱导因子,可以减少活性氧(reactive oxygen species,ROS)释放,降低细胞凋亡,保护细胞免于氧糖剥夺/复氧复糖造成的损伤[9-10]。有研究发现,SNHG12 可负调控miR-138 的表达,敲除SNHG12 可通过上调miR-138 而抑制非小细胞肺癌细胞生长,并诱导细胞凋亡,因而推测LncRNA SNHG12 可能通过调控miR-138-5p/HIF-1α 轴改善H/R引发的人血管内皮细胞损伤[11]。本研究通过建立H/R 人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)模型对此进行探讨。
1 材料与方法
1.1 材料
1.1.1 主要试剂 HUVECs 及其专用培养基购于武汉普诺赛生命科技有限公司;LncRNA SNHG12、miR-138-5p、甘油醛-3-磷酸脱氢酶(GAPDH)、U6 及HIF-1α 引物、LncRNA SNHG12 过表达质粒、Lnc-RNA SNHG12 空载质粒、miR-138-5p mimics、miR-138-5p mimics 阴性对照由上海吉玛基因有限公司提供;达尔伯克改良伊格尔培养基(DMEM)(含双抗)培养基、0.25%胰蛋白酶-EDTA(含酚红)消化液、减少了血清的MEM(Eagle's)培养基(Opti-MEM)、脂质体2000、CCK-8 试剂盒、Annexin V-异硫氰酸荧光素(FITC)/碘化丙啶(PI)凋亡检测试剂盒、一步法实时荧光定量试剂盒、总RNA 提取试剂盒、BCA 蛋白浓度测定试剂盒、高效放射免疫沉淀法(radio-immunoprecipitation assay,RIPA)裂解液、人IL-6、IL-17、IL-18 ELISA 试剂盒、ROS 检测试剂盒、乳酸脱氢酶(LDH)活性检测试剂盒均购于北京索莱宝科技有限公司;兔源GAPDH 一抗、兔源半胱氨酸天冬氨酸蛋白酶-9(caspase-9)一抗、兔源Bcl-2 相关X 蛋白(Bcl-2-associated X protein,Bax)一抗、兔源HIF-1α一抗、羊抗兔二抗均购于美国Abcam公司。
1.1.2 主要仪器 En-Vision 型多功能酶标仪购于珀金埃尔默企业管理(上海)有限公司;Countstar Rigel 荧光细胞分析仪购于上海睿钰生物科技有限公司;UV5Nano紫外可见分光光度计购于梅特勒-托利多国际有限公司;ABI7500 型PCR 仪购于美国ABI 公司;FACS caliber 流式细胞仪、PowerPac 蛋白电泳仪购于美国BD 公司;Trans-Blot SD 型转膜仪、ChemiDoc XRS型凝胶成像仪购于美国Bio-Rad公司。
1.2 方法
1.2.1 细胞模型建立及分组转染 快速解冻复苏HUVECs,以培养HUVECs 的专用培养基重悬后,接种于T-25 培养瓶,进行无菌培养,当细胞生长至80%左右时以1∶3比例传代。
细胞分组:取上述传代的HUVECs,接种于24孔板,无菌培养24 h,随机分为对照组、H/R 模型组(细胞H/R 模型)、H/R+LncRNA SNHG12 过表达组、H/R+miR-138-5p mimics组、H/R+共转染组(用来验证LncRNA SNHG12 改善H/R 人血管内皮细胞损伤是否通过调控miR-138-5p/HIF-1α 实现)、H/R+共转染阴性对照(LncRNA SNHG12 空载质粒+miR-138-5p mimics阴性对照)组(每组6个重复孔)。
细胞转染:分别以50 μl Opti-MEM 培养基溶解质粒、mimics、mimics 阴性对照,配制为LncRNA SNHG12过表达质粒、LncRNA SNHG12空载质粒、miR-138-5p mimics 及miR-138-5p mimics 阴性对照溶液,再以200 μl Opti-MEM 培养基脂质体2000,配制为脂质体2000 溶液,将50 μl 脂质体2000 溶液分别与上述质粒、miR-138-5p mimics 及miR-138-5p mimics阴性对照溶液混匀,制成转染液,各组浓度参照各自说明书进行设定,将培养液替换为Opti-MEM 培养基,加入转染液后转染6 h,弃去Opti-MEM 培养基后替换为细胞培养液,继续培养24 h完成转染。
细胞模型建立及标本采集:取上述分组后的各组细胞,除对照组、H/R 模型组外的其余各组细胞按上述细胞转染方法进行分组转染:H/R+LncRNA SNHG12 过表达组转染LncRNA SNHG12 过表达质粒,H/R+miR-138-5p mimics 组转染miR-138-5p mimics,H/R+共转染组转染LncRNA SNHG12 过表达质粒和miR-138-5p mimics,H/R+共转染阴性对照组转染Lnc-RNA SNHG12 空载质粒和miR-138-5p mimics 阴性对照,转染的同时对H/R 模型组和转染组细胞给予5 h 缺氧后复氧1 h[12],来诱导建立H/R细胞模型,对照组细胞常规培养,均于造模2 h 后收集各组细胞,重复上述操作4 次,得到4 份细胞标本。
1.2.2 CCK-8 法检测细胞活力 通过细胞计数板检测HUVECs 浓度后,稀释为1.0×105个/ml,接种于96 孔板,无菌培养24 h,随机分为上述6 组,另选6个孔不接种细胞作为空白对照组, 除对照组外,其余各组细胞给予5 h 缺氧后复氧1 h,诱导建立H/R模型,同时参照1.2.1中方法进行分组转染,继续培养24 h,弃细胞培养液,替换为含适量CCK-8试剂的新培养液,2 h 后酶标仪测定各孔吸光度(A),计算细胞活力(%)=(A实验组-A空白对照组)/(A对照组-A空白对照组)×100%[12]。
1.2.3 流式细胞术检测细胞凋亡 将传代的HUVECs 接种于24 孔板,按照1.2.1 中方法分组处理后,加入适量胰酶消化、100 g离心,得到各组细胞沉淀,经PBS(8.0 g NaCl、0.2 g KCl、1.44 g Na2HPO4、0.24 g KH2PO4溶于800 ml蒸馏水中,用HCl调节pH至7.4,最后加蒸馏水定容至1 L)洗涤后重悬,依次加入适量Annexin V-FITC 与PI混匀,于37.5 ℃下避光孵育15 min,100 g 离心,以PBS 洗涤细胞沉淀,以500 μl PBS 重悬各组细胞,上样至流式细胞仪中,检测各组细胞凋亡情况[12]。
1.2.4 ELISA 检测细胞IL-6、IL-17、IL-18 水平 取1 份1.2.1 中收集的各组细胞,加入高效RIPA 裂解液,混匀后于冰水浴中裂解2 h,然后1 000 g 离心收集上清,各取0.1 ml 以ELISA 试剂盒分别测量其中IL-6、IL-17、IL-18 水平:包被96 孔板、加入样品液孵育、加入酶标抗体孵育、加入底物液显色后终止反应,以酶标仪测定各孔吸光度后,根据说明书中方法计算出IL-6、IL-17、IL-18水平。
1.2.5 荧光探针法测定ROS 水平 取1 份1.2.1中收集的各组细胞,加入荧光探针DCFH-DA,DCFH-DA 可自由穿过细胞膜,其本身没有荧光,进入细胞后,能被细胞内的酯酶水解生成DCFH,从而使探针被装载到细胞内,细胞内的活性氧可氧化DCFH,使其成为有荧光的DCF,测定DCF 的荧光值,即可知道细胞内活性氧的水平,以相对荧光强度表示(A.U.)。
1.2.6 分光光度计法检测细胞LDH 水平 取1.2.4 中细胞裂解样品液0.1 ml,加入工作液显色后终止反应,以分光光度计测定各孔吸光度后,根据说明书方法计算LDH水平[9-10]。
1.2.7 qRT-PCR 检 测 细 胞miR-138-5p 及HIF-1α mRNA 表达 取1份1.2.1中收集的各组细胞,以试剂盒提取其总RNA 后,采用一步法实时荧光定量试剂盒做qRT-PCR 实验,具体步骤及反应条件设置参照各自说明指导进行,HIF-1α 使用GAPDH 做内参,miR-138-5p 使用U6 做内参,所得各组基因Ct 值运用2-ΔΔCt算法进行分析,最终测出各组miR-138-5p 及HIF-1α mRNA的相对表达,各基因引物序列见表1。
1.2.8 Western blot 检测细胞凋亡蛋白caspase-9、Bax 及HIF-1α 蛋白表达 取1 份1.2.1 中收集的各组细胞,加入高效RIPA 裂解液,于4 ℃下裂解、1 000 g 离心,提取总蛋白,使用试剂盒经BCA 法测出浓度后调至各组相等[10],将其变性后分别取20 μl上样,110 V 下电泳75 min 分离蛋白,然后40 mA 下湿转60 min 将其移至硝酸纤维膜上,37.5 ℃下孵育5%脱脂奶粉溶液2 h,封闭膜上蛋白,然后根据分子量分别剪下caspase-9、Bax、GAPDH 及HIF-1α 蛋白条带,4 ℃下孵育相应一抗10 h,TBST(10 mmol/L Tris-HCl+150 mmol/L NaCl+2%Tween20,pH7.4)洗膜3 次,37.5 ℃下孵育羊抗兔二抗1.5 h,TBST 洗膜3 次,显色、拍照,以Image J 软件定量各蛋白条带灰度值,对其进行统计分析后得出各蛋白相对表达量。
2 结果
2.1 各组细胞活力情况 与对照组相比,H/R 模型组细胞活力降低(P<0.05);与H/R 模型组、H/R+共转染组相比,H/R+LncRNA SNHG12 过表达组细胞活力升高(P<0.05),H/R+miR-138-5p mimics组细胞活力降低(P<0.05);与H/R 模型组相比,H/R+共转染阴性对照组、H/R+共转染组细胞活力差异无统计学意义(P>0.05,表2)。
表2 各组细胞活力(±s,n=6)Tab.2 Cell viability of each group (±s,n=6)

表2 各组细胞活力(±s,n=6)Tab.2 Cell viability of each group (±s,n=6)
Note:Compared with control group, 1)P<0.05; compared with H/R model group, 2)P<0.05; compared with H/R+co-transfection group, 3)P<0.05.
Cell viability/%100.0±0.00 41.03±9.121)96.01±15.732)3)25.13±4.052)3)41.17±7.481)41.09±8.021)Groups Control H/R model H/R+LncRNA SNHG12 overexpression H/R+miR-138-5p mimics H/R+co-transfection H/R+co-transfection negative control
2.2 各组细胞凋亡情况 与对照组相比,H/R 模型组细胞凋亡率升高(P<0.05);与H/R 模型组、H/R+共转染组相比,H/R+LncRNA SNHG12 过表达组细胞凋亡率降低(P<0.05),H/R+miR-138-5p mimics组细胞凋亡率升高(P<0.05);与H/R 模型组相比,H/R+共转染阴性对照组、H/R+共转染组细胞凋亡率差异无统计学意义(P>0.05,图1、表3)。
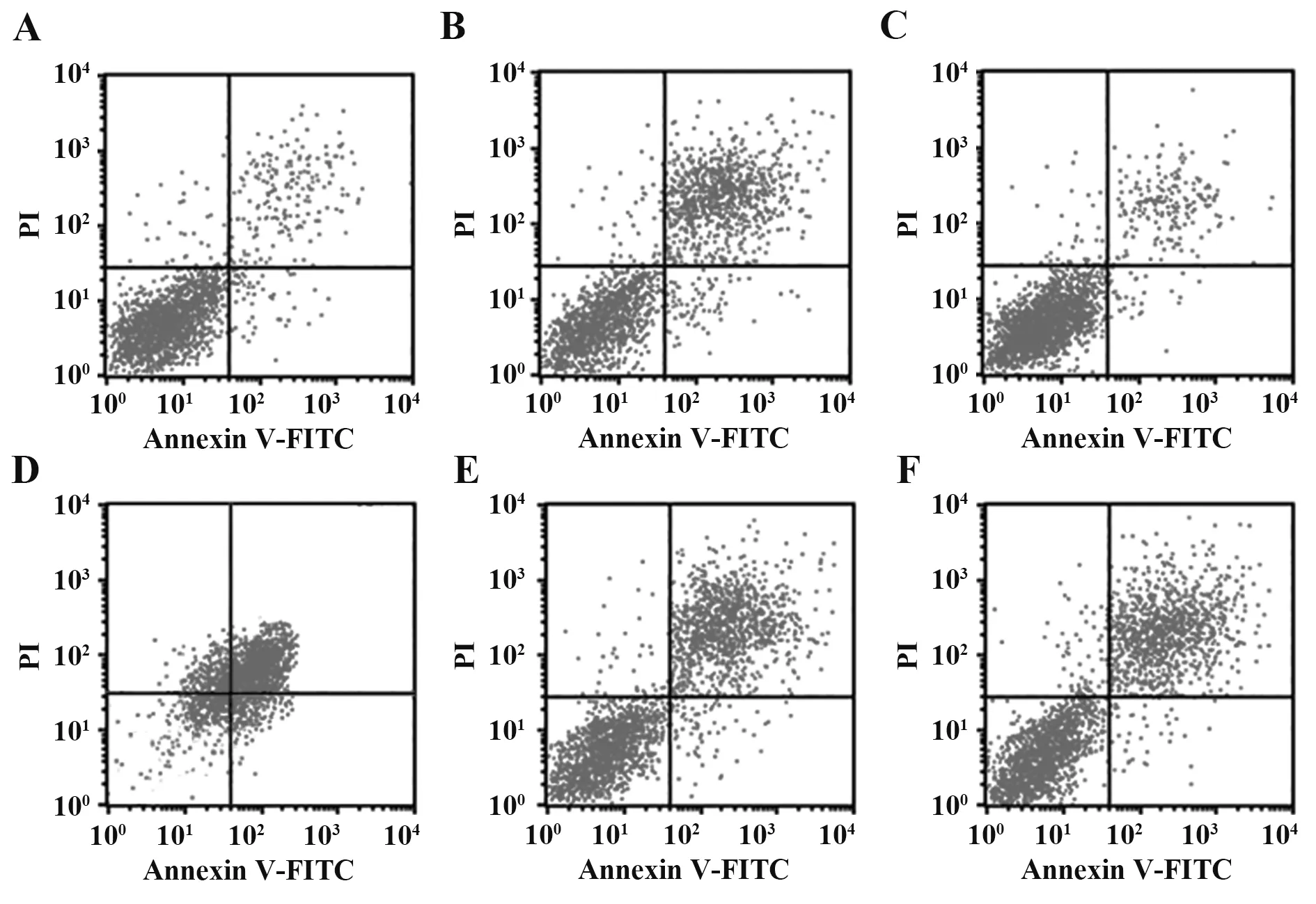
图1 流式细胞术检测各组细胞凋亡情况Fig.1 Apoptosis was detected by flow cytometry
表3 各组细胞凋亡率(±s,n=6)Tab.3 Apoptosis rate of each group (±s,n=6)
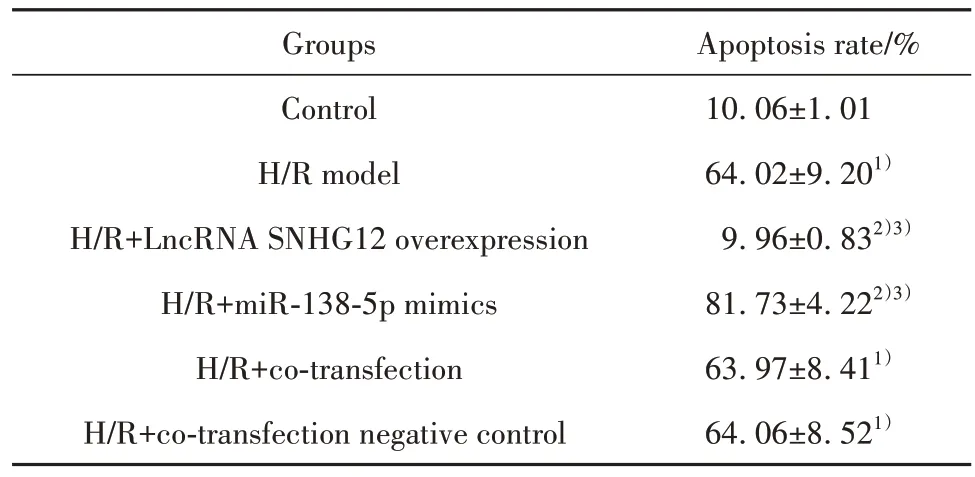
表3 各组细胞凋亡率(±s,n=6)Tab.3 Apoptosis rate of each group (±s,n=6)
Note:Compared with control group, 1)P<0.05; compared with H/R model group, 2)P<0.05; compared with H/R+co-transfection group, 3)P<0.05.
Apoptosis rate/%10.06±1.01 64.02±9.201)9.96±0.832)3)81.73±4.222)3)63.97±8.411)64.06±8.521)Groups Control H/R model H/R+LncRNA SNHG12 overexpression H/R+miR-138-5p mimics H/R+co-transfection H/R+co-transfection negative control
2.3 各组细胞ROS、LDH 检测水平 与对照组相比,H/R 模型组细胞ROS、LDH 水平升高(P<0.05);与H/R 模型组、H/R+共转染组相比,H/R+LncRNA SNHG12 过表达组细胞ROS、LDH 水平降低(P<0.05),H/R+miR-138-5p mimics 组细胞ROS、LDH 水平升高(P<0.05);与H/R 模型组相比,H/R+共转染阴性对照组、H/R+共转染组细胞ROS、LDH 水平差异无统计学意义(P>0.05,表4)。
表4 各组细胞ROS、LDH检测水平(±s,n=6)Tab.4 Detection levels of ROS and LDH in cells of each group (±s,n=6)

表4 各组细胞ROS、LDH检测水平(±s,n=6)Tab.4 Detection levels of ROS and LDH in cells of each group (±s,n=6)
Note:Compared with control group, 1)P<0.05; compared with H/R model group, 2)P<0.05; compared with H/R+co-transfection group, 3)P<0.05.
Groups Control H/R model H/R+LncRNA SNHG12 overexpression H/R+miR-138-5p mimics H/R+co-transfection H/R+co-transfection negative control ROS/(×103A.U.)4.64±0.59 43.07±8.221)LDH/(U·kg prot)0.54±0.10 1.32±0.271)6.04±0.832)3)0.56±0.112)3)67.31±10.242)3)41.98±9.041)1.97±0.322)3)1.30±0.251)43.74±8.651)1.33±0.281)
2.4 各组细胞炎症因子IL-6、IL-17、IL-18水平 与对照组相比,H/R 模型组细胞炎症因子IL-6、IL-17、IL-18 水平升高(P<0.05);与H/R 模型组、H/R+共转染组相比,H/R+LncRNA SNHG12 过表达组细胞炎症因子IL-6、IL-17、IL-18 水平降低(P<0.05),H/R+miR-138-5p mimics 组 细 胞 炎 症 因 子IL-6、IL-17、IL-18 水平升高(P<0.05);与H/R 模型组相比,H/R+共转染阴性对照组、H/R+共转染组细胞炎症因子IL-6、IL-17、IL-18 水平差异无统计学意义(P>0.05,表5)。
表5 各组细胞炎症因子IL-6、IL-17、IL-18水平(±s,n=6)Tab.5 Levels of cytokines IL-6, IL-17 and IL-18 in each group (±s,n=6)

表5 各组细胞炎症因子IL-6、IL-17、IL-18水平(±s,n=6)Tab.5 Levels of cytokines IL-6, IL-17 and IL-18 in each group (±s,n=6)
Note:Compared with control group, 1)P<0.05; compared with H/R model group, 2)P<0.05; compared with H/R+co-transfection group, 3)P<0.05.
IL-18/(ng·L-1)12.62±1.10 67.25±7.281)14.01±1.132)3)84.17±9.242)3)64.98±6.121)65.81±7.501)Groups Control H/R model H/R+LncRNA SNHG12 overexpression H/R+miR-138-5p mimics H/R+co-transfection H/R+co-transfection negative control IL-6/(ng·L-1)16.18±2.12 63.72±10.871)18.06±2.982)3)95.83±12.722)3)60.39±8.401)64.96±11.051)IL-17/(ng·L-1)5.65±0.71 37.24±5.821)7.03±1.022)3)58.79±6.922)3)34.97±3.811)37.54±5.531)
2.5 各组细胞miR-138-5p 及HIF-1α mRNA 水平
与对照组相比,H/R 模型组细胞HIF-1α mRNA 水平升高(P<0.05),miR-138-5p 水平降低(P<0.05)。与H/R 模型组、H/R+共转染组相比,H/R+LncRNA SNHG12 过表达组细胞HIF-1α mRNA 水平升高(P<0.05),miR-138-5p 水平降低(P<0.05);H/R+miR-138-5p mimics 组 细 胞miR-138-5p 水 平 升 高(P<0.05),HIF-1α mRNA 水平降低(P<0.05)。与H/R模型组相比,H/R+共转染阴性对照组、H/R+共转染组细胞miR-138-5p 及HIF-1α mRNA 水平差异无统计学意义(P>0.05,表6)。
表6 各组细胞miR-138-5p 及HIF-1α mRNA 水平(±s,n=6)Tab.6 miR-138-5p and HIF-1α mRNA level of cells in each group (±s,n=6)
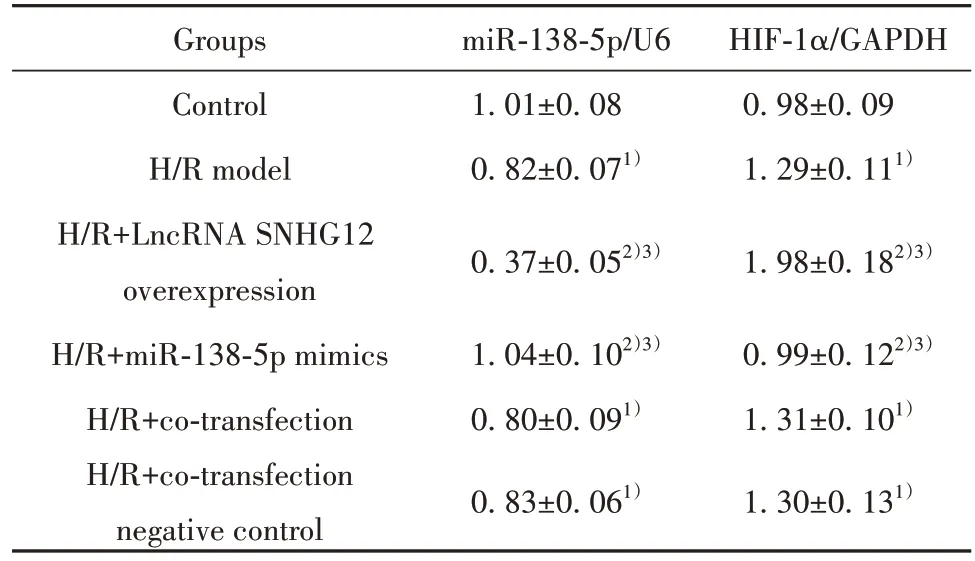
表6 各组细胞miR-138-5p 及HIF-1α mRNA 水平(±s,n=6)Tab.6 miR-138-5p and HIF-1α mRNA level of cells in each group (±s,n=6)
Note:Compared with control group, 1)P<0.05; compared with H/R model group, 2)P<0.05; compared with H/R+co-transfection group, 3)P<0.05.
Groups Control H/R model H/R+LncRNA SNHG12 overexpression H/R+miR-138-5p mimics H/R+co-transfection H/R+co-transfection negative control miR-138-5p/U6 1.01±0.08 0.82±0.071)HIF-1α/GAPDH 0.98±0.09 1.29±0.111)0.37±0.052)3)1.98±0.182)3)0.99±0.122)3)1.31±0.101)1.30±0.131)1.04±0.102)3)0.80±0.091)0.83±0.061)
2.6 Western blot检测各组细胞凋亡蛋白caspase-9、Bax 及HIF-1α 蛋白水平 与对照组相比,H/R 模型组细胞caspase-9、Bax 及HIF-1α 蛋白水平升高(P<0.05)。与H/R 模型组、H/R+共转染组相比,H/R+LncRNA SNHG12 过表达组细胞HIF-1α 蛋白水平升高(P<0.05),caspase-9、Bax 蛋 白 水 平 降 低(P<0.05);H/R+miR-138-5p mimics 组细胞HIF-1α 蛋白水平降低(P<0.05),caspase-9、Bax 蛋白水平升高(P<0.05)。与H/R 模型组相比,H/R+共转染阴性对照组、H/R+共转染组细胞caspase-9、Bax 及HIF-1α蛋白水平差异无统计学意义(P>0.05,图2、表7)。
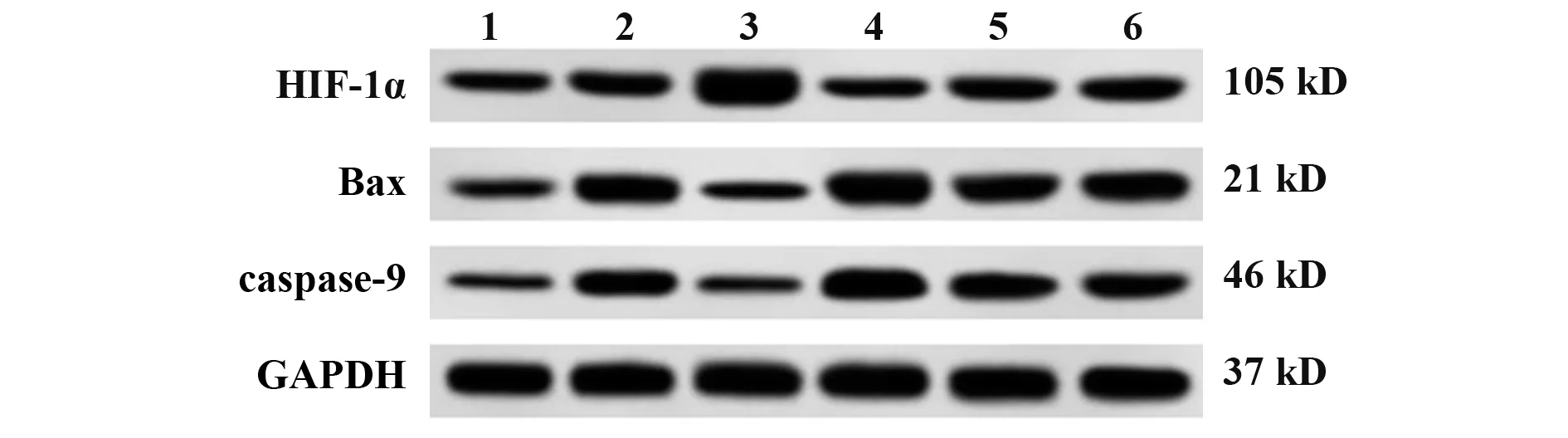
图2 蛋白免疫印迹检测各组细胞凋亡蛋白caspase-9、Bax及HIF-1α的表达Fig.2 Apoptosis proteins caspase-9, Bax and HIF-1α were detected by Western blot
表7 各组细胞caspase-9、Bax及HIF-1α蛋白表达水平(±s,n=6)Tab.7 caspase-9, Bax and HIF-1α protein expression levels of cells in each group (±s,n=6)

表7 各组细胞caspase-9、Bax及HIF-1α蛋白表达水平(±s,n=6)Tab.7 caspase-9, Bax and HIF-1α protein expression levels of cells in each group (±s,n=6)
Note:Compared with control group, 1)P<0.05; compared with H/R model group, 2)P<0.05; compared with H/R+co-transfection group, 3)P<0.05.
HIF-1α/GAPDH 0.48±0.05 0.63±0.061)1.38±0.172)3)0.49±0.042)3)0.62±0.071)0.64±0.051)Groups Control H/R model H/R+LncRNA SNHG12 overexpression H/R+miR-138-5p mimics H/R+co-transfection H/R+co-transfection negative control caspase-9/GAPDH 0.37±0.04 0.86±0.121)0.39±0.052)3)1.29±0.162)3)0.85±0.121)0.87±0.111)Bax/GAPDH 0.41±0.07 0.95±0.111)0.43±0.082)3)1.34±0.152)3)0.94±0.101)0.96±0.131)
3 讨论
缺血再灌注发生后,血管内氧稳态被破坏,导致ROS、自由基大量产生释放,诱导促炎因子过表达,造成血管内皮细胞严重损伤与凋亡,是缺血再灌注组织损伤的主要发病机制之一,建立血管内皮细胞H/R 模型,对于体外研究组织缺血再灌注损伤具有重大意义[13-14]。本研究给予体外培养的HUVECs 缺氧5 h,再进行复氧1 h 处理,诱导建立细胞模型,结果显示,相比未做处理的细胞,其凋亡率、细胞ROS、LDH、IL-6、IL-17 及IL-18 水平、细胞caspase-9 及Bax 蛋白水平升高,细胞活力降低,表明H/R 可诱导ROS、促炎细胞因子大量产生释放,引发过氧化及炎症反应,促使细胞凋亡,造成严重的细胞损伤,揭示H/R模型构建成功。
LncRNA SNHG12是细胞存活、凋亡及损伤的重要调控因子,在脑缺血再灌注损伤后,表达水平会有所上调,发挥脑组织保护作用,过表达LncRNA SNHG12,可抑制自噬,降低缺血再灌注诱导的ROS和丙二醛(malondialdehyde,MDA)释放,抑制氧化应激,显著提高细胞活力,减弱其凋亡,改善脑缺血再灌注损伤[15-17]。本研究结果显示,过表达H/R 模型细胞中LncRNA SNHG12,可增强细胞活力,降低细胞凋亡率、细胞ROS、LDH、IL-6、IL-17及IL-18水平、细胞caspase-9 与Bax 蛋白水平,表明LncRNA SNHG12 表达会在细胞H/R 后保护性升高,促进其表达,可阻止氧化应激与炎症反应发生发展,促使细胞存活,抑制其凋亡,减轻细胞损伤,进一步增强LncRNA SNHG12的细胞保护作用。
HIF-1α 作为一种缺氧诱导因子,在H/R 处理后,表达会上调,可保护细胞免于H/R造成的炎症及氧化应激损伤[18]。miR-138-5p 是HIF-1α 的一个调控因子,可负向调节其表达水平,且缺血再灌注可诱导miR-138-5p 表达上调,而下调miR-138-5p 表达可显著降低心肌细胞凋亡率,减轻心肌梗死后心肌组织损伤,改善心功能[8,19]。另有研究表明,LncRNA SNHG12 可正调控HIF-1α 表达,改善氧化低密度脂蛋白诱导的血管平滑肌细胞表型变化,因而推测调控miR-138-5p/HIF-1α 轴可能是LncRNA SNHG12 改善H/R 引发的人血管内皮细胞损伤的分子机制[20]。本研究结果显示,过表达H/R 模型细胞中miR-138-5p,可降低其细胞活力、细胞HIF-1α mRNA 及蛋白水平,升高细胞凋亡率、细胞ROS、LDH、IL-6、IL-17 及IL-18 水平、细胞caspase-9 与Bax蛋白水平,表明miR-138-5p/HIF-1α 轴参与介导H/R引发的血管内皮细胞损伤过程,促进miR-138-5p 表达,可下调HIF-1α表达,加重细胞损伤及凋亡,且在H/R 模型细胞中过表达LncRNA SNHG12,可降低其miR-138-5p 水平,升高HIF-1α mRNA 及蛋白水平,但Lnc-RNA SNHG12改善H/R 人血管内皮细胞损伤是否通过调控miR-138-5p/HIF-1α实现的,目前尚未有明确报道,本研究为了对此进行研究验证,于H/R模型细胞中共转染了LncRNA SNHG12 过表达质粒和miR-138-5p mimics,结果显示,以miR-138-5p mimics 可减弱LncRNA SNHG12 阻止H/R 引发的严重与氧化应激,增强细胞活力的作用,逆转其抗凋亡功效,表明LncRNA SNHG12 阻止H/R 引发的炎症与氧化应激,促使细胞活力增强和逆转其抗凋亡功效,最终改善H/R 人血管内皮细胞损伤是通过下调miR-138-5p,上调HIF-1α表达实现的。
总 之,LncRNA SNHG12 可 下 调miR-138-5p 表达,促进HIF-1α 表达,抑制ROS 和炎症细胞因子释放,阻止氧化应激及炎症发生发展,增强细胞活力,减弱凋亡过程,改善细胞损伤,调控miR-138-5p/HIF-1α 轴是其分子机制之一,本研究为临床各种组织器官缺血再灌注损伤的防治提供了新的治疗靶点,促进了心血管疾病治疗策略的发展。

