CD4+T细胞极化在炎症性疾病中作用的研究进展①
晏 伟 薛丹风 江淑玲 凌鑫萍 李 娜 (南昌大学第一附属医院,南昌 330006)
1 CD4+T细胞极化概述
CD4+T 细胞向特定T 细胞表型的特定细胞分化被称为CD4+T 细胞极化,其在机体炎症调节过程中发挥重要作用[1-2]。受外界环境及细胞因子等因素影响,CD4+T 细胞可极化为Th1、Th2、Th17 和Treg 等效应细胞。具体而言:①IL-12 上调T-bet,使CD4+T细胞极化为Th1细胞。Th1细胞会释放IFN-γ、TNF-α及IL-2,从而加剧炎症反应;②IL-4 促使STAT6 激活后,诱导GATA3表达,引发Th2极化。Th2细胞又可分泌IL-4及IL-13等发挥抑炎作用;③TGF-β、IL-1β、IL-6 等共同作用使RORγt 活化,进而实现Th17 极化。Th17 细胞会释放IL-17 等促炎因子促进炎症;④TGF-β 诱导Foxp3 表达进而促进Treg 极化。Treg细胞又可释放IL-10、TGF-β 等抑炎因子来抑制炎症。
因此,本综述旨在总结并探讨CD4+T 细胞极化在不同炎症性疾病中的调控作用及机制,以期为后续展开相关研究提供参考和依据。
2 CD4+T细胞极化在炎症性疾病中的作用
CD4+T 细胞极化与多发性硬化(multiple sclerosis,MS)、结肠炎、类风湿关节炎(rheumatoid arthritis,RA)及特应性皮炎(atopic dermatitis,AD)等多种炎症性疾病有关,详见表1,具体阐述如下。
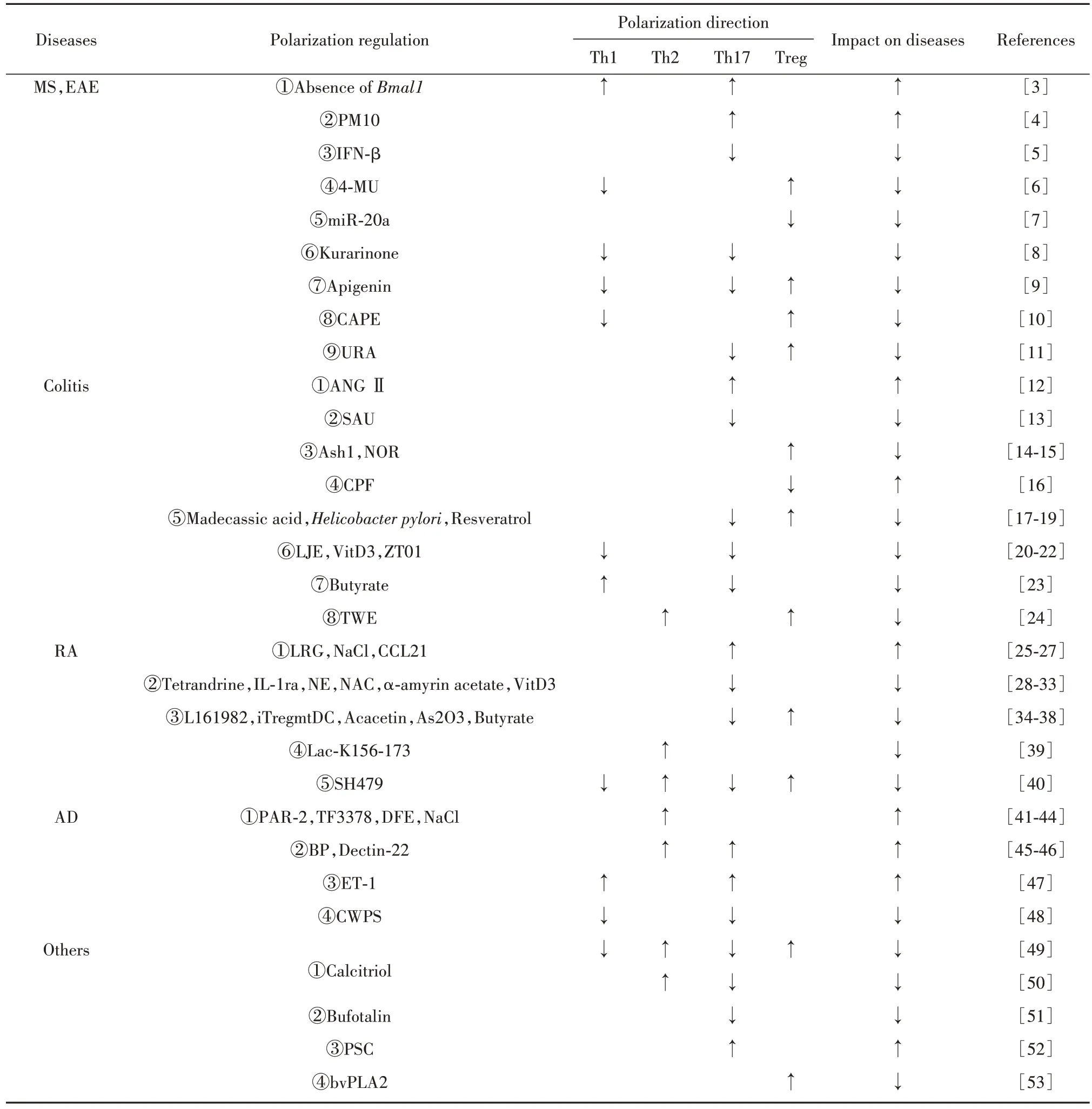
表1 CD4+T细胞极化在炎症性疾病中的作用Tab.1 Role of CD4+T cell polarization in inflammatory diseases
2.1 CD4+T 细胞极化与MS MS 是一种以中枢神经系统损害为特征的自身免疫炎症性疾病。实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)是MS 的动物模型。Th1 和Th17 极化增强可加剧MS 及EAE 疾病进展。SUTTON 等[3]发现,小鼠髓系细胞时钟基因Bmal1缺失能使分泌IL-1β 的CD11b+Ly6hi单核细胞扩增和浸润,进而引起Th1 和Th17 反应增强,并产生更多致病性IFN-γ+/IL-17+T细胞,加重EAE。CORTESE等[4]研究显示,空气污染物颗粒物10(PM10)可诱导先天免疫细胞产生Th17极化细胞因子(IL-1β、IL-6)加剧MS炎症。
常用药干扰素-β(IFN-β)可通过活化的树突状细胞(dendritic cell,DC)限制CD4+T 细胞向Th17 极化,从而减轻EAE或MS的严重程度[5]。而4-甲基伞形酮(4-MU)可促使T 细胞从Th1 表型转向FoxP3+Treg 表型,进而减轻EAE[6]。但近期有研究报道,miR-20a 能通过降低丝裂原活化蛋白激酶9(Map3k9)表达抑制Treg极化,减轻EAE[7]。
不仅如此,天然类物质也被广泛应用于MS 及EAE 的治疗。苦参素可抑制Th1 及Th17 极化延缓EAE 进展[8]。芹菜素可通过下调RelB 蛋白将Th1和Th17 表型转变为Treg 发挥抗炎作用,其降低了Tbet、IFN-γ 及IL-17 表达,但增加了IL-10、TGF-β 和FoxP3 表达[9]。咖啡酸苯乙酯(CAPE)通过抑制NFκB 活化使CD4+IFN-γ+T 细胞比例下调、CD4+Foxp3+T细胞比例升高,进而在MS 中发挥抗炎功效[10]。果类成分鞣花酸可在肠道中形成乌萝卜素A(URA),其可直接靶向芳烃受体(AhR),随后抑制Th17 极化并阻碍IL-17、IFN-γ分泌,上调抑炎因子IL-10水平,最终减轻EAE[11]。
2.2 CD4+T 细胞极化与结肠炎 结肠炎疾病进展涉及CD4+T 细胞极化。血管紧张素Ⅱ(ANG Ⅱ)通过JAK2/STAT 信号通路,不仅直接促进Th17 极化,亦可诱导结肠上皮细胞释放TGF-β1 及IL-6 间接促进Th17 极化,加剧结肠炎症[12]。与之相反,茄子酮(SAU)不仅抑制Th17 分化,还可通过Blimp-1 途径促使IL-10 产生,进而改善结肠炎[13]。H3K4 甲基转移酶Ash1 通过增强TGF-β-Smad2/3 信号、去甲酚定(NOR)通过调节AhR/糖酵解轴及NAD+/SIRT1/SUV39H1/H3K9me3 信号通路,均可促进Treg 极化,预防并减轻结肠炎[14-15]。给予有机磷农药毒死蜱(CPF)后,结肠炎小鼠可通过ACh 和AChRs 相互作用抑制Treg 极化,下调IL-10 和Foxp3 mRNA 表达,最终加重结肠组织损伤[16]。
调控Th17/Treg 动态平衡亦可改善结肠炎。XU等[17]发现,羟基乙酸通过PPARγ/AMPK/ACC1 信号通路降低结肠炎小鼠Th17 比例,提高Treg 比例,从而改善结肠炎。幽门螺杆菌定植可降低结肠炎小鼠IL-6 释放、增加TGF-β 表达,随后抑制Th17 反应并诱导Treg 反应,同时降低IL-17 水平,增加IL-10表达,最终在结肠炎中发挥保护作用[18]。ALRAFSA等[19]研究表明,白藜芦醇诱导的微生物群对结肠炎治疗有积极作用,表现出对CD4+Foxp3+T 细胞的极化促进及CD4+IFN-γ+T和CD4+IL-17+T细胞的减少。
此外,多种药物还可通过抑制Th1/Th17 极化来防治结肠炎。一项探讨金银花水提物(LJE)灌胃给药对小鼠结肠炎影响的实验表明,LJE 可通过下调Th1及Th17相关炎症细胞因子(IL-12、TNF-α、IFN-γ和IL-1β、IL-6、IL-17)预防结肠炎[20]。维生素D3(VitD3)、ZT01 均通过JAK-STAT 信号通路抑制Th1和Th17 极化,进而治疗结肠炎[21-22]。与上述研究有出入的是,丁酸可通过差异化调节Th1 和Th17 分化控制T 细胞诱导结肠炎的能力:在Th1 极化条件下,丁酸促进T 细胞表达T-bet,而在Th17 极化条件下,其会抑制Th17 相关转录因子,而后促进Th1 发育但抑制Th17 发育[23]。塔希伯水提物(TWE)使巨噬细胞偏向M2表型后,可通过诱导Th2和Treg极化改善结肠炎[24]。
2.3 CD4+T 细胞极化与RA RA 是最常见的炎症性关节炎,其动物模型为胶原诱导性关节炎(collagen induced arthritis,CIA)。富含亮氨酸的α2 糖蛋白(LRG)可通过增强TGF-β-Smad2 途径促进Th17极化,加速CIA 进展[25]。JUNG 等[26]发现,RA患者滑液中Na+和IL-17 含量较高,且高盐饲养的CIA 小鼠脾脏中Th17比例及肠道、滑膜中IL-17表达均较高,由此指出NaCl 可能通过影响Th17 细胞分化加重RA。VAN RAEMDONCK 等[27]研究显示,趋化因子CCL21 在RA 滑膜组织中的大量表达可使IL-6 表达增加,进而驱动Th17极化,加重RA。
而抑制Th17 极化有益于RA 及CIA 的防治。粉防己碱可通过AhR途径减少Th17细胞分化,达到改善小鼠CIA 目的[28]。LEE 等[29]发现人骨髓间充质干细胞(MSCs)表达的抗炎细胞因子白细胞介素1 受体拮抗剂(IL-1ra)可通过抑制IL-1RaKO 小鼠Th17极化改善其炎症。同时,LIU 等[30]证明去甲肾上腺素(NE)可通过激活b2-AR/PKA 信号抑制Th17 极化,进而在CIA 中发挥抗炎作用。而N-乙酰半胱氨酸(NAC)、α-香菇蛋白醋酸酯通过抑制RORγt 转录、VitD3 通过miR-124 介导的IL-6 信号转导,均可抑制Th17极化,进而改善RA及CIA[31-33]。
调控Th17 与Treg 的极化状态亦可改善RA 及CIA。L161982 干预后,提高了CIA 小鼠Treg 水平、降低了小鼠血浆和组织中IL-17 水平、减少了Th17极化,最终减轻了CIA 严重程度[34]。成熟的耐受树突状细胞(iTre-gmtDC)可表达更高水平的FoxP3,在更大程度上抑制Th17 分化,并促使Treg/Th17 反应平衡,进而更有效地抑制CIA[35]。植物提取物金合欢素可通过增强Treg 反应、抑制Th17 反应修复Th17/Treg 失衡,从而降低CIA 的发生率[36]。同样,三氧化二砷(As2O3)通过STAT3调节,不仅显著抑制RA 患者Th17 分化、促进Treg 分化,也降低了IL-17、IL-6 和TNF-α 表达、增强了IL-10 和TGF-β 释放,进而改善RA[37]。而丁酸可通过显著抑制IL-1β、IL-6、IL-17 释放、上调IL-10 表达及促进Treg 极化抑制CIA 炎症[38]。多肽Lac-K156-173 可通过甘露糖受体(MR)调节DC 的分化、成熟和功能,进而上调Jagged1,随 后 引 起Th2 极 化,显 著 改 善 小 鼠CIA[39]。CHEN 等[40]研究指出,SH479 可通过JAK-STAT 信号通路将Th17/Th1 反应转变为Th2/Treg 表型来治疗RA,其可降低IL-17 和IFN-γ 水平并增强IL-10 和IL-4表达。
2.4 CD4+T 细胞极化与AD AD 是一种常见的以Th2 反应为主的慢性炎症性皮肤病。蛋白酶激活受体-2(PAR-2)的激活会引起胸腺基质淋巴生成素(TLSP)产生及嗜碱性粒细胞聚集,进而促进Th2 极化,加剧AD[41]。而AD 患者皮肤中的金黄色葡萄球菌TF3378 亦可诱导Th2 免疫反应,增加AD 治疗难度[42]。粉 尘 螨 提 取 物(DFE)首 先 激 活TLR1 和TLR6,随后刺激角质形成细胞释放IL-25 和IL-33,进一步引起Th2免疫应答极化,最终加剧AD的过敏症状及炎症反应[43]。研究证明,AD患者皮肤中NaCl比例较高,其可通过渗透敏感转录因子NFAT5 和激酶SGK-1 诱导Th2 极化,塑造适宜AD 进展的微环境,加重AD[44]。
此外,HONG 等[45]发现烟雾中的苯并芘(BP)可通过Ahr/Arnt 轴极化Th2 及Th17 反应,在致敏阶段诱导AD。LIANG 等[46]研究指出,Dectin-22 介导的过敏原致敏及增敏可使IL-33、IL-6等Th2和Th17相关炎症因子上调,随后引起TSLP 诱导Th2/Th17 极化,进而引发AD。NAKAHARA 等[47]证实AD 患者表皮中内皮素-1(ET-1)上调,ET-1可使DC-T细胞反应向Th17/Th1 极化转变,随后加重AD。值得庆幸的是,天然草药提取物白蜡虫粗多糖(CWPS)可通过抑制Th1/Th17 极化减轻AD 炎症反应,在CWPS干预组中,Th1 及Th17 的比例、T-bet 和RoRγt 的基因表达、细胞因子(IFN-γ、IL-17A 和IL-6)的表达均明显低于生理盐水组[48]。
2.5 CD4+T 细胞极化与其他炎症性疾病 除上述疾病外,CD4+T 细胞极化也与牙周炎等其他炎症性疾病相关。BI 等[49]研究显示,骨化三醇干预的大鼠牙周炎组织IL-17水平降低、IL-4和IL-10水平升高,外周血中Th2 和Treg 百分比增加、Th1 和Th17 百分比下降。该团队还发现骨化三醇处理后,小鼠Th细胞表现出Th2 极化增强,GATA3 和STAT5 的基因及蛋白水平均提高;而Th17 极化降低,RoRγt 基因及蛋白水平也降低[50]。
蟾蜍林能抑制Th17 极化及IL-17、IFN-γ 分泌,进而改善慢性炎症性自身免疫性疾病干燥综合征(SS)炎症反应[51]。另有研究指出,CD4+T 细胞在原发性硬化性胆管炎(PSC)中呈现出Th17 极化,倾向[52]。而蜂毒磷脂酶A2(bvPLA2)可诱导Foxp3+Treg极化减轻小鼠多发性关节炎[53]。
3 总结与展望
综上所述,CD4+T 细胞极化在MS、结肠炎、RA及AD 等多种炎症性疾病的发生发展及防治中发挥重要作用。总体而言,CD4+T 细胞向Th1 及Th17 极化会加重炎症性疾病,而向Th2 及Treg 极化有利于减轻炎症。但这并不绝对,如miR-20a 可通过抑制Treg 极化减轻EAE[7];丁酸可通过差异化调节Th1和Th17 分化控制T 细胞诱导结肠炎的能力[23]。而在AD 疾病中,因其还涉及一定的致敏过程等,发病机制更为复杂,Th2极化增强会加重疾病。
CD4+T 细胞的可塑性极强,其向某一亚型效应细胞群的极化是动态变化的。因此,上述多项研究通过外在的药物干预人为调控CD4+T细胞的极化状态,使其向有益于减轻和改善炎症性疾病的方向发展。同时,CD4+T 细胞的极化也是一个极其复杂的免疫过程。不同药物可通过促进或抑制同一极化方向达到相同的防治效果。而同一药物在不同疾病中,其极化作用也可能不同[23,38]。提示在今后进行相关研究时,应具体问题具体分析。另外,CD4+T细胞极化涉及的途径或靶基因尚未阐明,期待今后的研究能丰富相关内容。
最后,天然类物质在调控CD4+T 细胞极化以改善炎症性疾病方面具有广阔的前景,下一步研究可以此为切入点探讨炎症性疾病防治的新策略。

