丹参酮ⅡA 通过miR-155-5p 激活SIRT1-AMPK 通路改善H9c2 心肌细胞缺血/再灌注损伤①
张磊磊 谢周良 权晓强 丁付燕
(河南省人民医院心脏中心,华中阜外医院,郑州大学华中阜外医院成人心脏外科,郑州 450003)
急性心肌梗死是全球除癌症外导致人类死亡的主要原因[1]。急性心肌梗死的标准治疗方法是打开阻塞的冠状动脉及时进行再灌注治疗,但该方法会造成心脏的额外损伤,称为缺血/再灌注(ischemia/reperfusion,I/R)损伤,大大降低了患者的再灌注治疗效果[2]。I/R 损伤是一个复杂的病理过程,再灌注后炎症因子的异常释放、心肌细胞的大量凋亡及自由基的大量生成均能进一步加重心脏损伤[3]。研究表明miRNA 在I/R 损伤中发挥重要作用,其通过调节相关信号通路及靶基因表达成为心肌I/R 损伤的潜在治疗靶点[4]。最新研究显示,miR-155-5p参与调控心肌I/R 损伤[5]。沉默信息调节因子1(Sirtuin 1,SIRT1)-腺苷酸活化蛋白激酶(adenosine 5'-monophosphateactivated protein kinase,AMPK)通路不仅与脂质代谢有关,而且参与调控心肌I/R 损伤[6-7]。丹参酮ⅡA(Tanshinone ⅡA,TⅡA)是唇形科植物丹参的主要活性物质,具有扩展血管、降低血压、抗血栓等功能,在冠心病、心率过速等心血管疾病中有显著的治疗效果[8]。相关文献显示,TⅡA有助于减轻心肌I/R 损伤,但其具体作用机制尚不完全明确,目前尚未见TⅡA 通过调节SIRT1-AMPK通路在心肌I/R 损伤中发挥作用的报道[9]。本研究拟利用H9c2 心肌细胞构建I/R 损伤模型,初步探讨TⅡA 对H9c2 心肌细胞I/R 损伤的保护作用及其与miR-155-5p、SIRT1-AMPK 通路的调控关系,旨在为心肌I/R 损伤的临床治疗提供新的靶点和实验依据,为完善TⅡA 保护心肌细胞I/R 损伤的分子机制提供一定的理论依据。
1 材料与方法
1.1 材料
1.1.1 细胞来源 H9c2心肌细胞购自中国科学院细胞库。H9c2 细胞复苏后置于添加10%胎牛血清的DMEM 培养基中,在37 ℃、含5%CO2的细胞培养箱中培养。
1.1.2 主要试剂及仪器 DMEM 培养基购自武汉尚恩生物技术有限公司;TⅡA购自成都仪睿生物科技有限公司;miR-155-5p 模拟物(miR-155-5p mimics)及其阴性对照(miR-NC)购自百奥迈科生物技术有限公司;Lipofectamine 3000 购自美国Thermo Fisher Scientific公司;AceQ®qPCR SYBR Green Master Mix试剂盒购自南京诺唯赞生物科技股份有限公司;四甲基偶氮唑蓝(MTT)试剂盒购自艾博抗(上海)贸易有限公司;Annexin V-FITC/PI细胞凋亡检测试剂盒购自上海翌圣生物科技公司;TNF-α、IL-4、IL-10、IL-17、乳 酸 脱 氢 酶(lactate dehydrogenase,LDH)、丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)ELISA 试剂盒购自武汉赛培生物科技有限公司;SIRT1、AMPK、p-AMPK、β-actin 抗体及对应二抗购自美国Abcam 公司。细胞培养箱购自广州南方生化医学仪器有限公司;实时荧光定量PCR(qRT-PCR)仪购自上海普迪生物技术有限公司;酶标仪购自美谷分子仪器(上海)有限公司;流式细胞仪购自贝克曼库尔特商贸(中国)有限公司。
1.2 方法
1.2.1 模型构建与分组 对数生长期的H9c2细胞采用缺氧/复氧的方法构建I/R 损伤模型:首先将H9c2细胞置于不含糖的DMEM 培养基中,于缺氧培养箱(参数设置为:37 ℃、1%O2、5%CO2)中持续培养4 h;然后将细胞更换至高糖的DMEM 培养基中,在正常培养箱中继续培养2 h。TⅡA 溶解于DMSO,并调节浓度至10 μmol/L。将造模成功的H9c2 细胞随机分为模型组、TⅡA 组(加入10 μmol/L TⅡA 干预24 h)、TⅡA+miR-NC 组(细胞转染miR-NC 后加入10 μmol/L TⅡA 干预24 h)、TⅡA+miR-155-5p mimics 组(细胞转染miR-155-5p mimics 后加入10 μmol/L TⅡA 干预24 h),TⅡA 的干预浓度和时间是在参考文献[10]的基础上通过预实验所确定,另取常规培养的H9c2 细胞(添加等量DMSO)作为对照组,miRNA 转染的具体操作按照Lipofectamine 3000说明书严格进行。
1.2.2 qRT-PCR 检测miR-155-5p 表达水平 提取各组处理后的H9c2 细胞总RNA,反转录为cDNA,然后使用AceQ®qPCR SYBR Green Master Mix 配制PCR 反应体系,采用qRT-PCR 仪进行PCR 扩增,实验结果以U6为内参进行归一化,并采用2-ΔΔCt法计算miR-155-5p 的相对表达水平。U6 正向引物:5'-CTCGCTTCGGCAGCACA-3',反 向 引 物:5'-AACGCTTCACGAATTTGCGT-3';miR-155-5p 正向引物:5'-GTATCCAGTGCGTGTCGTGG-3',反向引物:5'-GTATCCAGTGCGTGTCGTGG-3'。
1.2.3 MTT法检测细胞活力 将H9c2细胞接种至96 孔板,调整细胞密度为1×105个/ml,并按照1.2.1方法进行处理,然后分别加入MTT 试剂10 μl,37 ℃下培养4 h,最后用酶标仪检测波长为450 nm 时各孔的光密度(OD)值,并计算其细胞活力。细胞活力(%)=(OD实验组-OD空白组)/(OD对照组-OD空白组)×100%。
1.2.4 流式细胞术检测细胞凋亡 将各组H9c2细胞制备成细胞悬液,置于圆底管中(细胞密度为1×105个/ml),先加入5 μl Annexin V,反应15 min后,再加入5 μl PI,然后使用流式细胞仪观察细胞凋亡情况,并用Flow Jo 软件对数据进行定量分析。Annexin V 单独染色表示细胞发生早期凋亡,Annexin V/PI双染表示细胞处于晚期凋亡。凋亡率(%)=(早期凋亡细胞数+晚期凋亡细胞数)/总细胞数×100%。
1.2.5 ELISA 检测炎症因子、心肌细胞损伤标志物及氧化应激标志物水平 将处理后的各组H9c2 细胞进行离心,收集上清液,按照ELISA试剂盒说明书检测炎症因子TNF-α、IL-4、IL-10、IL-17、心肌细胞损伤标志物LDH 和氧化应激标志物MDA、SOD水平。
1.2.6 Western blot 检测SIRT1、AMPK 蛋白表达分别提取1.2.1中各组H9c2细胞总蛋白,采用SDSPAGE 电泳分离后转至PVDF 膜,使用5%~8%的脱脂牛奶阻断印迹1 h,加入SIRT1、AMPK、p-AMPK、β-actin 抗体,4 ℃培养过夜,缓冲液冲洗膜3 次后加入对应二抗,2 h 后采用ECL 检测系统和NIH Image J软件分析条带灰度值。
2 结果
2.1 TⅡA 通过miR-155-5p 对H9c2 细胞增殖的影响 与对照组相比,模型组miR-155-5p 表达显著升高,细胞活力显著降低(P<0.05);与模型组比较,TⅡA组miR-155-5p表达显著降低,细胞活力显著升高(P<0.05);与TⅡA 组和TⅡA+miR-NC 组相比,TⅡA+miR-155-5p mimics组miR-155-5p表达显著升高,细胞活力显著降低(P<0.05),见表1。
表1 MTT法检测各组H9c2细胞活力(±s,n=6)Tab.1 H9c2 cell viability of each group detected by MTT method (±s, n=6)

表1 MTT法检测各组H9c2细胞活力(±s,n=6)Tab.1 H9c2 cell viability of each group detected by MTT method (±s, n=6)
Note:Compared with control group, 1)P<0.05; compared with model group, 2)P<0.05; compared with TⅡA group, 3)P<0.05; compared with TⅡA+miR-NC group, 4)P<0.05.
Groups Control Model TⅡA TⅡA+miR-NC TⅡA+miR-155-5p mimics miR-155-5p Cell viability/%100.00±0.11 67.49±5.231)93.67±8.462)92.58±8.15 52.94±4.283)4)1.00±0.03 1.56±0.211)1.03±0.082)1.05±0.12 2.89±0.433)4)
2.2 TⅡA 通过miR-155-5p 对H9c2 细胞损伤的影响 图1、表2显示,模型组细胞凋亡率、LDH活性较对照组明显升高(P<0.05);TⅡA 组细胞凋亡率、LDH 活性较模型组明显降低(P<0.05);TⅡA+miR-155-5p mimics 组细胞凋亡率、LDH 活性较TⅡA+miR-NC组和TⅡA组明显升高(P<0.05)。

图1 流式细胞术检测各组H9c2细胞凋亡Fig.1 Apoptosis of H9c2 cells in each group detected by flow cytometry
表2 流式细胞术和ELISA检测各组H9c2细胞凋亡和LDH水平(±s,n=6)Tab.2 Apoptosis and LDH level of H9c2 cells in each group were detected by flow cytometry and ELISA(±s, n=6)
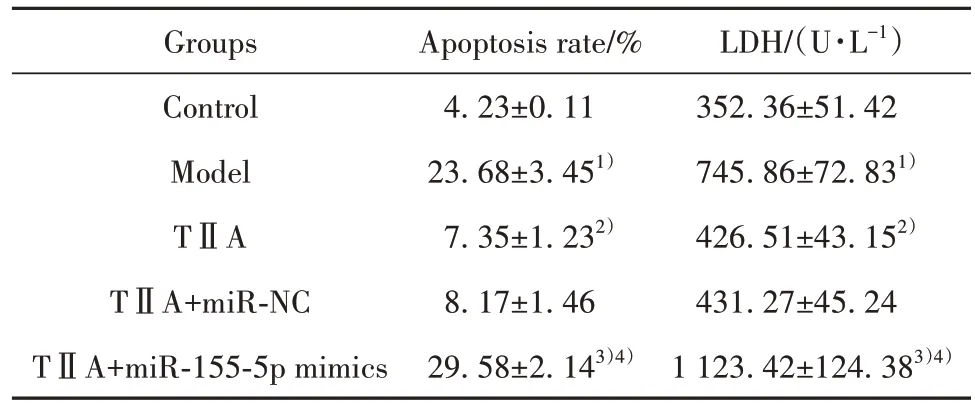
表2 流式细胞术和ELISA检测各组H9c2细胞凋亡和LDH水平(±s,n=6)Tab.2 Apoptosis and LDH level of H9c2 cells in each group were detected by flow cytometry and ELISA(±s, n=6)
Note:Compared with control group, 1)P<0.05; compared with model group, 2)P<0.05; compared with TⅡA group, 3)P<0.05; compared with TⅡA+miR-NC group, 4)P<0.05.
LDH/(U·L-1)352.36±51.42 745.86±72.831)426.51±43.152)431.27±45.24 1 123.42±124.383)4)Groups Control Model TⅡA TⅡA+miR-NC TⅡA+miR-155-5p mimics Apoptosis rate/%4.23±0.11 23.68±3.451)7.35±1.232)8.17±1.46 29.58±2.143)4)
2.3 TⅡA 通过miR-155-5p 对H9c2 细胞炎症反应的影响 与对照组比较,模型组TNF-α和IL-17水平升高,IL-4 和IL-10 水平降低(P<0.05);与模型组比较,TⅡA 组TNF-α 和IL-17 水平降低,IL-4 和IL-10水平升高(P<0.05);与TⅡA 组和TⅡA+miR-NC 组比较,TⅡA+miR-155-5p mimics 组TNF-α 和IL-17 水平升高,IL-4和IL-10水平降低(P<0.05),见表3。
表3 ELISA检测各组H9c2细胞炎症因子水平(±s,ng/L,n=6)Tab.3 ELISA detection of H9c2 cell inflammatory factors levels in each group (±s,ng/L,n=6)

表3 ELISA检测各组H9c2细胞炎症因子水平(±s,ng/L,n=6)Tab.3 ELISA detection of H9c2 cell inflammatory factors levels in each group (±s,ng/L,n=6)
Note:Compared with control group, 1)P<0.05; compared with model group, 2)P<0.05; compared with TⅡA group, 3)P<0.05; compared with TⅡA+miR-NC group, 4)P<0.05.
IL-17 11.26±1.12 19.65±0.891)12.14±1.162)12.35±1.23 33.56±2.053)4)Groups Control Model TⅡA TⅡA+miR-NC TⅡA+miR-155-5p mimics TNF-α 22.43±1.05 43.56±2.141)26.35±1.422)27.06±1.53 52.89±2.373)4)IL-4 44.35±2.36 32.51±1.841)43.56±2.412)42.78±2.35 28.47±1.383)4)IL-10 65.49±1.57 56.27±1.251)63.85±1.622)62.58±1.65 49.34±1.133)4)
2.4 TⅡA 通过miR-155-5p 对H9c2 细胞氧化应激标志物的影响 模型组MDA含量显著高于对照组,SOD 活性显著低于对照组(P<0.05);TⅡA 组MDA含量明显低于模型组,SOD 活性明显高于模型组(P<0.05);TⅡA+miR-155-5p mimics 组MDA 含量显著高于TⅡA 组和TⅡA+miR-NC 组,SOD 活性显著低于TⅡA组和TⅡA+miR-NC组(P<0.05),见表4。
表4 ELISA检测各组H9c2细胞MDA、SOD水平(±s,n=6)Tab.4 MDA and SOD levels of H9c2 cells in each group detected by ELISA (±s, n=6)

表4 ELISA检测各组H9c2细胞MDA、SOD水平(±s,n=6)Tab.4 MDA and SOD levels of H9c2 cells in each group detected by ELISA (±s, n=6)
Note:Compared with control group, 1)P<0.05; compared with model group, 2)P<0.05; compared with TⅡA group, 3)P<0.05; compared with TⅡA+miR-NC group, 4)P<0.05.
Groups Control Model TⅡA TⅡA+miR-NC TⅡA+miR-155-5p mimics MDA/(mmol·ml-1)SOD/(U·ml-1)137.45±5.78 85.64±3.261)134.58±9.422)133.68±8.79 46.95±9.533)4)5.02±0.13 13.24±3.211)7.16±1.542)7.21±1.65 21.45±2.673)4)
2.5 T ⅡA 通 过miR-155-5p 对H9c2 细 胞SIRT1-AMPK 通路的影响 如图2所示,模型组SIRT1蛋白表达明显低于对照组,p-AMPK/AMPK 值明显小于对照组(P<0.05);TⅡA 组SIRT1蛋白表达明显高于模型组,p-AMPK/AMPK 值明显高于模型组(P<0.05);TⅡA+miR-155-5p mimics 组SIRT1 蛋白表达明 显 低 于T ⅡA 组 和T ⅡA+miR-NC 组,p-AMPK/AMPK 值明显小于TⅡA 组和TⅡA+miR-NC 组(P<0.05)。
3 讨论
心肌缺血发生时,进行再灌注治疗有助于减小患者心肌梗死面积并保护心脏功能,但再灌注治疗过程中往往会诱发更严重的心肌损伤,进而加速心脏功能恶化[11]。心肌I/R 损伤的调控机制十分复杂,其中炎症反应、氧化应激、心肌细胞凋亡起关键作用。文献显示TⅡA 具有抗炎、抗氧化等作用,能够通过提高SOD 活性、降低IL-1β 表达减轻心肌 I/R损伤[12]。miR-155 参与调控心血管疾病的进展,研究发现敲低miR-155 可有效降低大鼠心肌I/R 损伤和H9c2 细胞缺氧/复氧损伤[13]。此外,近期研究显示TⅡA 可通过抑制miR-155 表达改善骨关节炎的炎症反应。而miR-155-5p 是miR-155 的亚型之一,本研究猜测TⅡA 可能通过调控miR-155-5p 改善心肌细胞I/R损伤。
本研究构建了H9c2 心肌细胞I/R 损伤模型,结果显示,模型组miR-155-5p 表达显著升高,细胞活性显著降低;TⅡA 处理后细胞活性显著升高;在TⅡA 组的基础上转染miR-155-5p mimics 上调miR-155-5p 表达后,细胞活力明显下降,提示TⅡA 可能通过抑制miR-155-5p 提高H9c2 心肌细胞活力。心肌细胞异常凋亡是导致心肌I/R 损伤的主要原因之一,研究表明在心肌I/R 损伤大鼠模型中细胞凋亡率明显升高[14-15]。本研究发现模型组细胞凋亡率明显升高;TⅡA可降低细胞凋亡率,而上调miR-155-5p使TⅡA 处理后的细胞凋亡率再次升高,说明TⅡA可能通过抑制miR-155-5p 降低H9c2 心肌细胞凋亡。
减轻炎症反应、抑制机体的氧化应激是治疗I/R损伤的关键。TNF-α 的大量积累会诱发IL-17 等促炎因子表达,从而加剧炎症反应,促进细胞凋亡[16]。IL-4、IL-10 是细胞中的抗炎因子,其含量增加对心肌损伤有改善作用[17]。LDH 在机体细胞中广泛存在,与细胞的氧化还原反应有关,可作为标志物评估心肌细胞损伤[18-19]。在心肌发生I/R 损伤时会产生大量自由基,自由基发生过氧化反应最终会生成MDA,因此MDA 水平的检测有助于评定细胞的氧化损伤程度;而SOD 可清除细胞中的氧自由基,从而使细胞发挥正常生理功能[20]。本研究结果显示,TⅡA 处理可减轻H9c2细胞的炎症因子和氧化应激标志物水平,miR-155-5p mimics 的加入使TⅡA 处理后的相关因子水平得到逆转,提示TⅡA 能够有效降低H9c2心肌细胞的炎症反应和氧化应激损伤,其机制与下调miR-155-5p表达有关。
据报道,SIRT1-AMPK 通路不仅与心血管疾病、糖尿病、肝损伤等多种疾病的发生发展有关,还与氧化应激进程及能量代谢相关[7,21-23]。SIRT1活化后可激活LKB1,而LKB1 表达上调能够提高AMPK 的磷酸化水平,从而抑制心肌梗死诱导的心肌凋亡和心肌能量代谢紊乱[23]。WANG 等[24]研究发现山楂酸通过激活SIRT1/AMPK 信号通路改善I/R 损伤大鼠的心脏功能。近期研究发现,miR-155-5p 负调控SIRT1 表达,且miR-155-5p 通过抑制SIRT1 信号通路促进梗阻性肾病肾间质纤维化[25]。基于此,本研究推测上调miR-155-5p 对H9c2 心肌细胞I/R 损伤的促进作用与SIRT1-AMPK 通路有关。本研究通过Western blot 分析发现,TⅡA 处理可使模型组细胞中SIRT1 蛋白表达及AMPK 磷酸化水平(p-AMPK/AMPK)显著升高;miR-155-5p mimics 的干预则逆转了TⅡA 对SIRT1 蛋白表达及AMPK 磷酸化水平的影响,提示TⅡA 可能通过下调miR-155-5p 激活SIRT1-AMPK通路,缓解H9c2心肌细胞的I/R损伤。
综上所述,TⅡA可通过抑制miR-155-5p表达改善H9c2 心肌细胞I/R 损伤,这可能与激活SIRT1-AMPK 通路有关,为心肌I/R 损伤的机制研究和临床治疗提供了新的实验依据。

