乳酸片球菌R-4 细菌素PA-1 原核表达及其理化特性
焦 明, 罗玉霞, 陈亚男, 舒 伦, 吉林台, 金 山*
(1.内蒙古农业大学 兽医学院,内蒙古 呼和浩特 010018;2.农业农村部动物临床诊疗技术重点实验室,内蒙古 呼和浩特 010018;3.阿拉善左旗农牧区生态管理综合行政执法局,内蒙古 巴彦浩特 750325;4.内蒙古农业大学动物科学学院,内蒙古 呼和浩特 010018)
据世界卫生组织报告,随着涉及食品病原菌和腐败菌的食品安全事故频发, 每年约有10 亿人食物中毒,约42 万人因食物中毒死亡,因此人们越来越关注食品安全问题。 其中金黄色葡萄球菌、大肠杆菌和单增李斯特杆菌为主要致病菌。 利用乳酸菌产生的抑菌物质,尤其是通过细菌素来抑制食品病原菌和腐败菌越来越得到人们的认同[1-2]。 细菌素是一种无抗药性、无残留的天然蛋白质[3],能够防止食品腐败变质,延长食品保质期[4],作为食品添加剂替代品有一定潜力[5]。
细菌素是细菌代谢过程中通过核糖体合成的一类抑菌肽[6],具有抗细菌、真菌等作用[7],主要分为四大类:Ⅰ类细菌素为含有修饰氨基酸的多肽[8];Ⅱ类细菌素为不含修饰氨基酸的多肽;Ⅲ类细菌素为大相对分子质量蛋白质[9],此类细菌素在核糖体生成后不经修饰,相对分子质量大于10 000[10];Ⅳ类细菌素为复合型大分子复合物,由于其带正电荷且具有疏水性,故可以和粗提物中其他大分子物质聚合形成复合物[11]。
片球菌素属于Ⅱa 类细菌素, 主要由乳酸片球菌、戊糖片球菌、小片球菌产生[12]。 片球菌素PA-1的操纵子由pedA、pedB、pedC、pedD 组成,pedA 为其结构基因。 片球菌素具有耐热性,对许多革兰氏阳性菌有抑制作用,对部分革兰氏阴性菌也有抑制作用,显示了较宽的抑菌普。 另外片球菌素具有高等电点和亲水特性,乳酸片球菌素的抑菌活性与分子结构也有一定关系。 乳酸片球菌素的分子结构中α-螺旋含量上升,β-折叠、转角含量降低的时候,乳酸片球菌素的活性也降低[13]。 但是天然的细菌素产量有限,纯化困难,目前主要通过发酵法[14]和化学合成法[15]大量获取,但二者的成本都相对较高,产量较低,并且化学合成的细菌素活性不稳定。 近年来随着基因工程技术的发展, 原核表达技术日趋成熟,因此通过原核表达来获取大量细菌素也是比较好的选择[16-17]。 此外,从各个乳酸菌菌株中发掘潜在的细菌素(如鼠李糖乳杆菌)[18],以及用纳米技术提高细菌素稳定性和作用力也是未来的趋势[19-20]。
1 材料与方法
1.1 材料与试剂
乳酸片球菌R-4 和金黄色葡萄球菌:内蒙古农业大学微生物实验室保存;E.coli DH5α 感受态细胞、pMD19-T 载体、pET-32a(+)载体、T4 DNA 连接酶、rTaq DNA 聚合酶、dNTP、SacⅠ和Hind III 限制性核酸内切酶:宝生物工程(大连)有限公司;E.coli BL21(DE3)感受态细胞:北京全式金生物技术有限公司;核酸染料:北京泰克生物技术有限公司;标准相对分子质量核酸DNA Marker DL-2000、DNA Marker DL-5000、 蛋白质相对分子质量标准(180 000):碧云天生物科技有限公司;氨苄青霉素、异丙基硫代半乳糖苷: 美国西格玛奥德里奇公司;细菌基因组提取试剂盒、DNA 凝胶回收试剂盒、质粒小量提取试剂盒、Tris、SDS、Alycine、 考马斯亮蓝R-250:天根生化科技(北京)有限公司;LB 培养基、MRS 肉汤培养基:青岛高科园海博生物技术有限公司;透析袋MD55、过氧化氢酶、胃蛋白酶、胰蛋白酶、 脱脂奶粉、TBST、PVDF 膜、BCA 蛋白质浓度测定试剂盒:北京索莱宝科技有限公司;小鼠抗Histag 单克隆抗体、山羊抗小鼠IgG-HRP:北京博奥赛生物技术有限公司;Super ECL PLUS: 苏州宇恒生物 科 技 有 限 公 司;Binding/Wash Buffer、Elution Buffer、Ni-NTA Sefinose(TM) Resin:生工生物工程(上海)股份有限公司。
1.2 仪器与设备
恒温水浴锅:日本SANYO 公司;恒温生化培养箱: 美国热电公司; 核酸电泳仪、SDS-PAGE 电泳仪、半干转膜仪:伯乐生命医学产品(上海)有限公司;高速离心机、冷冻离心机:赛默飞世尔科技(中国)有限公司;电子天平:美国颇尔公司;多功能酶标仪、PCR 仪:基因有限公司;脱色摇床:海门市其林贝尔仪器制造有限公司;核酸凝胶成像仪:上海复日科技仪器有限公司;恒温振荡培养箱:美国热电公司。
1.3 研究方法
1.3.1 克隆载体pMD19-T-pedA 构建根据NCBI上GenBank 公布的pedA 基因序列(Accession number M83924) 设计带有保护性碱基和酶切位点的 引 物P.P-F:5′-AACCCCGAGCTCGCAAAAAAA TTGAAAAATTAACT-3′和引物P.P-R:5′-CCCGGG AAGCTTGACTAGCATTTATGATTACCTTG-3′。 引物带有的酶切位点分别是SacⅠ和Hind III。提取乳酸片球菌R-4 的DNA,通过聚合酶链式反应(polymerase chain reaction,PCR) 对pedA 基因片段进行扩增。PCR 反应体系如下:3.0 μL 乳酸片球菌R-4 DNA,2.5 μL 10×Taq 缓冲液,2.0 μL dNTP 混合液,2.0 μL Mg2+,0.5 μL rTaq 酶,1.0 μL 引物P.P-F (质量浓度10 mg/mL),1.0 μL 引物P.P-R (质量浓度10 mg/mL);13.0 μL ddH2O,总体系25.0 μL。 反应条件为:95 ℃预变性3 min;95 ℃变性30 s、60 ℃退火30 s、72 ℃延伸30 s,共30 个循环;72 ℃修复延伸5 min。反应完成后,取扩增pedA 基因片段5 μL 进行琼脂糖凝胶电泳检测, 对目的片段pedA 基因进行胶回收后与pMD19-T 载体连接, 构建克隆载体pMD19-TpedA 并转入E.coli DH5α 感受态细胞,选取阳性克隆接种于含氨苄青霉素(终质量浓度100 μg/mL)的LB 液体培养基过夜培养,提取质粒后双酶切鉴定。
1.3.2 表达载体pET-32a-pedA 构建提取重组质粒pMD19-T-pedA 后与表达载体pET-32a(+)同时用限制性核酸内切酶SacⅠ、Hind III 进行酶切,用T4 DNA 连接酶对回收的pedA 片段和pET-32a(+)酶切产物进行连接, 连接体系如下:4.0 μL 回收的pedA 片段,2.0 μL pET-32a(+)载体酶切回收产物,1.0 μL 10×DNA 连接缓冲液,1.0 μL T4 DNA 连接酶(3 U/μL),2.0 μL ddH2O,总体系为10.0 μL。连接体系于4 ℃过夜,次日将连接产物转入E.coli BL21(DE3)感受态细胞。 挑取E.coli BL21(DE3)单菌落接种于含氨苄青霉素 (终质量浓度100 μg/mL)的LB 液体培养基过夜培养, 提取重组质粒pET-32apedA 进行双酶切鉴定。
1.3.3 重组菌的诱导表达将含有阳性质粒pET-32a-pedA 的重组菌接种于100 mL 的LB 液体培养基中,37 ℃、180 r/min 培养至OD600为0.4~0.6,加入100 μL 异丙基硫代半乳糖苷(240 mg/mL),25 ℃过夜诱导。诱导完成的菌液于7 000 r/min 离心15 min后弃上清液,用生理盐水重悬菌体,重复2 次。 通过超声波细胞破碎仪破碎菌体, 于12 000 r/min 离心15 min,分离上清液和沉淀,上清液用0.22 μm 的滤膜过滤,上清液变性后进行检测。
1.3.4 成功表达的乳酸片球菌R-4 细菌素PA-1纯化将2 mL Ni-NTA 琼脂糖纯化树脂装入Ni-NTA 预装柱, 结合/洗脱缓冲液平衡柱子。 取5 mL结合/洗脱缓冲液与上清液混匀,装入已添加填料的柱子,蛋白质与填料于4 ℃过夜结合。2 倍柱体积的结合/洗脱缓冲液清洗柱子,用洗脱缓冲液洗脱带有His-tag 的乳酸片球菌R-4 细菌素PA-1。 纯化后的乳酸片球菌R-4 细菌素PA-1 用SDS-PAGE 检测纯化情况并采用BCA 法检测蛋白质质量浓度。
1.3.5 乳酸片球菌R-4 细菌素PA-1 的Western blot 方法鉴定以小鼠抗His-tag 单克隆抗体为一抗,工作浓度1∶6 000,山羊抗小鼠Ig G-HRP 为二抗,工作浓度1∶5 000。 纯化的乳酸片球菌R-4 细菌素PA-1 经SDS-PAGE 检测后切下相应位置的PAGE 胶,进行转膜。 37 ℃封闭4 h,用TBST 洗涤,一抗4 ℃孵育16 h 后TBST 洗涤, 二抗孵育2 h,TBST 洗膜后进行显影。
1.3.6 乳酸片球菌R-4 细菌素PA-1 的活性鉴定通过双层平板法鉴定乳酸片球菌R-4 细菌素PA-1的蛋白质活性,并以洗脱缓冲液各组分作为对照。
1.3.7 乳酸片球菌R-4 细菌素PA-1 理化特性以1×106CFU/mL 的金黄色葡萄球菌悬液为指示菌, 将纯化的乳酸片球菌R-4 细菌素PA-1 的pH调至2、4、6、8、10、12, 检测不同pH 下的乳酸片球菌R-4 细菌素PA-1 对金黄色葡萄球菌抑菌效果。乳酸片球菌R-4 细菌素PA-1 在40、60、80、100、121 ℃处理20 min,检测不同温度下乳酸片球菌R-4 细菌素PA-1 对金黄色葡萄球菌抑菌效果。 乳酸片球菌R-4 细菌素PA-1 用过氧化氢酶、 胃蛋白酶、胰蛋白酶(终质量浓度均为20 mg/mL)于37 ℃处理2 h,之后于80 ℃水浴30 min 将酶灭活,检测不同酶处理对乳酸片球菌R-4 细菌素PA-1 抑菌效果的影响。 乳酸片球菌R-4 细菌素PA-1 经紫外线照射0、2、4、6、8、10 h 来检测其对紫外线的敏感性。
2 结果与分析
2.1 乳酸片球菌R-4 细菌素pedA 基因的克隆和表达载体构建
如图1 所示,将提取的乳酸片球菌R-4 基因作为模板,用特异性引物P.P-F 和P.P-R 扩增出序列长度为186 bp 的目的基因,与预期条带大小相符。

图1 pedA 基因片段PCR 扩增结果Fig.1 PCR amplification of pedA gene fragment
目的条带纯化后与克隆载体pMD19-T 过夜连接,将重组质粒pMD19-T-pedA 用限制性核酸内切酶SacⅠ和Hind III 双酶切,结果见图2。 在2 600 bp和186 bp 处获得2 条条带,与克隆载体和乳酸片球菌R-4 细菌素pedA 基因大小相符, 表明pedA 基因与载体pMD19-T 成功连接并转入到E.coli DH5α感受态细胞。

图2 重组pMD19-T-pedA 质粒的酶切鉴定Fig.2 Identification of recombinant plasmid pMD19-TpedA by restriction enzyme digestion
回收纯化pedA 基因与pET-32a(+)进行连接后, 将重组质粒pET-32a-pedA 经限制性核酸内切酶SacⅠ和Hind III 双酶切,结果见图3。在5 900 bp和186 bp 处获得2 条条带, 与表达载体pET-32a(+)和pedA 基因大小相符,表明目的基因pedA 与表达载体pET-32a(+)连接成功。

图3 重组质粒pET-32a-pedA 的酶切鉴定Fig.3 Identification of recombinant plasmid pET-32apedA by restriction enzyme digestion
2.2 乳酸片球菌R-4 细菌素PA-1 的诱导表达和分离纯化
将pET-32a(+)转入E.coil BL21(DE3)感受态细胞作为空载体, 与含重组质粒pET-32a-pedA 的E.coil BL21(DE3)细胞形成对照,用IPTG 诱导培养,SDS-PAGE 电泳结果见图4。 pET-32a-pedA 表达相对分子质量26 000 的蛋白质条带,而pET-32a(+)表达的蛋白质相对分子质量为21 000,表明乳酸片球菌R-4 细菌素PA-1 成功表达。

图4 乳酸片球菌R-4 细菌素PA-1 的SDS-PAGE 电泳结果Fig.4 SDS-PAGE electrophoresis results of Pediococcus acidilactici R-4 bacteriocin PA-1
带有His-tag 的乳酸片球菌R-4 细菌素PA-1经Ni-NTA 柱纯化后的SDS-PAGE 结果见图5。 在相对分子质量26 000 处出现单一条带,表明乳酸片球菌R-4 细菌素PA-1 纯化效果良好。通过BCA 法测得第一次洗脱的蛋白质质量浓度为0.245 mg/mL。
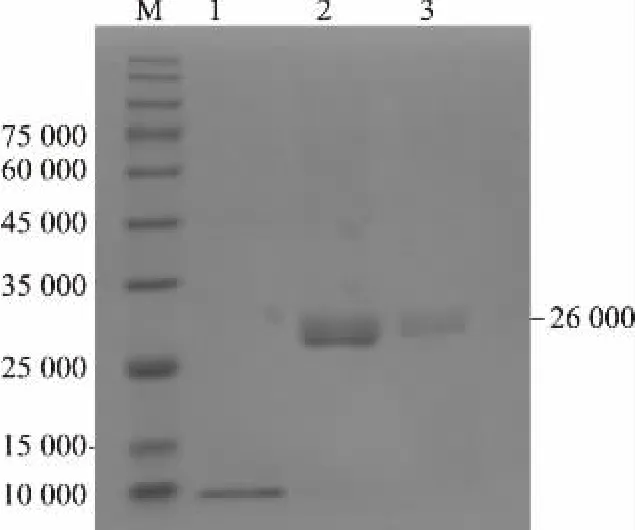
图5 纯化后的乳酸片球菌R-4 细菌素PA-1 的SDSPAGE 电泳图Fig.5 SDS-PAGE electrophoresis of purified Pediococcus acidilactici R-4 bacteriocin PA-1
乳酸片球菌R-4 细菌素PA-1 的Western blot结果见图6。 在相对分子质量26 000 处显影并出现单一条带, 表明所纯化出来的蛋白质为带His-tag的乳酸片球菌R-4 细菌素PA-1。

图6 纯化后乳酸片球菌R-4 细菌素PA-1 的Western blot鉴定Fig.6 Identification of purified Pediococcus acidilactici R-4 bacteriocin PA-1 by western blot
将乳酸片球菌R-4 细菌素PA-1 以及洗脱缓冲液各组分进行抑菌试验,结果见图7。纯化后含洗脱缓冲液的乳酸片球菌R-4 细菌素PA-1 和250 mmol/L 咪唑同样具有抑菌效果。将纯化后含洗脱缓冲液的乳酸片球菌R-4 细菌素PA-1 和洗脱缓冲液各组分梯度透析后进行抑菌试验,结果见图8。透析后的咪唑失去抑菌效果,而乳酸片球菌R-4 细菌素PA-1 通过透析除去咪唑等洗脱缓冲液成分后仍具有抑菌效果, 表明乳酸片球菌R-4 细菌素PA-1具有蛋白质活性。

图7 纯化后乳酸片球菌R-4 细菌素PA-1 及各组分的抑菌作用Fig.7 Antibacterial activity of purified Pediococcus acidilactici R-4 bacteriocin PA-1 and its components

图8 乳酸片球菌R-4 细菌素PA-1 和各组分透析后的抑菌作用Fig.8 Antibacterial activity of Pediococcus acidilactici R-4 bacteriocin PA -1 and its components after dialysis
2.3 乳酸片球菌R-4 细菌素PA-1 理化特性分析
2.3.1 温度对乳酸片球菌R-4 细菌素PA-1 抑菌效果的影响如图9 所示, 未处理的乳酸片球菌R-4 细菌素PA-1 对金黄色葡萄球菌的抑菌圈直径为15.4 mm。 乳酸片球菌R-4 细菌素PA-1 在40~100 ℃处理20 min 后仍显示出良好的抑菌作用,菌抑圈直径在14.7~15.6 mm;121 ℃处理20 min 后抑菌圈直径仍有14.1 mm,表明乳酸片球菌R-4 细菌素PA-1 具有耐热性。

图9 温度对乳酸片球菌R-4 细菌素PA-1 抑菌效果的影响Fig.9 Effect of temperatures on the antibacterial effect of Pediococcus acidilactici R-4 bacteriocin PA-1
2.3.2 pH 对乳酸片球菌R-4 细菌素PA-1 抑菌效果的影响如图10 所示,pH 8 对乳酸片球菌R-4细菌素PA-1 对金黄色葡萄球菌抑菌圈直径为15.3 mm,在pH 2 时乳酸片球菌R-4 细菌素PA-1 抑菌效果最好,抑菌圈直径达到16.5 mm。 在pH 4~6 时抑菌圈直径虽然逐步下降,但仍具有较高的抑菌效果,抑菌圈直径分别为16.0 mm 和15.7 mm,比pH 8 的乳酸片球菌R-4 细菌素PA-1 抑菌作用略强。pH 10 和pH 12 比pH 8 时乳酸片球菌R-4 细菌素PA-1 抑菌效果明显降低, 抑菌圈直径分别为14.6 mm 和14.0 mm。 这表明乳酸片球菌R-4 细菌素PA-1 具有较好的耐酸性,对碱性环境较为敏感。

图10 pH 对乳酸片球菌R-4 细菌素PA-1 抑菌效果的影响Fig.10 Effect of pH environments on the antibacterial effect of Pediococcus acidilactici R-4 bacteriocin PA-1
2.3.3 酶种类对乳酸片球菌R-4 细菌素PA-1 抑菌效果的影响如图11 所示, 未处理的乳酸片球菌R-4 细菌素PA-1 对金黄色葡萄球菌抑菌圈直径为15.3 mm, 经胰蛋白酶和胃蛋白酶处理的乳酸片球菌R-4 细菌素PA-1 失去抑菌作用,经过氧化氢酶处理的乳酸片球菌R-4 细菌素PA-1 仍然显示出较好的抑菌效果,抑菌圈直径为14.9 mm,表明胃蛋白酶和胰蛋白酶可能分解乳酸片球菌R-4 细菌素PA-1,而过氧化氢酶对其没有影响。

图11 酶种类对乳酸片球菌R-4 细菌素PA-1 抑菌效果的影响Fig.11 Effect of enzymes on the antibacterial effect of Pediococcus acidilactici R-4 bacteriocin PA-1
2.3.4 紫外线照射时间对乳酸片球菌R-4细菌素PA-1 抑菌效果的影响如图12 所示,未照射紫外线的乳酸片球菌R-4 细菌素PA-1 对金黄色葡萄球菌抑菌圈直径为15.4 mm,经2~10 h 紫外线照射后仍具有较好的抑菌效果,抑菌圈直径为15.1~15.8 mm,表明紫外线照射对其抑菌效果几乎没有影响,乳酸片球菌R-4 细菌素PA-1 对紫外线不敏感。
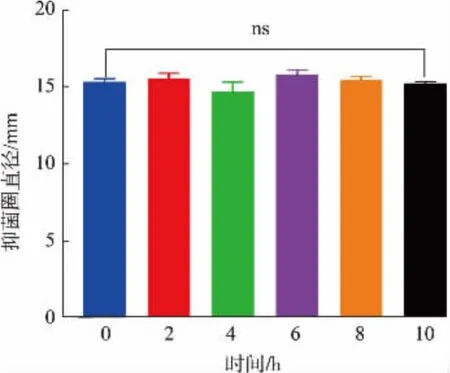
图12 紫外线照射时间对乳酸片球菌R-4 细菌素PA-1 抑菌效果的影响Fig.12 Effect of different UV irradiation times on the antibacterial effect of Pediococcus acidilactici R-4 bacteriocin PA-1
3 结 语
pET-32a(+)作为优秀的表达载体,其Lac 基因仅在经IPTG 诱导后才会进行表达, 有利于表达的进行。pET-32a(+)在N 端含有His-tag,有利于表达后利用His-tag 经Ni-NTA 柱进行蛋白质纯化。 作者在大肠杆菌表达系统中成功表达相对分子质量26 000 的乳酸片球菌R-4 细菌素PA-1, 并用Ni-NTA 柱纯化出乳酸片球菌R-4 细菌素PA-1,经Western blot 鉴定为乳酸片球菌R-4 细菌素PA-1,为后续试验提供了较高纯度的乳酸片球菌R-4 细菌素PA-1。
李亚玲报道分离纯化后的乳酸片球菌细菌素在121 ℃处理20 min 后抑菌圈直径为10.26 mm[21],本研究所表达纯化的乳酸片球菌R-4 细菌素PA-1经121 ℃处理20 min 后抑菌圈直径为14.1 mm,有明显提高,可能是因为乳酸片球菌R-4 细菌素PA-1 质量浓度更高。乳酸片球菌R-4 细菌素PA-1经40~100 ℃处理20 min 后表现出较好的抑菌效果并基本保持稳定, 抑菌圈直径为15.6~14.7 mm ,表明具有较好的耐高温特性, 与李亚玲的结论相似。食品制作过程中常用的巴斯德高温灭菌为60~80 ℃,因此乳酸片球菌R-4 细菌素PA-1 作为食品添加剂与食品一同高温灭菌后仍能保持抑菌活性。研究发现, 乳酸片球菌R-4 细菌素PA-1 在pH 2时抑菌效果最好,pH 4~6 则相对稳定, 碱性环境中抑菌效果开始下降。 这与高兆建等报道发酵乳杆菌细菌素在pH 2~6 有较好的稳定性,在pH>6 时抑菌作用开始降低基本一致[22]。 相比于已经商业化的乳酸链球菌素,乳酸片球菌R-4 细菌素PA-1 在酸性食品中有较好抑菌效果。 乳酸片球菌R-4 细菌素PA-1 经紫外照射不会影响其抑菌活性, 含有乳酸片球菌R-4 细菌素PA-1 的食品适当存放在紫外线照射环境中,可能起到双重杀菌作用。 乳酸片球菌R-4 细菌素PA-1 经蛋白酶处理后失去抑菌活性,与陆洲等报道分离得到的植物乳杆菌细菌素在5 mg/mL 的胃蛋白酶和胰蛋白酶处理2 h 后完全失去抑菌作用的结果一致[23]。 因此在食用含乳酸片球菌R-4 细菌素PA-1 的食品后,乳酸片球菌R-4 细菌素PA-1 在胃部被消化失活, 不会进入肠道而影响肠道菌群。 基于以上性质,乳酸片球菌R-4 细菌素PA-1 在抑制食品病原菌以及食品保存方面都具有较为广阔的应用前景。

