大肠杆菌生物膜关键组分缺失对细胞性能的影响
乔 君, 宫登科, 刘格尔, 陈玲嫣, 伍圆明,詹 依, 郭 勇, 孟祥宇, 王小元*,2,
(1.食品科学与资源挖掘全国重点实验室,江南大学,江苏 无锡 214122;2.江南大学 国际食品安全联合实验室,江苏 无锡 214122;3.江南大学 生物工程学院 江苏 无锡 214122)
大肠杆菌生物膜由多糖、脂质、蛋白质、胞外DNA、蛋白质等组成[1-4]。 生物膜在维持结构完整性和刚性[5-7]、保护菌株免受不利环境影响[8-11]以及促进细菌和宿主细胞[12-13]之间的相互作用等方面至关重要。 但是,一些生物生物膜组分可对工业生产造成潜在的不利影响。 例如在食品工业中,生物膜会增加产品变质或被病原微生物群污染的风险[14];在医疗领域,植入物或针管上的生物膜会引起患者严重感染[15]。此外,含有生物膜的病原菌会导致抗生素耐药,形成休眠细胞,增加治愈难度和感染风险[16]。 对于工业发酵行业而言,生物膜的形成会消耗一定的底物和能源,而这些底物和能源本可以更好地促进细胞生长。 其次,生物膜会阻碍营养物质的吸收,导致菌体营养受限或生长缓慢。 最后,生物膜可介导生物污垢的形成,从而减少设备传热,增加腐蚀,缩短发酵设备的使用寿命[17-19]。
菌毛、鞭毛和卷曲纤维是存在于细胞表面的大分子蛋白质附属物,菌毛在生物膜的形成、附着、侵袭和细胞运动等方面发挥着重要的作用[20-21]。 卷曲纤维也介导细胞间黏附和侵袭,促使菌落在宿主体内定植,增加致病风险[7]。 卷曲纤维由csGBAgDEFG操纵子编码合成[13,22-23]。鞭毛是另外一种存在于大肠杆菌生物膜上的大分子蛋白质附属物,在生物膜的合成、运动性和趋化性中发挥作用[24]。鞭毛的合成和组装由4 个基因簇,共50 个基因的参与[25-27],分别为flhEABcheZYBRtaptarcheWAmotBCflhCD、 fliYZACD ST、fliEFGHIJKLMNOPQR、flgNMQBCDEFGHIJKL。
大肠杆菌的非必需生物膜组分中,除含有上述蛋白质类附属物外,还包含大量不同种类的胞外多糖。 纤维素是自然界中发现的最丰富的有机聚合物,细菌通常产生纤维素作为细胞外成分,用于机械和化学保护, 细菌纤维素由9 个基因编码合成bcsGFEyhjRQbcsABZC 。 唾液酸是单体以独特的α-(2,8)和(或)α-(2,9)键连接的直链聚合物,具有促进婴幼儿神经系统发育的作用。 唾液酸由6 个基因簇编码合成nanRATEKyhcH。 克拉酸又称M-抗原,是由肠道细菌产生的具有高质量分数的L-岩藻糖(约30%)的胞外多糖。 据报道,由肠道微生物产生的克拉酸可以延长宿主的寿命,具有延缓衰老的作用[28-31],克拉酸在食品、化妆品和医药等领域具有广阔的应用前景。 脂多糖是微生物产生的强力毒素,由类脂A、核心多糖和O-抗原组成[32-34]。 在大肠杆菌中,类脂A 是必需组分,核心多糖和O-抗原是非必需生物膜组分, 去除核心多糖和O-抗原能够起到减毒效果。 核心多糖由14 个基因参与合成waaDFCQGPSBORYZUL[34]。 O-抗原由11 个基因参与合成操纵子rfbBDACXglfwbbHIJKL[35]。 肠杆菌共同抗原(ECA)位于许多肠致病菌外膜,是一种由3个氨基糖重复单元组成的碳水化合物抗原[33]。 4 型荚膜是大肠杆菌的表面保护组分,可偶联于膜蛋白质表面,为菌体提供物理、化学压力保护,在菌体与环境间的相互作用中发挥重要作用。 4 型荚膜主要由7 个基因簇合成ymcDCBAyccZetpyccC[36-37]。 聚-β-1,6-N-乙酰葡萄糖胺是一种新发现的胞外多糖,是主要的生物膜黏附素,对生物膜的产生及维持其完整性起着重要作用。 聚-β-1,6-N-乙酰葡萄糖胺由4 个基因编码合成pgaABCD[38]。
聚羟基丁酸酯(PHB)是微生物为储存过量碳合成的生物大分子,其在细胞内形成不溶的球形内含物或颗粒[39-41]。 PHB 具有生物降解性、生物相容性、压电性等性质,在生物降解塑料、组织工程支架等领域有广泛的应用[42-43]。
为考察去除大肠杆菌非必需生物膜组分对菌株生长和产物合成效率造成的影响,作者首先筛选出大肠杆菌MG1655 中非必需生物膜组分,再采用Crispr-Cas9 基因编辑技术敲除MG1655 基因组中各生物膜组分的合成基因簇,构建了缺失不同生物膜组分的突变菌株,并考察其生长和表型变化。 鉴于微生物具有储存过量碳合成PHB 的特性,作者以含有PHB 合成关键基因的质粒pBHR68 为探针,考察去除大肠杆菌的非必需生物膜组分能否节约底物和能源。 作者所在实验室经前期研究发现,通过去除大肠杆菌菌毛和ECA 可以有效减少碳源消耗,提高细菌生长速度, 并显著提高PHA 和L-苏氨酸产量。 因此,作者进一步对大肠杆菌MG1655 中其他非必需生物膜组分进行研究。
1 材料与方法
1.1 试剂与仪器
1.1.1 主要试剂卡那霉素、氨苄西林、壮观霉素、异丙基-β-D-硫代吡喃半乳糖苷(IPTG):西格玛-奥德里奇(上海)贸易有限公司;DNA 聚合酶:南京诺唯赞生物科技股份有限公司;质粒提取试剂盒和基因组提取试剂盒: 上海生工生物工程有限公司;PCR 产物纯化试剂盒和凝胶纯化试剂盒:天根生化科技(北京)有限公司;其他均购自中国医药集团有限公司。
1.1.2 主要仪器设备PCR 仪(ETC-811):广州东盛生物科技有限公司;核酸蛋白质定量仪(Nanodrop 2000):赛默飞世尔科技(中国)有限公司;紫外分光光度计(UV-1800PC):上海美谱达股份有限公司;水平核酸电泳仪(DYCP-31DN):北京六一股份有限公司;电转仪(Micro Pulser):美国伯乐股份有限公司;酶标仪(Cytation 5):美国伯腾股份有限公司;荧光分光光度计(Hitachi):日本日立公司。
1.2 菌株、质粒和引物
本研究所用菌株、质粒及其遗传特性见表1。所用引物序列见表2, 引物由苏州金唯智生物科技有限公司合成。
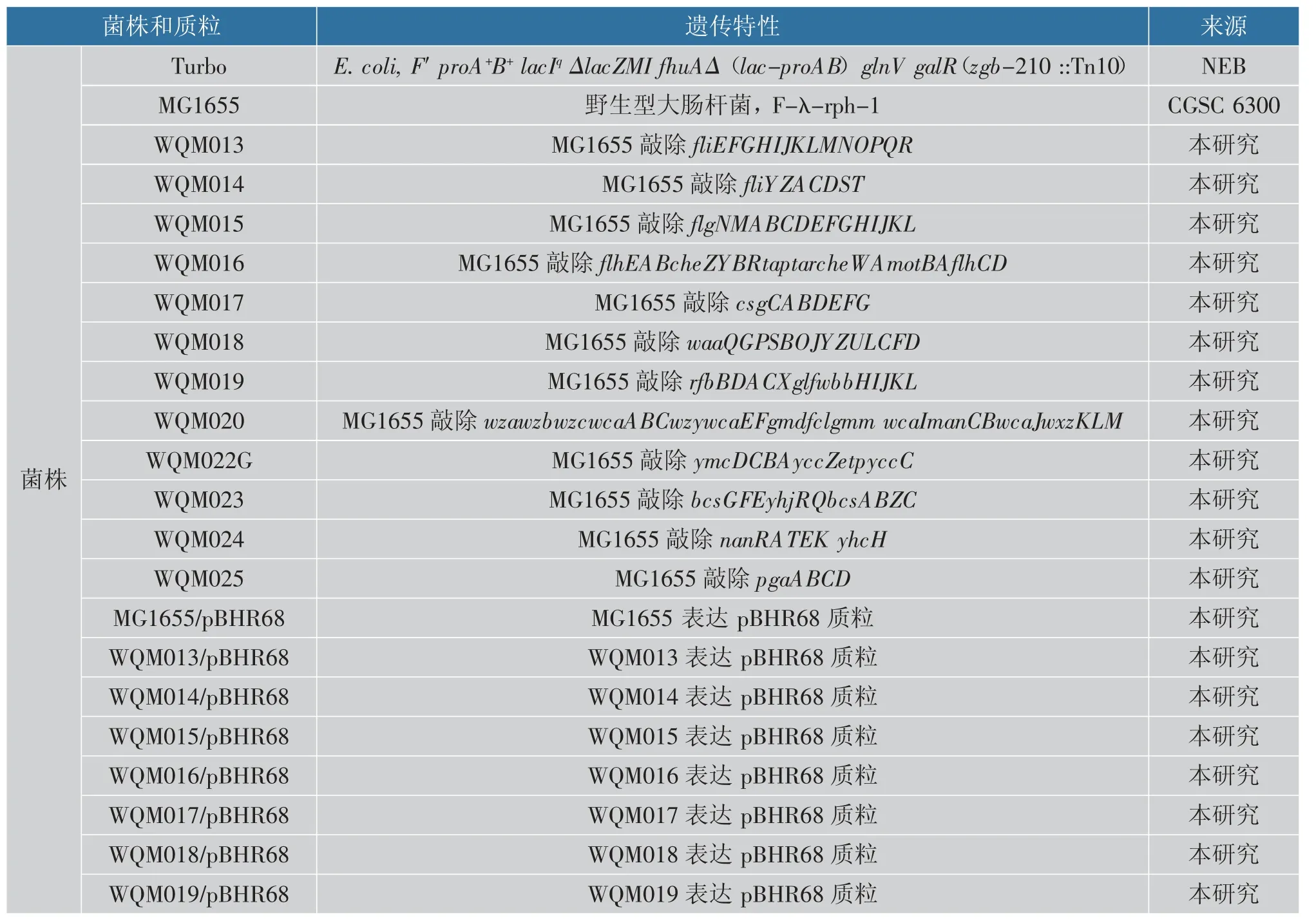
表1 本实验中所用菌株、质粒及特性Table 1 Strains and plasmids used in this study and their characteristics
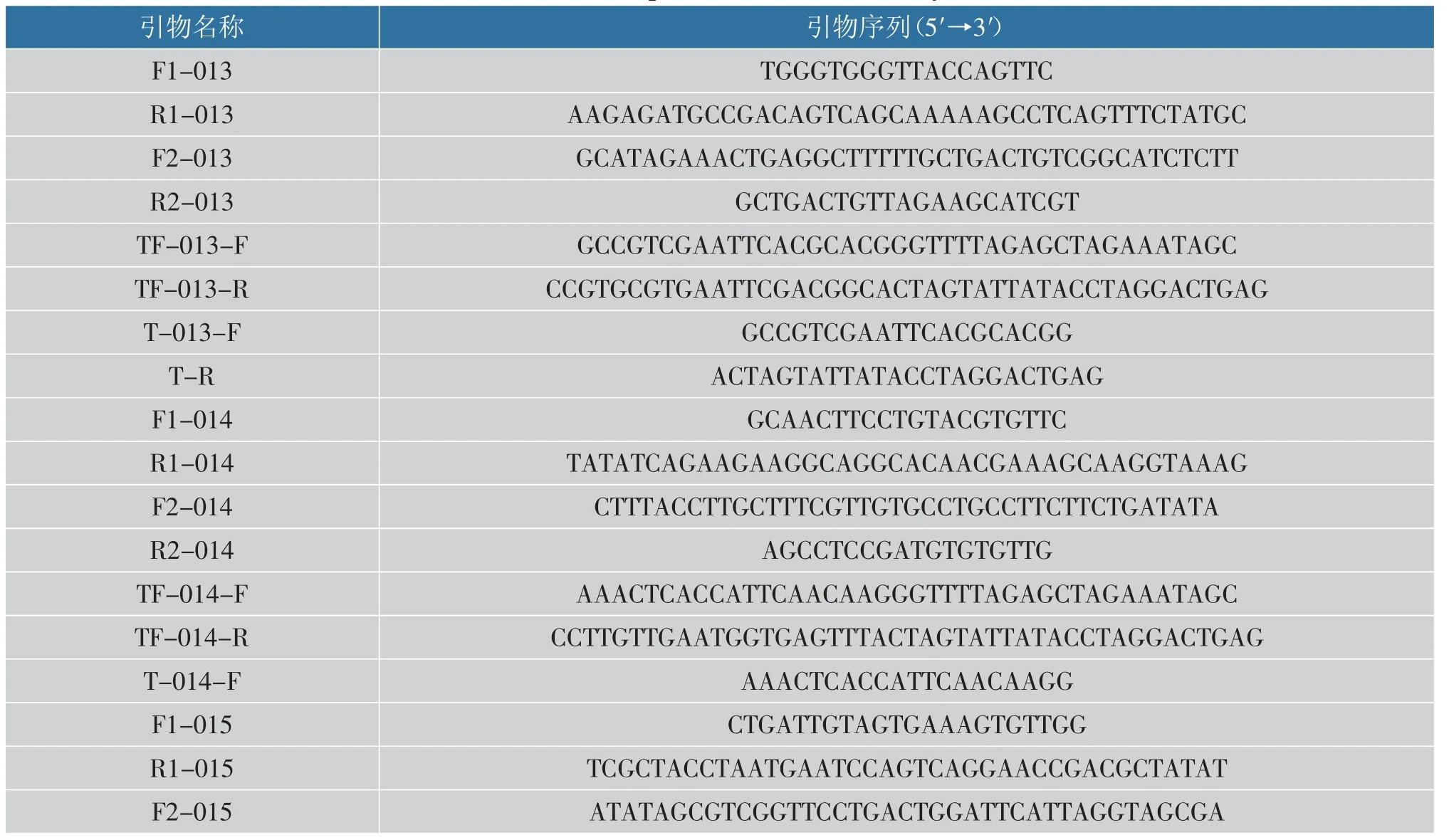
表2 本实验中用到的引物Table 2 All primers used in this study
1.3 培养基及培养条件
1.3.1 培养基 在LB 培养基、M9 培养基和PHB发酵培养基中加入卡那霉素(50 mg/L)、 壮观霉素(50 mg/L)或氨苄青霉素(100 mg/L),维持筛选压力。
1.3.2 培养条件PHB 发酵条件参见文献[44]。
1.4 生长曲线测定
活化的大肠杆菌菌株分别接入LB 和M9 培养基中,于37 ℃、200 r/min 培养,每隔2 h 取样测定OD600,直至OD600基本稳定。
1.5 质粒、突变株和PHB 生产菌株的构建
1.5.1 质粒的构建基因敲除中以pTargetF 为模板构建pTargetF013-025 系列质粒。 以pTargetF013 为例, 使用引物TF-013-F/TF-013-R 反向PCR 扩增获得质粒片段,再用凝胶纯化试剂盒纯化。 纯化后的质粒片段用T4 DNA 连接酶连接,将其转入大肠杆菌Turbo 感受态细胞,37 ℃复苏1 h 后涂布壮观霉素抗性平板,用T-013-F/T-R 引物筛选菌落并测序验证质粒正确性。 其他敲除质粒采用相同的方法和对应的质粒构建。
1.5.2 突变菌株的构建采用Crispr-Cas9 双质粒无痕基因编辑技术敲除大肠杆菌MG1655 基因组中的相关基因簇,该方法需要包含pTargetF 系列质粒和供体DNA。 pTargetF 系列质粒构建如1.5.1 所述, 供体DNA 的获得以WQM013 的构建为例进行详细说明。 以大肠杆菌MG1655 基因组为模板,分别用引物对F1-013/R1-013 和F2-013/R2-013 扩增获得上下游同源臂片段。获得的产物经DNA 纯化回收试剂盒纯化后, 以该上下游同源臂片段为模板,用引物F1-013/R2-013 重叠PCR,再利用DNA纯化回收试剂盒纯化后,即得到供体DNA。 将供体DNA(400 ng)和pTargetF013(100 ng)混合后电转入MG1655/pCas 感受态细胞中。 复苏后涂布于含有卡那霉素和壮观霉素的平板,在30 ℃下培养48 h,用引物F1-013/R2-013 挑选突变株,并测序验证其正确性。 其他突变株使用相同的方法构建。
1.5.3 PHB 生产菌株的构建将携带基因PHB 合成关键基因phaCAB 的pBHR68 质粒电转到野生型MG1655 和 突 变 株 WQM013 -020、WQM022G、WQM023-025 中,用引物T-PHB-F 和T-PHB-R 验证正确性。
1.6 镜检及膜通透性
1.6.1 结晶紫染色大肠杆菌细胞固定后,加入质量分数1%结晶紫静置30 s,无菌水冲洗后晾干,在光学显微镜下观察菌体形态。
1.6.2 胞外多糖染色采用单宁媒染染色法进行胞外多糖染色[29]。大肠杆菌细胞在LB 和M9 固体培养基上培养24 h, 挑取单菌落并固定在载玻片上,加入品红溶液(0.3 mL 品红碱、90 mL 体积分数5%苯酚、10 mL 体积分数95%乙醇)染色3 min,无菌水冲洗后加媒染液(2 g/L 硫酸铝钾饱和溶液、0.3 g/L FeCl3、1.5 g/L 单宁体积比为5∶2∶3)染色3 h,无菌水冲洗后用质量分数1%亚甲蓝处理30 s, 无菌水冲洗晾干后在油镜下观察样品。
1.6.3 膜通透性检测膜通透性评价采用N-苯基-α-萘胺(NPN)法[29,32]。 细胞培养12 h 后,收集菌体并洗涤2 次, 菌体重悬于1.92 mL 磷酸盐缓冲液(pH 7.2)中。 细胞悬液中加入1 mmol/L NPN,使菌体浓度OD600为0.5,然后用荧光分光光度计测定荧光强度(激发和发射波长分别为350 nm 和420 nm)。
1.7 PHB 定量分析
使用尼罗红染色法对产PHB 菌株进行高通量筛选,PHB 发酵结束后,离心收集菌体,加入TSE 蔗糖缓冲液 (10 mmol/L Tris-HCl、pH 7.5,20 g/dL 蔗糖溶液,2.5 mmol/L Na-EDTA 溶液), 使其OD600为0.4,冰上孵育10 min,离心收集菌体,用1 mmol/L氯化镁溶液重悬至相同菌体浓度。 将3 μL 尼罗红溶液(1 mg/mL DMSO 溶解)添加到1 mL 细胞悬液中,混匀后在37 ℃避光孵育30 min,立即用酶标仪在37 ℃下检测荧光强度,激发波长为485 nm,发射波长为565 nm。
1.8 基因转录分析
全转录组分析按已报道的方法执行[29]。 大肠杆菌MG1655 和WQM018 分别培养至对数中期,4℃、12 000 r/min 收集菌体, 磷酸缓冲液洗涤2 次后用液氮速冻。 大肠杆菌MG1655 基因组用于序列读取、比对和分析。RNA 文库的提取、构建和测序委托苏州金唯智生物技术公司操作。 原始转录组序列数据已上传到NCBI Sequence Read Archive 数据库(SRA),项目序号为PRJNA603230。
2 结果与分析
2.1 大肠杆菌非必需生物膜组分筛选及突变株的构建
为了考察去除非必需生物膜组分对菌株生长和表型产生的影响,作者选择大肠杆菌MG1655 模式菌株为研究对象。 首先查阅比对大肠杆菌MG1655 基因组, 筛选出非必需生物膜组分11 个,分别是:菌毛、鞭毛、卷曲纤维、核心多糖、O-抗原、克拉酸、肠杆菌共同抗原、4 型荚膜、纤维素、唾液酸和聚-β-1,6-N-乙酰葡萄糖胺。 其中,菌毛、鞭毛和卷曲纤维属于大分子蛋白质聚合物类,其他8 种属于胞外多糖类。 前期研究发现,去除大肠杆菌菌毛和ECA 可以促进菌株生长并提高生产效率[44]。 因此,作者分别敲除鞭毛、卷曲纤维、核心多糖、O-抗原、克拉酸、4 型荚膜、纤维素、唾液酸和聚-β-1,6-N-乙酰葡萄糖胺的11 个操纵子, 构建出突变株WQM013、WQM014、WQM015、WQM016、WQM017、WQM018、WQM019、WQM020、WQM022G、WQM023、WQM024 和WQM025,见图1。

图1 大肠杆菌MG1655 的非必需生物膜组分Fig.1 Non-essential biofilm components in E.coli MG1655
2.2 非必须生物膜组分缺失突变株的生长改变
11 个突变菌株分别在富营养的LB 培养基和营养缺乏的M9 培养基中培养,其生长曲线见图2。 在LB 培 养 基 中,WQM018、WQM019、WQM020 和WQM023 的生长速度和生物量不及对照菌株MG1655,涉及的组分为核心多糖、O-抗原、克拉酸和纤维素, 说明这4 种组分对菌株的生长至关重要,去除它们可能会造成生物膜变薄或破损,对菌株产生不利影响。 其他突变株的生长与对照菌株相当,这可能是由于LB 培养基中的营养比较丰富,不能明显体现出去除生物膜组分可节约能源和底物及对菌株的促进效果。 在M9 培养基中,WQM013、WQM014、WQM016 和WQM024 生长速度和生物量明显优于对照菌株,涉及组分鞭毛和唾液酸,这可能是由于M9 培养基(基础培养基)营养匮乏,细菌需要通过自身先合成必需氨基酸或其他关键物质用于鞭毛或唾液酸合成, 而去除鞭毛或唾液酸后,细胞可以节约底物和能源用于生长。
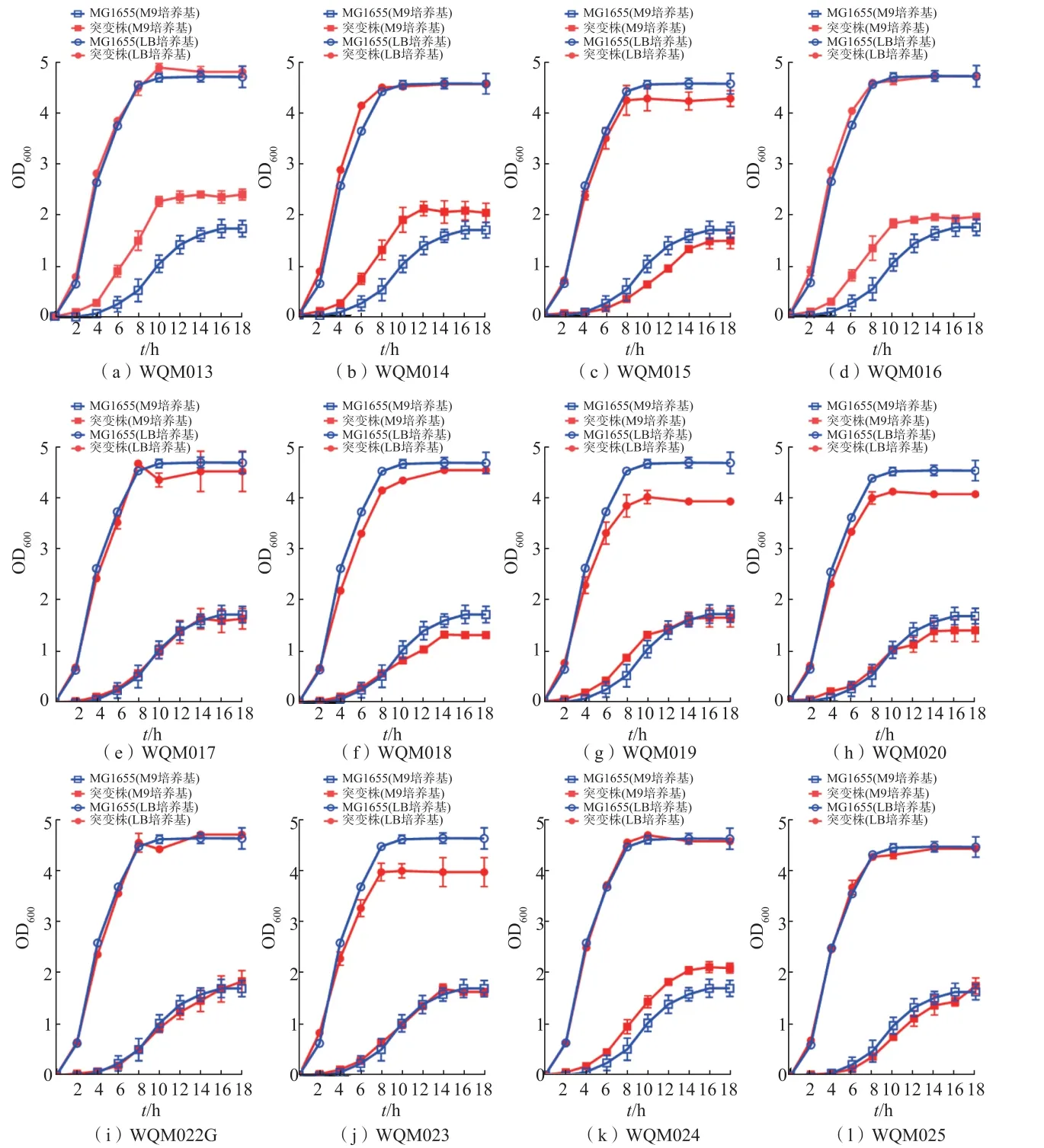
图2 突变株在LB 和M9 培养基中生长曲线Fig.2 Growth curves of mutants cultured in LB and M9 medium
2.3 缺失大肠杆菌非必需生物膜组分对膜通透性的影响
大肠杆菌非必需生物膜组分位于细胞外膜和周质空间, 它们的缺失会导致生物膜厚度的改变,进而改变膜通透性。 有研究表明,敲除ECA 相关基因后,大肠杆菌膜通透性显著提高[44]。 如图3 所示,突 变 株 WQM013、WQM014、WQM015、WQM016、WQM018、WQM020 和WQM024 通透性增加, 尤其突变株WQM018 膜通透性比对照株提高了近40%。而WQM013、WQM014、WQM015 和WQM016 均 属于鞭毛缺失突变株,后续实验可以考察4 个鞭毛基因簇全部敲除后膜通透性的变化。 此外,敲除克拉酸和唾液酸基因簇也能显著增加膜通透性,这会更有利于营养物质的吸收以及发酵产物的外排,减少致病菌的耐药性和致病风险。
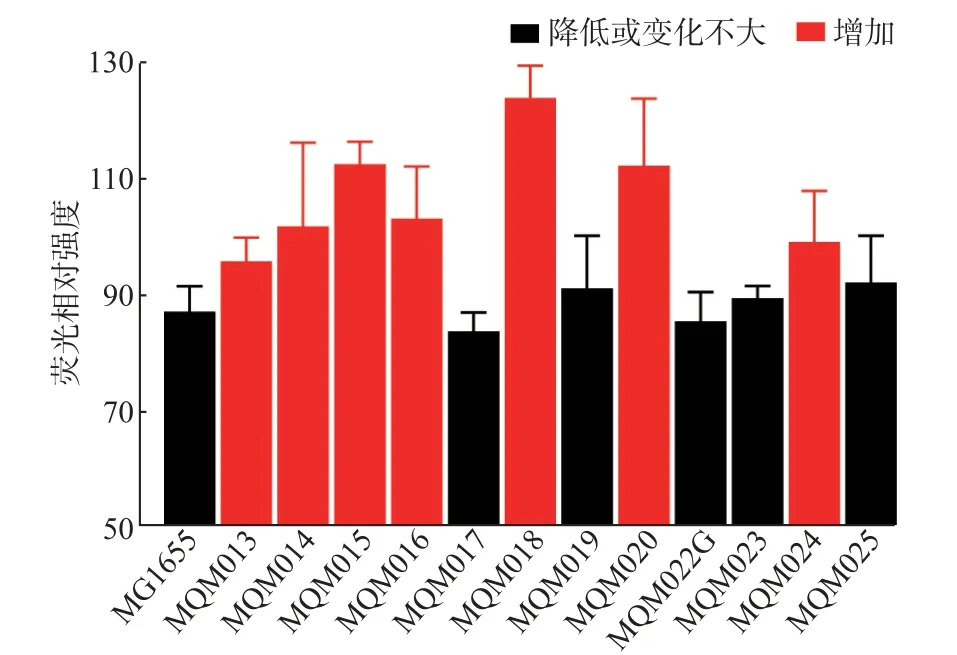
图3 大肠杆菌非必需生物膜组分缺失突变株的膜通透性Fig.3 Membrane permeability of E.coli mutants lacking non-essential biofilm components
2.4 大肠杆菌非必需生物膜组分缺失对PHB 合成的影响
将含有PHB 合成关键基因phaCAB 的pBHR68质粒分别导入对照菌株MG1655 和各突变株,构建了重组菌株MG1655/pBHR68、WQM013-020/pBHR68、WQM022G/pBHR68、WQM023-025/pBHR68。如图4 所示, 所有含有pBSK 空载质粒的菌株不能合成PHB,当转入PHB 合成质粒后,PHB 产量明显增加。 所有突变株在LBG 培养基中PHB 的产量与对照菌株相当,产量较低。在M9G 培养基中,WQM015/pBHR68、WQM018/pBHR68、WQM019/pBHR68、WQM020/pBHR68、WQM022G/pBHR68、WQM023/pBHR68、WQM024/pBHR6-8、WQM025/pBHR68 的PHB 产量较野生型有所提高, 其中WQM018/pBHR68 的PHB 产量最高, 比对照菌株提高了35.32%。通过显微镜观察,可以看到突变株WQM015/pBHR68、WQM018/pBHR68、WQM019/pBHR68、WQM020/pBHR68、WQM022G/pBHR68、WQM023/pBHR68、WQM024/pBHR68、WQM025/pBHR68 菌体变长变粗, 胞内产生白色PHB 颗粒, 而对照菌株MG1655/pBHR68 为肉眼不可见白色PHB 颗粒,见图5。 此外,8 个产PHB 突变株中, 除W-QM015/pBHR68 为鞭毛突变株外, 其他均为胞外多糖突变株。 初步判定去除核心多糖、O-抗原、克拉酸、4 型荚膜、纤维素、唾液酸和聚-β-1,6-葡萄萄糖胺后,可以节约能源和底物,用于PHB 合成。
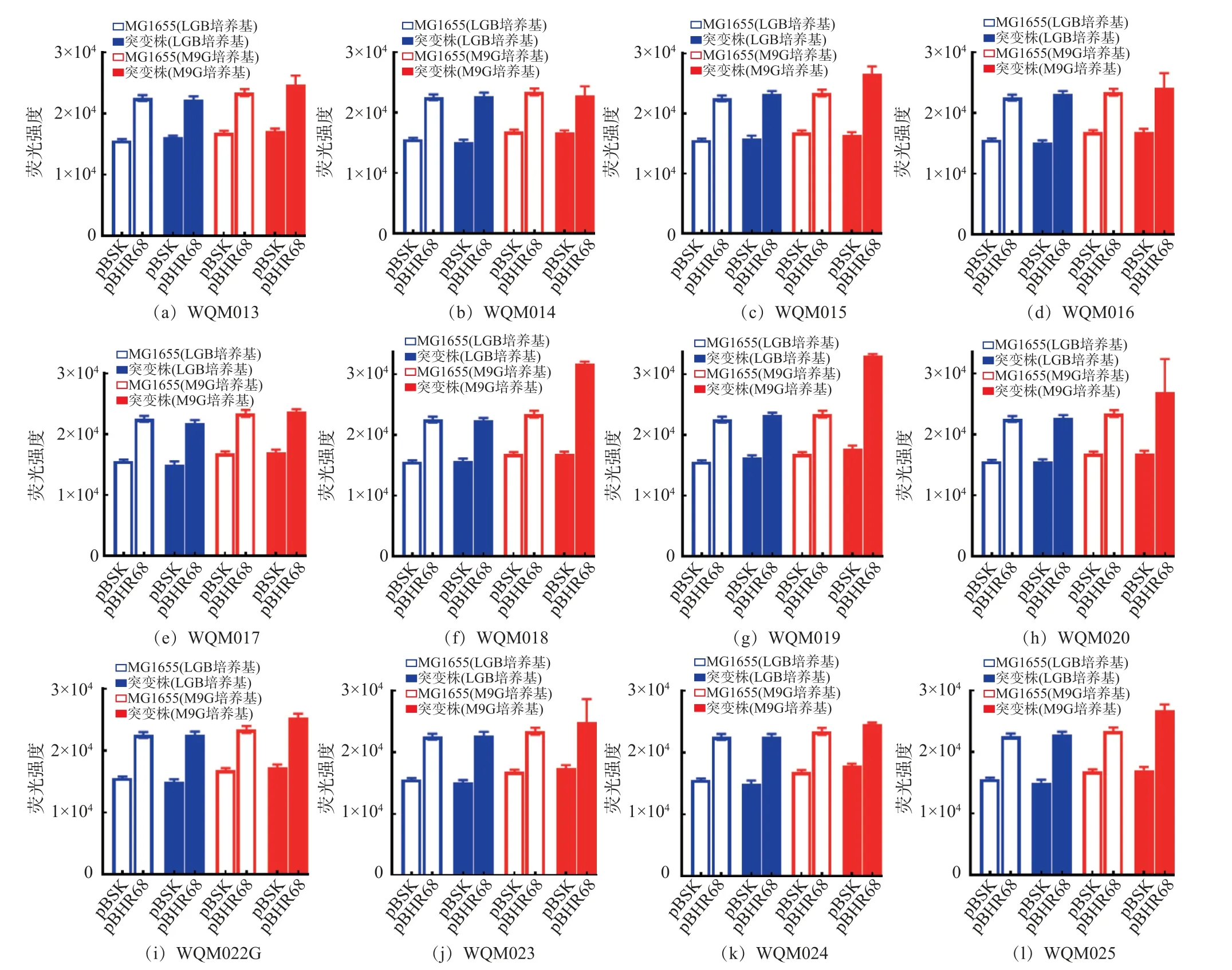
图4 含有PHB 生产质粒的突变株产PHB 能力分析Fig.4 Analysis of PHB production ability of mutants containing PHB-producing plasmid
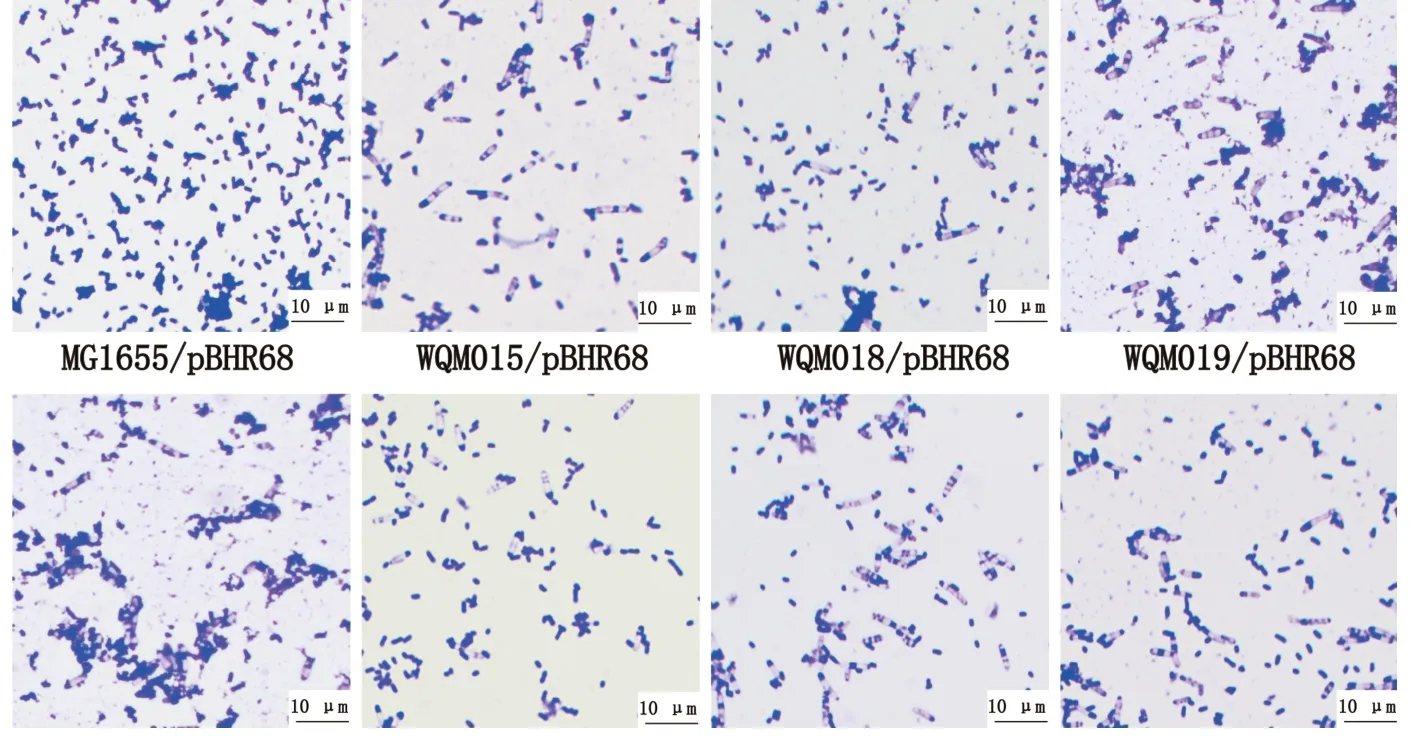
图5 镜检观察M9G 培养基中的PHB 合成菌株Fig.5 Microscopic observation of PHB-producing strains in M9G medium
2.5 核心多糖缺失对克拉酸合成的影响
作者在构建非必需生物膜组分缺失的突变株时,发现敲除核心多糖的WQM018 突变株在平板上能长出黏液状菌落。 进一步对其产生条件和种类进行初步分析发现, 对照株MG1655 在37 ℃培养时,无论是在LB 还是M9 培养基培养都不产生黏液状菌落,胞外多糖染色视野中看不到媒染的蓝色胞外多糖;而WQM018 在M9 培养基中,菌落略显黏稠,镜检视野有少量蓝色媒染的胞外多糖。 在30 ℃培养时,MG1655 在M9 平板上的菌落略显黏稠,染色后视野微蓝, 而WQM018 在LB 和M9 培养基中均能长出明显的黏液状菌落,镜检视野中含有大量的媒染的蓝色胞外多糖,见图6。
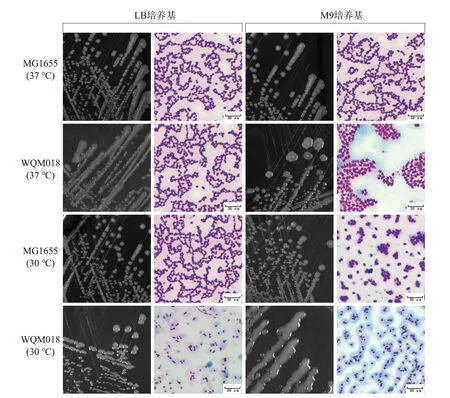
图6 MG1655 和WQM018 产胞外多糖观察Fig.6 Observation of exopolysaccharides produced by MG1655 and WQM018
从镜检图片可以看出,WQM018 产生了大量的胞外多糖。为推断所产胞外多糖的种类,以MG1655为对照,对WQM018 的转录水平进行考察。 从图7可以看出,所有与克拉酸合成和组装相关的基因大幅上调, 推断WQM018 产生的胞外多糖为克拉酸,这与文献报道的截短核心多糖促进克拉酸合成相符[29]。此外,卷曲纤维及菌毛合成的相关基因显著下调,见图8。 结合WQM018 的膜通透性明显增强的结果, 推测促进克拉酸合成的原因为: 大肠杆菌MG1655 去除核心多糖后,突变株WQM018 膜通透性增强,导致WQM018 合成大量的克拉酸以维持适当的胞内渗透压。 胞外大量克拉酸的积累和分泌又导致了菌毛及卷曲纤维合成的减少。 至于为何产生克拉酸维持渗透压, 不是其他种类的胞外多糖,还需深入研究。
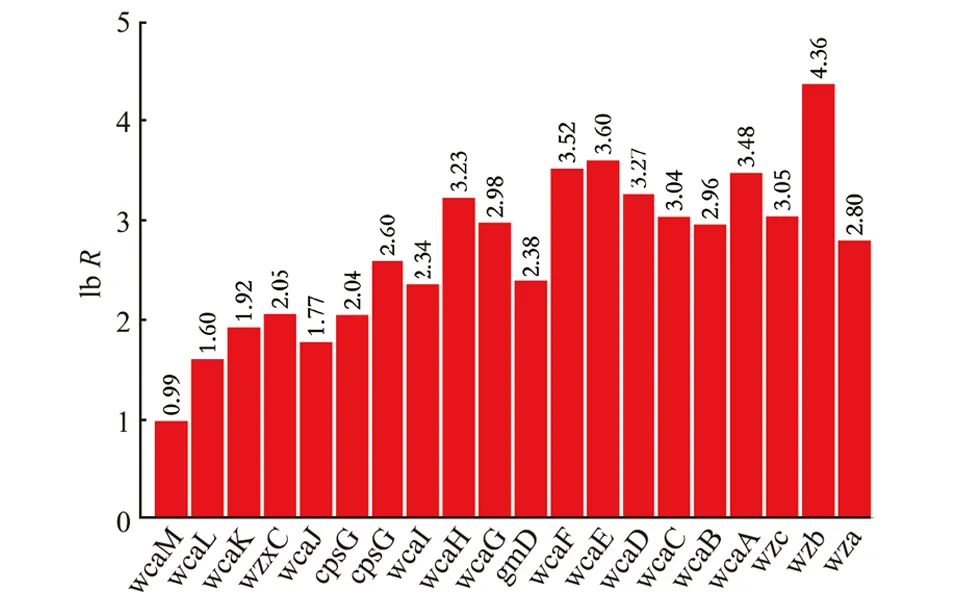
图7 WQM018 中克拉酸合成基因的转录水平Fig.7 Transcriptional levels of genes related to colanicacid biosynthesis in WQM018
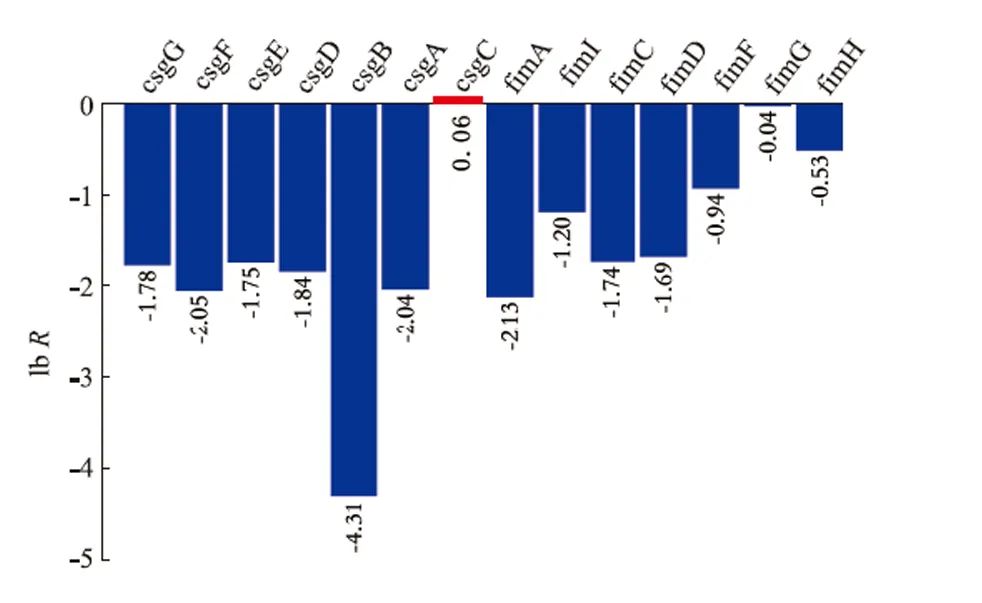
图8 WQM018 中卷曲纤维和菌毛合成基因的转录水平Fig.8 Transcriptional levels of genes related to curl and fimbriae biosynthesis in WQM018
3 结 语
大肠杆菌因其具有清晰的遗传背景和宽松的培养条件常被作为模式菌株,广泛应用于生物工程和工业微生物的研究中。 与此同时,大肠杆菌具有复杂且种类繁多的生物膜组分,这些组分在菌体趋化性、 抵御外界压力和侵染等方面发挥着重要作用。 但是在发酵工业中,这些生物膜组分的合成和组装需要耗费大量的能源和底物,而且某些生物膜组分还存在巨大的安全隐患。
作者以提高菌株优良性能并减少致病风险为出发点, 汇总了大肠杆菌生物膜的11 种非必需生物膜组分, 从基因水平分别去除这些生物膜组分,考察其生长、膜通透性、节约碳源和重塑代谢等方面的变化。 整体而言,突变株在LB 培养基中表现出抑制生长或变化不明显。敲除鞭毛fliE-R、fliY-T 和flhE-D 基 因 簇, 构 建 的WQM013、WQM014 和WQM016 在M9 培养基中生长优于对照菌株。 敲除鞭毛基因簇flgN-L,构建的突变株WQM015 生长变差,但有利于PHB 合成。 分别敲除鞭毛的4 个基因簇后,通透性都得到增强,因此应深入研究组合敲除鞭毛4 个基因簇的突变株。 去除胞外多糖类组分基本都能积累PHB 和增强菌株通透性,下一步应构建组合敲除菌株,进一步增强膜通透性和提高PHB产量。 但是,在所用胞外多糖组分中,仅敲除4 型荚膜、唾液酸和聚-β-1,6-葡萄糖胺能促进其在M9 培养基中的生长。 因此,应重点考察这3 种组分缺失的突变株及鞭毛突变株,进一步提高生长性能。 其次,去除大肠杆菌核心多糖能重塑代谢调控,促进克拉酸的生产。 这些结果为大肠杆菌非必需生物膜组分存在必要性的研究提供了理论依据,也为其他菌株的改造和发酵产物的产量提高提供了新思路。

