布氏乳杆菌细菌素BSX01 对金黄色葡萄球菌及其生物被膜形成的影响
江宇航, 周寰宇, 辛维岗, 徐美余,何 秀, 张棋麟, 林连兵*
(1.昆明理工大学 生命科学与技术学院, 云南 昆明 650500;2.云南省高校饲用抗生素替代技术工程研究中心,云南 昆明 650500)
金黄色葡萄球菌(Staphylococc aureus)属于革兰氏阳性球菌,是葡萄球菌属中的典型食源性致病菌代表,约有20%~30%的人群携带此种病原菌[1-2]。金黄色葡萄球菌污染食物后可通过食物处理者或食物表面感染人体或动物进而传播到整个食物链中,诱发皮炎、肺炎、骨髓炎和败血症等疾病发生,严重者可导致肌肉痉挛甚至休克[2]。 同时,金黄色葡萄球菌能够耐高温、耐高渗,对磺胺类药物具有很强的耐药性,这使得很难对金黄色葡萄球菌进行防控[3-4]。 金黄色葡萄球菌产生的主要毒素为肠毒素,其对大多数处理方法例如高温和低pH 等具有相对较高的耐受性,进一步增加了食物中毒风险[1,5]。 此外,据欧洲食品安全局(EFSA)统计,欧洲2017 年由金黄色葡萄球菌引起的食源性疾病事件有27 起,造成了352 人患病。 我国2011—2016 年食源性疾病监测数据分析表明,金黄色葡萄球菌引起的食源性疾病暴发总次数为314 次,疾病总数为5 196 例,占细菌性食物中毒事件的20%以上,仅次于副溶血性 弧 菌 (Vibrio parahaemolyticus) 和 沙 门 氏 菌(Salmonella)[6]。因此,找到有效方法减缓金黄色葡萄球菌污染造成的食品安全问题是十分重要的。
生物被膜是指细菌为了适应生存环境黏附于有生命或无生命戊糖的表面,产生多糖基质等胞外聚合物将其自身包围形成的大量细菌聚集膜样结构化群落,具有耐热和耐干燥等特性[7-8]。 细菌生物被膜形成的高密度结构使其在酸性和抗生素作用条件下也能很好生存,这严重阻碍了抗菌剂对细菌的抑制和杀伤[8-9]。 当食品微生物形成生物被膜时,由于难以清洗和彻底去除,会出现餐厨设备表面破坏、传热效率低、能耗高等问题,这造成了极大的浪费[9-10]。 因此,如何有效清除生物被膜是食品工业面临的严峻考验[11]。目前解决食源性致病菌形成生物被膜的相关研究主要集中在其形成能力和对环境耐受抗性等方面, 关于借助微生物代谢产物抑制金黄色葡萄球菌等食源性致病菌形成的生物被膜研究较少。
布氏乳杆菌(Lactobacillus buchneri)是乳酸菌属中的一种, 在食品发酵时具有增加有氧稳定性、提升发酵香味及抑制其他病原菌生长的效果[12-13]。同时,乳酸菌属的部分细菌在生长过程中能够代谢生成抑菌活性物质,可有效抑制或杀灭多种致病性细菌,具有高效、无耐药性、无毒、无残留等优点[14]。目前对乳酸杆菌细菌素作用于以金黄色葡萄球菌为代表的食源性致病菌及其对生物被膜形成的影响研究较少,这严重限制了乳酸杆菌细菌素在食品领域的应用范围[14-15]。 因此,作者在观测布氏乳杆菌生长及其抑制金黄色葡萄球菌活性的基础上,利用ÄKTA 纯化系统串联Superdex 30 Increase 及MALDI-TOFMS,得到纯化后的布氏乳杆菌细菌素。进一步考察酶敏感性,对热、酸碱稳定性以及最小抑菌质量浓度等特性,并借助荧光倒置显微镜进一步评估了布氏乳杆菌细菌素对金黄色葡萄球菌生物被膜形成的影响,旨在为金黄色葡萄球菌及其生物被膜的清除提供一种高效的抑菌活性物。
1 材料与方法
1.1 实验材料
布氏乳杆菌分离自发酵豆粕,金黄色葡萄球菌分离自肉类加工制品,均由昆明理工大学生命科学与技术学院噬菌体与肠道微生物研究室保存。
1.2 主要试剂
MRS 培养基、LB 培养基:北京陆桥技术有限责任公司;磷酸盐缓冲液(PBS,pH 7.4):国药(上海)化学试剂有限公司;0.22 μm 滤膜:上海生工生物工程股份有限公司;胃蛋白酶、胰蛋白酶、蛋白酶K、木瓜蛋白酶、过氧化氢酶:美国Sigma 公司;BCA 试剂盒、ABP 试剂盒:上海贝博生物科技有限公司。
1.3 仪器与设备
Power Wave XS 微孔板扫描分光光度计: 美国BIO-TEK 有限公司;UV-900 AKTA 蛋白质纯化系统:瑞典GE 公司;CHA-S 恒温振荡器:国华电器有限公司;CF16RXII 低温离心机、ES-2030 型冷冻干燥仪:日立(Hitachi)有限公司;PHSJ-3FpH 计:上海仪电科学仪器股份有限公司; 荧光倒置显微镜:上海万衡精密仪器有限公司。
1.4 布氏乳杆菌的生长与抑制金黄色葡萄球菌活性曲线
将活化后的布氏乳杆菌以体积分数3%接种于500 mL 的MRS 液体培养基中,37 ℃恒温培养,每2 h(0~36 h)取发酵液5 mL,以MRS 培养基作空白对照,测定OD600和pH 值。 同时,取发酵液2 mL 于8 000 r/min 离心10 min, 收集上清液, 经0.22 μm滤膜过滤去除菌体细胞[16]。最后,以金黄色葡萄球菌为指示菌(107CFU/mL),采用牛津杯双层平板法检测不同时间点的布氏乳杆菌细菌素 (以下简称BSX01)抑菌活性,每组设3 个重复。
1.5 细菌素的提取与纯化
将布氏乳杆菌以体积分数3%接种于500 mL的MRS 液体培养基中,37 ℃培养24 h, 于4 ℃、8 000 r/min 离心10 min, 收集上清液。 用0.22 μm滤膜过滤去除菌体,将具有活性的无细胞上清液通过AKTA pure 纯化系统,使用Superdex 30 Increase层析柱,平衡2 个柱体积,在pH 6.2 条件下洗脱,洗脱体积为1.5 倍柱体积,280 nm 处检测细菌素含量,流量为0.3 mL/min,每0.5 mL 为一管进行收集,通过牛津杯双层平板法测定其抑菌活性。 将多次初步纯化得到的具有抑菌活性的收集液混合后,通过Superdex 30 Increase 进行二次纯化, 检测其抑菌活性[6,16]。 最后,将经过2 次纯化得到的具有抑菌活性的收集液进行冷冻干燥,于4 ℃冰箱中保存备用。
BSX01 的相对分子质量大小及蛋白质质量浓度的测定分别采用MALDI-TOF MS 和BCA 蛋白质检测试剂盒进行。 细菌素相对分子质量大小测定:方法及流程参照文献[16],具体交由北京百派克生物科技有限公司进行; 蛋白质质量浓度的测定:称取1.0 mg 干粉溶于1 mL ddH2O 中,按照BCA 蛋白质检测试剂盒[6,17]说明绘制标准溶液曲线(y=1.062X+0.016 3,R2=0.992 3),计算每毫升溶液中的蛋白质质量,每个试样设置3 组重复。
1.6 细菌素的酶敏感性
将上述纯化样品pH 调至7.0,加入过氧化氢酶和不同蛋白酶溶液(胃蛋白酶、胰蛋白酶、蛋白酶K)使其终质量浓度为1.0 mg/mL,37 ℃水浴2 h, 然后于80 ℃水浴10 min 使蛋白酶活性丧失[18]。 以金黄色葡萄球菌为指示菌,利用牛津杯双层平板法检测不同酶溶液处理后的细菌素抑菌活性变化,记录抑菌圈直径。 以未加酶溶液处理的BSX01 作为对照,每个试样设置3 组重复。
1.7 细菌素的热及酸碱稳定性测定
取上述纯化样品,分别按以下处理进行细菌的热及酸碱稳定性测定。 37、60、80、100、121 ℃处理30 min 后, 自然冷却至室温; 以1 mol/L 的HCl 或NaOH 溶液调节pH 至2.0、4.0、6.0、8.0、10.0、12.0,分别置于37 ℃保温2 h,调至pH 6.5[18-19]。 采用牛津杯双层平板法检测经不同处理后的细菌素溶液对金黄色葡萄球菌的抑制能力,以未经处理的BSX01为对照,每个样品设置3 组重复。
1.8 MIC 测定
BSX01 对金黄色葡萄球菌的MIC 值参照文献[6,20]的方法测定。 将BSX01(1.0 mg/mL)在无菌PBS(pH 7.2)中连续稀释,并将10 μL 稀释液与90 μL 含金黄色葡萄球菌(107CFU/mL)的LB 培养基混合[21]。 37 ℃孵育24 h,在600 nm 处测定吸光度,每组重复3 次。 MIC 定义为:BSX01 在37 ℃培养24 h 后未观察到指示菌菌株生长的最低质量浓度[22]。 每个样品设置3 组重复。
1.9 细菌素对金黄色葡萄球菌生物被膜形成的影响
为观察细菌素对金黄色葡萄球菌生物被膜形成的影响, 首先用终质量浓度分别为0、1/2 MIC、1 MIC、2 MIC 的BSX01 与100 μL 金黄色葡萄球菌(107CFU/mL)添加到24 孔微量滴定板中,在37 ℃下恒温孵育30 h 后形成生物被膜。弃上清液以去除未附着的金黄色葡萄球菌,用PBS 缓冲液(pH 7.4)洗涤微量滴定板上的多余残留,得到金黄色葡萄球菌生物被膜。将金黄色葡萄球菌生物膜按照ABP 试剂盒荧光成像检测的操作说明进行,加入1.0 μL 的Nuc View Green 染料后在室温下对生物被膜染色15 min,弃染色液,用PBS 缓冲液(pH 7.4)洗涤2 次以上,去除游离的染色液,置于荧光显微镜下观察金黄色葡萄球菌生物被膜形成情况[7,23]。 最后,加入100 μL PBS 缓冲液(pH 7.4)与各处理的金黄色葡萄球菌生物被膜混合后,测OD595,每个样品设置3组重复。
1.10 数据分析
所有测得的数据均包含3 次生物学重复,以平均值±标准差(SD)表示。 利用Microsoft Excel 2010和IBM SPSS 22.0 统计软件分别对数据进行整理分析。 数据对间显著性检验利用t 检验 (Student’s t Test)进行;采用One-Way ANOVA 进行单因素方差分析和最小显著差异法 (Least -Significant Difference,LSD)测验差异显著性[19],显著性水平阈值P<0.05。
2 结果与分析
2.1 布氏乳杆菌生长与BSX01 抑制金黄色葡萄球菌活性曲线
将布氏乳杆菌于37 ℃培养36 h, 分阶段测定其在600 nm 下的吸光值度、pH 值及对金黄色葡萄球菌的抑菌效果,结果见图1。 布氏乳杆菌培养2 h后进入对数生长期,在20 h 达到峰值,然后菌体数量逐渐平稳,达到稳定期;对金黄色葡萄球菌的抑菌效果从4 h 就开始出现, 到26 h 时达到峰值,抑菌圈直径稳定在(26.36±0.86) mm;pH 随着时间的推移逐渐下降,在28 h 达到3.5±0.3,并持续保持平稳。 表明布氏乳杆菌在生长初期就开始产生酸类物质,随着pH 值的下降菌体量逐渐上升,说明有机酸是布氏乳杆菌在生长过程中产生的一种必要代谢产物。 此外,BSX01 对金黄色葡萄球菌的抑菌作用随着菌体量的增加逐渐增加,特别是在布氏乳杆菌进入稳定期前后, 其抑菌圈直径大幅增大, 说明BSX01 可能是布氏乳杆菌在生长后期产生的一种重要次级代谢产物。

图1 布氏乳杆菌的生长与BSX01 拮抗活性曲线Fig.1 Curves of Lactobacillus buchneri growth and BSX01 antagonistic activity
2.2 BSX01 的提取及纯化
将具有抑菌活性的布氏乳杆菌上清液经Superdex 30 Increase 分离纯化后,得到A1~A7 多个洗脱峰,见图2。 经过牛津杯双层法检测后,A3、A4洗脱峰对应的收集液具有明显的抑菌活性,再将其进一步纯化上样后得洗脱峰B1、B2,检测后发现B2洗脱峰的抑菌圈直径明显优于B1 洗脱峰, 因此收集B2 洗脱峰对应的洗脱液进行后续实验。将B2 洗脱液经冷冻干燥处理,通过MALDI-TOF MS 分析发现,布氏乳杆菌代谢产生的主要抑菌活性物质的相对分子质量大小为773.56,这与马国涵等[24]和Li等[6]在大菱鲆和肉鸡肠道中发现的乳杆菌产生的抑菌活性物质的相对分子质量大小相似, 推测同为I类细菌素。 因此,布氏乳杆菌产生的抑菌活性物质可能是一类具有高抑菌活性的小分子多肽或小分子蛋白质。
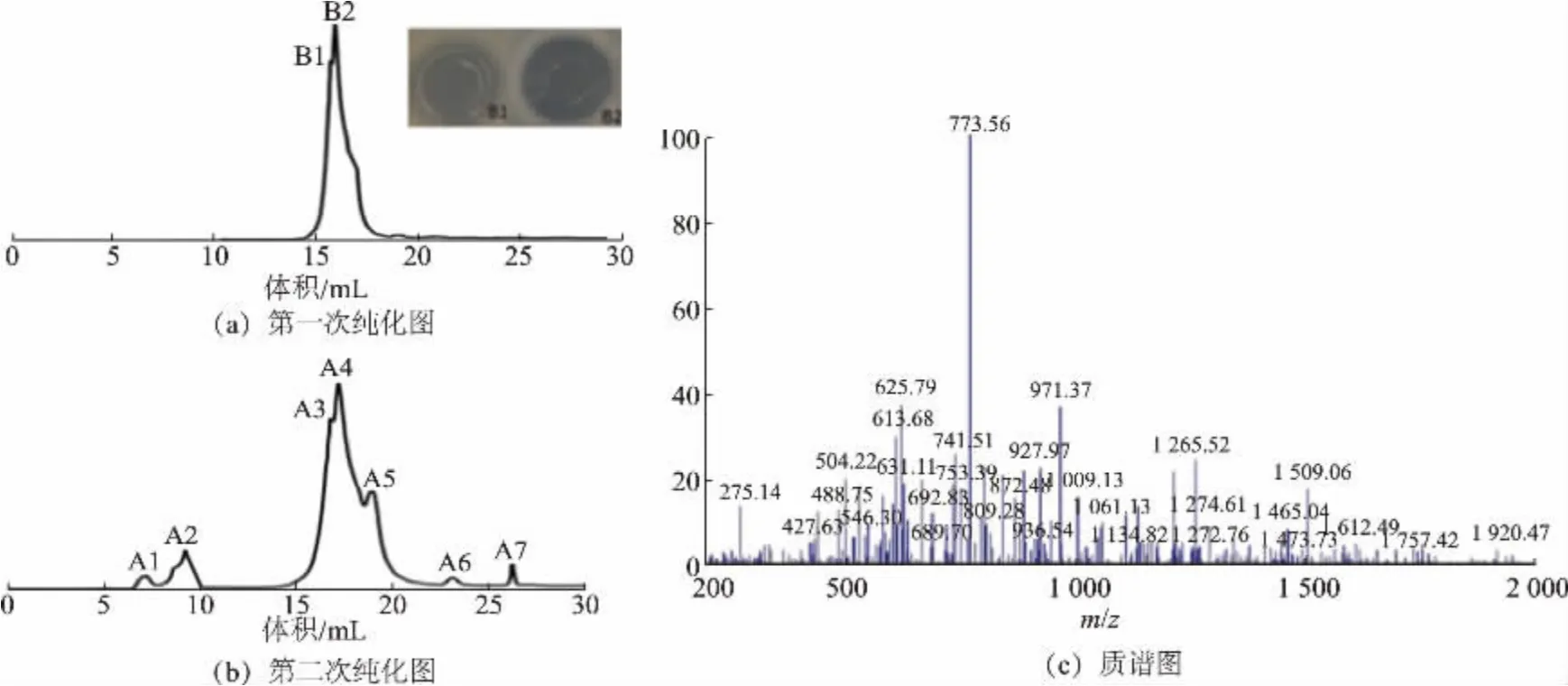
图2 BSX01 的纯化与质谱图Fig.2 Purification and mass spectrum of BSX01
2.3 BSX01 的酶敏感性
为进一步确定布氏乳杆菌产生的抑菌活性物质是一种蛋白质类细菌素,作者首先用过氧化氢酶对BSX01 进行处理,发现其抑菌圈直径与对照相比未发生显著下降(P >0.05),初步说明过氧化氢不是主要的抑菌活性物质。利用蛋白酶K、胰蛋白酶和胃蛋白酶分别对BSX01 进行处理, 结果发现BSX01经蛋白酶K、胰蛋白酶和胃蛋白酶处理后,抑菌圈直径与对照相比发生了显著下降(P <0.05),尤其是经蛋白酶K 处理后, 抑菌圈直径下降最为明显,仅为(9.83±0.32) mm,见图3。 结果说明布氏乳杆菌产生的BSX01 对蛋白酶敏感,存在着类蛋白质性质[18,25],进一步证实了布氏乳杆菌细菌素BSX01 为Ⅰ类细菌素。

图3 BSX01 的酶敏感性Fig.3 Enzyme sensitivity of BSX01
2.4 BSX01 的热及酸碱稳定性
细菌素抑菌活性的高低仅代表该细菌素有较好的抑菌效果,然而实际应用中细菌素的稳定性也是影响工业化生产的重要因素。对BSX01 进行酸碱耐受与热稳定性测试,结果发现在过酸(pH 2.0)和过碱(pH 10.0)处理后,BSX01 仍保持一定的抑菌活性。随着pH 值的上升,对金黄色葡萄球菌的抑菌活性逐渐下降, 在pH 10.0 时抑菌圈直径最低,为(19.07±0.64) mm。 但在pH 10 时,BSX01 仍保持77.5%的抑菌活性,较同类研究[16,18]中经过相同处理后的抑菌活性更高,这说明BSX01 在耐碱方面具有良好的耐受能力。 同时,BSX01 在37~121 ℃处理30 min 后, 随着温度的升高抑菌圈活性逐渐下降,且在高温区段(80、100、121 ℃)中抑菌活性损失较大,在80 ℃时仅保留76.0%的抑菌活性。 但121 ℃加热30 min 后, 抑菌活性也仅损失了不到40%,说明虽然BSX01 在高温处理后抑菌活性会有所损失,但仍然能够保留较高的抑菌活性,显示出较宽的温度应用范围[19],见图4。
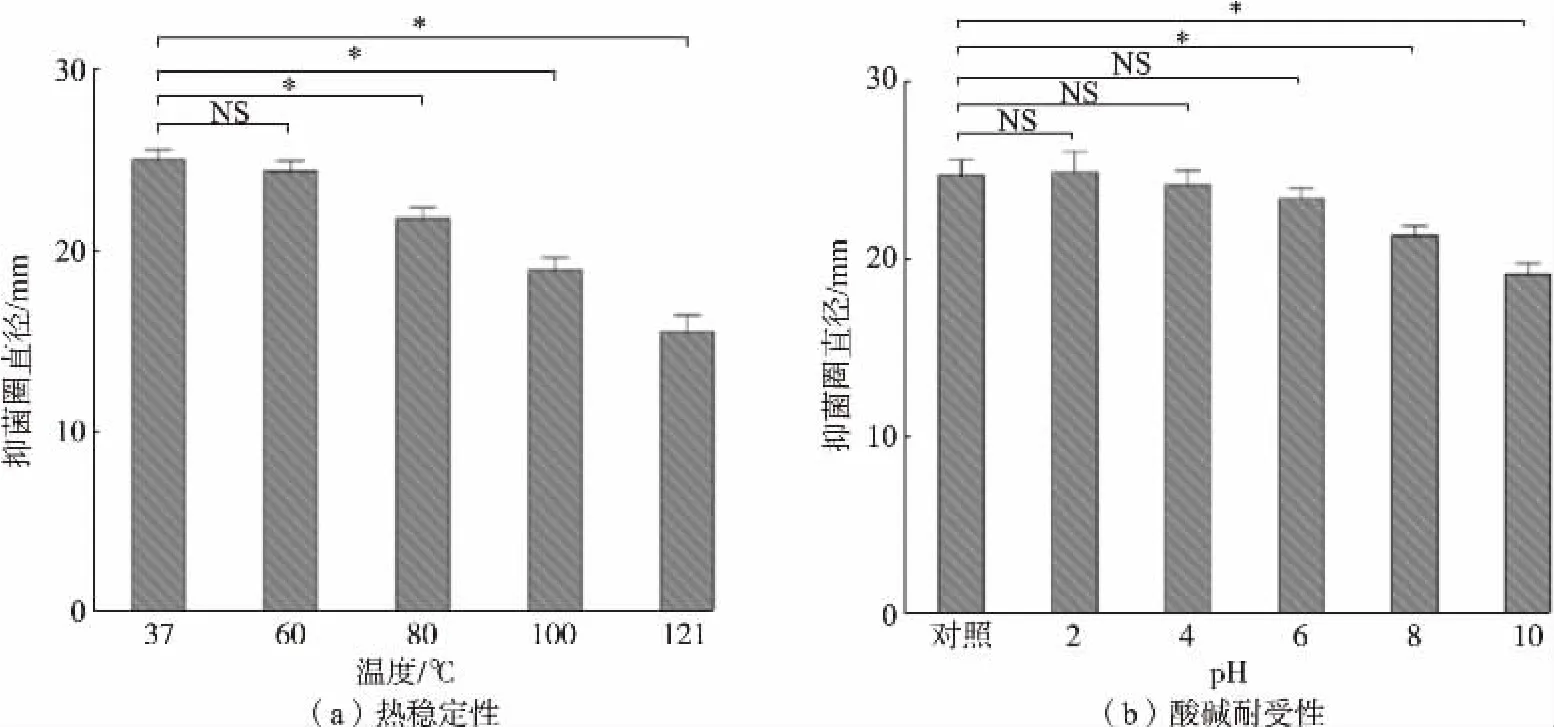
图4 BSX01 的热稳定性与酸碱耐受性Fig.4 Thermal stability and acid-base tolerance of BSX01

图5 不同MIC 的BSX01 抑制金黄色葡萄球菌生物被膜的形成Fig.5 Inhibition effect of BSX01 with different MIC on the formation of Staphylococcus aureus biofilm
2.5 BSX01 的MIC 及对金黄色葡萄球菌生物被膜形成的抑制作用
最小抑菌浓度对于细菌素实际应用具有重要的意义。通过将不同质量浓度纯化后的BSX01 作用于金黄色葡萄球菌,确定得到最小抑菌质量浓度仅为12.50 μg/mL, 这与目前部分研究中抑制金黄色葡萄球菌的最小抑菌质量浓度一致[6,21]。 分别用0、1/2MIC、1MIC、2MIC 的BSX01 处理金黄色葡萄球菌, 在37 ℃培养30 h 后通过荧光倒置显微镜进行观察,发现随着细菌素质量浓度的增加,生物被膜形成的密度逐渐下降,在1/2MIC 的BSX01 处理后,其生物被膜形成的密度较对照发生了较大幅度下降;当以1MIC 的布氏乳杆菌细菌素处理后,生物被膜形成的密度较对照相比仅有稀疏的金黄色葡萄球菌菌体出现;以2MIC 的BSX01 处理后,几乎无肉眼可见的生物被膜形成,这说明BSX01 质量浓度的提高能够有效抑制金黄色葡萄球菌生物被膜的形成,且仅需要较低质量浓度的BSX01。此外,600 nm下的吸光度分别为1.23±0.14、0.66±0.18、0.38±0.29和0.23±0.06, 进一步证明了获得的BSX01 以低浓度就能够有效抑制金黄色葡萄球菌生物被膜的形成[23]。
3 结 语
本研究证实了前期筛选得到的布氏乳杆菌在生长过程中产生了一种细菌素类代谢产物,其能够对金黄色葡萄球菌起到明显抑制作用。 该细菌素(BSX01)的相对分子质量为773.56,对蛋白酶敏感,具有类蛋白质性质,推测为I 类细菌素,并对温度和pH 表现出较高的耐受性, 最低抑菌质量浓度仅为12.50 μg/mL。 同时,该细菌素在不同MIC 的抑菌质量浓度下均能明显抑制金黄色葡萄球菌生物被膜的形成,在减缓金黄色葡萄球菌生物被膜形成方面效果显著。 研究结果证实,布氏乳杆菌产生的细菌素类抑菌物质具有良好抑菌特性,具有高效的抑制金黄色葡萄球菌生物被膜形成能力,为将该细菌素应用于食品工业中防治以金黄色葡萄球菌为代表的食源性致病菌及其生物被膜引发的相关问题提供理论基础。

