魔芋葡甘聚糖对人结肠细胞株基因组稳定性的影响
李 翔, 曹 宇, 唐湘华, 汪 旭,3, 倪 娟*
(1.云南师范大学 生命科学学院, 云南 昆明 650500;2.云南师范大学 生物能源持续开发与利用教育部工程研究中心,云南 昆明 650500;3.台州耶大基因与细胞治疗研究中心,浙江 台州 318000)
魔芋(konjac)是多年生天南星科草本植物的地下块茎。 魔芋葡甘聚糖(konjac gluconnan,KGM)是魔芋块茎中的水溶性膳食纤维,为一种高相对分子质量非离子型杂多糖,具有水溶性、成膜性、持水性、胶黏性、增稠性、衍生性、配伍性等多重优良特性和特殊的生物活性[1-3]。 KGM 具有降低胆固醇、预防高血压、高血脂、糖尿病等多种生理功效[4-5]。
肠道是人体最大的消化和排泄器官[6],肠黏膜上皮细胞通过相互连接,形成了一个完整的生物屏障(肠上皮细胞屏障),在维护肠道健康中发挥重要作用[7]。 基因组稳定性是维护细胞生理稳态的重要基础,基因组稳定性下降是众多癌细胞的特征之一[8]。少量的基因组不稳定性(genome instability,GIN)可诱发细胞周期停滞,细胞将启动相应机制修复受损基因组;若细胞出现过高且不可逆的GIN 时,细胞的生存将受到威胁,通过各种死亡途径被清除[9]。 在消化道中,若肠道细胞GIN 增加,肠道细胞将出现生存劣势,进而使肠道屏障功能发生异常,引发生化级联反应,导致肠内慢性炎症及多种肠道疾病如炎症性肠病、肠易激综合征,以及一部分肠外慢性炎症的发生。 若机体长期处于炎症微环境中,DNA将会受到持续的氧化胁迫及炎症因子的干扰,再次增加其损伤概率, 导致GIN 的发生频率显著增加,细胞程序性死亡过程终止,增大细胞恶性转化及形成肿瘤细胞的可能[10]。
许多研究表明,植物多糖能够有效地抑制癌症的发生发展[11],植物多糖可通过调控细胞周期、诱导凋亡、干扰能量代谢、调控信号通路等生物学过程抑制或延缓癌细胞的增殖过程。 例如,蒲公英多糖在体内可促进P53 和Bax 的表达,并抑制Bcl-2 的表达,从而诱导乳腺癌细胞凋亡,发挥其抗乳腺癌作用[12];绿茶中的茶多糖可以降低结肠癌细胞周期蛋白cyclin D1 的表达[13],阻止肿瘤细胞由G1 期进入S 期,使癌细胞的分裂及增殖受到干扰;Wu 等人用裙带菜多糖处理乳腺癌MCF-7 细胞, 观察到裙带菜多糖可以阻滞细胞S 期[14]。已有研究表明,KGM对维护肠道屏障具有积极的生理效应,能有效保护胃黏膜,清洁胃壁,还具有良好的肠道益生性[15-16]。流行病学实验表明,KGM 对预防结肠癌具有一定的积极效应[17-19],其可能通过影响细胞因子如IL-1β、TNF-α 和IFN-γ 等的表达发挥抗肿瘤作用。作者研究了KGM 对不同类型肠道细胞的GIN 的影响,以及对不同类型细胞的生长状况产生差异的影响。
1 材料与方法
1.1 材料与试剂
人正常结肠上皮细胞NCM460、 人结肠癌细胞SW620、HCT116 细胞:中国科学院细胞库;二甲基亚砜:Biosharp 公司;细胞松弛素B(cytochalasin b,CB)、磷酸缓冲盐溶液(PBS)、青/链霉素溶液、L-谷氨酰胺、 新生牛血清、RPMI-1640 培养基:Gibco 公司;四甲基偶氮唑盐(MTT):美国Sigma 公司;台盼兰染液:Solarbio 公司;吉姆萨粉末:上海三思尔公司;KGM: 由作者所在生物能源持续开发利用教育部工程研究中心提供。
1.2 主要仪器与设备
超净工作台SW-CJ-2FD 型: 苏州安泰空气技术有限公司;二氧化碳培养箱MCO-15AC 型:日本三洋;细胞涂布离心机TXD3 型:湖南湘仪离心机仪器有限公司; 光学显微镜VANOX-S 型: 日本Olympus;酶标仪SpectraMax iD3 型:美谷仪器有限公司;立式压力蒸汽灭菌锅LDZX-50KBS 型:上海申安医疗器械厂。
1.3 细胞培养
NCM460、SW620 及HCT116 细 胞 株 分 别 培 养于含有体积分数10%新生牛血清、 体积分数1%谷氨酰胺(L-glutamine,L-Glu)、体积分数0.1%青霉素/链霉素溶液的RPMI-1640 完全培养基中, 并置于培养箱内静置培养,培养箱内CO2体积分数为5%,温度为37 ℃,每2~3 d 更换一次培养基,待细胞铺满75%~90%瓶底面积时进行细胞计数并传代。
1.4 细胞活力检测
1.4.1 KGM 储备液配制称取2.4 g KGM 溶于10 mL 蒸馏水中,配置成240 mg/mL 的储备液。
1.4.2 加药处理将NCM460、SW620 及HCT116细胞以每孔4×105个/mL 接种至细胞培养96 孔板中,于37 ℃、体积分数5%的CO2条件下培养,待细胞贴壁后, 每孔加入预设质量浓度(0、0.625、1.25、2.5、5、10、20、40 mg/mL) 的KGM 分别处理24、48、72 h。
1.4.3 MTT 法检测细胞活力经加药处理后,每孔加入四甲基噻唑蓝(tetramethylthiazole blue,MTT)20 μL 继续培养4 h 后终止培养。 吸弃每孔液体,加入150 μL DMSO 后置摇床上缓慢摇匀10 min。待结晶物充分溶解后, 用酶标仪在490 nm 波长处测定吸光度,绘制生长曲线[20]。
式中:I 为细胞存活率,%;OD实验组为实验组在490 nm 处吸光度;OD对照组为对照组在490 nm 处的吸光度。
1.5 胞质阻断分裂微核分析细胞组实验 (CBMNCyt)
将NCM460、SW620 及HCT116 分 别 以3×105个/mL 接种到细胞培养6 孔板中,于37 ℃、体积分数5%的CO2条件下培养, 待细胞贴壁后, 加入KGM(0、5、20、30 mg/mL),72 h 后弃含KGM 的培养基,用含有CB(终质量浓度为3 μg/mL)的培养基继续培养,24~28 h 后收集细胞。 经涂片、固定、染色、封片后,分别按计数标准统计单核、双核细胞中的微核、多核、核质桥、核芽、凋亡等指标,计算不同质量浓度KGM 处理后3 种受试细胞的GIN、 核分裂指数(nuclear division index,NDI)和凋亡率,见图1。

图1 CBMN-Cyt 实验中各种指标的示意图Fig.1 Representative images of various indicators in the CBMN-Cyt experiment
1.6 统计分析
实验数据用SPSS 25.0 进行统计学分析,用one-way ANOVA 进行组件比较, 所有数据均用平均数±标准误表示;用GraphPad Prism 8.0.2 软件作图。
2 结果与分析
2.1 KGM 对结肠上皮细胞活力的影响
经不同质量浓度KGM 处理NCM460、SW620、HCT116 细 胞24、48、72 h 后,MTT 法 检 测 细 胞 活力, 结果见图2~4。 5~40 mg/mL 的KGM 处理24、48、72 h, 显著提高了NCM460 细胞的活力 (P<0.05), 见图2。 经5~40 mg/mL KGM 处理24 h 后,SW620 和HCT116 细胞活力显著提高(P<0.05);处理48 h 后,SW620 细胞活力无显著变化(P>0.05),HCT116 细胞在10~40 mg/mL 处理后细胞的活力显著提高(P<0.05)。 随着处理时间和KGM 质量浓度的增加,2 株癌细胞SW116 和SW620 的细胞活力显著被抑制。 当处理72 h 后,在KGM 质量浓度达40 mg/mL 时,极显著降低了2 株癌细胞的细胞活力并且致死率达54.5%和41.5%,表明KGM 可抑制结肠癌细胞增殖,见图3~4。 根据细胞活力数据显示,将后续实验的最高质量浓度设置为HCT116 半致死质量浓度的80%,即30 mg/mL,处理时间为72 h。
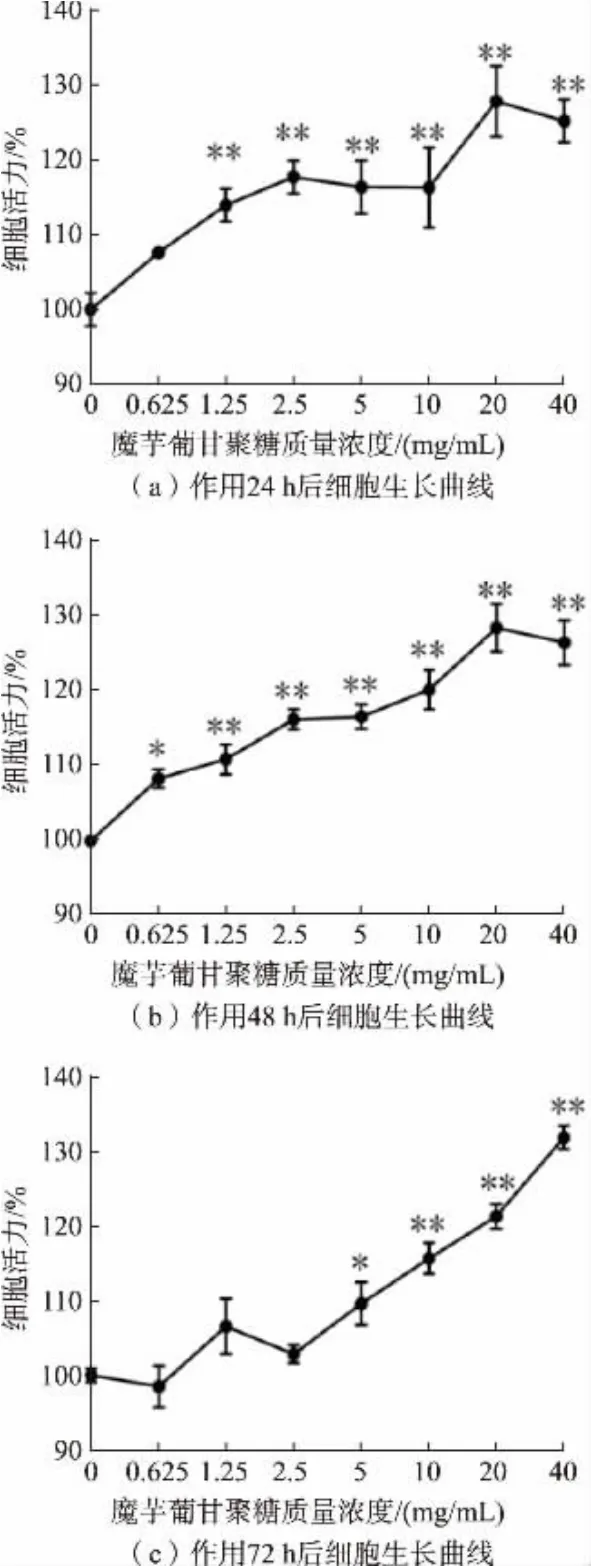
图2 不同质量浓度KGM 处理24、48、72 h 对NCM460 细胞活力的影响Fig.2 Effects of different concentrations of KGM on the viability of NCM460 cells treated for 24,48 and 72 h
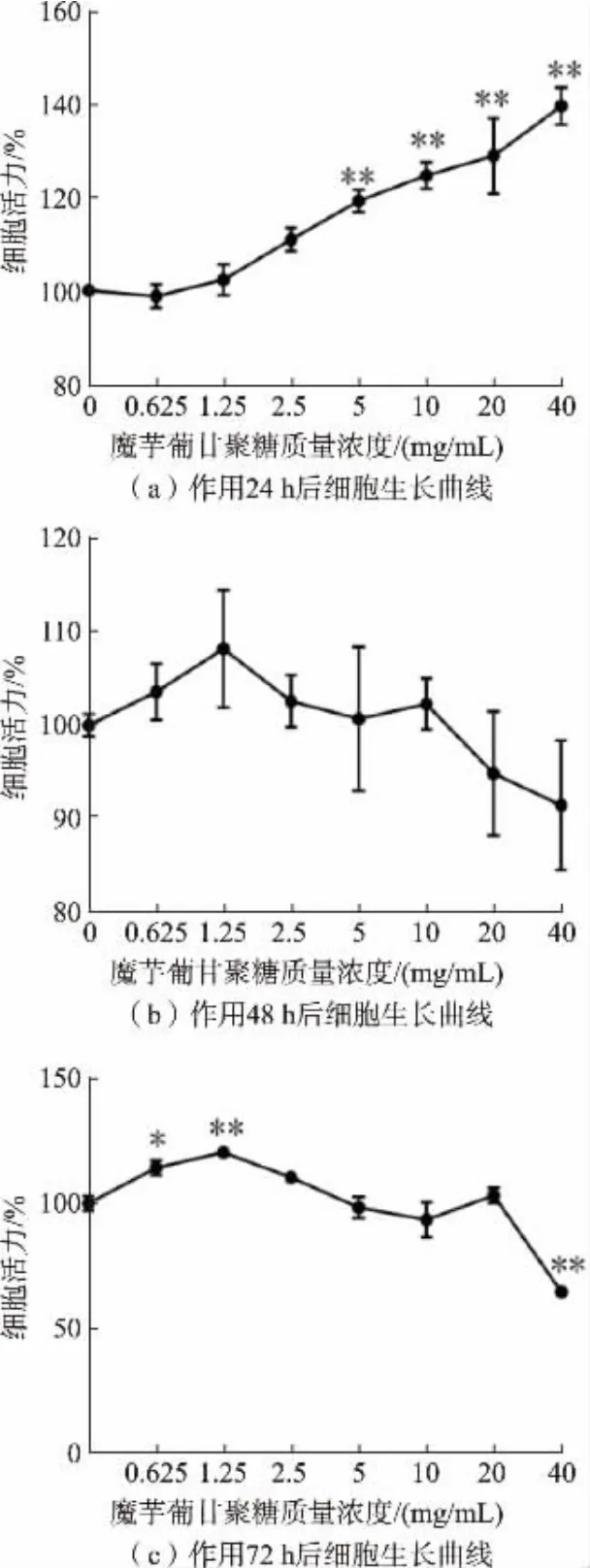
图3 不同质量浓度KGM 处理24、48、72 h 对SW620细胞活力的影响Fig.3 Effects of different concentrations of KGM on the viability of SW620 cells treated for 24,48 and 72 h

图4 不同质量浓度KCM 处理24、48、72 h 对HCT116 细胞活力的影响Fig.4 Effects of different concentrations of KGM on the viability of HCT116 cells treated for 24,48 and 72 h
2.2 KGM 对结肠上皮细胞基因组不稳定性及凋亡的影响
2.2.1 不同质量浓度KGM 对NCM460 GIN、NDI 以及细胞凋亡发生频率的影响CBMN-Cyt 实验结果显示,KGM 处理NCM460 细胞72 h 后,5~20 mg/mL的KGM 可极显著降低其微核发生频率 (P<0.01),KGM 为20~30 mg/mL 时核质桥发生频率显著上升(P<0.05),核芽发生频率无显著变化,见图5(a);中低质量浓度(5~20 mg/mL)的KGM 则降低了GIN 水平和细胞凋亡率,对正常肠道细胞的健康表现出维护效应; 但高质量浓度 (30 mg/mL) 的KGM 处理NCM460 细胞72 h 后其GIN 显著升高,提示高质量浓度KGM 会诱发正常结肠细胞基因组不稳定性,见图5(b)。 这与郭伟等[21]的动物模型研究结果一致,即高质量浓度KGM 不利于肠道健康;不同质量浓度KGM 对细胞的NDI 发生频率无显著影响,见图5(c);随着KGM 质量浓度的升高,细胞凋亡率逐渐降低,见图5(d)。 30 mg/mL 的KGM 极显著降低NCM460 的凋亡率(P<0.001)。
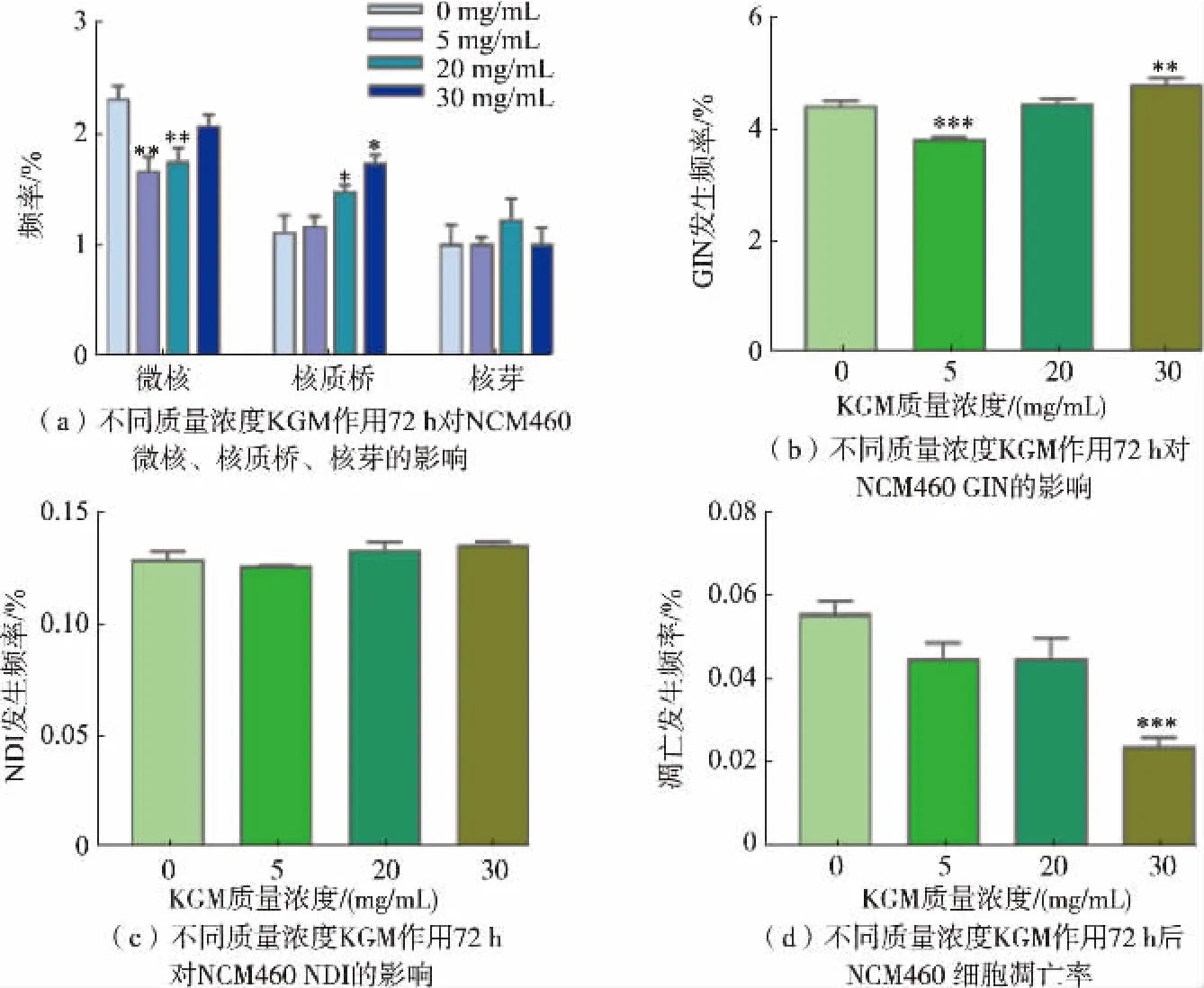
图5 不同质量浓度KGM 处理72 h 对NCM460 细胞凋亡、NDI 和GIN 的影响Fig.5 Effects of different concentrations of KGM on apoptosis,NDI,and GIN of NCM460 cell treated for 72 h
2.2.2 不同质量浓度KGM 对SW620 GIN、NDI 以及细胞凋亡发生频率的影响KGM 处理72 h 后,质量浓度为5~30 mg/mL 时极显著增加了SW620 细胞微核、核芽的发生频率(P<0.001),核质桥发生频率无显著变化,见图6(a);KGM 质量浓度为5~30 mg/mL 时,GIN 发生频率显著增加 (P<0.05)。KGM 在20~30 mg/mL 时,GIN 发生频率增加极显著(P<0.001),见图6(b);NDI 发生频率随KGM 质量浓度的增加呈极显著降低趋势,P<0.001;KGM 在20~30 mg/mL 时细胞凋亡发生率极显著增加 (图6(d),P<0.001)。

图6 不同质量浓度KGM 处理72 h 对SW620 细胞凋亡、NDI 和GIN 的影响Fig.6 Effects of different concentrations of KGM on apoptosis,NDI,and GIN of SW620 cell treated for 72 h
2.2.3 不同质量浓度KGM 对HCT116 GIN、NDI 以及细胞凋亡发生频率的影响处理72 h 后,质量浓度为5 mg/mL 的KGM 极显著增加了HCT116 细胞微核发生频率(P<0.01),质量浓度20 mg/mL 的KGM显著增加其微核发生频率(P<0.05),见图7(a);KGM 质量浓度在20 mg/mL 时核质桥发生频率极显著增加(P<0.05),KGM 质量浓度在5、30 mg/mL 时核芽发生频率极显著增加(P<0.05);KGM 质量浓度在5~30 mg/mL 时GIN 发生频率极显著增加(P<0.001),见图7(b);KGM 质量浓度在5 mg/mL 和30 mg/mL 时NDI 发生频率显著降低(P<0.05),见图7(c); 在KGM 质量浓度为5~30 mg/mL 时细胞凋亡发生率极显著增加(P<0.001),见图7(d)。
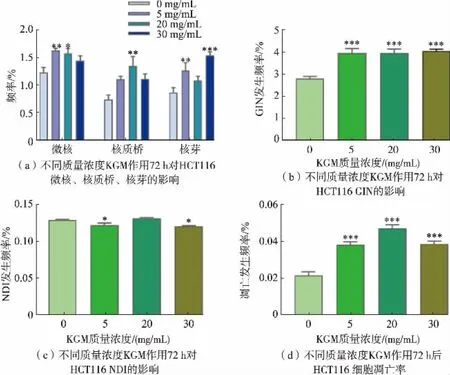
图7 不同质量浓度KGM 处理72 h 对HCT116 细胞凋亡、NDI 和GIN 的影响Fig.7 Effects of different concentrations of KGM on apoptosis,NDI and GIN of HCT116 cell treated for 72 h
3 结 语
目前,已有研究证明KGM 对肠道健康有益,其作为一种优质的益生元, 可促进肠道中双歧杆菌、乳酸杆菌等有益菌的生长[22-23],可使受损的黏膜屏障功能恢复,起到调节肠道微生物群稳态、抑制病原菌大量繁殖、增强肠道免疫的作用,对肠道疾病的缓解起到积极作用[24-25]。 本研究显示,在正常结肠上皮细胞NCM460 中,中低质量浓度(5~20 mg/mL)的KGM 降低了GIN 水平和细胞凋亡率, 对正常肠道细胞的健康表现出维护效应。 但高质量浓度(30 mg/mL) 的KGM 处理NCM460 细胞72 h 后使其GIN 显著升高,这与黄夏伶等研究结果一致[26]。在高剂量葡甘聚糖处理后的老年小鼠中,易见结肠炎性细胞聚集以及小肠完整结构破坏,即高剂量的KGM造成肠道细胞生成劣势,这可能是大多数肠道动力不足的老年人过量食用葡甘聚糖后排便困难的重要原因之一。质量浓度为5~30 mg/mL 的KGM 能够显著诱发SW620 和HCT116 细胞高水平GIN,并降低2 株结肠癌细胞的NDI,使细胞凋亡率显著升高。KGM 在正常细胞和癌细胞中表现出不同的效应,即在正常细胞中可维护基因组稳定性,而在癌细胞中则诱发基因组不稳定性, 这可能是其维护肠道健康的分子基础。 结果显示, 高质量浓度(30 mg/mL)的KGM 处理NCM460 细胞72 h 后可使其GIN 显著升高,细胞凋亡率显著降低,这与目前对GIN 与细胞凋亡相互关系的研究结论存在差距。 其原因可能是细胞凋亡率与KGM 质量浓度之间存在时间上的滞后,后期将适量增加KGM 的质量浓度再次验证。 本研究仅在离体条件下从基因组稳定性水平考查了KGM 对不同病理状态的肠上皮细胞的影响,对于其作用机理还有待从活体及分子水平更进一步深入研究。

