原发性胰腺淋巴瘤的CT、MRI 和PET/CT 表现
陈伯柱,孙双双,仇毓东,伏旭,史炯,唐敏*
1.南京大学医学院附属鼓楼医院医学影像科,江苏 南京 210008;2.南京大学医学院附属鼓楼医院胆胰外科,江苏 南京 210008;3.南京大学医学院附属鼓楼医院病理科,江苏 南京 210008;*通信作者 唐敏 chencbz@qq.com
原发性胰腺淋巴瘤(primary pancreatic lymphoma,PPL)是起源于胰腺、主体位于胰腺区域的结外淋巴瘤,可伴有邻近淋巴结受累及远处播散[1]。PPL的治疗策略及预后与胰腺癌存在巨大差异,化疗是其标准治疗方法,缓解率高,5年生存率约为45%,当患者并发胆道梗阻等需要减压时可实施手术[2-3]。但临床中由于PPL罕见,仅约占胰腺肿瘤的0.5%,常误诊为胰腺导管腺癌[2]。本研究拟分析PPL的临床及CT、MRI和PET/CT表现,提高对本病的认知,减少误诊。
1 资料与方法
1.1 研究对象 回顾性分析2017年1月—2021年12月南京大学医学院附属鼓楼医院4例PPL的临床及影像资料。女2例,男2例,年龄分别为58、63、64、67岁。纳入标准:①病理诊断明确;②于本院行影像学检查。排除标准:①临床资料缺失;②影像资料缺失或质量差导致无法分析。临床资料包括患者性别、年龄、主诉、肿瘤标志物(甲胎蛋白、癌胚抗原、CA125、CA19-9、CA72-4、CA242)、术前诊断、手术方式及病理诊断等。4例患者均行胰腺CT平扫及增强扫描、上腹部MRI及全身PET/CT检查。本研究经本院伦理委员会批准(2022-149-01),豁免患者知情同意。
1.2 影像学检查
1.2.1 CT检查 采用GE Lightspeed 64、GE Discovery HD 750多层螺旋CT扫描仪,扫描范围从膈顶至双肾下缘,管电压120 kV,自动调制管电流,扫描层厚/层间距5.0 mm,螺距1.25,视野350 mm×350 mm,矩阵512×512,重建层厚/间隔1.25 mm。增强扫描经肘静脉团注碘海醇(350 mgI/ml,剂量2.0 ml/kg,速度3.0~4.5 ml/s),分别于注射后35~45、60~70、180 s扫描得到动脉期、门静脉期和延迟期图像。
1.2.2 MRI检查 采用Philips Ingenia CX 3.0T超导型MRI仪,呼吸门控及16通道相控阵线圈,扫描序列:屏气冠状位T2WI,TR/TE 515/70 ms,层厚/层间距5/1 mm;呼吸触发横轴位T2 SPAIR,TR/TE 724/70 ms,层厚/层间距5/1.5 mm;自由呼吸横轴位扩散加权成像(DWI),b=0、800 s/mm2,TR/TE 515/70 ms,层厚/层间距5/1.5 mm;屏气横轴位mDIXON,包括同相位、反相位、脂相、水相,TR/TE 3.2/1.5 ms,层厚/层间距4.4/-2.2 mm;3D磁共振胰胆管成像(magnetic resonance cholangiopancreatography,MRCP),TR/TE 2 500/556 ms,层厚/层间距2/-1 mm。
1.2.3 PET/CT 成像平台为Philips Gemini GXL 16 PET/CT,静脉注射18F-FDG 5.18 MBq/kg,静息60 min后进行显像。PET扫描视野256 mm,矩阵128×128,层厚2 mm,采集8~10个床位,每个床位2 min。CT扫描管电压120 kV,管电流150 mA,层厚5 mm,螺距0.938,采用3D LOR-RAMLA方法获得重建后的图像,层厚5 mm。
在后处理工作站选择重建后图像,重建图像以横断面、冠状面、矢状面和三维容积像方式显示。
1.3 影像分析 由2名主治医师知晓病理诊断后共同阅片,并经讨论达成一致。CT重点分析病灶的部位、大小、形态、强化方式以及周围血管情况。MRI重点分析病灶的信号特点、胰胆管改变。PET/CT重点评估淋巴瘤的累及范围,并测量病灶的最大标准化摄取值(SUVmax)。
2 结果
2.1 临床资料 4例中,1例黄疸、1例体检发现胰腺占位、1例左上腹痛、1例右上腹痛。术前血清肿瘤标志物检查仅1例黄疸患者CA19-9升高(35.9 U/ml,正常范围0~27 U/ml)。治疗:胰十二指肠切除术1例(黄疸患者)、开腹手术活检1例、超声内镜引导下细针穿刺吸取术2例。病理结果:弥漫大B细胞淋巴瘤3例,低级别滤泡淋巴瘤1例。4例后续均于血液科接受化疗,其中1例同时接受放疗,均部分缓解。
2.2 影像学表现 病灶位于胰头3例,胰体尾1例。病灶长径5.2~11.4 cm。CT平扫均呈低密度,增强扫描轻中度较均匀强化,1例病灶内见不强化坏死区,4例血管重建病灶均包绕周围血管,包绕动脉未见明显狭窄,2例受累静脉狭窄。病灶MRI T1WI呈低信号,T2WI呈稍高信号,DWI呈明显高信号,MRCP显示胆胰管扩张1例。淋巴结肿大2例,肿大淋巴结密度、信号较均匀。4例均在手术后1个月内接受PET/CT检查,2例病灶局限于胰腺及周围间隙,1例胰周多发淋巴结受累,1例存在远处(盆腔、纵隔、左锁骨上)播散,SUVmax为9.2~21.3。
2.3 术前影像诊断 术前影像正确诊断淋巴瘤2例,表现为胰头部软组织肿块向外生长,1例包绕下腔静脉(图1),1例包绕胰十二指肠动脉,脾静脉-门静脉汇合部狭窄(图2);术前影像误诊为胰腺癌1例,表现为胰腺体尾部肿块,包绕周围腹腔干及脾动脉,脾静脉狭窄闭塞,同时病灶内存在小片坏死,腹膜后多发肿大淋巴结;术前影像误诊为肿块型胰腺炎1例,表现为胰头部弥漫浸润,肝总动脉及门静脉主干局部受包绕,未见明显狭窄变形,肝内外胆管显著扩张,胰体尾部胰管轻度扩张,胆总管下端及头部胰管鸟嘴状狭窄,见胰管穿通。
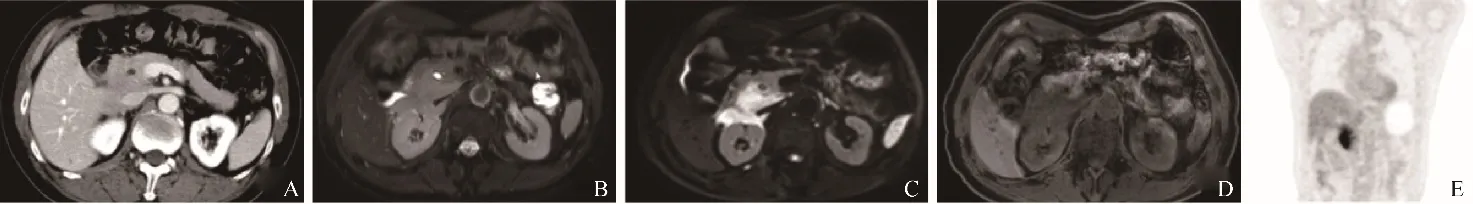
图1 男,67岁,PPL。CT增强扫描静脉期显示胰头肿块均匀中度强化,向腹膜后浸润生长包绕下腔静脉(A);MRI示胰头区肿块T2WI呈稍高信号(B),DWI(b=800 s/mm2)呈明显高信号(C),T1WI呈低信号(D);术前影像诊断淋巴瘤,活检术后4周PET/CT显示病灶局限于胰腺及其周围(E),SUVmax为10.5

图2 女,58岁,PPL。CT增强扫描静脉期显示胰头肿块中度均匀强化,内见血管穿行(A),静脉期最大密度投影图像显示胰头周围动脉走行自然,脾静脉-门静脉汇合部狭窄(B);DWI(b=800 s/mm2)呈明显高信号(C),胰胆管受压改变(D),术前诊断淋巴瘤,活检术后2周PET/CT显示病灶主体位于胰腺,同时腹腔及腹膜后多发高代谢灶(E),SUVmax为21.3
3 讨论
3.1 PPL的临床表现 PPL好发于中老年男性,肿瘤标志物CA19-9、癌胚抗原均可正常,发生胆道梗阻时部分患者CA19-9可有轻度升高[2-3],病理类型倾向于B细胞表型的非霍奇金淋巴瘤,弥漫性大B细胞淋巴瘤是最常见的组织学亚型[4-6]。本组中2例为老年男性,1例阻塞性黄疸患者出现CA19-9轻度升高,3例为弥漫大B细胞淋巴瘤,与报道基本一致。
3.2 PPL的影像表现 本组中3例发生于胰头,Mishra[2]亦报道PPL胰头高发,考虑与胰头存在较多淋巴组织有关。PPL体积通常较大,本组病灶长径均>5 cm。同其他部位的淋巴瘤类似。PPL密度及信号较均匀,CT平扫呈稍低密度,MRI T1WI呈低信号,T2WI呈等或稍高信号,DWI呈明显高信号,轻-中度渐进性强化,坏死囊变少见。此外,淋巴瘤还存在比较特异性的血管漂浮征,即病灶包绕但不侵犯邻近大血管[1,7-9],本组中包绕的动脉均可见此征象,但2例受累静脉出现狭窄,考虑与静脉张力较低、管壁较薄有关。PPL通常无胆胰管扩张[8-9],本组中仅1例胰头弥漫浸润患者出现肝内外胆管及胰管扩张。PPL引起淋巴结肿大多呈轻中度均匀强化[1,8-9],无明显坏死。PET/CT常用于判断淋巴瘤的累及范围,PPL表现为明显的18F-FDG高摄取,本组中2例病灶局限于胰腺及胰周结构,2例有多处累及,但病灶主体位于胰腺,综合考虑为PPL[1]。
3.3 鉴别诊断及误诊分析 PPL需与胰腺癌、肿块型胰腺炎、转移性淋巴结相鉴别,其治疗和预后有很大差异。①胰腺癌:本组1例术前误诊为胰腺癌,肿块内部坏死、脾静脉受累闭塞等征象支持该诊断,但仔细观察发现,脾动脉血管漂浮征、肿大淋巴结强化均匀等征象与胰腺癌表现不符。胰腺癌累及血管的范围通常较小,且管壁多不光整。此外,胰腺癌多伴CA19-9升高,肿块通常较小,形态不规则,边界不清,密度不均,嗜神经和嗜血管生长,胰头癌易侵犯胆胰管引起双管征,较早出现梗阻和腹痛等症状[1,7-9]。PET/CT亦可用于鉴别,PPL的SUVmax通常为7.4~26.5,高于胰腺癌[10]。②肿块型胰腺炎:本组1例术前误诊为肿块型胰腺炎,胰头弥漫浸润肿大、边界不清、渐进性较均匀强化、胰管贯通征、胆总管渐进性狭窄支持肿块型胰腺炎的诊断,该例鉴别较为困难。颜有霞等[11]研究指出PPL的SUVmax显著高于慢性肿块型胰腺炎,可作为鉴别诊断的重要指标。③转移性淋巴结:胰腺周围存在多组淋巴结,该区域较为广泛的淋巴结转移需要与PPL鉴别,通常转移性淋巴结存在原发肿瘤病史,多环状强化,内部坏死液化多见,而PPL多为轻中度均匀强化,较少出现坏死[12]。
PPL的CT、MRI及PET/CT表现具有一定特征性,提高对以上影像学表现的认知有助于术前正确诊断,对临床诊疗具有重要价值。

