SyMRI 定量技术在海马硬化型颞叶内侧癫痫中的应用
王一婷,闫梦楠,摆玉财,李健,熊昱辉,陈兵*
1.宁夏医科大学临床医学院,宁夏 银川 750004;2.宁夏医科大学总医院放射科,宁夏 银川 750004;3.通用电气医疗有限公司,北京 100176;*通信作者 陈兵 Chenbing135501@163.com
癫痫是由于神经元过度活动引起的一过性症状和体征[1],是最常见的神经系统疾病之一,全球有超过7 000万人受到影响[2]。颞叶癫痫是最常见的药物难治性癫痫,其中病灶位于内侧颞叶者为颞叶内侧癫痫(medial temporal lobe epilepsy,MTLE),海马硬化(hippocampal sclerosis,HS)是其主要原因[3]。手术切除致痫灶是MTLE-HS最有效的治疗方法,但术前准确识别HS是目前临床医学亟待解决的难题。MRI常用于诊断HS,然而至少30%的颞叶癫痫患者常规MRI阴性[4],增加了临床诊断的困难。此外,HS的MRI诊断以视觉评估、定性为主,极易受到医师主观性影响,因此其量化诊断尤为重要。
海马分割是研究海马亚区特征的前提,目前普遍依赖人工分割,而非自动分割。同时大多数海马研究均集中在确定总体特征变化上,而非细化到亚区。freeSurfer是基于Linux平台的全免费开源软件,可完成对海马及其亚区的分割,已成为测量神经解剖结构皮质厚度和体积准确且可靠的工具[5]。近年出现的快速多对比度集成磁共振成像(synthetic magnetic resonance imaging,SyMRI)技术又称一站式弛豫定量(magnetic resonance image complication,MAGiC),仅通过一次多动态多回波序列扫描即可以重建出具有多种不同对比度的图像。除常规T1WI、T2WI、PDWI等参数,还可以直接获得反映组织生物物理特性的定量参数,如弛豫时间T1、T2,相应的弛豫率R1、R2及质子密度(proton density,PD)值等[6]。MAGiC技术已应用于颅脑、前列腺、骨骼肌肉等系统的疾病研究,在癫痫的应用较少[7-9]。本研究拟分析SyMRI技术在MTLE-HS各亚区弛豫时间的定量研究价值,以期为临床提供更加可靠高效的影像学依据。
1 资料与方法
1.1 研究对象 前瞻性收集2021年1月—2023年1月宁夏医科大学总医院经MRI诊断(25例)和病理证实(3例)为单侧HS患者28例,男11例,女17例;年龄11~59岁,平均(36.1±14.8)岁;左侧HS 17例,右侧HS 11例。所有癫痫病例诊断标准参考国际抗癫痫联盟2014年诊断标准[10]。同期纳入健康志愿者38例作为对照组,男24例,女14例;年龄9~59岁,平均(29.7±13.9)岁。两组受试者年龄和性别构成差异无统计学意义(t/χ2=1.811、3.688,P均>0.05),具有可比性。
病例组纳入标准:①脑电图显示颞叶发作期或发作间期痫样放电;②有MTLE发作的临床症状;③MRI有单侧HS阳性表现。对照组纳入标准:①无颅脑外伤及中枢神经系统疾病史;②无心血管病史及内分泌疾病史;③神经病学、精神心理医学检查无阳性发现;④常规头颅MRI无异常发现。
排除标准:①神经系统及精神相关疾病;②脑肿瘤、外伤或手术史;③大脑先天性发育畸形、脑血管性疾病等;④年龄>60岁;⑤脑电图信息不完善及MRI图像质量差。
本研究经本院医学研究伦理审查委员会批准(KYLL-2021-0295),受试者均知情同意。
1.2 检查方法 采用GE SIGNA Architect 3.0T 超导MR扫描系统及48通道相控阵头颅线圈。扫描参数:横轴位3D T1WI,TR 8.2 ms,TE 3.4 ms,层厚1.0 mm,层间距1.0 mm,翻转角8°,激励次数1,带宽31.25 Hz;斜冠状位T2WI,TR 2 600 ms,TE 85 ms,层厚2.0 mm,层间距1.0 mm,翻转角111°,激励次数4,带宽50 Hz;MAGiC,TR 4 417 ms,TE 22.9 ms,层厚2.0 mm,层间距0 mm,激励次数1,带宽22.73 Hz。
1.3 图像分析 由2名副高及以上职称放射科医师采用双盲法对所有影像资料进行独立分析,结果不一致时由另一名主任医师重新评估,协商后达成一致。MRI直接征象为海马体积减小、T2信号增高,间接征象为海马内部结构破坏显示不清,可伴有同侧侧脑室颞角扩大、颞叶萎缩等。
1.4 图像后处理 通过freesurfer 7.3.2对3D T1 MPRAGE图像进行海马及其亚区自动分割,使用其截断面作为感兴趣区(ROI),见图1。使用SyMRI StandAlone 8.0.4将MAGiC图像进行后处理得到T1、T2、PD定量图。将定量图与ROI融合(图2),在海马头、体各取一个层面即可自动获取相应层面亚区的T1、T2、PD值。为保证所有受试者ROI位置相对一致,海马头选取所有亚区完全显示后的第3个层面,此层海马头亚区结构显示最典型完整;海马体选取整个海马最中间的层面。此外,受限于软件分割精度,海马角(CA)的CA2始终包含在CA3中。最后,记录每例受试者各亚区的定量参数值,取头、体部测量值的平均值作为最终测量值。对照组最终值取双侧海马测量值的平均值。

图1 男,18岁,左侧HS。A.双侧海马头T1结构像;B.经自动分割后得到的双侧海马头的ROI;C.双侧海马体T1结构像;D.经自动分割后得到双侧海马体的ROI;矢状位图均为左侧海马;图中深蓝色代表下托,红色代表CA1,绿色代表CA3,棕色代表CA4,浅蓝色代表齿状回,紫色代表海马尾

图2 男,18岁,左侧HS。A.从左到右依次为双侧海马头T2、T1、PD定量图;B.双侧海马头ROI与T2、T1、PD定量图的融合图;C.双侧海马体T2、T1、PD定量图;D.双侧海马体ROI与T2、T1、PD定量图的融合图;图中深蓝色代表下托,红色代表CA1,绿色代表CA3,棕色代表CA4,浅蓝色代表齿状回
1.5 统计学分析 应用SPSS 27.0、Graphpad prism 8和MedCalc 20.0.22软件。采用Kappa检验分析2位医师诊断HS的一致性。符合正态分布的计量资料采用±s表示,使用单因素方差分析比较,进一步采用Bonferroni检验进行多重比较;不符合正态分布的计量资料采用M(Q1,Q3)表示,使用Kruskal-WallisH检验比较,进一步采用Bonferroni校正法进行两两比较。对组间差异有统计学意义的参数进行共线性分析,方差扩大因子>10则存在多重共线性问题,采用逐步回归法对共线性变量进行处理后得到显著变量。对显著性参数绘制受试者工作特征(ROC)曲线评价其诊断效能,采用Delong检验比较各参数曲线下面积(AUC)。P<0.05为差异有统计学意义。
2 结果
2.1 一致性分析 2位放射科医师诊断HS的一致性较好(Kappa=0.907,P<0.001)。
2.2 各组间定量参数值比较 HS患侧组、健侧组及对照组亚区各定量参数比较结果见表1。3组间除下托(subiculum,SUB)的T1和PD值差异无统计学意义(P>0.05)外,其余亚区各参数值差异均有统计学意义(P<0.05)。
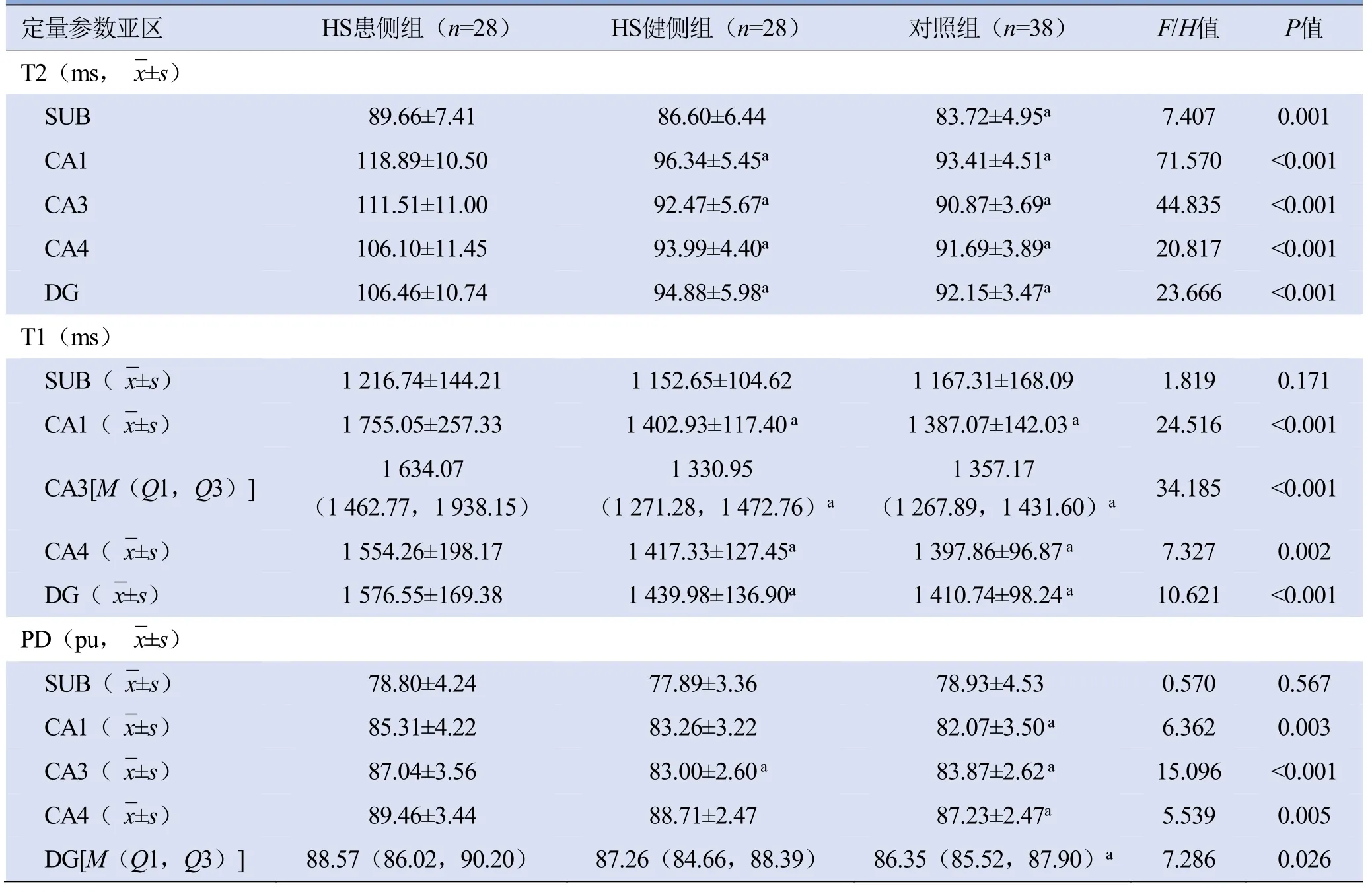
表1 HS患侧组、健侧组及对照组各亚区定量参数比较
进一步组间两两比较结果显示:HS患侧组CA1、CA3、CA4、齿状回(DG)的T2、T1值均高于健侧组及对照组,PD值高于对照组;患侧组SUB的T2值高于对照组,患侧组CA3的PD值高于健侧组,差异均有统计学意义(P<0.05)。患侧组与健侧组SUB的T2值,CA1、CA4 和DG 的PD 值差异均无统计学意义(P>0.05)。健侧组与对照组各亚区各参数值差异均无统计学意义(P>0.05)。
2.3 各定量参数对HS的诊断效能 对组间差异有统计学意义的参数进行共线性分析,采用逐步回归法对共线性变量进行处理,结果显示CA1、CA3、SUB的T2值为显著性变量(模型调整后R2=0.828,F=105.089,P<0.001,方差扩大因子=2.693、2.113、1.721)。对显著性参数绘制ROC曲线评价其诊断效能(表2、图3)。CA1、CA3、SUB区T2值的AUC分别为0.972、0.972和0.752。CA1、CA3亚区T2值的AUC最大,两者差异无统计学意义(P>0.05)。CA1、CA3亚区T2值的诊断效能均优于SUB的T2值,差异有统计学意义(P=0.000 1、P=0.000 7)。

表2 CA1、CA3、SUB亚区T2值对HS的诊断效能

图3 CA1、CA3、SUB亚区T2值的ROC曲线
CA1 和CA3 区T2 值联合诊断HS 的AUC 为1(P<0.000 1),与CA1和CA3亚区T2值的AUC比较,差异无统计学意义(P>0.05)。
3 讨论
HS是MTLE最常见的病理类型,典型的病理学改变为海马区神经元丢失和胶质细胞增生,可能与热性惊厥、外伤、感染、癫痫持续状态及自身免疫、遗传等因素相关[11]。freesurfer是一款MR数据处理软件包,可对高分辨率MRI图像进行分割、配准及三维重建,实现海马及其亚区的自动分割并得到各亚区ROI。基于freesurfer的海马区分割方法对MTLE海马区萎缩更敏感[12]。组织病理学评估和海马体自动分割结果有显著相关性[13]。freesurfer海马自动分割方法近年已应用到颞叶癫痫、阿尔茨海默病等疾病的研究中,具有很好的前沿性、可重复性和可靠性[14-15]。MAGiC技术通过一次多动态多回波序列扫描可以获得组织的弛豫时间和PD等定量信息,扫描时间短,成像速度快。与常规MRI的定性诊断相比,MAGiC定量技术对疾病的评估更加客观与精准[16]。因而可利用MAGiC技术对海马组织进行量化分析。
目前影像科主要由放射医师根据常规MRI图像目测诊断HS,其结果易受到较多因素影响,如扫描设备、序列、参数、受试者个体差异及医师主观因素等,极易漏诊或误诊;同时,常规MRI无法精确到海马亚区,故无法对其进行深入研究。本研究利用海马自动分割技术联合MAGiC技术对MTLE-HS患者海马亚区进行定量分析,与常规MRI的视觉评估、定性分析以及传统的海马手动分割相比,具有较好的客观性和可重复性及更高的精确性、精准度和检测效能。相关研究表明,在MTLE中T2弛豫时间测量等定量成像技术可以提高HS的诊断敏感度[17]。本研究同样发现,HS患侧各亚区的T2值均高于对照组,患侧CA1、CA3、CA4、DG的T2值均高于健侧且有显著差异,表明T2对HS的诊断具有重要临床应用价值。Rodionov等[18]研究中正常海马T2值的上限为109 ms,硬化性海马T2值为109.4~124.4 ms,与本研究结果接近但不完全相同,可能与扫描技术、分割方法及测量精度不同有关。硬化的海马T2值增高是海马皮质锥体细胞缺失及伴有不同程度的星形胶质细胞增生所致。组织T2信号和其水含量密切相关,T2值越高,自由水含量越多。Peixoto-Santos等[19]研究表明,HS患者星形胶质细胞水通道蛋白4过表达和细胞外基质蛋白聚糖增多会影响组织水分子的分布,使海马区水含量增多,进而导致局部T2值增高。此外,本研究中单侧HS患者对侧T2值的变化与Vos等[17]的研究结果一致但精确度更高,进一步提示双侧海马间存在一定程度的相互影响。因此,通过SyMRI技术量化海马亚区T2值对于评估HS是有意义的。2013年,国际抗癫痫联盟依据神经元缺失和胶质增生的亚区部位将HS分为3种类型,该分型与术后疗效相关[20]且依赖术后病理检查,而本研究通过对海马亚区T2值的定量测量,有望实现HS的术前分型及预测手术疗效。
同时,本研究也发现HS患侧组CA1、CA3、CA4、DG的T1值均高于健侧组及对照组,且存在显著差异。Wang等[21]认为,纵向弛豫时间与髓鞘成熟有关。硬化的海马区脱髓鞘与神经元变性会引起T1值变化,表明T1值也可作为HS的定量参数指标。本研究发现HS患侧组CA1、CA3、CA4、DG的PD值高于对照组,CA3的PD值高于健侧组且有显著差异,与课题组既往研究结果存在差异[22-23],可能是测量方法及测量精度不同所致。PD值反映氢质子在脑内均匀、稀疏的分布,在顽固性癫痫的影像学中应用较少,但具有较好的灰白质对比度,能使小的皮质病变与相邻脑脊液形成足够的对比[24]。也有研究表明,T1值和PD值取决于蛋白质、磷脂和脂肪等大分子的浓度,以及水分含量和流动性,所以可以作为中枢神经系统髓鞘降解、轴突丢失、炎症、水肿或基质破坏等微结构改变的敏感指标以及潜在的生物标志物[25],未来仍需进一步探索。
本研究同时分析了显著性变量的诊断效能,发现其诊断效能明显高于本课题组既往未进行分区时得到的AUC,可能与部分区域,如SUB对整体海马的测量值产生中和影响有关。因此,通过对海马亚区弛豫时间的定量研究,有望提高MRI诊断HS的准确度和敏感度,为临床提供更加真实、可靠的数据。
本研究存在一定的局限性:①样本量较小,会使样本数据存在偏倚,需要纳入更多病例以减小误差;同时由于样本量偏小,未研究海马萎缩程度不同对结果的影响。②缺乏足够的病理结果支持,无法保证所有样本的影像诊断与病理结果一致,后续将加强多学科合作,纳入更多经病理证实的样本数据以验证本研究结果。③因经术后病理证实的HS样本量偏小,未对HS进行分型,后续将纳入更多样本以阐明不同分型对结果的影响。④由于分割软件的精度限制,无法进行CA2及海马尾的分割,影响了测量的精度。⑤单独使用一种技术诊断效能有限,后续会探索联合2种或者2种以上成像技术对HS的诊断价值,以期实现优势互补。
总之,本研究采用SyMRI技术定量测量海马亚区组织的弛豫时间,发现CA1、CA3区T2值可有效提高HS的诊断效能,提示该技术可在HS术前评估中发挥重要作用,对诊断和定侧有一定的应用价值。

