从胰管改变谈胰腺疾病的诊断
邵成伟
海军军医大学第一附属医院放射诊断科,上海 200433
【提要】 胰管犹如树叶的叶脉贯穿于整条胰腺,因此胰腺的疾病极易累及胰管,甚至起源于胰管,从而导致胰腺内外分泌功能不同程度的受损。深入认识和正确诊断胰腺疾病,就需要对胰管的正常解剖和病理改变有深刻了解。本文以胰管为中心,对胰腺各类疾病展开阐述。
胰管犹如树叶的叶脉贯穿于整条胰腺,因此胰腺的疾病极易累及胰管,甚至起源于胰管,从而导致胰腺内、外分泌功能不同程度的受损。深入认识和正确诊断胰腺疾病,就需要了解胰管的正常解剖和病理改变。
一、胰管的解剖与组织学
胰管分为主胰管(main pancreatic duct)和副胰管(accessory pancreatic duct)。主胰管通常称胰管(pancreatic duct),在胰腺实质内,从胰尾起始自左向右穿过胰体,约在胰体上下缘中间稍偏后的胰实质内穿行,至胰颈处则向下、向后、向右达十二指肠降部内侧壁处与胆总管并行一段,位于胆总管之左、内后下方,胰管与胆总管一起斜行穿十二指肠壁,末端管径缩窄,而后与胆总管汇合[1]。胰管平均长13.8 cm(8.2~19.1 cm),管径从左向右逐渐增大,尾端管径平均为0.2 cm,头端管径平均0.4 cm。胰管有两个生理狭窄区,分别在头体交界处和胰体中1/3处。胰管在胰尾、胰体内行程中有15~20对小的分支胰管呈直角汇入。这些小支主要有头上支、头下支(即钩突支)、体上支、体下支、尾上支和尾下支(图1A)。
显微镜下胰腺无纹状管,闰管逐渐汇合形成小叶内导管,后者被覆小立方形细胞,其胞质淡染,小叶内导管周围可以是致密的腺泡也可以是薄层纤维组织。这些小叶内导管与更大的小叶间导管(图1B)相延续,后者被覆分泌黏液的柱状细胞。主胰管和副胰管除了有更多的杯状细胞外,其细胞成分与小叶间导管相似。从小叶内导管至主导管(胰管),管腔逐渐增大,单层立方上皮变为单层柱状上皮,主导管为单层高柱状上皮,上皮内可见杯状细胞,并有散在的内分泌细胞。有的导管上皮细胞还具有分泌水和电解质的作用[2]。

图1 胰管各级胰管命名(1A);胰腺小叶间导管管径较大,内衬分泌黏的柱状细胞,周围围绕较宽的纤维组织(1B,HE染色 ×200)
二、胰管的成像技术
多排螺旋CT(multidetector computed tomo-graphy, MDCT)、磁共振胰胆管成像(magnetic resonance cholangiopancreatography,MRCP)、内镜逆行胰胆管造影(endoscopic retro-grade cholangio-graphy,ERCP)和内镜超声(endoscopic ultrasono-graphy,EUS)检查均能很好地显示胰管,为临床诊治提供重要依据。其中,MDCT后处理技术中的曲面重建(curved planar reformation,CPR)技术,可以沿着主胰管走向进行重建,能将弯曲的主胰管在一个平面上完整、清晰地显示,有助于展示胰管的全貌[3](图2A)。MRCP属于重T2WI的一种成像,可清楚显示胰管胆管及其分支结构,是临床上非常实用且效能良好的一种无创检查技术[4]。MRCP有3类成像方法:三维容积采集、二维连续薄层扫描和二维厚层块投射扫描。配合呼吸触发技术的三维容积采集可获得较多的薄层(1 mm)原始图像,有助于管腔内小病变的显示,图像可进行各种后处理,并且重建图像效果好(图2B)。缺点是扫描时间相对较长,如果呼吸运动不均匀,图像质量不理想。二维连续薄层扫描的优点在于可以获得相对薄层(3~4 mm)的图像,采用屏气扫描,图像质量不受呼吸运动影响,但因有层间隔及层厚不够薄,通常不能重建高质量的三维图像。二维厚层块投射扫描对厚度为2~10 cm的容积进行厚层块激发和采集,一次扫描得到一幅厚层块投射图像(图2C)。该方法优点在于扫描速度快,一幅图像仅需1到数秒,管道结构连续性好,无阶梯样伪影。缺点是图像不能进行后处理,不能获得薄层的原始图像,容易遗漏小病变。由此可见上述3种方法各有优缺点,两种以上方法结合使用会获得更好的诊断效能。胰泌素增强MRCP(secretin-enhanced magnetic resonance cholangio-pancreatography,S-MRCP)借助于胰泌素刺激富含碳酸氢盐的胰液分泌提高胰管的可视化程度[5]。S-MRCP较广泛地运用于胰腺外分泌功能的评价和早期慢性胰腺炎的诊断。
ERCP属有创性检查,显示胰胆管细节最优,但不能直接显示胰腺实质、病灶边缘等形态改变,且有一定的严重并发症(如胰腺炎)发生率。EUS显示胰头和胰体、尾部需分别在十二指肠和胃内分段显示,发现病灶时可穿刺获取组织学特征,但易漏检胰腺头体交界处的病灶,易将胰管小分支误认为小血管。
三、CP中的胰管改变
CP是一种由遗传、环境等因素引起的胰腺组织进行性慢性炎症性疾病[6],其病理特征为胰腺腺泡萎缩、破坏和间质纤维化[7]。临床以反复发作的上腹部疼痛和胰腺内、外分泌功能不全为主要表现,可伴有胰管结石、胰腺实质钙化、胰管狭窄、胰管不规则扩张、胰腺假性囊肿形成等[7]。CP的胰管改变病理上分为两个阶段。第一阶段:小叶中心发生萎缩和间质纤维化,导致主胰管和分支胰管的弥散性或局限性扩张。这种病理改变发生在早期CP,此时CT和MRI很难显示胰管的改变(图3A、3B),EUS或S-MRCP上可以显示(图3C)。第二阶段:随着病变的进展,胰腺纤维化程度的加重和主胰管内大量结石形成,主胰管上皮发生溃疡和瘢痕形成,此时主胰管呈现出扩张和狭窄交替的“串珠样”改变(图4A、4B)。此阶段影像上胰管粗细不均,节段性狭窄和扩张,主胰管内可见粗大的结石影;同时分支胰管可见扩张,CT上可见点状高密度结石影(图4C)。

图3 男,35岁,轻度慢性胰腺炎患者。3A 横断面胰腺增强MRI门脉期可见胰腺大小、形态显示良好,胰腺实质强化良好,主胰管未见明显扩张;3B 注射胰泌素前主胰管纤细,体、尾部显示欠清,分支胰管几乎不可见;3C 注射胰泌素后,主胰管全程显示清晰,沿着主胰管全程可见多发分支胰管显示

图4 中度慢性胰腺炎导致的胰管扩张。4A 大体标本见胰腺萎缩,分叶状结构消失,主胰管迂回扩张(↑);4B 低倍镜下示胰腺萎缩,间质纤维增生明显,主胰管扩张呈“串珠”样(HE染色 ×10);4C 横断面门静脉期CT图像示胰腺实质萎缩,胰管显著扩张(↑),其内可见高密度结石影和与胰管相通的假性囊肿影(↑)
自身免疫性胰腺炎(autoimmune pancreatitis,AIP)属于一种特殊类型的CP,其病理学特征包括导管周围弥散性淋巴浆细胞浸润(1型)或者中心粒细胞浸润(2型),导管周围及静脉周围弥散性席纹状纤维化和闭塞性静脉炎[8]。导管周围炎细胞浸润主要累及中等或大的小叶间导管,小导管也可受累,受累导管的管腔狭窄且不规则呈海星状(图5A)。影像上一般不能显示小叶间导管,但可出现主胰管弥散性或节段性不规则狭窄,但不截断,上游胰管轻度扩张,称之为胰管穿通征(胰管在病灶区狭窄,但不中断。图5B)。

图5 自身免疫性胰腺炎所致的胰管扩张。5A 低倍镜下示主胰管扩张呈“海星”样周围大量淋巴细胞浸润,胰腺小叶萎缩(HE染色 ×10);5B 二维磁共振胰胆管成像示胰头部主胰管狭窄,但未截断,上游主胰管扩张 图6 胰腺癌所致的胰管扩张。6A 二维磁共振胰胆管造影示胰头部肿块(↑);上游的胰管和肝内外胆管显著扩张,出现典型的“双管征”;6B 横断面CT增强门静脉期图像示胰体尾部肿块(黄↑)导致上游主胰管扩张(白↑)和胰腺实质萎缩
四、胰腺癌和其他肿瘤导致的胰管改变
胰腺癌引起的胰管改变分为两种病理学状态。第一种为经典的胰腺导管腺癌发生理论,即正常导管发展为导管内上皮内瘤变(pancreatic intrae-pithelial neoplasia,PanIN)1~3级,最后发展为胰腺导管腺癌[9]。第二种为胰腺导管腺癌由于具有围管性生长的特点,侵犯和压迫正常胰管,导致胰管扩张。然而,影像上无法区分上述两种病理学过程,影像图像仅仅表现为胰管的截断并上游胰管不同程度的扩张。胰头部的胰腺癌,常引起胆管和胰管同时扩张,出现典型“双管征”(图6A);胰体尾部肿块一般只引起上游胰管的扩张(图6B);部分胰头、胰尾脾门附近的胰腺癌可以无任何胰胆管扩张的表现。当伴存胰腺分裂,即使有胰头癌,但其背侧胰管不一定会梗阻。梗阻扩张的主胰管通常表现为连续性均匀、串珠样和不规则扩张,张力高,甚至可见分支胰管扩张。胆总管的梗阻完全,导致上游肝内外胆管扩张表现为“软藤”状。MDCT和MRCP均可以非常好地显示梗阻点的形态、是否伴有肿块及胰胆管扩张的特征。
胰腺其他肿瘤(如胰腺神经内分泌肿瘤、实性假乳头状肿瘤、浆液性囊腺瘤和黏液性囊腺瘤等)通常压迫病灶区的胰管,影像表现为肿块处胰管狭窄或突然截断,并继发上游胰管扩张,但因肿块质地相对柔软、生长缓慢,上游胰管的扩张程度不如胰腺癌显著(图7)。但是,这些肿瘤引起的胰管改变极少见,甚至临床上因为胰管的改变导致误诊。

图7 胰腺其他肿瘤导致的胰管扩张。7A 胰腺横断面CT增强动脉晚期图像示胰颈部可见一枚环形强化的小肿块(黄↑)导致上游主胰管扩张(白↑)和胰腺实质萎缩,术后病理证实为胰腺神经内分泌肿瘤;7B 胰腺横断面T2WI示胰头部可见一枚以囊性成分为主的囊实混杂信号的肿块(黄↑),肿块上游胰腺萎缩,主胰管中等度扩张(白↑);7C 胰腺横断面脂肪抑制T2WI示胰颈部可见一枚囊性肿块(黄↑)导致上游主胰管扩张(白↑),术后病理证实为浆液性囊腺瘤
五、胰管内肿瘤的胰管改变
胰管内生长或者与胰管相通的病变主要有胰腺导管内乳头状黏液性肿瘤(intraductal papillary mucinous neoplasm,IPMN)、胰腺导管内管状乳头状肿瘤(intraductal tubulopapillary neoplasm,ITPN)和胰腺假性囊肿(pancreatic pseudo cyst,PPC),胰腺神经内分泌肿瘤罕见位于胰管内。上述肿瘤以IPMN最为常见。IPMN是胰腺导管上皮来源的肿瘤,起源于主胰管或其分支胰管的一种产黏液的、以乳头状生长为特征的肿瘤;按其形态分为分支胰管型、主胰管型和混合型,以前两者多见[10]。分支胰管型表现为与胰管相通的“葡萄串状”的囊性病灶,常常伴有上游和(或)下游胰管的扩张;主胰管型IPMN表现为主胰管弥散性或局段性扩张,胰管内可见壁结节;混合型IPMN则兼有二者表现(图8)。ITPN为生长在胰管内、产黏液较少的肿瘤,极罕见。PPC依据与胰管的关系分为与胰管相通和与胰管不相通两类[11],与胰管相通的PPC由于胰管狭窄、结石及蛋白栓阻塞胰管压力增高、胰管破裂所致,极易与分支型IPMN混淆(图4C),此时要结合临床病史进行诊断。

图8 胰腺导管内乳头状黏液性肿瘤导致的胰管扩张。8A 分支胰管型IPMN,高倍镜示分支胰管导管上皮低级别异型增生(胃型),局部呈乳头状结构(HE染色 ×100);8B 为8A同一患者术前影像学图像,二维磁共振胰胆管造影示与主胰管相通的囊性高信号病灶(黄↑),上下游主胰管和分支胰管不同程度扩张;8C 混合型IPMN,图为平行胰管切面的大病理切片,显示囊腔内多发乳头形成,并可见黏液分泌(HE染色 ×10);8D 为图8C同一患者术前影像学图像,横断面脂肪抑制T2WI显示全胰主胰管和分支胰管多发扩张的囊性病灶呈水样高信号
六、从胰管改变出发的胰腺疾病诊断思路
胰管改变影像学上最容易辨认的是胰管扩张,因此从胰管扩张入手诊断较为简单。胰管扩张的标准在不同报道中存在差异,通常影像学检查胰管直径>3 mm即考虑胰管扩张[12],而舒健等[13]认为在MRCP中主胰管直径>3.5 mm诊断为胰管扩张。日本胰腺学会《胰腺癌临床实践指南(2019年版)》[14]中则认为超声提示胰体部主胰管直径>2.5 mm即存在胰管扩张。美国埃默里大学医学院的胰管扩张标准为CT检查示胰头部主胰管直径>3 mm、胰体尾部主胰管直径>2 mm[15]。由此可见目前对于胰管扩张还缺乏统一的诊断标准。
笔者进一步将胰管扩张分为被动扩张和主动扩张。胰管被动扩张几乎全部伴有狭窄,此时将狭窄分为单处狭窄和多处狭窄。胰管单处狭窄以胰腺癌和胰腺其他肿瘤少见表现为主,其次是CP和AIP,而多处狭窄多见于CP和AIP。胰管主动扩张通常由于肿瘤位于导管内或与胰管相通,主要包括IPMN、ITPN和其他肿瘤少见表现(图9)。
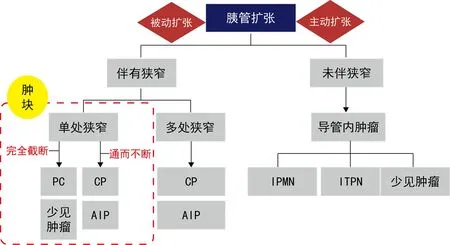
图9 从胰管改变出发的胰腺疾病诊断思路
综上所述,胰管是胰腺解剖的重要结构,胰管改变是胰腺疾病诊断的重要线索。胰管改变原因可以是胰腺内病变也可以是胰腺外病变导致。胰管改变形态可以为扩张、狭窄或者两者同时具备。因此识别胰管改变的影像学特征,并且深刻认识这些影像学特征背后的病理机制,可以提高疾病诊断的准确率,进而为下一步临床治疗方案的制定提供依据。
利益冲突作者声明不存在利益冲突

