自动定量CT影像上肿瘤3D体积术前预测可切除性胰腺癌总体生存期的队列研究
曹凯 李学周 赵冰辉 边云 蒋慧 方旭 李晶 刘芳 陆建平 陈炜
1海军军医大学第一附属医院放射诊断科,上海 200433;2海军军医大学第一附属医院病理科,上海 200433
胰腺癌术前新辅助治疗可显著提高局部晚期、交界可切除胰腺癌患者的生存率[1],故最新指南建议,对于可切除性胰腺癌,可考虑就高危患者进行术前新辅助治疗,但术前高风险特征的定义尚不明确。因此,寻找有效的胰腺癌高危标志物,对于指导可切除胰腺癌是否进行术前新辅助治疗至关重要。CT影像是胰腺导管腺癌(pancreatic ductal adenocarcinoma, PDAC)诊断及可切除性评估最常用的成像方式。近期有研究表明,PDAC肿瘤长径>3 mm与患者术后早期复发密切相关[2]。然而,使用实体瘤疗效评价标准(response evaluation criteriain solid tumors, RECIST)测量的基础是假设肿瘤为球形,以期在 CT影像上对肿瘤最大直径的二维(two-dimensional, 2D)测量可替代肿瘤体积。实际上,这一假设偏理想化,其主要考虑测量的推广、普及、易用性,以及无需专用软件即可快速完成肿瘤直径的测量,但并不能保证总是准确,尤其是PDAC经常表现出肿瘤呈不规则形和各向异性生长。因此,肿瘤三维(three-dimensional, 3D)体积测量通常认为可能比2D测量更能准确可靠地反映肿瘤负荷[3]。尽管如此,肿瘤体积评估在临床环境中缺乏实用性,需要使用专用软件对CT数据进行复杂且耗时的人工后处理。近年来,CT影像中PDAC的自动分割受到关注。本课题组前期开发了一种可自主学习的、泛用性广的、针对多期像CT、基于多中心数据的全自动3D分割工具[4],其对PDAC的分割性能首次达到了人类医学专家的水平。本研究拟在198例可切除性PDAC患者中验证该自动3D分割工具获得的PDAC体积术前预测患者总体生存期的性能,并探讨其对目前常用的术前预后高危因素的补充价值。
资料与方法
一、一般资料和分组
连续收集2018年7月至2019年3月间海军军医大学第一附属医院诊治的198例可切除性PDAC患者的临床资料。入组标准:(1)手术病理确诊为PDAC;(2)术前1个月内有平扫期、动脉期、门静脉期3期增强CT扫描数据。排除标准:(1)已发生远处转移者;(2)进行过术前治疗;(3)术后生存期<3个月;(4)因支架安置或明显运动伪影造成的图像质量下降者;(5)失访者。患者电子病历从医院信息数据系统中回顾性查询。记录患者年龄、性别,有无黄疸或体重减轻,有无吸烟史或饮酒史,血清CA19-9和CEA水平,肿瘤位置及长径,手术切缘是否阳性及TNM分期等。按照血清CA19-9、CEA水平将患者分为CA19-9低水平组(≤210 U/ml)和高水平组(>210 U/ml)[5]、CEA正常组(<5 ng/ml)和升高组(≥5 ng/ml)。通过电话获取患者随访数据,截止时间为术后2年。总体生存期定义为从CT影像检查时间到最后一次随访或患者死亡时间。
二、多期相增强CT扫描方法
CT设备为东芝Aquilion ONE、飞利浦Brilliance iCT和西门子Sensation 64。扫描参数:管电压120 kV,管电流150 mAs,光束准直160 mm×0.5 mm,矩阵350×350,机架旋转时间0.5 s。CT平扫后行动态对比增强扫描。用高速注射器经前臂静脉以5.5 ml/s的注射速率,向患者注射90~95 ml浓度为370 mgI/ml的碘普罗胺(优维显370,德国拜耳先灵葆制药),之后再注射98 ml生理盐水冲洗。注射后20~25 s、35~40 s、60~70 s行动脉早期、动脉晚期和门静脉期对比增强扫描。扫描范围从横膈膜水平延伸至骨盆。图像重建厚度为1.0 mm和3.0 mm。因前期自动3D分割模型训练集为3.0 mmCT数据,故本研究继续采用3.0 mm。
三、全自动3D分割工具
全自动3D分割工具包括多期增强CT配准及PDAC肿瘤分割[4]。全自动流程在配置为Intel Xeon CPU E5-2650 v4和NVIDIA Titan RTX-6000 GPU的服务器上完成。先将CT设备采集到的3期(平扫期、动脉晚期、门静脉期)DICOM格式的图像(图1A~1C)转换为NifTI格式,再采用DEEDS配准算法[6]将平扫期和门静脉期图像配准到动脉晚期(胰腺实质期,为显示PDAC的最佳期相[7])图像(图1D~1F),根据美国国立综合癌症网指南,以动脉期为配准目标。最后将配准后的3期CT图像,运行训练好的UNet模型[4],对PDAC肿瘤及胰腺腺体进行2D(图1G)、3D分割(图1H)。UNet模型是在约1 000例PDAC的多中心CT图像上用自学习方法训练得到,其中205例PDAC由一位18年经验的胰腺影像专家完整地进行3D勾画。该模型全自动分割精确度Dice均值为0.71,首次达到与专家间差异值相当的水平,可视作达到胰腺放射学专家的勾画精度。
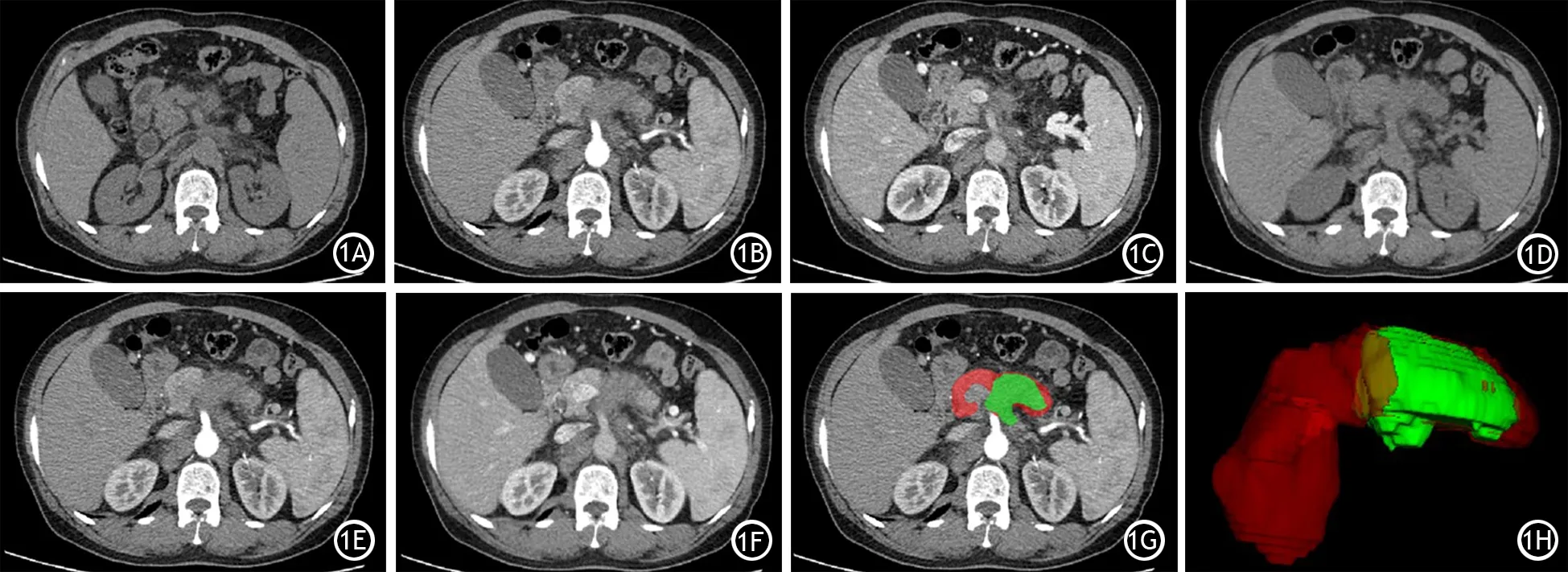
图1 全自动多期增强CT配准及PDAC自动分割工具示意图。输入:原始平扫期、动脉期、门静脉期CT图像(1A~1C);输出:自动配准后的平扫期、动脉期、门静脉期CT图像(1D~1F);输出:自动分割肿瘤的二维图(1G)与三维图(1H),绿色表明勾画的肿瘤,红色表明正常的胰腺
四、统计学处理
使用R软件(3.6.1版本)对数据进行统计学分析。不符合正态分布的计量资料以M(P25,P75)表示,计数资料以例(%)表示 。用Cox比例风险回归模型先行单因素分析,然后将其中P<0.1的单因素纳入多因素分析。用一致性指数(Harrell′s Concordance Index, C-index)评估单因素Cox模型的生存期预测的准确度。使用Studentt检验比较肿瘤体积与其他常用术前指标的预后性能,使用Kaplan-Meier生存分析和Log-rank test确定术前预测指标与总生存期之间的关系。绘制各指标的受试者工作特性曲线(receiver operating characteristic,ROC),计算曲线下面积(areas under the curves,AUC),评估各指标预测患者1、2年总生存期的精确度。P<0.05为差异有统计学意义。
结 果
一、患者的基本信息
198例患者年龄64(56,69)岁,其中82例(41.1%)≥65岁;男性119例(60.1%),女性74例(37.3%);黄疸76例(38.4%),体重减轻97例(49.0%);有吸烟史68例(34.3%)、饮酒史34例(17.1%);CA19-9>210 U/ml 84例(42.4%),CEA≥5 ng/ml 60例(30.3%);肿瘤位于胰头或钩突部117例(59.0%),胰体尾部81例(40.9%);肿瘤3D体积12.12(7.03,17.93)cm3;切缘阳性34例(17.1%);TNM分期Ⅰ期34例(17.1%)、Ⅱ期111例(56.0%)、Ⅲ期53例(26.7%)。中位随访时间为22个月,死亡108例。
二、术前指标预测患者总体生存期的单因素及多因素Cox回归分析
将患者术前指标进行单因素回归分析,结果显示,年龄、肿瘤3D体积、肿瘤部位、CA19-9和CEA水平与总体生存期相关(P值均<0.1,表1)。多因素回归分析结果显示,肿瘤3D体积、CA19-9和CEA水平均与总体生存期相关(P值均<0.05),其中肿瘤3D体积与总体生存期相关性最强(P<0.0001,表1)。
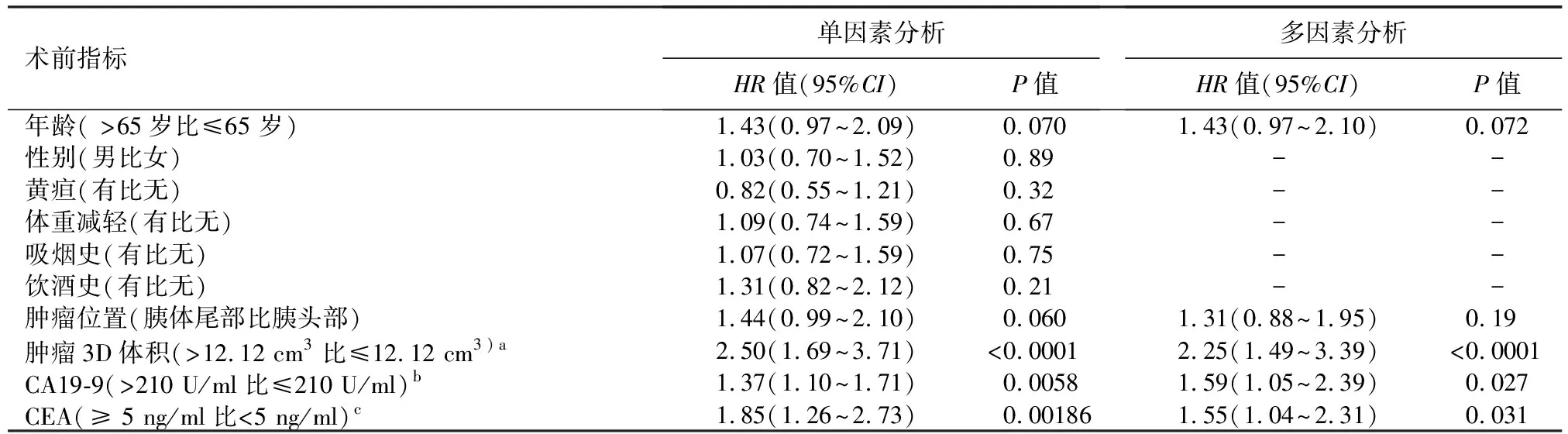
表1 可切除胰腺癌患者术前指标预测总体生存期的单因素和多因素Cox分析
三、肿瘤3D体积与肿瘤部位、肿瘤长径、血清CEA及CA19-9水平预测患者总体生存期的精确度
198例患者通过自动分割模型得到的肿瘤3D体积与其他常用的术前指标,包括CT最大横截面测量的肿瘤长径、血清CEA以及CA19-9水平等预测PADC患者生存期的C-index分别为0.667(0.617~0.717)、0.637(0.583~0.691)、0.593(0.527~0.659)、0.585(0.526~0.644),肿瘤3D体积的C-index显著高于其他常用术前指标,差异均有统计学意义(P值分别为0.0261、0.0275、0.0118)。肿瘤3D体积、肿瘤部位、肿瘤长径、血清CEA及CA19-9水平预测患者1年生存率的AUC值分别为0.726、0.562、0.703、0.583、0.602;2年生存率的AUC值分别为0.698、0.562、0.660、0.624、0.609,肿瘤3D体积的AUC值均为最高(图2)。
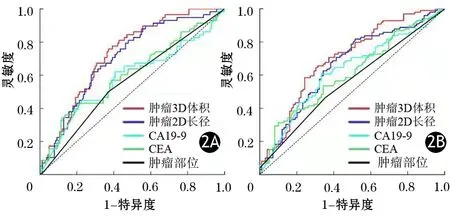
图2 肿瘤3D体积、肿瘤长径、血清CEA及CA19-9水平、肿瘤部位预测胰腺导管腺癌患者1(2A)、2(2B)年生存期的ROC曲线
四、肿瘤3D体积对CA19-9及CEA水平高低组患者总体生存期的影响
CEA、CA19-9低水平组和高水平组患者中,肿瘤3D体积大的患者生存期均显著低于肿瘤3D体积小的患者,差异均有统计学意义(HR=2.27,95%CI1.39~3.72;HR=2.42,95%CI1.23~4.74;HR=2.08,95%CI1.07~4.06;HR=2.67,95%CI1.63~4.38。P值分别为0.00085、0.0084、0.027、<0.0001,图3)。其中肿瘤3D体积大在CA19-9高水平组中对患者总生存期的影响最大。
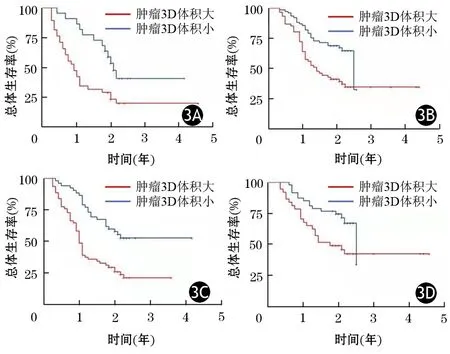
图3 CEA高(3A)低(3B)水平组和CA19-9高(3C)低(3D)水平组中肿瘤3D体积大、小患者的生存曲线
讨 论
随着胰腺癌术前新辅助治疗的开展,其作用也在不断发展。此前的研究表明,术前新辅助治疗能将一些交界可切除甚至局部晚期的PDAC降级到适合手术切除的程度[7-9],从而显著提高手术后患者的总体生存率;而对于可切除的PDAC患者,术前行新辅助治疗并没有延长患者的生存期[8]。因此,NCCN指南建议考虑对可切除胰腺癌中的高危患者进行新辅助治疗。
全自动3D CT影像分割工具无需手工操作,输入原始DICOM格式图像,可直接转换为NifTI格式,再采用DEEDS配准算法将平扫期和门静脉期图像配准到动脉晚期图像,即能直接输出肿瘤3D体积,因此是客观、可重复的,可减少传统2D肿瘤测量时组内(间)的差异性。全自动化3D测量工具作为一个新的生物标志物,能在术前可靠地预测患者总体生存期。本研究用该自动生物标志物将患者预后风险因素肿瘤3D体积及CEA、CA19-9水平分为高、低风险两层,调整后的肿瘤体积高风险较低风险的风险比率(HR)高两倍左右,且在所有分析的术前指标中,是最强预测因子。目前国内外指南多提倡针对病理诊断明确且合并高危因素的可切除胰腺癌患者开展新辅助治疗。已知的高危因素包括CEA或CA19-9显著增高、瘤体较大、区域淋巴结肿大疑似转移、体重显著降低和伴有明显疼痛等。然而,针对上述高危因素,目前尚缺乏一致的量化标准[10]。本研究的自动体积定量分析可能是可切除性胰腺癌术前决策的重要工具,尤其对于CEA≥5 ng/ml、CA19-9>210 U/ml的高危患者,瘤体较大者行新辅助治疗可能更为获益,瘤体较小者,经多学科讨论并综合评估患者意愿、体能状态及实际情况后或许可先行手术治疗。而对于CEA<5 ng/ml、CA19-9≤210 U/ml的低危的胰腺癌可切除性患者是否行新辅助治疗,目前还存有争议,虽然有研究结果显示新辅助治疗有望提高可切除胰腺癌患者R0切除率及降低淋巴结阳性率,但普遍样本量有限,证据等级不高,各研究之间存在异质性[11-13]。另有数据表明,约20%的可切除性胰腺癌患者由于新辅助治疗失败而出现疾病进展,或者体能状态下降,错失手术机会,因而对可切除性胰腺癌患者常规开展新辅助治疗应持审慎态度[14]。本研究的自动体积定量分析,将可切除性胰腺癌患者做了更精准的分层,推荐瘤体较大的患者先开展新辅助治疗,提示预后可能会更好。
本研究结果还显示,在预测总体生存期的性能方面,自动定量的体积优于医师手工2D测量。这也一定程度上反映了2D RECIST标准对于评估形状不规则的胰腺癌肿瘤及评估患者预后的局限性。事实上,肿瘤体积一直以来被认为是更理想的肿瘤负荷评估参数[15]。但要获得肿瘤体积,需要进行繁杂、耗时的手工勾画,且有的肿瘤边界并不好精确定义,这也是肿瘤体积一直未能在临床实践中采用的部分原因。本研究的3D自动PDAC肿瘤分割工具,首次达到了专家医师的水平,有望突破这一应用瓶颈。
本研究也存在一定局限性。首先,采集的验证数据来自跟模型开发集同一个医院,而衡量生物标志物效力的一个重要指标是其泛化能力,因此,需要进行外部多中心验证。其次,此自动工具计算一位患者的肿瘤体积需要约4 min,推进该工具在临床中的使用,需要进一步优化计算时间。最后,肿瘤体积是不可改变的因素,不能直接改善预后,为验证其对指导新辅助治疗的价值,需开展前瞻性临床试验。
总之,通过在独立内部验证集中对所开发的全自动CT影像胰腺癌肿瘤分割工具的验证,证实其测得的肿瘤3D体积可作为一个客观的生物标志物,对胰腺癌预后的预测精确度以及对现有的术前预后风险指标有补充作用。此自动生物标志物的预后精确度C-index为0.667(95%CI0.617~0.717),1年及2年生存预测AUC值为0.726和0.698,在术前常用的指标中为最强的预测因子,有望指导可切除性胰腺癌术前新辅助治疗的选择。
利益冲突所有作者均声明不存在利益冲突

