基于多排螺旋CT影像特征的胰腺腺泡细胞癌与胰腺导管腺癌的鉴别诊断
李琪 赵海燕 李娜 孟英豪 冯小晨 王铁功 曹凯 马超 边云 邵成伟
海军军医大学第一附属医院放射诊断科,上海 200433
胰腺腺泡细胞癌(pancreatic acinar cell carcinoma,PACC)是一种罕见的胰腺外分泌恶性肿瘤,起源于胰腺腺泡细胞,仅占原发性胰腺肿瘤的1%~2%[1]。多数PACC患者的临床表现缺乏特异性,与胰腺导管腺癌(pancreatic ductal adenocarci-noma, PDAC)难以区分[2],但两类疾病在起源、流行病学、治疗和预后方面有着明显的差异。本研究通过对比PACC与PDAC之间的多排螺旋CT(multi-dectector computed tomography, MDCT)影像特征,旨在为两者的鉴别诊断提供精确的影像学依据。
资料和方法
一、一般资料
回顾性分析2013年11月至2021年4月间海军军医大学第一附属医院经手术病理证实的26例PACC(PACC组)和145例PDAC患者(PDAC组)的临床资料。所有患者在1个月内均行 MDCT。排除标准:(1)MDCT扫描前接受过放疗、化疗或放化疗患者;(2)图像质量不佳、无法进行评估者。
二、CT扫描方法
采用640层CT(Aquilion ONE,日本佳能医疗)和256层断层CT(Brilliance iCT,美国飞利浦医疗)行螺旋扫描。扫描参数:管电压120 kV,管电流150 mAs,准直100 mm×0.5 mm,矩阵350×350,旋转时间0.5 s。平扫结束后行动态增强CT扫描。对比剂碘普罗胺(优维显370,德国拜耳先灵葆雅制药)注射剂量为90~95 ml(355 mgI/ml),流率5.5 ml/s,注射结束给予98 ml生理盐水冲洗。3期增强分别为动脉期(20~25 s)、门静脉期(60~70 s)、延迟期(110~130 s)。扫描层厚/层间距为0.8/1.0 mm。扫描范围从横膈膜水平到肾脏下缘水平。
三、CT图像分析
对两组患者肿瘤的以下11个指标进行评估:(1)肿瘤位置(胰头、胰颈或胰体、胰尾);(2)肿瘤大小(最大横截面直径)[3];(3)主胰管扩张(直径≥3 mm);(4)胆总管扩张(直径≥10 mm);(5)胰腺炎(肿块导致的阻塞性胰腺炎,CT表现为肿块周围或上游胰腺周围渗出,肾周筋膜增厚);(6)淋巴结转移(横断面短轴最大径≥10 mm)[4];(7)囊肿(潴留囊肿或假性囊肿);(8)实质萎缩(去除胰管后胰腺前后径<15 mm[5]);(9)侵犯十二指肠;(10)侵犯胆总管(肿块与十二指肠或胆总管分界不清);(11)血管侵犯(血管狭窄或闭塞,或血管与肿瘤接触面≥180°)。
四、病理图像分析
所有病理结果均来源于病理学报告,采集的内容包括肿瘤TNM分期、切缘、胆总管有无侵犯、十二指肠有无侵犯[6]。
五、统计学处理
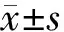
结 果
一、PACC组与PDAC组患者临床参数及病理学特征比较
PDAC组男性81例,女性64例,年龄(62±10)岁,体重指数(22.6±3.0)kg/m2;PACC组男性17例,女性9例,年龄(55±13)岁,体重指数(22.7±3.2)kg/m2。
肿瘤T分期:PDAC组T1期21例(14.5%),T2期92例(63.4%),T3期28例(19.3%),T4期4例(2.8%);PACC组T1期3例(11.5%),T2期9例(34.6%),T3期14例(53.9%)。N分期:PDAC组N0期34例(23.5%),N1期71例(49.0%),N2期40例(27.6%);PACC组N0期15例(57.7%),N1期4例(15.4%),N2期7例(26.9%)。胆总管侵犯:PDAC组49例(33.8%);PACC组3例(11.5%)。十二指肠侵犯:PDAC组66例(45.5%),PACC组6例(23.1%)。切缘阳性:PDAC组93例(64.1%),PACC组5例(19.2%)。PACC组与PDAC组患者的年龄、T分期、N分期、胆总管侵犯、十二指肠侵犯、切缘阳性差异均有统计学意义(P值均<0.05)。
二、PACC组与PDAC组MDCT影像特征比较
PACC组与PDAC组患者的肿瘤大小、胆管扩张、淋巴结转移、实质萎缩、血管侵犯差异均有统计学意义(P值均<0.05,表1)。典型PACC的MDCT影像特征表现为肿瘤体积大,边界清楚,胰管轻度扩张,十二指肠、胆管及血管未受到侵犯(图1);典型PDAC的MDCT影像特征表现为肿瘤体积不大,但胰腺实质明显萎缩,胰管、胆管明显扩张而成双管征(图2)。

图1 患者,男,39岁,上腹部不适1月余,术后病理为胰腺腺泡细胞癌。CT平扫示胰头部一最大径约12.5 cm肿块(↑,1A);增强CT动脉期示肿块轻度不均匀强化(↑,1B),十二指肠及血管未受侵犯(1C);胰体尾胰腺实质萎缩,胰管扩张(↑,1D)

图2 患者,男,腹胀呃逆15 d,术后病理为胰腺导管腺癌。增强CT动脉期示胰头钩突部一低密度肿块影,最大直径约2.3 cm(↑,2A);门静脉期示胰体尾胰腺实质萎缩(2B),主胰管扩张(↑,2C),胰周散在小淋巴结(↑,2D)

表1 26例胰腺腺泡细胞癌患者和145例胰腺导管腺癌患者多排螺旋CT影像特征比较
三、PACC组与PDAC组MDCT影像特征的单因素和多因素logistic分析
单因素回归分析显示,肿瘤大小(OR=1.05,95%CI1.02~1.08)、胆总管扩张(OR=0.34,95%CI0.12~0.94)、淋巴结转移(OR=0.17,95%CI0.06~0.45)、实质萎缩(OR=0.18,95%CI0.07~0.45)和血管侵犯(OR=0.29,95%CI0.12~0.69)与PACC呈显著相关(P值均<0.05)。多因素回归分析显示,肿瘤大小、淋巴结转移和实质萎缩与PACC呈显著相关(P值均<0.05,表2)。

表2 胰腺腺泡细胞癌与胰腺导管腺癌的多排螺旋CT影像特征的多因素回归分析
讨 论
PACC和PDAC在临床表现和影像学特征上有较多重叠,如腹痛、黄疸、肿瘤标志物升高、胰腺内边界欠清的肿块等,且PACC发病率低,因此PACC常被误诊为PDAC。但是,两者在起源、流行病学、治疗和预后方面却有着明显的差异。PACC起源于胰腺外分泌腺腺泡细胞,PDAC起源于导管上皮细胞。PACC相对于PDAC恶性程度明显降低[7],预后也较PDAC好[8-10],5年生存率为25%~50%。此外,目前治疗PACC的方法与PDAC大致相同,主要是手术切除,但淋巴结的清扫范围、化疗方案则与PDAC不同[11]。所以术前正确鉴别PACC和PDAC具有很大的临床价值。
目前PACC术前诊断最准确的方法是超声内镜检查,但其价格昂贵,取材量小,有导致急性胰腺炎的风险[12-13],作为诊断性的常规检查并非为最佳手段,而CT检查在临床中广泛应用,近年来多篇文献报道了PACC影像学特征。肿瘤体积大是PACC的特征之一[14]。Zong等[15]回顾分析了306例PACC患者,发现肿瘤大小中位数为50 mm。Schmidt等[16]回顾了美国1985年至2005年间865例PACC患者,发现肿瘤大小中位数为59 mm。本研究中76例PACC患者的肿瘤体积平均为46 mm,较之前报道略小,可能与现在医疗条件改善和健康体检的普及,更多PACC得以早期发现有关。PACC的体积较PDAC体积大的可能原因为PACC细胞成分多、纤维间质成分少、质地柔软[17]且膨胀性生长[18],而PDAC为富含纤维间质[19],边界不清且质地较硬[20],所以PACC体积较小时临床症状不明显,容易被患者忽视。胆管扩张在鉴别PDAC与PACC中有一定价值。Tatli等[21]发现PACC中胆管扩张比例为30%,Raman等[22]报道,即使肿瘤位于胰头或钩突,胆管扩张比例也仅为14%。本研究胆管扩张比例为19.23%,与文献报道类似,原因可能为PACC起源于腺泡细胞,而非导管上皮[23]。目前CT评估的转移性淋巴结无法和病理评估的淋巴结一一对应[24]。本研究以短轴最大径≥10 mm为转移性淋巴结,所得出的MDCT评估转移性淋巴结比例均低于病理评估淋巴结比例。笔者推测,<10 mm的淋巴结也可能为转移性淋巴结。PDAC组MDCT评估淋巴结转移比例高于PACC组,也反映出PDAC恶性度高,易于早期转移[25]。胰腺实质萎缩也是鉴别PACC与PDAC的一个特征。在PDAC中,导致胰腺萎缩的原因可能为肿瘤直接压迫,也可能为胰腺癌前病变引起,如胰腺上皮内瘤变[26]、胰腺导管内乳头状黏液性肿瘤[27],而PACC质地柔软[17],其压迫程度低于PDAC,所以实质萎缩比例较低。血管侵犯在PDAC中常见[28],而PACC膨胀性生长且经常可见包膜[21],包膜阻碍了肿瘤对周围组织的侵犯,所以血管侵犯比例也明显低于PDAC。
Raman等[22]认为,胰腺肿块体积大、外生性生长、包膜强化、胰胆管不扩张可以鉴别PACC和PDAC,但作者没有给出各项特征的权重系数,临床中难以实践。笔者进一步将5个差异有统计学意义的CT特征(肿瘤大小、胆管扩张、淋巴结转移、实质萎缩和血管侵犯)进行多变量回归分析,结果显示肿瘤大小(OR=1.07,P=0.001)、淋巴结转移(OR=0.23,P=0.02)、实质萎缩(OR=0.15,P=0.002)与PACC显著相关,提示以上3个变量可以预测PACC。
本研究还存在以下一些缺陷。首先,本研究为单中心研究,加上PACC为罕见病,样本量较小,未能建立诊断模型;其次,本研究仅针对PACC和PDAC两类胰腺癌。虽然这两类胰腺癌在胰腺恶性肿瘤中较为常见,但是在临床诊断中,PACC与胰腺神经内分泌肿瘤、实性假乳头状肿瘤之间也会产生误诊;最后MDCT评估的转移性淋巴结无法和病理评估的淋巴结一一对应,所以MDCT评估淋巴结的可靠性有待商榷。
综上所述,MDCT评估的肿瘤大小、胆管扩张、淋巴结转移、实质萎缩、血管侵犯在PACC与PDAC的鉴别诊断中有一定价值,其中肿瘤大小、淋巴结转移、实质萎缩是诊断PACC的独立预测因素。
利益冲突所有作者均声明不存在利益冲突

