钆塞酸二钠增强MRI 对不典型肝脓肿与单发肝转移瘤的鉴别诊断
何旭,韩鼎盛,黎雅琳,张嘉诚,黄婷婷,周彦汝,张岚,4*
1.河南中医药大学,河南 郑州 450046;2.河南中医药大学第一附属医院放射科,河南 郑州 450000;3.河南中医药大学第一附属医院MRI 科,河南 郑州 450000;4.河南中医药大学中医药信息智能分析与利用郑州市重点实验室,河南 郑州 450000;*通信作者 张岚 13837187787@163.com
肝脓肿由病原微生物沿肝动脉、门静脉系统和胆管系统感染所致[1],典型的临床表现为发热和剧烈腹痛,影像学征象有蜂窝征、簇形征或花瓣征等[2]。随着免疫缺陷人群的增多和抗生素的广泛运用,肝脓肿以非细菌性感染如真菌、结核分枝杆菌或寄生虫等所致不典型肝脓肿(atypical hepatic abscess,AHA)居多,其典型临床表现少见且缺乏典型的影像学表现,与肝细胞癌、肝内胆管癌和肝转移瘤等的影像学表现存在一定的交叉和重叠[3]。肝转移瘤通常为肝内多发病灶,少数为单发,在原发病灶未明确的情况下,鉴别AHA和肝转移瘤非常困难。在MRI动态增强上,肝脓肿在动脉期表现为脓肿壁的环形强化并持续强化,且多伴有动脉期一过性肝实质异常强化(transient hepatic abnormal enhancement,THAE),而大多数肝转移瘤动脉期表现为环形强化,也可出现病灶周围肝实质的短暂性强化[4-5],因此两者的鉴别诊断具有较大的挑战性。
肝细胞特异性对比剂钆塞酸二钠(gadolinium ethoxybenzyl diethylenetriamine pentaacetic acid,Gd-EOB-DTPA)增强MRI能够同时提供多期动态增强和肝胆期(hepatobiliary phase,HBP)图像,有助于更好地显示肝内病灶和鉴别肝脏病变[6]。本研究旨在探讨Gd-EOB-DTPA增强MRI对AHA与单发肝转移瘤(solitary hepatic metastasis,SHM)的鉴别诊断价值,为临床诊断和治疗提供参考依据。
1 资料与方法
1.1 研究对象 回顾性收集2019年9月—2023年2月河南中医药大学第一附属医院经病理证实的84例AHA和SHM的临床及影像资料。男51例,女33例,年龄32~81岁,平均(56.6±13.8)岁。纳入标准:①术前行肝脏Gd-EOB-DTPA增强MRI(包括动脉期、门静脉期、延迟期及HBP),若患者进行多次检查,仅纳入第一次的Gd-EOB-DTPA增强MRI图像;②肝内单发病灶;③Gd-EOB-DTPA增强MRI检查后1周内经穿刺活检或手术切除病理证实为AHA或SHM;④检查前未接受任何相关治疗,如全身或局部抗生素或抗结核治疗、介入治疗等。排除标准:①肝脓肿形成期,肝组织坏死液化彻底,有明显脓腔形成的典型肝脓肿;②MRI动态增强表现为无强化的病灶;③图像不清晰或存在严重呼吸运动伪影不能用于评估。本研究经本院伦理委员会批准(2023HL-034-01)。
1.2 检查方法 采用Philips Ingenia 3.0T MRI仪及16通道腹部线圈,呼吸触发模式。检查前患者空腹6 h以上,并进行呼吸和屏气训练。使用10 ml Gd-EOBDTPA(显爱,正大天晴药业公司)(0.025 mmol/kg),注射速度1 ml/s,注射完毕后用生理盐水20 ml冲洗。注射对比剂后分别在15~20 s、60 s、180 s、15~20 min扫描双动脉期(连续扫描动脉早期、动脉晚期)、门静脉期、延迟期及HBP。扩散加权成像(DWI)的b值取0和800 s/mm2。扫描序列及参数见表1。
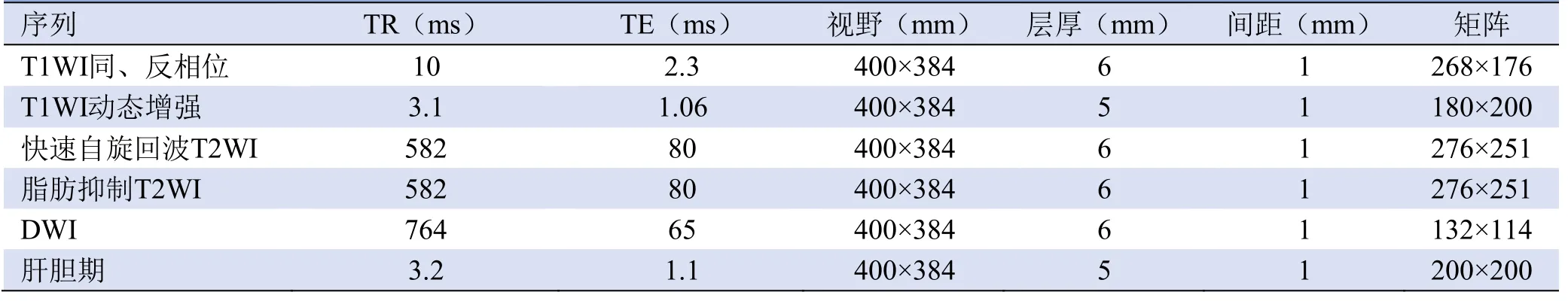
表1 肝脏Gd-EOB-DTPA增强MRI扫描序列及参数
1.3 图像分析 由2名具有5~10年工作经验的MRI诊断医师采用盲法分别阅片,意见不一致时由另一名副主任医师进行判断并达成一致。MRI各序列以周围正常肝实质作为参考,将病灶信号强度定义为高、等和低信号。评估指标包括,①一般特征:形态、最大径;②MRI平扫特征:T2WI病灶呈高信号、T1WI呈低信号;③MRI动态增强表现:动脉期强化方式、强化程度(以大血管强化程度为标准)及THAE;④门静脉期及延迟期强化方式;⑤DWI征象:非环形高信号,定义为病灶整体呈均匀高信号或不均匀高信号,无靶样外观;靶样高信号,定义为DWI病灶中央低信号、边缘高信号;⑥表观扩散系数(ADC)值:在b =800 s/mm2的ADC图中,勾画感兴趣区并测量ADC值(避开病灶内的囊变、出血、液化坏死区,取每个病灶最大截面及其上下层面各测量1次,取3次的平均值);⑦HBP病灶边缘信号特征:于动脉期及HBP,选取病灶最大截面,分别测量病灶最大径,包括动脉期呈环形强化环最大径,以此界定HBP病灶边缘,并以周围肝实质信号为参照,将病灶边缘分为缺损区(与病灶中心低信号区相近或更低)和非缺损区,非缺损区又分为灰色区(比病灶中心高但较周围肝实质低)和摄取区(与周围肝实质信号相近或更高),见图1。
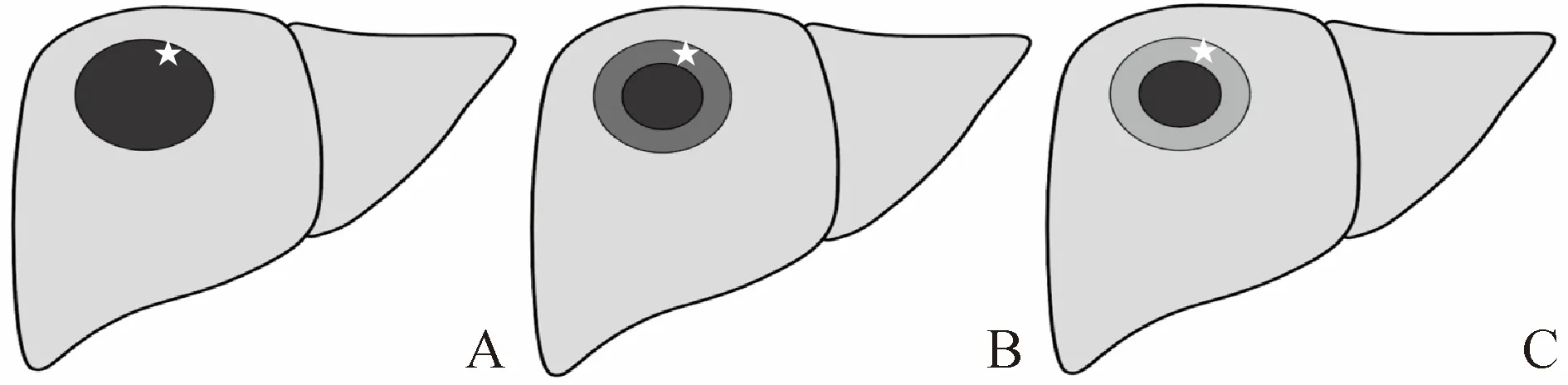
图1 动脉期呈环形强化的病灶根据病灶边缘部分在HBP的表现分类。A.缺损区;B.灰色区;C.摄取区;星号表示病灶边缘动脉期呈环形强化的部分
1.4 统计学分析 采用SPSS 26.0和MedCalc 15.8软件。符合正态分布的计量资料以±s表示,两组比较采用独立样本t检验;计数资料以例数(百分比)表示,组间比较采用χ2检验。将单因素Logistic回归分析中具有统计学意义的变量纳入二分类多因素Logistic回归模型分析,筛选出AHA与SHM的独立预测指标。绘制受试者工作特征(ROC)曲线分析各因素独立及联合预测AHA的诊断效能,并计算相应的曲线下面积(AUC)、敏感度、特异度和准确度,以Delong检验进行AUC比较。P<0.05为差异有统计学意义。
2 结果
2.1 一般特征 AHA组36例,年龄32~81岁,8例伴不同程度的乙型病毒性肝炎肝硬化,临床表现:轻中度发热7例、甲胎蛋白升高(≥7 ng/ml)8例。SHM组48例,年龄26~88岁,7例有乙型病毒性肝炎病史,临床表现:轻度发热4例、甲胎蛋白升高12例。SHM的原发肿瘤包括结直肠癌12例、胰腺癌7例、肺癌5例、胃癌5例、乳腺癌5例、胆囊癌4例、肝内胆管癌2例、壶腹癌2例、食管癌1例、食管下段贲门癌1例、前列腺癌1例、宫颈癌1例、子宫内膜癌1例及卵巢癌1例。AHA与SHM 组患者一般特征差异均无统计学意义(P>0.05),见表2。
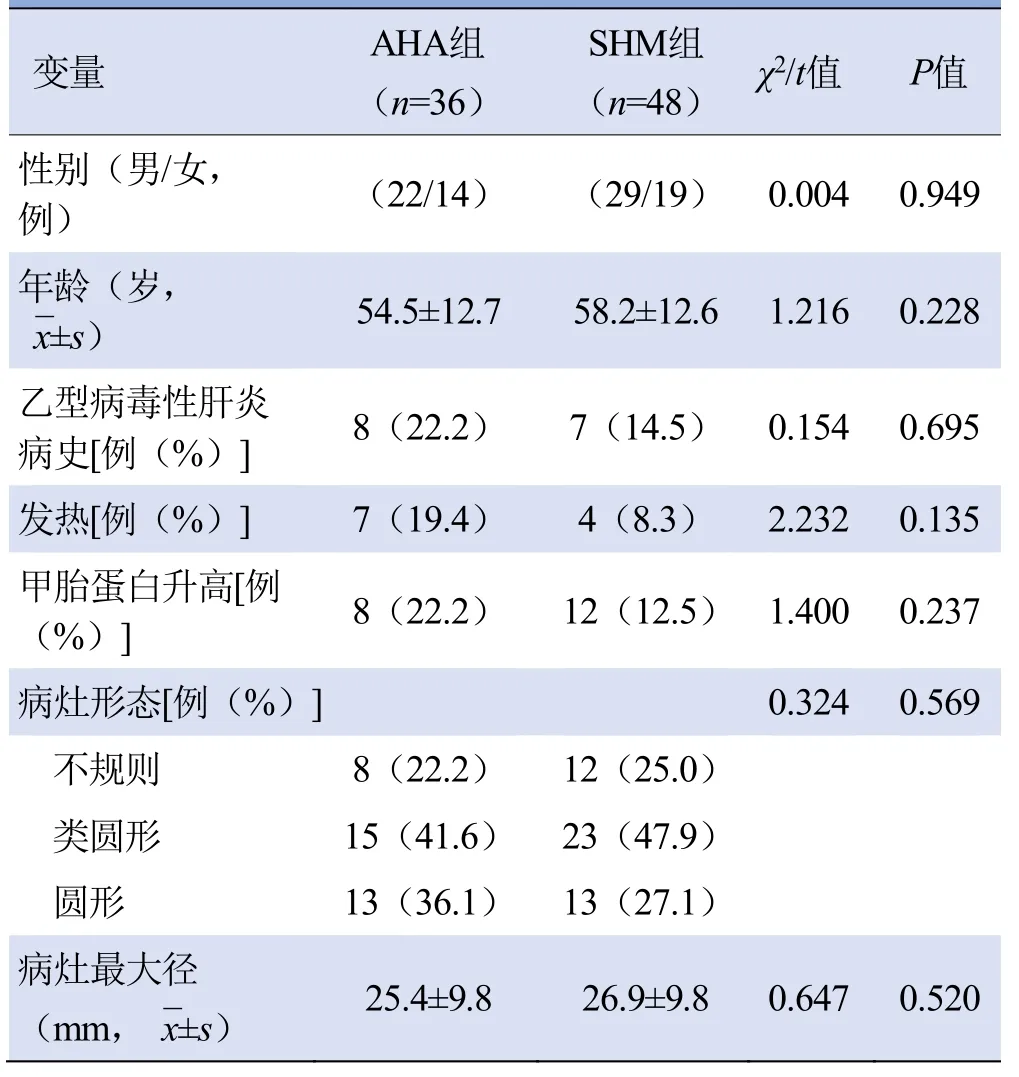
表2 AHA与SHM组患者的一般特征比较
2.2 MRI征象 单因素Logistic回归分析显示:DWI非环形高信号、HBP病灶边缘非缺损区AHA组多见,而DWI靶样高信号、HBP病灶边缘缺损区SHM组多见(P均<0.05),其余指标差异均无统计学意义(P>0.05)。将上述变量纳入二分类多因素Logistic回归分析显示:DWI非环形高信号(OR=5.467,95%CI1.206~24.789)和HBP病灶边缘非缺损区(OR=18.611,95%CI5.254~65.922)是AHA的独立预测指标(图2、3,表3)。

图2 男,70岁,SHM。病灶(箭)位于S8,最大径为10.9 mm。A.T1WI呈稍低信号;B.T2WI呈高信号;C.DWI病灶呈靶样高信号;D.动脉期病灶呈环形强化;E.门静脉期病灶持续强化;F.HBP病灶边缘缺损区:病灶边缘低信号,中央呈相对高信号

图3 男,55岁,AHA。病灶(箭)位于S3,最大径为6.8 mm。A.T1WI呈稍低信号;B.T2WI呈稍高信号;C.DWI病灶呈非环形高信号;D.动脉期病灶呈环形强化;E.门静脉期病灶持续强化;F.HBP病灶边缘灰色区,外周带信号比中心高但较周围肝实质低
2.3 ROC曲线分析 DWI非环形高信号、HBP病灶边缘非缺损区单独预测AHA的AUC分别为0.688和0.819,均低于两者联合的AUC(0.860,Z=2.420、4.143、2.005,P均<0.05);DWI非环形高信号、HBP病灶边缘非缺损区及两者联合指标预测AHA的准确度分别为66.7%、80.9%和83.3%,两者联合后显著提高了AHA的诊断效能(表4)。
3 讨论
肝脏是恶性肿瘤转移最常见的部位之一,任何部位的恶性肿瘤均可经门静脉、肝动脉和淋巴系统等转移至肝脏[7]。而肝脓肿在形成不完全的早期、转入慢性阶段或者吸收好转时影像学征象常不典型,与动脉期强化方式相似的肝转移瘤的影像学表现易重叠或交叉[8]。早期明确诊断对于正确选择治疗方案具有重要的临床价值[9]。本研究通过Gd-EOB-DTPA增强MRI甄别HBP的细微征象,并联合DWI对AHA和SHM进行鉴别诊断。
3.1 AHA与SHM的常规MRI鉴别诊断 DWI是唯一能够检测活体组织内水分子扩散情况的MRI功能成像方式[10],通过测量感兴趣区的ADC值进行量化分析,在鉴别肝脏肿瘤良恶性方面有一定意义[11]。本研究结果表明,SHM的平均ADC值与AHA无显著差异,原因与本组AHA无典型脓腔形成,或AHA处于晚期阶段,组织病理学上以纤维组织为主有关。另一方面,AHA DWI多表现为非环形高信号,而SHM则为靶样高信号,造成DWI表现不一的原因是AHA多由炎症细胞、肉芽组织和蛋白含量较高的浓稠液体组成[12],而SHM病灶中心存在囊变坏死区,DWI以低信号为主,随着肿瘤内细胞密度增加、细胞外间隙变小,富集肿瘤细胞的病灶边缘呈高信号[13],因此SHM多表现为DWI靶样高信号。
AHA与SHM均可表现为动脉期环形强化并持续强化,且多伴有THAE。本研究结果显示,AHA与SHM均有75%出现环形强化。AHA呈环形强化与其病理学特征相关。本组经病理证实为肉芽肿性炎的AHA多由结核分枝杆菌或寄生虫感染引起。结核性肝脓肿由广泛的干酪样变、坏死和肉芽组织组成[14]。寄生虫感染是由虫体引发肝实质发生急性坏死,伴大量炎症细胞、嗜酸性粒细胞、巨噬细胞和淋巴细胞聚集,导致坏死区被纤维组织包裹[15]。肉芽肿性炎由富含炎症细胞、肉芽组织的脓肿壁和中心未完全液化的部分脓腔构成,对比剂在肉芽组织伴纤维化的脓肿壁扩散较缓慢,这是导致AHA出现环形强化且持续性强化的原因[8],而SHM动脉期边缘环形强化与病灶边缘富血供的肿瘤细胞有关[16]。Zhuo等[5]发现AHA出现THAE的概率较高,THAE是AHA的重要征象之一。这是因为AHA通常在脓肿形成早期引起局部门静脉血流减少和代偿性动脉血流增加[4]。而SHM周围出现THAE是由于SHM的占位效应压迫或侵犯门静脉分支,动脉血流代偿性灌注所致,多见于富血供肿瘤的转移灶[17]。因此THAE的出现仅能高度提示AHA的可能性,并不具有特异性。
3.2 Gd-EOB-DTPA增强MRI鉴别诊断的优势 Gd-EOB-DTPA增强MRI可提供反映病灶血供特征的动态增强图像和肝细胞功能情况的HBP图像[18]。本研究结果显示,88.9%的AHA病灶边缘HBP出现非缺损区,包括38.9%的病灶边缘HBP灰色区和50.0%的病灶边缘HBP摄取区。多因素Logistic回归分析显示,DWI非环形高信号以及HBP病灶边缘非缺损区均为预测AHA的独立因素,DWI联合HBP病灶边缘非缺损区可显著提高AHA的诊断效能。AHA病灶边缘由正常功能的肝细胞、肉芽组织和炎症细胞构成,对Gd-EOBDTPA的摄取不受限或轻度受限,与周围肝实质相比HBP病灶边缘呈等或稍高信号[5]。当病灶边缘为富含纤维肉芽组织的脓肿壁时,可引起对比剂的滞留或缓慢清除,因此HBP病灶边缘呈等信号[19];若病灶边缘以炎症细胞浸润为主,常含功能减低的肝细胞,在HBP仍能摄取对比剂,故AHA的病灶边缘可呈稍高信号。此外,极小部分的AHA在HBP病灶边缘出现缺损区,这可能由于感染或炎症导致外周肝细胞或胆管功能受损严重,无法摄取对比剂而在HBP出现缺损区[5]。转移瘤内不含正常功能的肝细胞,而肿瘤细胞无法摄取Gd-EOB-DTPA,因此大多数转移瘤HBP表现为病灶边缘摄取缺陷。Choi等[19]发现78.9%的转移瘤HBP为病灶边缘缺损区或靶征,与本研究结果一致。本组SHM中12例HBP表现为病灶边缘的非缺损区或反靶征,即病灶中心低信号而周围呈相对高信号,多见于消化道肿瘤的肝转移,多由于病灶中心发生液化坏死,HBP呈相对于边缘的更低信号[20-21]。
3.3 本研究的局限性 AHA病例数较少,在后续研究中应进一步扩大样本量进行比较;纳入的AHA以非细菌性感染居多。
总之,Gd-EOB-DTPA增强MRI对AHA与SHM的鉴别诊断具有重要价值,DWI非环形高信号与HBP病灶边缘非缺损区是AHA的独立预测指标,两者联合能够提高AHA的诊断效能。

