氧化胁迫诱导苍白杆菌JP1形成VBNC状态及其特征
陈飞飞, 陈吉祥*, 王永刚, 徐嘉茜, 陈诗源
(1.兰州理工大学 石油化工学院,甘肃 兰州 730050;2.兰州理工大学 生命科学与工程学院,甘肃 兰州 730050)
石油开发及使用过程中造成的环境污染问题日益严重,生物修复技术因对环境友好而成为最具前景的污染治理技术[1]。以石油降解菌为主体的生物修复技术已成为近年研究的热点[2-3]。目前,已有200多种可降解石油的微生物被发现,其中细菌的石油降解效率较高[4-5]。苍白杆菌(Ochrobactrumsp.)存在于多种复杂环境中,能有效降解石油烃等污染物[6-7]。在恶劣的自然环境中,大部分微生物能形成活的非可培养(Viable but non-culturable state,VBNC)状态[8-9]。VBNC状态是指某些细菌在不良环境中形成的一种休眠状态,常规培养条件无法繁殖,但可保持代谢活性[9-11]。研究表明低温、寡营养、抗生素、有毒物质及H2O2等可诱导细菌进入VBNC状态[12-14]。VBNC状态的细胞在适宜条件下复苏为可培养形式[15-17]。氧化应激对大肠埃希菌、芽胞杆菌和沙门氏菌等细菌的作用已被广泛研究[14,18],如低浓度的H2O2会使沙门氏菌进入VBNC状态[19]。目前关于微生物VBNC状态的研究多集中于食品检测、流行病学及公共卫生学等领域的大肠埃希菌、沙门氏菌等菌株,而对污染物环境生物修复领域的微生物,如苍白杆菌研究较少[20-24]。本研究通过不同浓度的H2O2处理苍白杆菌JP1,使其进入VBNC状态,研究苍白杆菌JP1细胞VBNC状态的形成过程,VBNC状态细胞的形态,复苏后苍白杆菌RJP1的生长特性及石油降解能力,有助于进一步探究苍白杆菌在恶劣条件下的存活机制,为石油污染环境生物修复的菌种筛选及应用提供参考。
1 材料与方法
1.1 材料
1.1.1 菌株来源 实验所用的苍白杆菌(Ochrobactrumsp.)JP1分离自西部荒漠地区的石油污染土样。土样溶解后采用LB固体培养基进行菌种初步筛选、原油基础培养基复筛,并将筛得的菌种保藏于兰州理工大学石油化工学院环境生物技术实验室。
1.1.2 培养基(g/L) ①LB培养基:蛋白胨10,酵母提取物5,NaCl 10,琼脂20,蒸馏水1 000 mL,pH 7.0;②基础培养基:NH4NO33,K2HPO41.5,KH2PO41.5,NaCl 0.5,MgSO4·7H2O 0.1,CaCl20.01,FeCl20.01,蒸馏水1 000 mL,pH 7.0。
1.1.3 主要试剂与仪器设备 LIVE/DEADBacLight细菌活力检测试剂盒(生工(上海)股份有限公司),其他试剂均为国产和进口分析纯。紫外分光光度计(UV-2102PC,尤尼柯上海仪器公司);红外测油仪(OIL-460,北京华夏科创公司);激光共聚焦显微镜(FV-2000,奥林巴斯);扫描电子显微镜(JSM-5600LV,日本电子光学公司);透射电子显微镜(HT7800,HITACHI);台式高速冷冻离心机(Neofuge 15R,上海力申科学仪器公司)。
1.2 方法
1.2.1 不同浓度H2O2对苍白杆菌JP1生长的影响 挑取苍白杆菌JP1单菌落接种于装有50.0 mL LB培养基的三角瓶,180 r/min、30 ℃恒温培养至对数期。以1.0%(体积分数,下同)的接种量接种于装有50.0 mL LB培养基的三角瓶,培养至培养液OD600为0.211~0.273,分别添加30.0%的H2O2,使得培养液H2O2的终浓度为0.0、10.0、25.0、50.0和75.0 mmol/L,180 r/min、30 ℃恒温摇床培养;0、6、12、24、36、48 h取样,紫外分光光度计测定OD600,筛选出有效抑制苍白杆菌JP1生长的H2O2浓度。
1.2.2 H2O2诱导苍白杆菌JP1形成VBNC状态 将培养液取出测定OD600为0.211~0.273,添加30.0% H2O2,以有效抑制苍白杆菌JP1生长的H2O2初浓度为实验组,对照组添加同体积无菌水,每组3个平行。分别于0、6、12、24、36、48 h取样,紫外分光光度法测定OD600,平板涂布法对可培养细胞数进行计数,LIVE/DEADBacLight细菌活力检测试剂盒染色,激光共聚焦显微镜观察,通过软件Image J进行总细胞数、活细胞数计数[16]。
1.2.3 细胞形态观察 扫描电子显微镜(SEM)和透射电子显微镜(TEM)观察细胞形态,样品在8 500 r/min、4 ℃下离心10 min后收集细菌沉淀。0.85%无菌生理盐水重悬后离心,重复3次,弃去上清,2.5%的戊二醛固定沉淀。根据Ding等[25]的方法进行扫描和透射电子显微镜分析。
1.2.4 VBNC状态苍白杆菌细胞的复苏 苍白杆菌JP1经H2O2诱导进入VBNC状态后,取5.0 mL菌液10 000 r/min、4 ℃离心5 min,弃去上清,5.0 mL 0.85%生理盐水重悬菌体沉淀。1.0%的接种量接种于装有50.0 mL LB培养基的三角瓶,实验组添加经滤膜除菌的丙酮酸钠溶液,使丙酮酸钠的浓度为50.0 mmol/L,对照组添加同体积无菌水。180 r/min、30 ℃摇床培养,每组3个平行。0、6、12、24、36 h取样,紫外分光光度法测定OD600,平板涂布法计数培养液可培养细胞数。
1.2.5 H2O2处理前后苍白杆菌JP1生长特性分析 将苍白杆菌JP1和复苏后的苍白杆菌RJP1以1%的接种量接入装有50.0 mL LB培养基的三角瓶中,分别于10、20、25、30、35、40和50 ℃,180 r/min培养24 h,测定OD600,确定温度对菌株JP1和菌株RJP1生长的影响;菌株以1%的接种量接入pH分别为4、5、6、7、8、9和10的LB培养基中,180 r/min、30 ℃培养24 h,测定OD600确定pH对细菌生长的影响;以1%的接种量接入NaCl浓度分别为0.0%、0.5%、1.0%、1.5%、2.0%、2.5%和3.0%的LB培养基中,180 r/min、30 ℃培养24 h,测定OD600值,观察NaCl对菌株生长的影响。
1.2.6 石油降解率测定 将苍白杆菌JP1和复苏后的苍白杆菌RJP1以2.0%的接种量接种于含有一定浓度石油的基础培养基中,180 r/min、30 ℃恒温培养7 d。培养液取出后用50.0 mL的四氯乙烯分3次萃取,合并萃取液经Na2SO4(105 ℃烘干48 h)吸收多余水分,转移至容量瓶定容到50.0 mL,红外测油仪测定培养液中的石油浓度,根据公式计算菌株的石油降解率[26]。
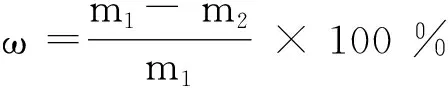
式中:ω:石油降解率(%);m1:培养液的初始石油浓度 (mg/L);m2:培养液的剩余石油浓度 (mg/L)。
2 结果与分析
2.1 不同浓度H2O2对苍白杆菌JP1生长的影响
培养液H2O2终浓度分别为0.0、10.0、25.0、50.0和75.0 mmol/L,培养、取样测定OD600,绘制苍白杆菌JP1在不同H2O2浓度下的生长曲线(图1a)。相比对照组(0.0 mmol/L H2O2),10.0、25.0、50.0和75.0 mmol/L浓度的H2O2均对苍白杆菌JP1的生长有抑制作用。当培养液的OD600为0.222,H2O2浓度为75.0 mmol/L时,明显抑制苍白杆菌JP1的生长。

图1 H2O2诱导苍白杆菌JP1进入VBNC状态Fig.1 Formation of VBNC state of Ochrobactrum sp. JP1 induced by H2O2A:苍白杆菌JP1在不同H2O2浓度下的生长曲线;b:培养液的OD600; c:培养液的可培养数A: Growth curves of Ochrobactrum sp. JP1 under different concentrations of H2O2; b: OD600 of culture; c: Log10cfu/mL of culture
2.2 H2O2诱导苍白杆菌JP1形成VBNC状态
添加H2O2使培养液终浓度为75.0 mmol/L,培养并取样测定OD600、可培养细胞数、总细胞数和活细胞数。对照组(0.0 mmol/L H2O2)培养液的OD600呈现自然生长,实验组(75.0 mmol/L H2O2)培养液的OD600基本维持不变(图1b);培养至6 h时,相对于对照组,实验组可培养细胞数明显下降,12 h时实验组培养液所涂布的LB固体培养基经恒温培养后表面不再有菌落生长,表明苍白杆菌JP1在终浓度为75.0 mmol/L的H2O2下培养12 h会进入VBNC状态(图1c)。
LIVE/DEADBacLight细菌活力检测试剂盒染色后,通过激光共聚焦显微镜观察,活细胞细胞膜完整,染色后为绿色(图2a),细胞膜受损的死细胞染色后为红色;总细胞数、活细胞数基本保持不变,可培养数在培养12 h时降为0 cfu/mL(图2b)。
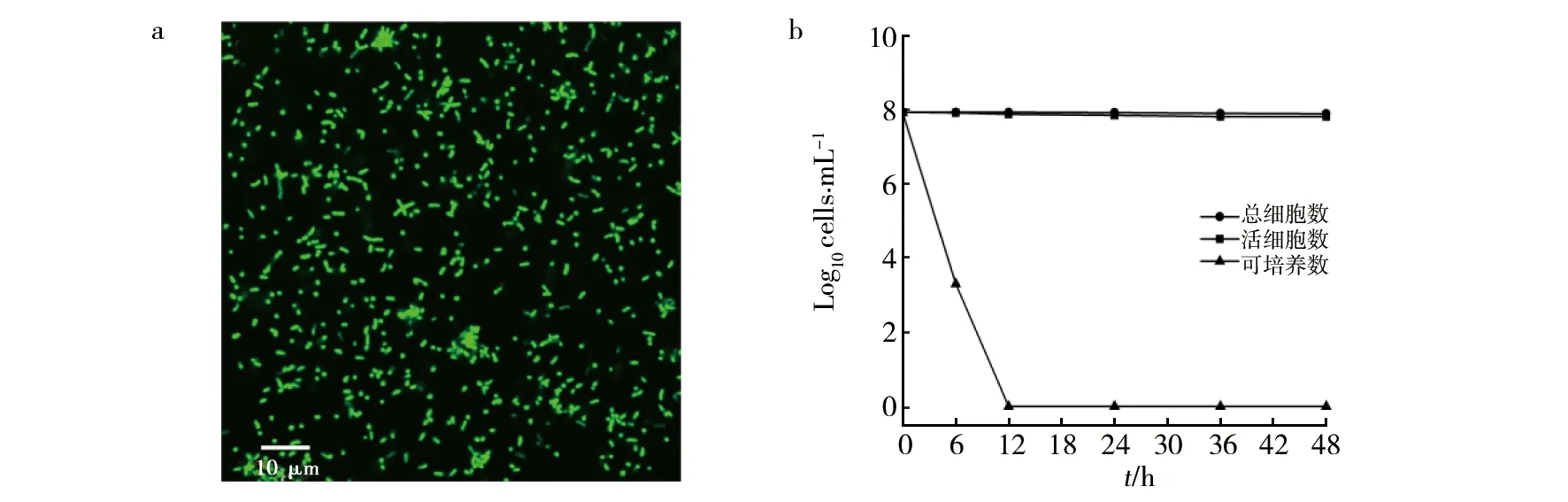
图2 细胞染色及总细胞数、活细胞数和可培养细胞计数Fig.2 Cell staining and total cell count, viable cell count and cultivable cell countA:实验组苍白杆菌JP1活细胞染色图;b:总细胞、活细胞和可培养细胞计数A: Staining picture of live cells of Ochrobactrum sp. JP1 in the experimental group; b: Total cell, live cell and culturable cell counts
2.3 细胞形态观察
扫描电子显微镜观察到未经75.0 mmol/L H2O2处理的苍白杆菌JP1细胞表面光滑饱满,呈杆状(图3a),经75.0 mmol/L H2O2处理的细胞大部分缩小变成球体(图3b)。透射电子显微镜观察到未经75.0 mmol/L H2O2处理的苍白杆菌JP1细胞质分布均匀,细胞壁结构完整(图3c),而经过75.0 mmol/L H2O2处理的大部分细胞发生明显变化,主要表现在周质间隙增大、胞内物质聚集、外漏甚至变成“空壳”,但仍有极少数细胞质均匀分布(图3d)。

图3 苍白杆菌JP1细胞H2O2处理前后的细胞形态Fig.3 Cell morphology of Ochrobactrum sp. JP1 cells before and after H2O2 treatmentA:未处理的细胞-SEM;b:75.0 mmol/L H2O2处理的细胞-SEM;c:未处理的细胞-TEM;d:75.0 mmol/L H2O2处理的细胞-TEMA:Untreated cells -SEM;b:H2O2 (75.0 mmol/L) treated cells -SEM;c:Untreated cells -TEM;d:H2O2 (75.0 mmol/L) treated cells-TEM
2.4 VBNC状态苍白杆菌JP1的复苏
通过离心去除原培养液中的H2O2,将VBNC状态的苍白杆菌JP1细胞接种于LB培养液恒温培养。取样测定如图4a所示,0~12 h,培养液的OD600基本维持不变;12 h以后,培养液的OD600明显增加。培养液中可培养细胞数变化见图4b,培养至6 h,对照组(0.0 mmol/L丙酮酸钠)和实验组(50.0 mmol/L丙酮酸钠)LB培养液中苍白杆菌RJP1的可培养细胞数分别为4 790 cfu/mL和4 820 cfu/mL,随着培养时间的增加,可培养细胞数持续增加。培养至12 h,实验组培养液中的可培养细胞数是对照组的1.6倍,24 h时,实验组培养液中的可培养细胞数是对照组的3.2倍,表明在适宜的生长条件下,移除H2O2胁迫作用后,VBNC状态的苍白杆菌JP1能在较短时间内复苏,恢复可培养性,并且丙酮酸钠对VBNC状态苍白杆菌JP1的复苏具有促进作用。
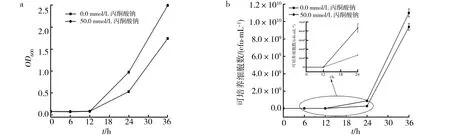
图4 VBNC状态苍白杆菌JP1的复苏Fig.4 The resuscitation of VBNC state Ochrobactrum sp. JP1 A:培养液的OD600;b:培养液的可培养细菌数A:OD600 of the culture; b: The culture numbers
2.5 H2O2处理前后苍白杆菌JP1的生长特性
将苍白杆菌JP1和去除H2O2复苏后的苍白杆菌RJP1接种于LB培养基,分别于不同温度、初始pH和盐度,180 r/min培养24 h,取样测定数据如图5所示,2种菌株细胞的适宜生长条件基本一致,温度25.0~40.0 ℃、pH 5~9、盐度为0.0%~1.0%,表明VBNC状态的苍白杆菌JP1去除H2O2的胁迫作用恢复可培养性后,与自然状态的苍白杆菌JP1一样,具有较好的环境适应能力。

图5 菌株JP1和菌株RJP1的生长特性Fig.5 Growth characteristics of strain JP1 and strain RJP1A:温度对菌株生长的影响;b:初始pH对菌株生长的影响;c:盐度对菌株生长的影响 a: Effect of temperature on the growth of the bacteria; b: Effect of initial pH on the growth of the bacteria; c: Effect of NaCl concentration on the growth of the bacteria
2.6 H2O2对苍白杆菌石油降解性能的影响
将苍白杆菌JP1、去除H2O2的胁迫复苏后的苍白杆菌RJP1接种于含有一定浓度石油的基础培养基中,通过红外测油仪测定培养液中剩余的石油浓度。结果显示,复苏后的苍白杆菌RJP1细胞的石油降解率没有受到明显的影响。培养液中石油的初始浓度和剩余浓度,菌株JP1和菌株RJP1的石油降解率如表1所示。

表1 细菌石油降解率测定Table 1 Determination of petroleum degradation rates of the different bacterial cells
3 讨 论
H2O2因其具有氧化性而被广泛应用于微生物的杀菌消毒,并且可诱导细菌进入VBNC状态。Morishige等[27]的研究结果表明向含肠炎沙门氏菌(Salmonella)细胞浓度为1.0×107cfu/mL的LB培养液中添加H2O2,当培养液的H2O2浓度为10.0 mmol/L,培养45 min后培养液中的肠炎沙门氏菌进入VBNC状态。本研究发现在初始浓度为8.1×107cfu/mL苍白杆菌JP1的LB培养液中,当H2O2终浓度为75.0 mmol/L时,30 ℃、180 r/min恒温振荡培养12 h后苍白杆菌JP1 细胞进入VBNC状态。不同种属的细菌对H2O2的耐受性存在显著差异,但培养液初始的细胞浓度是导致其存在显著差异的主要原因和细菌能否进入VBNC状态的重要前提。此外,致使细菌进入VBNC状态的方式是多种多样的,Ye等[28]的研究结果表明,当培养液中大肠埃希菌(Escherichiacoli)细胞数目为105~6cfu/mL时,0.5 mg/L的余氯处理6 h后大肠埃希菌进入VBNC状态。
环境因素诱发细菌进入VBNC状态后,典型的特征是细胞出现收缩变小等形态变化,在大多数细菌细胞中都能观察到细胞内物质的积累。H2O2诱导苍白杆菌JP1进入VBNC状态后,细胞由杆状变为球状。透射电子显微镜观察到,VBNC状态的细胞周质间隙显著增大,核区被压缩至细胞中心。在一些经低温和寡营养诱导而形成的VBNC状态细菌细胞中也观察到了同样的现象。Gao等[29]研究发现鳗弧菌(Vibroanguillarum)细胞经过6个月的饥饿培养,细胞由短棒状变为球状,细胞平均长度明显缩短。聂新颖等[30]采用H2O2处理鼠伤寒沙门氏菌(Salmonellatyphimurium)使其处于VBNC状态,观察到细胞形态以及胞内物质的变化情况与本研究观测结果一致。
VBNC状态的细菌可以通过不同的条件复苏。Morishige等[27]通过添加30.0 mmol/L的丙酮酸钠,对VBNC状态的肠炎沙门氏菌进行复苏,结果表明,与对照组(0 mmol/L丙酮酸钠)相比,肠炎沙门氏菌细胞的可培养性提高90.3倍。本研究发现,在VBNC状态苍白杆菌JP1的复苏过程中,培养至24 h,实验组(50.0 mmol/L丙酮酸钠)复苏培养液中的可培养数是对照组 (0 mmol/L丙酮酸钠)的3.2倍,说明合适浓度的丙酮酸钠能够促进VBNC状态细菌细胞的复苏。此外,Pinto等[31]采用改变培养温度的方法,使低温(4 ℃)诱导进入VBNC状态的大肠埃希菌恢复了可培养性。寡营养的土壤培养基经过12 h的培养后,其中耐金属贪铜菌(Cupriavidusmetallidurans)的可培养数目降为0 cfu/mL,Giagnon等[32]在土壤培养基中添加葡萄糖酸盐后,培养基中的可培养数恢复到了较高水平。除物理刺激、添加化学物质等复苏方法外,有些活性蛋白质也有助于VBNC状态细菌的复苏,Panutdaporn等[13]通过添加复苏促进因子(Rpf)使得VBNC状态的沙门氏菌获得可培养性。Li等[33]向含VBNC状态哈维弧菌(Vibroharveyi)的培养液中添加活性蛋白YeaZ,也实现了复苏。

