毛木耳不同生长期菌棒微生物群落研究
叶 雷, 张 波, 李小林*, 谭 伟*
(1.四川省食用菌研究所, 四川 成都 610066;2.四川农业大学 资源学院,四川 成都 611130)
毛木耳(AuriculariacorneaEhrenb.)是木耳科(Auriculariaceae)、木耳属(Auricularia)的大型真菌,曾用学名A.polytricha[1],主要分黄背木耳和白背木耳,主产四川、山东、江苏等地,据中国食用菌协会统计,四川是我国毛木耳最大产地,2019年鲜耳产量92.15万t,占全国毛木耳总产的54.74%[2]。我国毛木耳栽培模式为“熟料袋栽荫棚出耳”[3],栽培基质以常压蒸汽灭菌(温度98~102 ℃,灭菌12~15 h)为主,有研究显示常压灭菌条件下菌棒中依然存在“污染源”。叶礼奎[4]报道食用菌栽培中细菌、病毒、霉菌和虫害是主要污染源,灭菌后的基质中仍然存在细菌芽胞,并作为培养料的第一污染源。黄毅[5]对金针菇菌棒细菌污染的研究显示:菌包的真菌性污染是显著的,肉眼可见的,而细菌性污染易被忽视且具有隐形性,损失是巨大的。陈俏彪等[6]研究表明,食用菌基料采取常压灭菌生产时,细菌芽胞不能完全杀死能引起培养料的污染。那么在毛木耳栽培基质中存在哪些微生物?它们对毛木耳菌棒、子实体等的影响如何?四川省食用菌研究所毛木耳研究课题组采用高通量测序技术对毛木耳不同出耳阶段菌棒微生物群落进行了研究,以明析毛木耳菌棒中微生物群落情况,为毛木耳高效栽培提供参考。
1 材料与方法
1.1 材料
1.1.1 供试材料 供试菌株为上海1号,四川主栽品种,经形态学和分子生物学鉴定为毛木耳(Auriculariacornea);所用有机原料新鲜无霉变,均为正品;料袋规格为折径17.5 cm×长47 cm×厚0.004 cm,聚乙烯材质,一端开口。
1.1.2 培养基 母种培养基为马铃薯葡萄糖琼脂培养基(PDA培养基);原种和栽培出耳培养基(以干料计,质量分数,%):木屑33,玉米芯30,米糠20,高粱壳10,玉米粉2,石灰4,石膏1。原料参数要求参见黄忠乾等[3]。
1.1.3 主要试剂与仪器设备 E.Z.N.A.®Soil DNA Kit (OMEGA Bio-Tek, Norcross, Georgia, USA);凝胶回收试剂盒(AP-GX-250, AXYGEN公司);荧光试剂(Quant-iT PicoGreen dsDNA Assay Kit,上海诺宁生物科技有限公司);AMPure XP 磁珠(美国贝克曼库尔特公司);Q5高保真DNA聚合酶(NEB公司);MiSeq Reagent Kit V3 (600 cycles)。Illumina (Miseq, Illumina公司);TruSeq Nano DNA LT Library Prep Kit(FC-121-4003,Illumina);PCR仪(ETC 811, 东胜兴业科学仪器有限公司);定量仪器Microplate reader(FLx 800, BioTek);离心机 (5427R, 德国艾本德股份公司);-80 ℃ 冰箱(DW-HL 528S, 中科美菱);涡旋振荡器米欧(mix-28+, 广州围古润仪器有限公司);拌料机、装袋机、灭菌器、液体菌种发酵和接种成套设备(连云港国鑫食用菌成套设备有限公司)。
1.2 方法
1.2.1 代料栽培方法 按照栽培基质配方准确称量栽培组分,并采用工厂化制袋成套设备进行拌料、装袋、灭菌和接种。培养料充分混匀且含水量为62%;装料重为2.3 kg/袋(湿料,菌棒长一致);装袋完成后机械对料袋开口端扎丝直接封口;采用常压灭菌,设定参数100 ℃维持14 h;灭菌完成后菌棒出锅采用制冷机进行强冷,待菌棒中间温度25~28 ℃时,采用液体接种机对灭菌冷却料袋接种菌种50 g/袋(接种2孔),并用无菌无纺布封口;菌棒放置在25 ℃控温培养房无光培养至菌丝满袋,完成后熟培养15 d后筛选菌丝洁白、无菌皮、无杂点的菌棒上架出耳(出耳棚事先消毒处理)。菌棒腹面均匀划开三个口,呈“V”字型,口径1.5 cm,朝下,后续养菌5 d,控制环境空气湿度85%~95%,光照200~300 lx,温度自然,进行菌袋的催耳和出耳管理[3]。获得第一潮干耳103 kg/1 000袋。
1.2.2 样本采集 对菌棒样本分4个阶段采集,菌丝满袋后熟(记为0 d)、原基形成(记为20 d)、原基分化开片(记为35 d)和子实体边缘微卷成熟(记为50 d),并分别编号为ful、pri、ope和mat(图1)。每个时期3个生物学重复,分细菌和真菌群落两大组样本进行测定,共计24个样本。菌棒样本采集时,随机选择菌棒,首先用0.1%的酸性高锰酸钾进行菌棒表面的消毒,用75%的酒精棉球擦拭菌棒表面消毒,然后将预处理的菌棒用无菌塑料膜包裹放入无菌的超净工作台上,按照无菌操作流程,在开“V”字型出耳口的腹面的背面位置,用手术刀将菌棒表面塑料袋划开,用镊子随即夹取料袋中部培养料和菌丝体的混合物放入无菌EP管中作为样本,立即将样本用液氮冷冻15 min,然后-80 ℃冰箱冻存备用。
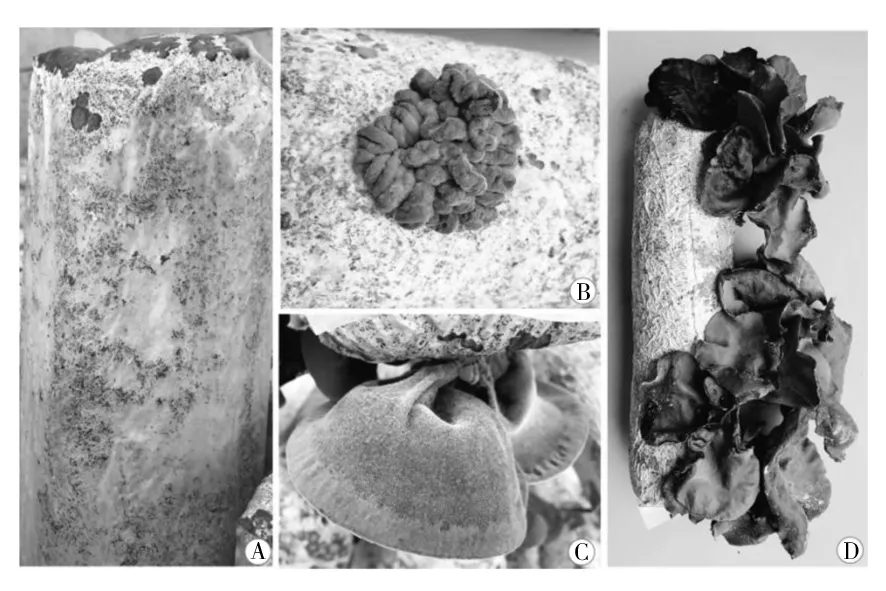
图1 各采样期菌棒和子实体形态Fig.1 Morphology of artificial bed-log and fruiting body at different sampling periodsA:菌丝满袋后熟期(ful);B:原基形成期(pri);C:原基分化开片期(ope);D:子实体边缘微卷成熟期(mat)A: The mycelium full of bags (ful); B: Prophase of fruiting body formation (pri); C: Fruiting body stretch period (ope); D: Maturation stage of fruiting body (mat)
1.2.3 总DNA提取、PCR扩增和高通量测序 采用E.Z.N.A.®Soil DNA Kit提取样本总DNA,琼脂糖(0.8%)凝胶电泳和紫外分光光度计对提取DNA进行定量分析。采用NEB公司的Q5高保真DNA聚合酶对细菌16S rRNA V3~V4高变区和真菌ITS1区进行PCR扩增,扩增引物和反应条件参照相关文献进行[7-9]。采用琼脂糖(0.2%)凝胶电泳检测PCR产物,凝胶回收试剂盒进行目标条带的切胶回收。测序文库制备采用Illumina公司的TruSeq Nano DNA LT Library Prep Kit。使用Illumina MiSeq测序仪进行2×300 bp的双端测序[7,10]。
1.2.4 下机数据分析 对高通量测序的下机原始数据进行质量筛查(窗口大小为10 bp,步长为1 bp),去除嵌合体等疑问序列,使用QIIME软件进行OTU(Operational Taxonomic Unit)归并划分(以97%的相似度),针对细菌16S rRNA基因数据库,采用Greengenes数据库[11],真菌18S rRNA基因数据库采用Silva数据库[12]去除劣质数据[13]。后续结合相关软件构建稀释曲线,进行多样性分析、群落组成分析、细菌菌群代谢功能预测等[14]。细菌和真菌测序原始数据以FASTQ格式保存,并上传至NCBI SRA数据库,登录号分别为PRJNA 780 254、PRJNA 780 257。
2 结果与分析
2.1 测序质量分析
对高通量测序下机原始数据进行处理后,获得细菌16S rRNA有效序列503 724条,真菌有效序列712 728条。进一步对序列长短进行统计,结果细菌测定多数样本的序列分布在400~450 bp。在97%相似水平下进行OTU划分,ful、pri、ope和mat期样本的细菌OTU种类分别为1 054、734、767和1 030;真菌OTU种类分别为154、117、130和107,对共有OTU进行分析,制作Venn图,结果所有样本间细菌共有OTU为249个(图2A),真菌为88个(图2B)。进一步制作稀释曲线,结果随着样本测序深度增加曲线的切线斜率趋于零,表明样本测序深度能很好的反映样本微生物多样性(图2C、2D)。细菌物种注释分属25门54纲85目134科199属;真菌物种注释隶属于5门9纲15目12科19属。
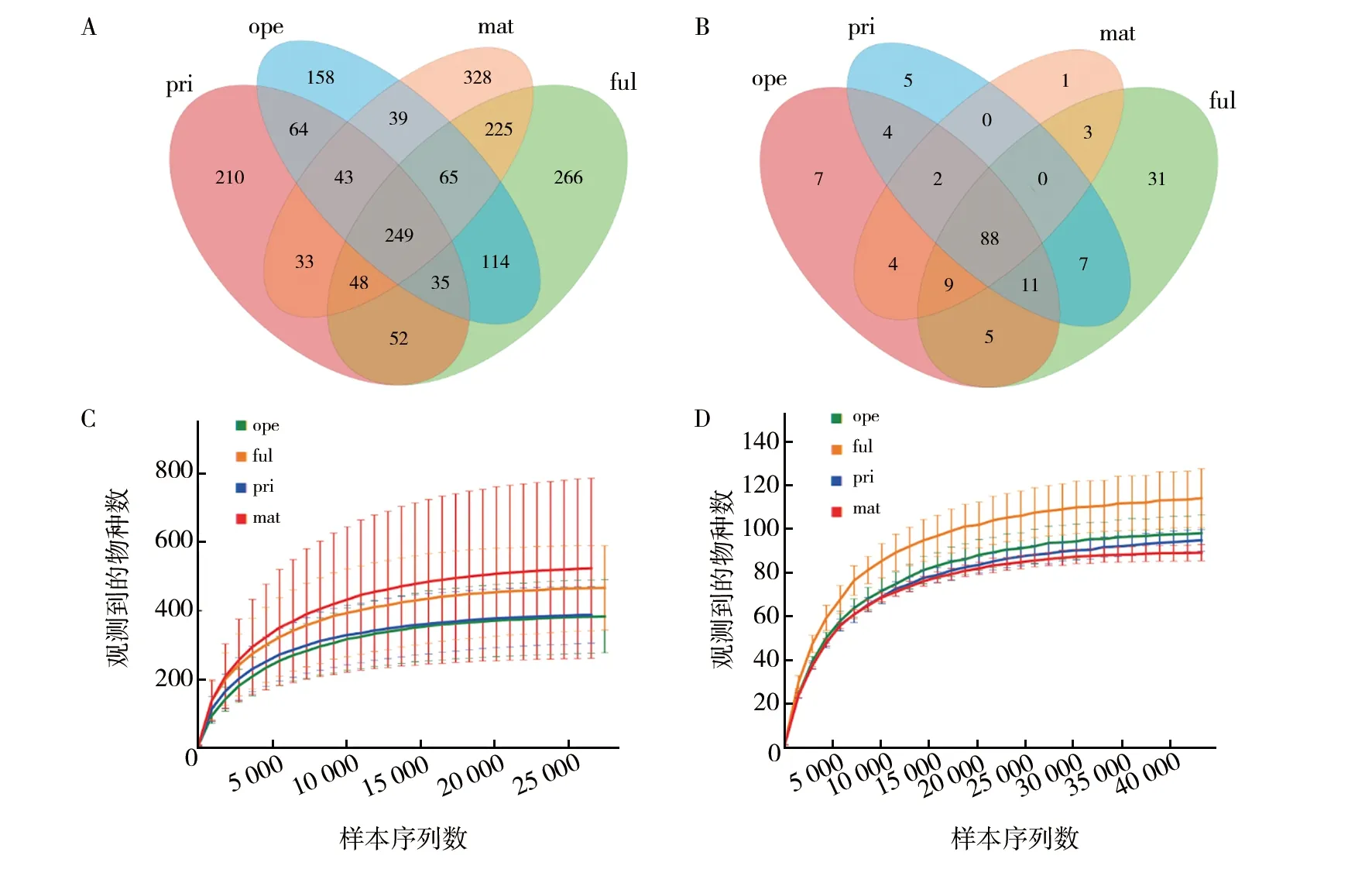
图2 共有OTU的Venn图和物种稀释曲线Fig.2 Venn diagram of shared OTU and Rarefaction curveA和B分别为细菌和真菌的Venn图; C和D分别为细菌和真菌的稀释曲线A and B are Venn diagrams of bacteria and fungi respectively; C and D are the rarefaction curves of bacteria and fungi respectively
2.2 毛木耳子实体不同生长期菌棒物种多样性指数
在进行多样性指数计算前,对OTU丰度矩阵中的全体样本,根据90%的最低测序深度统一进行“拉平处理”,以避免测序深度导致的样本间多样性差异,更为客观地反映不同样本间菌群的Alpha和Beta多样性差异,提高分析可靠性。使用QIIME软件计算样本的Chao1、ACE、Shannon和Simpson指数(表1),以反映其Alpha多样性。稀释曲线(图2C)的平均高低顺序为mat>ful>ope>pri,表明mat期样本细菌多样性更丰富,pri期样本细菌多样性更低。稀释曲线(图2D)的平均高低顺序为ful>ope>pri>mat,表明ful期样本真菌多样性更丰富,mat期样本真菌多样性更低。对多样性指数进行分析,结果在0.05水平上细菌均表现差异不显著。Chao1和ACE指数越大,表明群落的丰富度越高,说明mat期细菌群落丰富度高,ope期时更低;真菌在ful期显著高于mat期,而在pri和ope期差异不显著,说明在ful期有更高的多样性。Shannon指数和Simpson指数很好地反映群落均匀度,值越高表明群落的多样性越高,说明pri期有更高的细菌群落多样性;ful期真菌群落多样性显著高于其他时期(表1)。

表1 多样性指数Table 1 Diversity index
2.3 毛木耳子实体不同生长期菌棒群落组成分析
2.3.1 门分类水平下菌群结构分析 在门分类水平下,毛木耳不同生长期菌棒细菌相对丰度最高的前4个分别为变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)和拟杆菌门(Bacteroidetes),且以变形菌门为主要优势门。变形菌门在mat期中相对丰度最高为77.4%(百分数为相对丰度),其次为pri期(57.5%)、ful期(55.1%)和ope期(45.4%);厚壁菌门以ope期(51.3%)最高,其次为ful期(36.4%)、pri期(24.7%)和mat期(13.4%);放线菌门以pri期(4.5%)最高,其次为ful期(3.5%)、mat期(2.0%)和ope期(0.6%);拟杆菌门以样本mat期(5.5%)最高,其次为ful期(2.0%)、pri期(1.5%)、ope期(1.4%)(图3A)。可见在毛木耳ful、pri和mat期均以变形菌门为最具优势菌门,在ope期以厚壁菌门为最具优势菌门。担子菌门(Basidiomycota)和子囊菌门(Ascomycota)是菌棒真菌相对丰度最高的2个门,在所有时期的样本中,担子菌门为最主要的真菌门,其相对丰度达99.29%~99.95%。子囊菌门在ful期相对丰度最高为0.58%,其他时期低于0.11%(图3B)。
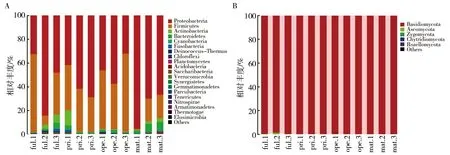
图3 门分类水平下细菌(A)和真菌(B)菌群组成及相对丰度Fig.3 Composition and relative abundance of bacterial (a) and fungal (b) community based on phylum level
2.3.2 属分类水平下菌群结构分析 在属分类水平下,各时期菌棒细菌相对丰度最高的前10个属及分布:赖氨酸芽胞杆菌属(Lysinibacillus)在ope期相对丰度最高(36.42%);假单胞菌属(Pseudomonas)在pri期相对丰度最高(35.85%);不动杆菌属(Acinetobacter)和苍白杆菌属(Ochrobactrum)在mat期相对丰度最高(35.85%、14.92%);土壤芽胞杆菌属(Solibacillus)在pri期相对丰度最高(14.85%);贪铜菌属(Cupriavidus)在ful期相对丰度最高(5.98%);嗜糖假单胞菌属(Pelomonas)在mat期相对丰度最高(4.84%);链球菌属(Streptococcus)在ful期相对丰度最高(4.82%);厌氧芽胞杆菌属(Anoxybacillus)在ope期相对丰度最高(3.77%);雷尔氏菌属(Ralstonia)在mat期相对丰度最高(2.50%)。即,ful期主要以赖氨酸芽胞杆菌属(25.71%)和不动杆菌属(14.38%)相对丰度最高;pri期以假单胞菌属(35.85%)和土壤芽胞杆菌属(14.85%)相对丰度最高;ope期以赖氨酸芽胞杆菌(36.42%)和假单胞菌属(21.73%)相对丰度最高;mat期以不动杆菌属(27.94%)和苍白杆菌属(14.92%)相对丰度最高(图3A、4A)。毛木耳子实体在不同生长时期菌棒真菌均以木耳属(Auricularia)相对丰度最高(99.19%~99.94%),在ful期木耳属相对丰度达99.19%,其次是拟青霉属(Simplicillium)(0.25%);在pri期木耳属相对丰度达99.93%,其次是假丝酵母属(Candida)(0.01%);在ope期木耳属相对丰度达99.83%,其次是嗜热真菌属(Thermomyces)(0.03%);在mat期木耳属相对丰度达99.94%,其次是短梗霉属(Aureobasidium)(0.02%)和丝孢菌属(Scedosporium)(0.01%)(图3B、4B)。对mat期干耳产量进行统计,获得产量(103±12) g/袋,耳片边缘厚度(0.94±0.21) mm/片。可见在毛木耳子实体生长发育的不同阶段菌棒内细菌菌群组成丰富且有较大差异,而真菌组成以木耳属占绝对优势,另检测出了拟青霉属和曲霉属(Aspergillus)等其他少量真菌属。木耳属的相对丰度在一定程度上影响产量形成。
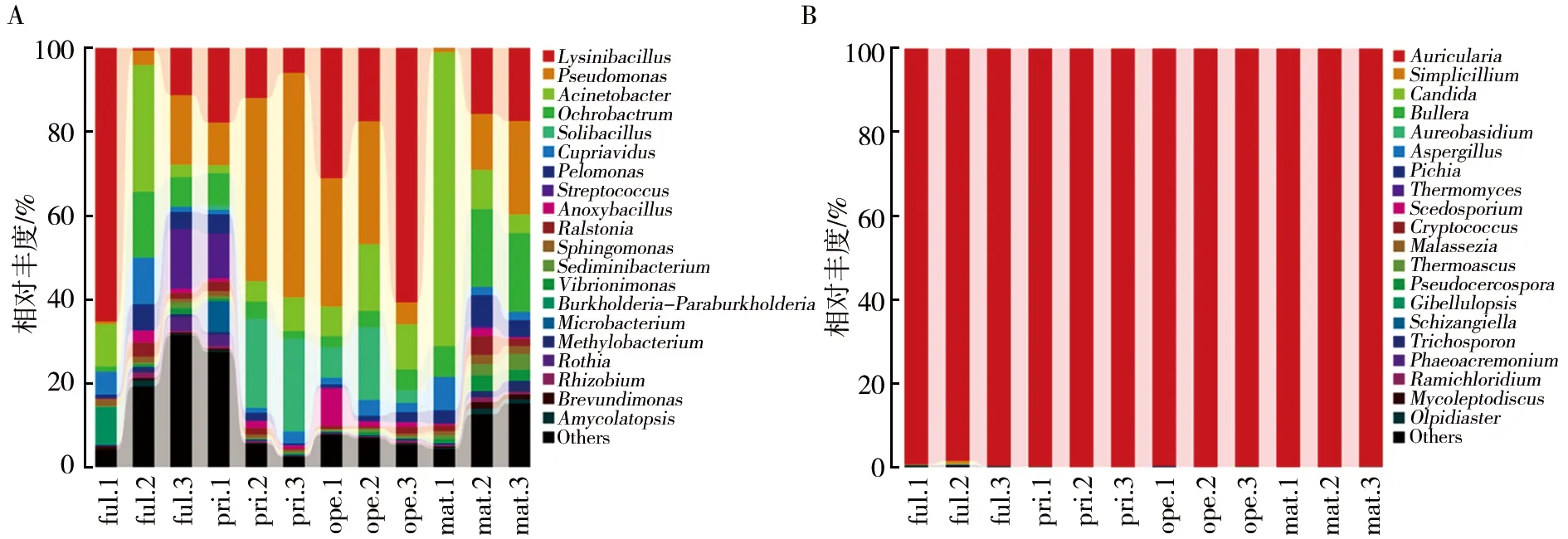
图4 属分类水平下细菌(A)和真菌(B)菌群组成及相对丰度Fig.4 Composition and relative abundance of bacterial (A) and fungal (B) community based on genus level
为进一步直观展示样本细菌和真菌群落组成关系,使用R软件进行聚类分析并绘制热图。通过聚类的方式,将高丰度和低丰度的分类单元加以区分,并通过聚类热图中小方块的颜色梯度来反映样本之间群落组成的相似度(图5)。
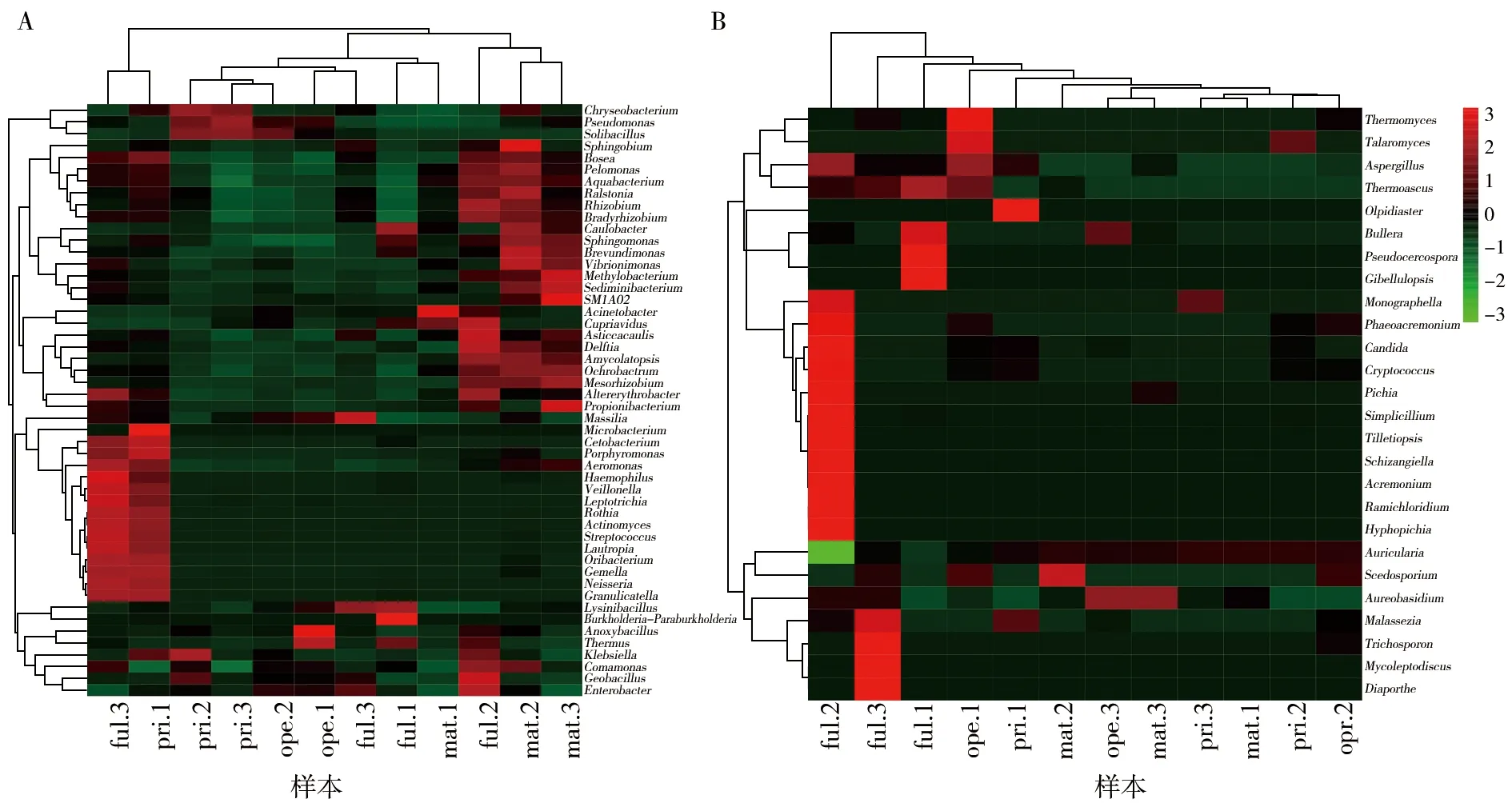
图5 基于属水平的细菌(A)和真菌(B)菌群组成热图及聚类分析Fig.5 Heat map and cluster analysis of sample based on genus level红色小方块代表在对应样本中丰度较高的属,绿色小方块代表丰度较低的属The red square represents the genus with higher abundance in the corresponding sample, and the green square represents the genus with lower abundance
2.3.3 毛木耳子实体不同生长期菌棒菌群组成的Beta多样性分析 为探究不同样本间细菌和真菌群落结构相似性(差异性),使用R软件对加权Weighted的UniFrac距离矩阵分别进行非度量多维标度分析(Non-metric multidimensional scaling,NMDS),通过二维排序图展现不同时期菌棒样本群落的结构分布,以观测毛木耳不同生长阶段菌棒菌群差异。对不同时期毛木耳菌棒菌群基于加权UniFrac距离NMDS分析,对样本进行细菌群落NMDS分析表明,同一时期各样本距离较分散,说明各样本的组成差异较明显(图6A);对样本进行真菌群落NMDS分析表明,除ful期样本与其他各时期距离较分散外,其他各组样本几乎重叠,说明ful期样本菌棒中真菌群落与其他各时期存在显著差异(图6C)。采用Weighted UniFrac距离矩阵通过非加权组平均法(Unweighted pair-group method with arithmetic means,UPGMA)对样本进行聚类分析,采用“等级树”展示毛木耳不同生长阶段菌棒样本间的相似度,图中样本间的分枝长度越短,两样本越相似。毛木耳不同生长期样本细菌的UPGMA聚类分析结果显示,mat样本单成一枝,说明毛木耳成熟期菌群组成与其他时期存在显著不同,其他各样本间菌群相似情况如图6B所示。同样对真菌样本UPGMA聚类分析结果表明,ful期样本与其他样本有更远的分枝,剩余的其他样本有更短的分枝,说明ful期菌棒真菌群落组成与其他时期显著不同(图6D)。
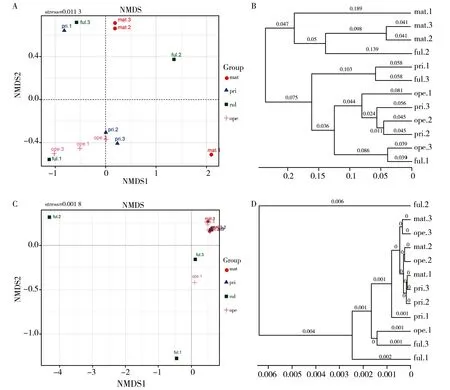
图6 毛木耳菌棒细菌(A和C)和真菌(B和D)菌群基于加权UniFrac距离NMDS分析和UPGMA聚类分析Fig.6 NMDS analysis and UPGMA cluster analysis based on weighted UniFrac distance of bacterial (A and C) and fungal (B and D) communities
2.3.4 毛木耳子实体不同生长期菌棒细菌群落代谢功能预测 本研究基于PICRUSt(Phylogenetic Investigation of Communities by Reconstruction of Unobserved States)开展细菌群落的代谢功能预测,以便更好地了解菌群在毛木耳菌棒中发挥的作用,实现其“身份”与“功能”的对应[15]。通过PICRUSt对16S rRNA基因序列在KEGG、COG和Rfam功能谱数据库中进行预测,并根据各样本预测的功能类群丰度分布结果,绘制了KEGG第二等级分布图(图7)。结果表明,毛木耳子实体不同生长期菌棒细菌富集的功能主要包括外源生物降解、核苷酸、萜类化合物和聚酮类化合物、氨基酸、维生素、脂质、聚糖生物合成、碳水化合物代谢等。该图基于“小提琴”的“宽窄”间接反映毛木耳不同生长时期对应功能类群数据分布的密度高低,越宽表明该丰度下对应的样本越多。在ful期细菌群落多发挥外源生物降解与代谢和氨基酸代谢的作用;在pri期更多发挥的是碳水化合物代谢的作用;在ope期更多发挥的是外源生物降解与代谢的作用;在mat期更多发挥的是外源生物降解与代谢、氨基酸代谢和脂质代谢的作用。
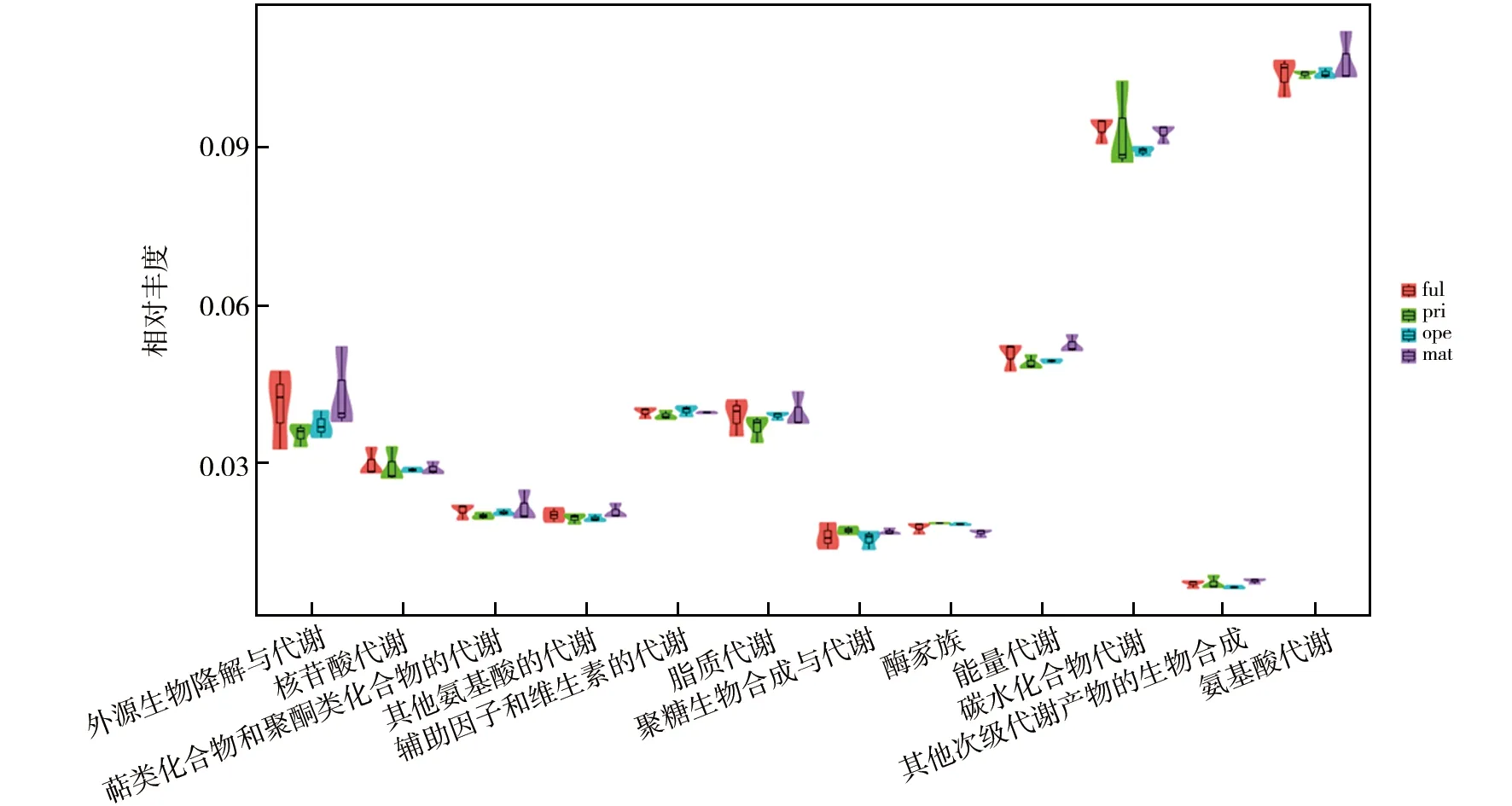
图7 基于PICRUSt的细菌代谢功能预测的KEGG第二等级分布Fig.7 KEGG diagram for metabolic function prediction based on PICRUSt of bacterial community
3 讨 论
菌棒菌群组成是影响食用菌单产的重要因素,间接影响种植效益,然而,国内外关于毛木耳出耳期菌棒微生物多样性研究较少。本研究表明基料常压灭菌条件下,毛木耳出耳期菌棒有着丰富的细菌群落,在不同出耳阶段菌棒细菌群落组成具有较大差异,以变形菌门、厚壁菌门、放线菌门和拟杆菌门为主,在属水平上以赖氨酸芽胞杆菌属、不动杆菌属、土壤芽胞杆菌属、厌氧芽胞杆菌属、假单胞菌属、贪铜菌属、嗜糖假单胞菌属、苍白杆菌属、链球菌属和雷尔氏菌属等为主,且在子实体不同生长阶段优势菌群存在较大差异。唐振[16]对外源一氧化氮处理下菌棒中细菌群落进行研究,表明厚壁菌门丰度最高,且检测出了拟杆菌门和放线菌门,优势菌属主要是芽胞杆菌属,与本研究结果有一致之处。在病原菌研究方面,贺新生等[17]对四川金堂袋栽黄背木耳发生的“坏头子病”的病原菌进行分离鉴定,确定病原菌为芽胞杆菌属细菌,其原因为常压灭菌难以杀死该菌芽胞,致使该菌在菌棒中大量繁殖,引起菌棒的溃烂,致使产量降低30%~70%。胡开辉等[18]对我国主栽食用菌细菌性病害报道认为,双孢蘑菇(Agaricusbisporus)细菌性斑点病、菌褶滴水病、干腐病和软腐病,平菇(Pleurotusostreatus)细菌性褐斑病、腐烂病,凤尾菇(Pleurotussajor-caju)黄斑病,金针菇(Flammulinavelutipes)细菌性褐斑病,草菇(Volvariellavolvacea)基腐病等均是假单胞菌属引起,双孢蘑菇细菌凹点病由芽胞杆菌属导致。Munsch等[19]发现康氏假单胞菌(Pseudomonascostantinii)能引起双孢蘑菇子实体病害。同样在本研究中检测出了芽胞杆菌属、假单胞菌属等多个菌属,为后续菌棒生理研究提供参考。高云虹等[20]对引起黑木耳栽培种污染的细菌进行鉴定时,获得3株引起栽培种污染的细菌,分别为类芽胞杆菌属、芽胞杆菌属和赖氨酸芽胞杆菌属,本研究也从毛木耳出耳菌棒中检测出了这3个属。Ma等[21]从杏鲍菇(Pleurotuseryngii)病害子实体中分离出可侵染其菌柄和菌盖的泛菌属(Pantoea)。刘绍雄等[22]对黑木耳常见病害进行调查时发现东洋芽胞杆菌(Bacillustoyonensis)引起黑木耳烂耳。托拉氏假单孢菌(Pseudomonastolaasii)能寄生于食用菌菌丝和子实体上[23],引起褐斑病[24]而不利于子实体的生长。关统伟等[25]对杏鲍菇常压灭菌培养料进行纯培养获得7株有差异的细菌菌株,其中包括芽胞杆菌属和假单胞菌属等,且多数为杆菌属。综上,毛木耳菌棒中潜在可能引起子实体生理性病害的菌群,但由于肉眼较难发现病灶,故难以统计。本研究基于PICRUSt对毛木耳子实体生长不同阶段菌棒菌群代谢功能进行预测,结果发现菌棒细菌与外源生物降解与代谢、核苷酸代谢、萜类化合物和聚酮类化合物的代谢、辅助因子和维生素的代谢、脂质代谢、聚糖生物合成与代谢、碳水化合物代谢等相关,预测结果显示部分细菌可能在子实体不同生长阶段发挥其效力,部分细菌的富集可能参与了毛木耳菌丝对基质营养的利用过程,如邱立友等[26]报道固氮菌荧光假单胞菌能在食用菌的菌丝表面形成菌膜,其固定的多余氮会供给菌丝以促进其生长。
毛木耳出耳期菌棒真菌类群主要归属于担子菌门和子囊菌门且以担子菌门为主,属水平上以木耳属为主,相对丰度高达99.94%,最终获得第一潮干耳(mat期)103 kg/1 000袋,可见木耳属在菌棒中的绝对优势是获得木耳子实体的关键,这与已知公认结果一致。除此之外,还检测出了极少量的拟青霉属、假丝酵母属、嗜热真菌属、短梗霉属、丝孢菌属和曲霉属等。毛木耳生产中常见真菌性“病害”主要是绿霉、毛木耳柱霉(Scytalidiumauricola)、曲霉和链孢霉等,本研究检测出相对丰度极低的拟青霉属和曲霉属等,推测这些菌的侵入多是由环境引入。在毛木耳真菌性病害中影响最广泛最严重的是毛木耳柱霉病害,又叫“油疤病”,彭卫红等[27-28]对该真菌病害病原菌进行了分离鉴定,确定为柱霉属新种,提出了该病的综合防控技术。据邱立友等[26]介绍,嗜热真菌属(降解纤维素、半纤维素等[29])、假单胞菌属等能促进食用菌的生长发育。拟青霉属可引起羊肚菌白霉病[30],危害子实体,影响羊肚菌土壤真菌群落结构;危害黑木耳菌棒的菌丝生长[31],引起高达20%的菌棒污染。嗜热真菌属能够降解培养料中的半纤维素可能促进了菌丝对基料的利用。本研究中,除木耳属以外的真菌属相对丰度仅0.06%~0.81%且未明显表现出污染症状,如果菌棒出现真菌性污染,最可能是由外界原因引起。本研究表明,毛木耳常压代料栽培菌棒中具有丰富的微生物多样性。细菌类群较真菌类群更丰富,且某些细菌可能是子实体病害的病原菌。真菌以木耳属相对丰度最高,另检测出极低丰度的拟青霉属和曲霉属等,未检测到柱霉属、青霉属、链孢霉等菌棒常见病原菌,推测这些真菌可能采取常压灭菌就能达到很好的灭杀效果。本研究对袋栽毛木耳生理病害及防控、高效栽培等具有生产指导意义。

