养猪微生物发酵床芽胞杆菌空间生态位特性
刘 波,陈倩倩,阮传清,王阶平,张海峰,刘国红,陈 峥,潘志针,刘 欣
福建省农业科学院农业生物资源研究所,福州 350003
微生物发酵床(microbial fermentation bed,MFB)利用植物废弃物如谷壳、秸秆、锯糠、椰糠等材料制作发酵床垫层,接种微生物,猪养殖在垫层上,排出的粪便由微生物分解消纳,原位发酵成有机肥[1]。大量的研究认为,微生物发酵床养殖是实现粪污无害化与环境友好型的一种自然健康养殖技术,能明显改善猪舍内的环境卫生,消除臭味,增强免疫力,降低呼吸道和消化道等疾病的发病率,减少抗生素等药物的使用,提高猪肉品质[2-10]。德国学者Kaufmann等研究了育肥猪微生物发酵床(the biological-bed system for fattening pigs)中猪粪营养平衡[11],法国学者Bonneau 等指出发酵床模式提供了养猪最优的环境和经济模式[12],国内学者陈倩倩等研究了微生物发酵床对猪大肠杆菌种群抑制作用[13],郑雪芳等报道了微生物发酵床对猪舍大肠杆菌病原的生物防治作用[14],发酵床中的芽胞杆菌对猪病防控、臭味分解、有机质降解发挥着重要的作用[15-21]。
微生物发酵床的空间微环境下,生物因子和非生物因子(营养成分、温度、湿度、pH、通气量等)决定了垫料微生物生长,形成了独特的生态位。Grinnell指出从微生境(microhabitat)、非生物因子(abiotic factor)、资源(resource)和被捕食者(predator)等环境限制性因子,把空间生态位定义为“恰好被生物所占据的最后分布单位”[22]。微生物空间生态位的研究较少,贺纪正等定义了适应环境的微生物功能群所占据空间为微生物生态位[23]。王子迎等提出在一定的植物病害系统中,某种病原物在其病害循环的每个时段上的全部生态学过程中所具有的功能地位,称为该病原物在该植物病害系统中的生态位[24]。Fazion等研究了苏云金芽胞杆菌在昆虫幼虫内的孢子萌发机制,指出带有pHT8_1质粒的菌体占据了幼虫体内生态位,从而导致病害的扩增[25];Zhang等研究婴儿食品蜡状芽胞杆菌污染菌时,发现带有肠毒素的菌株占有了中国婴儿食品污染菌的生态位[26];Blackburn 等建立了吉尔吉斯斯坦炭疽芽胞杆菌生态位模型,预测炭疽病发生的风险[27];Morton等开发了平衡树分析软件揭示微生物生态位变化[28];Piché-Choquette等研究了氢气氧化细菌改变土壤微生物生态位[29];Hong等研究了环境差异引起的土壤奇古菌(Thaumarchaeota)生态位的分化[30]。Chikerema 等建立了津巴布韦炭疽芽胞杆菌生态位空间模型[31]。
芽胞杆菌作为优势种类占据着微生物发酵床垫料空间生态位[13],刘国红等利用培养分离的方法研究了养猪微生物发酵床芽胞杆菌空间分布,从32份样品中共获得芽胞杆菌452株,分别隶属于芽胞杆菌纲的2个科、8个属、48个种,总含量高达4.41×108cfu/g,微生物发酵床的芽胞杆菌种类丰富、数量高[32]。关于养猪发酵床优势微生物群落—芽胞杆菌空间生态位特性的研究未见报道。
本研究通过采样程序,对微生物发酵床不同空间位置的垫料进行采样,分析垫料营养成分,利用宏基因方法组测定垫料微生物组,进行芽胞杆菌活菌计数,分析垫料芽胞杆菌空间生态位数量分布、亚群落分化、生态位宽度与重叠等,以期揭示养猪发酵床芽胞杆菌空间生态位特性,为阐明发酵床猪粪降解、臭味消除、猪病防控、资源化利用提供科学数据。
1 材料与方法
1.1 微生物发酵床空间生态位垫料采样方法
采样地点:福建省农业科学院福清现代设施农业样本工程示范基地。采样对象:微生物发酵床大栏养猪舍,该大栏发酵床猪舍建筑面积为2100 m2(长60 m,宽35 m),养殖面积为1600 m2,发酵床深度80 cm,发酵床垫料由33%椰糠、33%锯糠和34%谷壳组成。
发酵床饲养1600头育肥猪,饲养密度为每平方米1头,垫料管理表层30 cm每2天旋耕1次,底层不作翻耕,垫料下沉补充新垫料到原来高度,猪舍连续使用2年。将大栏发酵床长度方向划分8栏(记为1、2、3、4、5、6、7和8),宽度方向划分4栏(记为1、2、3、4),共32个小栏,采样格局平面图见图1。根据随机采样法选择采样点,每个采样点用五点取样方法,采集上层0—20 cm和下层40—60 cm深度垫料,采集的样品均匀混合后取1000 g装入无菌聚氯乙烯塑料瓶,带回实验室放入4 ℃冰箱内,进行芽胞杆菌的培养分离和宏基因组分析。垫料成分测定(水分、pH、有机质、全氮、腐殖酸、粗纤维)由资质单位福建省农科院土肥所完成。

图1 微生物发酵床空间生态位垫料采样格局Fig.1 Sampling pattern for spatial ecological niche analysis in microbial fermentation bed for pig raising横向1—8:猪舍横向1—8栏;纵向1—4:猪舍纵向1—4栏
1.2 微生物发酵床空间生态位细菌宏基因组测序
按土壤DNA提取试剂盒FastDNA SPIN Kit for Soil的操作指南,称取500 mg垫料样本进行总DNA的提取。采用琼脂糖凝胶电泳检测总DNA浓度,稀释至终浓度为1 ng/μL开展后续试验。采用原核生物16S rDNA基因V3—V4区通用引物U341F和U785R对各垫料样本总DNA进行PCR扩增,PCR反应重复3次。取相同体积混合后进行目的片段回收,所用胶回收试剂盒为AxyPrepDNA凝胶回收试剂盒(Axygen公司)。采用QuantiFluorTM-ST蓝色荧光定量系统(Promega公司)对回收产物进行定量检测。构建插入片段为350 bp的paired-end(PE)文库(TruSeqTMDNA Sample Prep Kit建库试剂盒,Illumina 公司),经Qubit定量和文库检测,HiSeq上机测序,测序由上海美吉完成。
1.3 微生物发酵床空间生态位芽胞杆菌活菌计数
通过梯度稀释涂布法,分离微生物发酵床样品中的芽胞杆菌,根据菌落形态特征等进行芽胞杆菌种类归类、分子鉴定、统计计数,每个样本重复3次,按垫料采样坐标的上层和下层分别统计活菌数,进行检验活菌数的垂直分布差异;分离纯化菌株,采用-80℃甘油冷冻法进行保存,采用Tris-饱和酚法提取芽胞杆菌基因组DNA,采用通用细菌16S rRNA引物进行扩增、测序、鉴定,方法参见Liu等所描述[33]。
1.4 微生物发酵床空间生态位芽胞杆菌数量(reads)分布
从宏基因组分析结果中提取芽胞杆菌属及其近缘属数量(reads)构建矩阵,分析比较垫料上层与下层数量差异、芽胞杆菌优势属的分布。
1.5 微生物发酵床空间生态位芽胞杆菌亚群落分化
利用宏基因组分析结果,提取芽胞杆菌属及其近缘属数量(reads),按上层和下层分布分别构建矩阵,以属种类为样本,采样点为指标,马氏距离为尺度,可变类平均法进行系统聚类,分析上层和下层芽胞杆菌亚群落分化特征。
1.6 微生物发酵床芽胞杆菌空间生态位宽度与重叠
以芽胞杆菌的属种类为样本,以空间样本为指标,构建数据矩,用Levins生态位宽度公式和Pianka生态位重叠公式分别计算生态位宽度和生态位重叠值[34]。计算公式如下:
(2)Pianka生态位重叠公式(Oik):
式中,Oik为芽胞杆菌属种类i和种类k的生态位重叠值,nij和nkj为芽胞杆菌属种类i和k在资源单位j中所占的个体比例,r为芽胞杆菌属种类个体总数。分析软件采用DPS v16.05数据处理系统。
2 结果与分析
2.1 微生物发酵床空间生态位垫料营养特性与芽胞杆菌活菌数分析
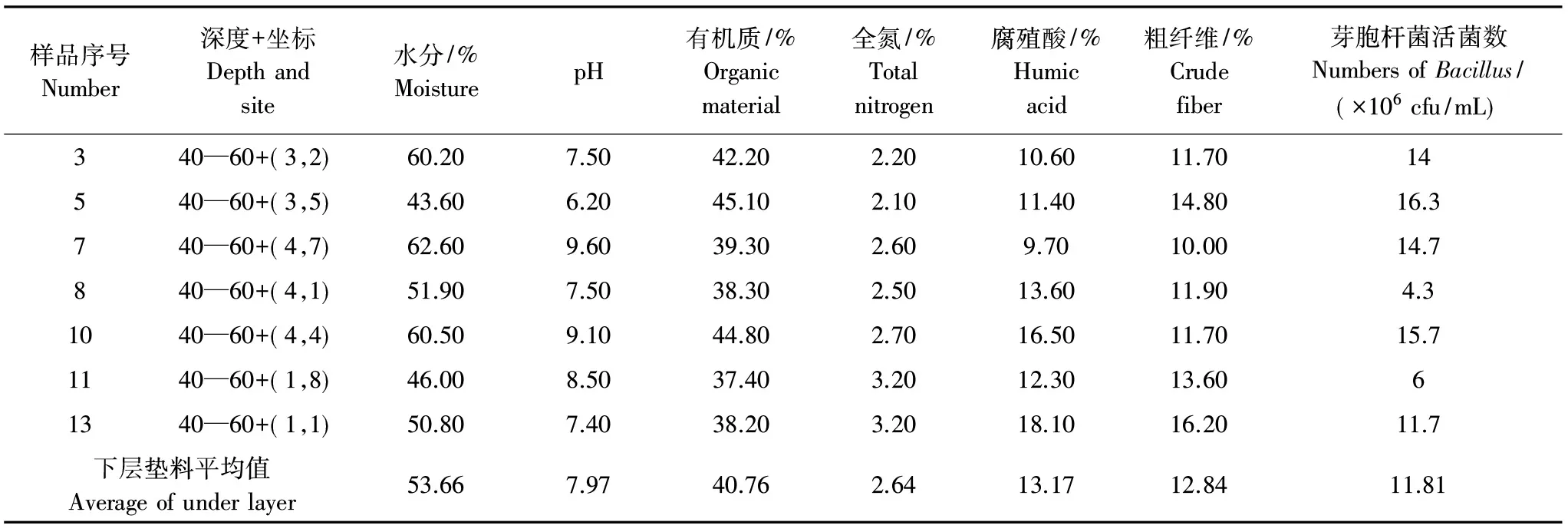
垫料营养特征指标测定实验结果见表1。微生物发酵床采样点垫料营养特性差异显著,垫料含水量差异范围为37.7%—62.6%,pH差异范围为6.2—9.2,有机质差异范围为37.4%—48.5%,全氮范围为2.0%—3.2%,腐殖酸差异范围为9.3%—16.5%,粗纤维差异范围为10.0%—17.8%。上层垫料与下层垫料的成分特性存在显著差异,上层垫料的水分和pH值低于下层,有机质和粗纤维含量高于下层,全氮和腐殖酸低于下层。

表1 微生物发酵床采样点垫料营养特性分析Table 1 Analysis of nutritional characteristics of the bedding litters sampled from the microbial fermentation bed
续表
实验测定微生物发酵床垫料芽胞杆菌活菌数(表2),并根据芽胞杆菌活菌数进行统计分析(表3)。微生物发酵床垫料空间采样点芽胞杆菌活菌数量存在显著差异,最小含量为4.3(×106cfu/mL),最大含量为26.7(×106cfu/mL);垫料上层(0—20 cm)采样单元芽胞杆菌含量平均值为15.34(×106cfu/mL),下层(40—60 cm)采样单元平均值为11.81(×106cfu/mL),两处理方差齐性,均值差异检验t=1.1634,df=12,P=0.2673。检测结果表明,上层垫料与下层垫料芽胞杆菌数量差异不显著(P>0.05)。
2.2 微生物发酵床空间生态位细菌宏基因组测序
测序结果见表4。垫料样本短序列(reads)范围为83279—135829条,细菌种类(OTUs)范围为929—1714个,测序覆盖度(Coverage)均在0.99以上;Ace指数、Chao指数、香农指数(Shannon)、辛普森指数(Simpson)。样本的稀释曲线(图2)和香农指数稀释曲线(图3)接近平台,表明测序深度已经基本覆盖样本中的所有细菌物种,覆盖率高(>0.99)。

表3 微生物发酵床垫料空间样本芽胞杆菌活菌计数均数t检验*Table 3 T-test on colony forming unit of the Bacillus-like species taken from the MFB
*均值差异检验t=1.1634,df=12,P=0.2673
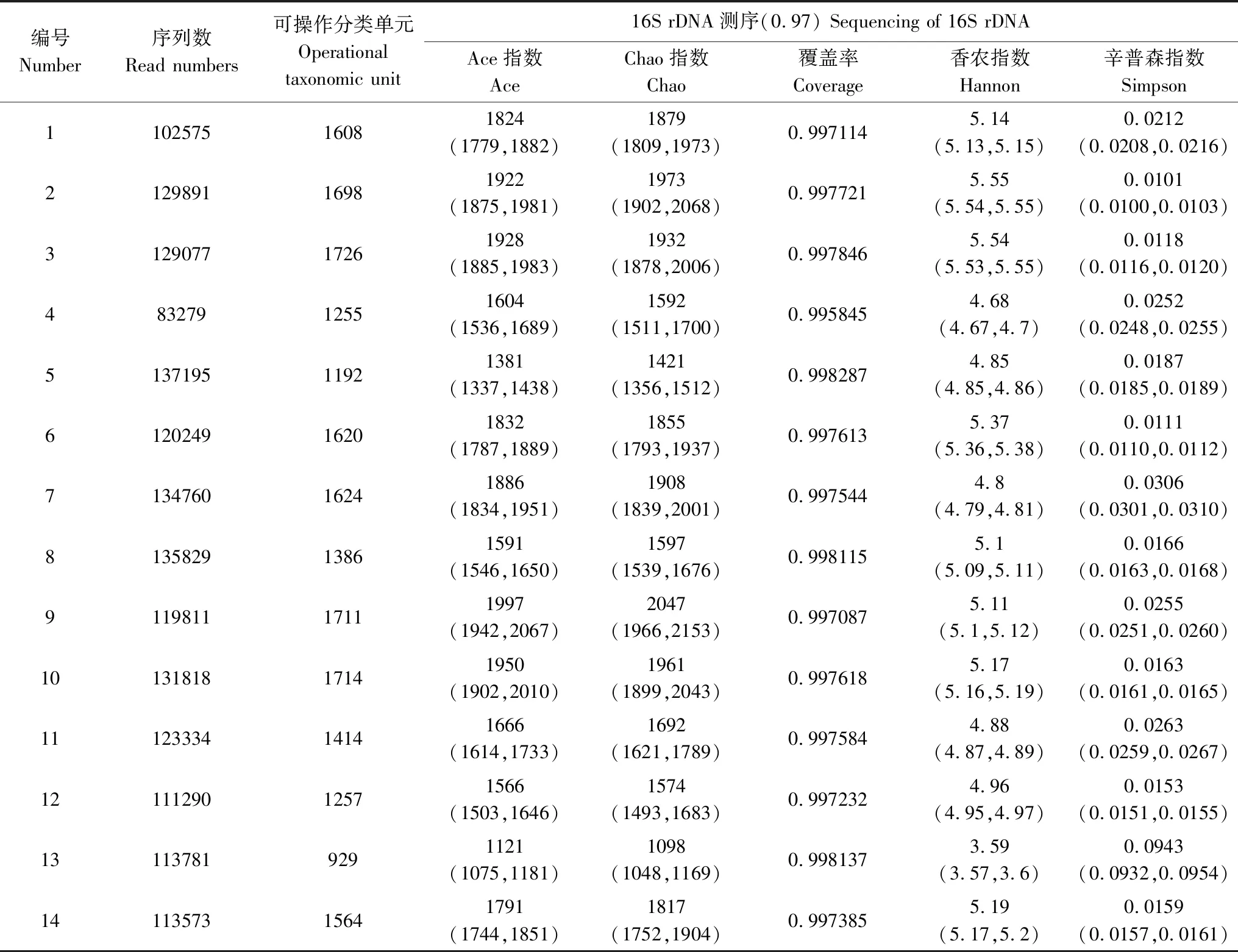
表4 微生物发酵床垫料空间生态位样本细菌宏基因组测定Table 4 Metagenome sequencing of the space ecological niche samples from the MFB
2.3 基于宏基因测序微生物发酵床空间生态位芽胞杆菌含量(reads)分布
2.3.1属水平的芽胞杆菌种类鉴定
利用宏基因测序,鉴定出芽胞杆菌目21个属(表5)和非芽胞杆菌目的3个属,分属于6芽胞杆菌个科,即芽胞杆菌科、脂环酸芽胞杆菌科、类芽胞杆菌科、动球菌科、芽胞乳杆菌科、待建立的科;相对含量最高的前3个属为Bacillus(芽胞杆菌属)(reads=8020)、Lactobacillus(乳杆菌属)(reads=4565)、Tuberibacillus(肿块芽胞杆菌属)(reads=1418);其中Halothiobacillus*(盐硫杆状菌属)属于γ-变形菌纲细菌,Roseibacillus*(玫瑰杆菌属)属于疣微菌纲细菌,Lactobacillus(乳杆菌属)属于乳杆菌目细菌。Ammoniibacillus#、Desulfuribacillus#、Roseibacillus*#、Tuberibacillus# 4个属在国内未见研究报道,为国内新记录属。
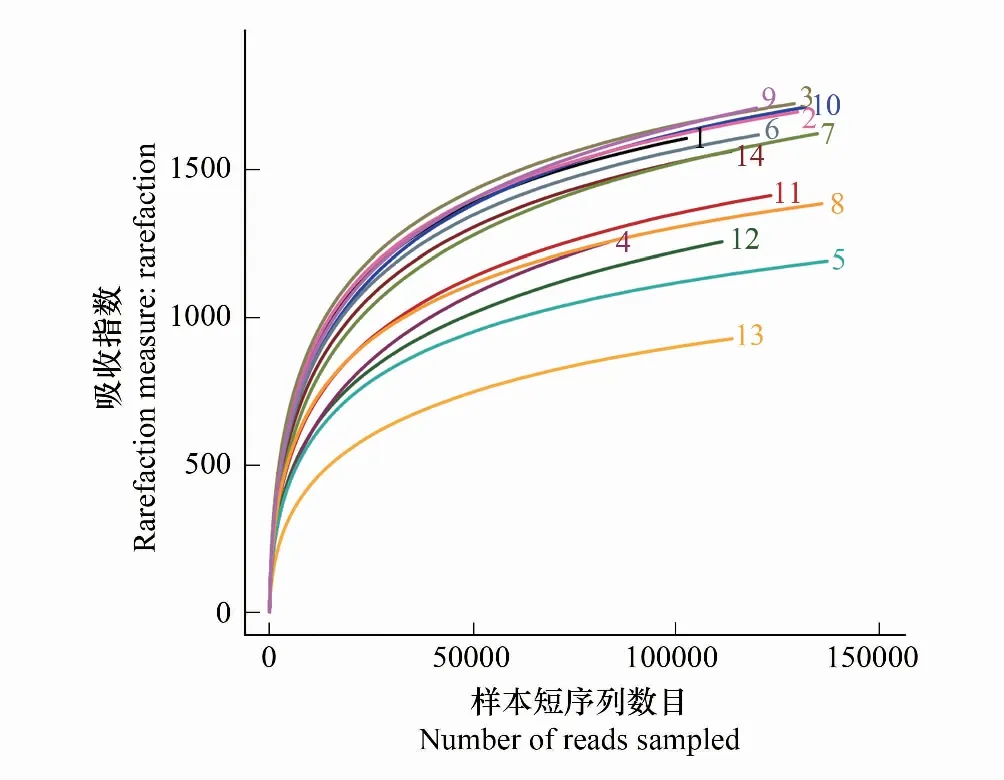
图2 发酵床垫料样本细菌read稀释曲线Fig.2 Dilution curve of bacterial reads in the litter samples from the MFB
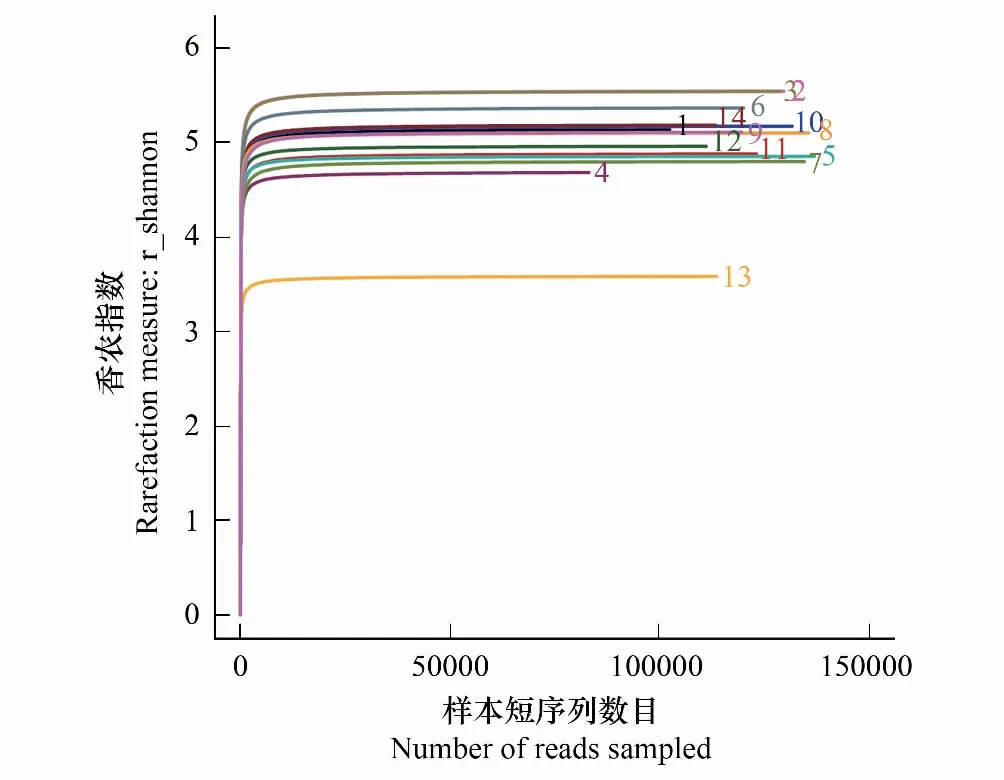
图3 发酵床垫料样本细菌香农指数稀释曲线Fig.3 Dilution curve of shannon index of bacteria in the litter samples from the MFB

表5 基于宏基因测序微生物发酵床垫料属水平芽胞杆菌种类鉴定Table 5 Identification of the Bacillus-like genera in the litter samples from the MFB based on metagenome sequencing
*为非芽胞杆菌纲种类,#为中国新记录属
2.3.2芽胞杆菌数量(reads)垂直分布
根据宏基因组测序的芽胞杆菌(reads)测定(表6),进行微生物发酵床上层和下层芽胞杆菌属水平含量(reads)均数t检验,分析结果见表7。上层芽胞杆菌数量平均值为1212.13,占细菌总数的1.25%;下层芽胞杆菌数量平均值为1339.43,占细菌总数的1.06%;两处理方差齐性,均值差异检验t=0.0798,df=12,P=0.9377,统计学上差异不著(P>0.05)。检测结果表明,上层垫料与下层垫料芽胞杆菌数量差异不显著。
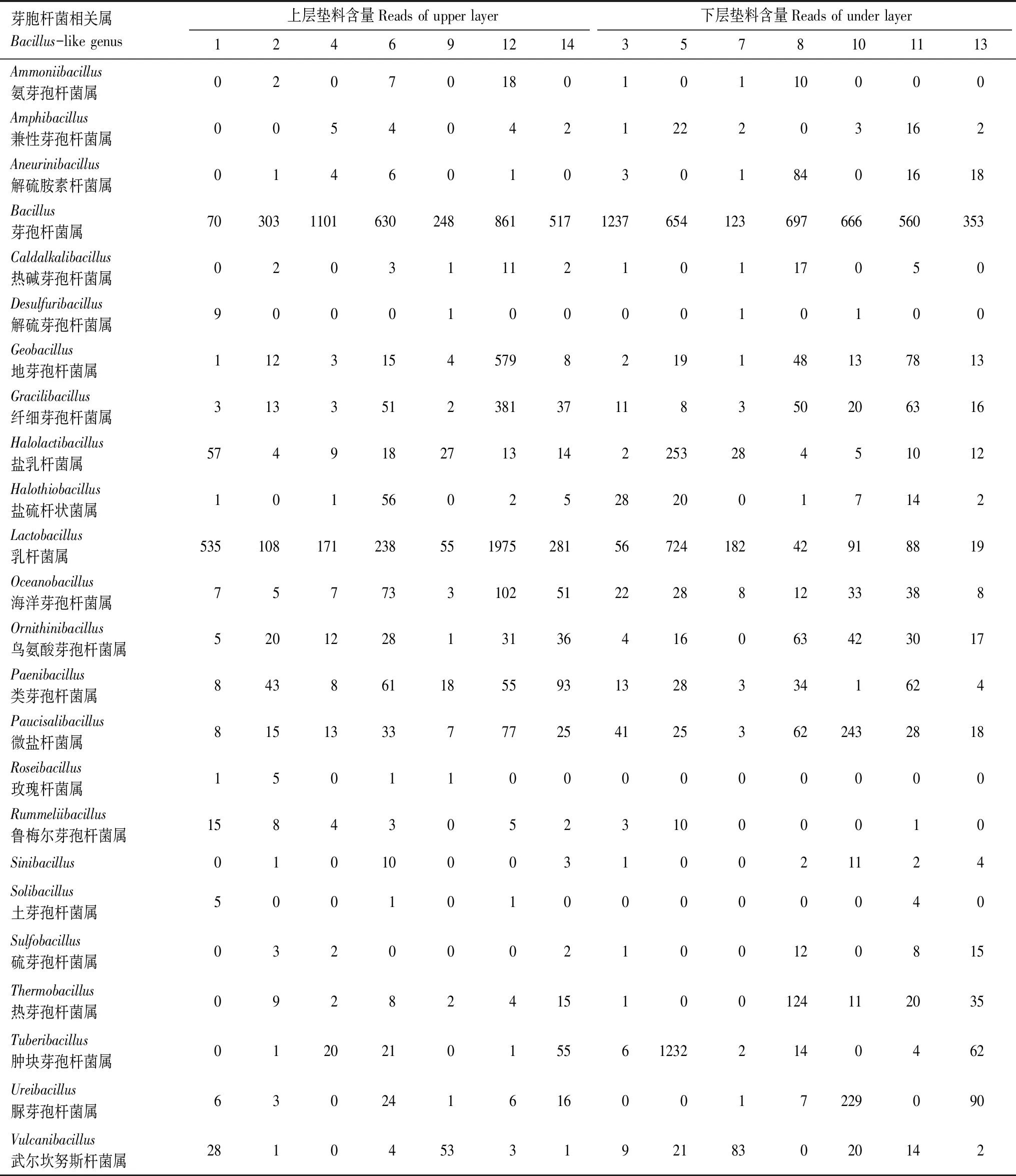
表6 基于宏基因组测序的微生物发酵床芽胞杆菌属水平含量(序列数)Table 6 Contents(reads)of the Bacillus-like genera in the litter samples from the MFB based on metagenome sequencing
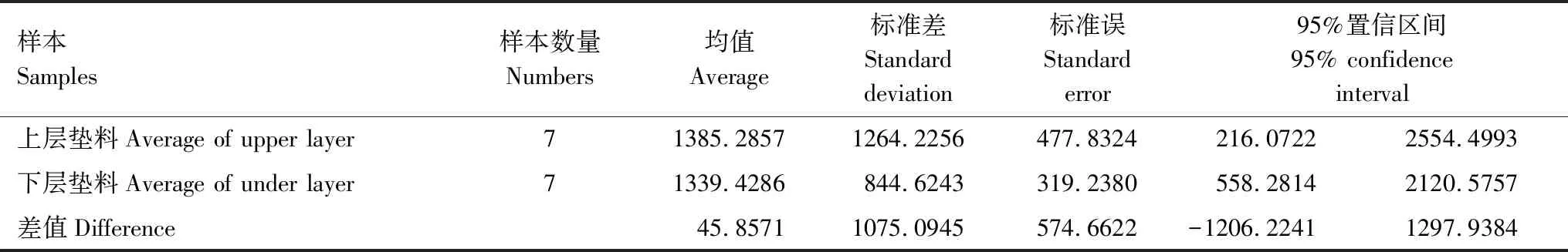
表7 基于宏基因组测序的微生物发酵床上层和下层芽胞杆菌属水平含量(reads)均数t检验*Table 7 T-test on contents (reads) of the Bacillus-like species in upper layer and under layer litters taken from the MFB
*均值差异检验t=0.0798,df=12,P=0.9377
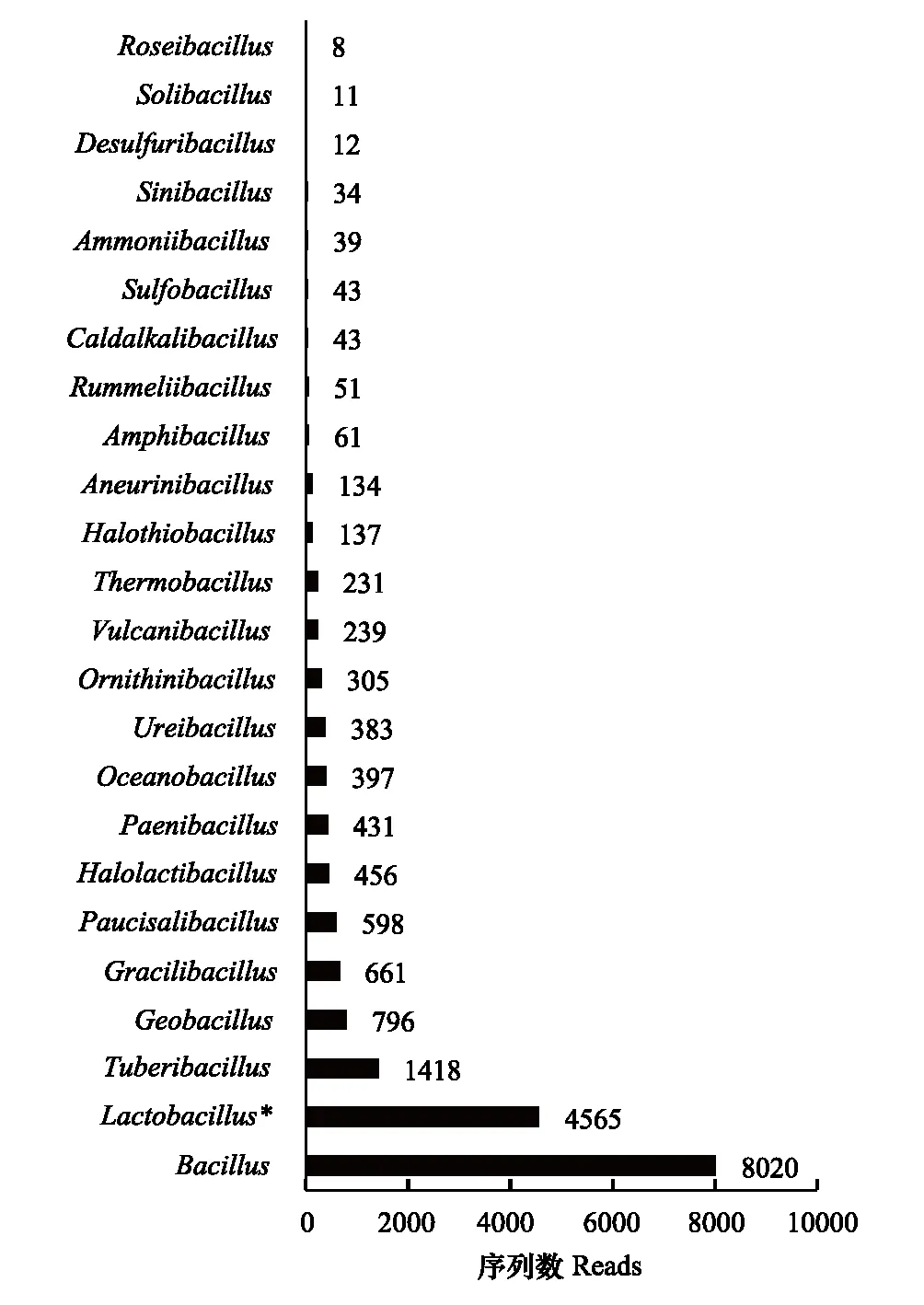
图4 微生物发酵床垫料样芽胞杆菌数量分布Fig.4 Read distribution of the Bacillus-like genera in the MFBRoseibacillus(玫瑰杆菌属)、Solibacillus(土芽孢杆菌属)、Desulfuribacillus(脱硫芽孢杆菌属)、Sinibacillus、Ammoniibacillus(氨芽孢杆菌属)、Sulfobacillus(硫芽孢杆菌属)、Caldalkalibacillus(热碱芽孢杆菌属)、Rummeliibacillus(鲁梅尔芽孢杆菌属)、Amphibacillus(兼性芽孢杆菌属)、Aneurinibacillus(解硫胺素杆菌属)、Halolactibacillus(盐乳杆菌属)、Thermobacillus(热芽孢杆菌属)、Vulcanibacillus(武尔坎努斯杆菌属)、Ornithinibacillus(鸟氨酸芽孢杆菌属)、Ureibacillus(脲芽孢杆菌属)、Oceanobacillus(海洋芽孢杆菌属)、Paenibacillus(类芽孢杆菌属)、Halothiobacillus(盐硫杆状菌属)、Paucisalibacillus(微盐杆菌属)、Gracilibacillus(纤细芽胞杆菌属)、Geobacillus(地芽孢杆菌属)、Tuberibacillus(肿块芽胞杆菌属)、Lactobacillus(乳杆菌属)、Bacillus(芽孢杆菌属)

图5 微生物发酵床上层和下层芽胞杆菌数量分布Fig.5 Read distribution of the Bacillus-like genera in the upper layer and under layer litters in the MFBSulfobacillus(硫芽孢杆菌属)、Solibacillus(土芽孢杆菌属)、Roseibacillus(玫瑰杆菌属)、Desulfuribacillus(脱硫芽孢杆菌属)、Aneurinibacillus(解硫胺素杆菌属)、Sinibacillus、Amphibacillus(兼性芽孢杆菌属)、Caldalkalibacillus(热碱芽孢杆菌属)、Ammonii-bacillus(氨芽孢杆菌属)、Rummeliibacillus(鲁梅尔芽孢杆菌属)、Thermobacillus(热芽孢杆菌属)、Ureibacillus(脲芽孢杆菌属)、Halolactibacillus(盐乳杆菌属)、Vulcanibacillus(武尔坎努斯杆菌属)、Tuberibacillus(肿块芽胞杆菌属)、Ornithinibacillus(鸟氨酸芽孢杆菌属)、Halothiobacillus(盐硫杆状菌属)、Paucisalibacillus(微盐杆菌属)、Oceanobacillus(海洋芽孢杆菌属)、Paenibacillus(类芽孢杆菌属)、Gracilibacillus(纤细芽胞杆菌属)、Geobacillus(地芽孢杆菌属)、Lactobacillus(乳杆菌属)、Bacillus(芽孢杆菌属)
2.3.3芽胞杆菌优势属分布
不同芽胞杆菌属及其近缘属数量(reads)发酵床分布结果显示(图4):微生物发酵床14个垫料样本检测到24个芽胞杆菌属,总量(reads)达19073,不同属数量分布差异显著,前5个分布最多的优势属为芽胞杆菌属(Bacillus)(8020)、乳杆菌属(Lactobacillus)(4565)、肿块芽胞杆菌属(Tuberibacillus)(1418)、地芽胞杆菌属(Geobacillus)(796)和纤细芽胞杆菌属(Gracilibacillus)(661)。
芽胞杆菌在垫料上层和下层垂直分布显示(图5):上层垫料芽胞杆菌各属总量(reads)为9697,含量最低的为土芽胞杆菌属(Solibacillus)仅为7(reads),最高的为芽胞杆菌属(Bacillus)达3730(reads);下层垫料芽胞杆菌各属总量(reads)为9376,总量与上层差异不显著,含量最低的玫瑰杆菌属(Roseibacillus)为0,最高的为芽胞杆菌属(Bacillus)达4290。不同芽胞杆菌优势属在垫料上层和下层数量垂直分布差异显著(图6),如芽胞杆菌属(Bacillus)上层分布(3730)低于下层分布(4290),肿块芽胞杆菌属(Tuberibacillus)上层(98)低于下层(1320);乳杆菌属(Lactobacillus)上层(3363)分布高于下层(1202),地芽胞杆菌属(Geobacillus)上层(622)高于下层(174),纤细芽胞杆菌属(Gracilibacillus)上层(490)高于下层(171)等等。
2.4 微生物发酵床空间生态位芽胞杆菌亚群落分化
分别构建上层和下层垫料不同样本芽胞杆菌数量(reads)矩阵,以属为样本,样方为指标,马氏距离为尺度,可变类平均法进行系统聚类。可以看出,垫料上下层芽胞杆菌亚群落分化存在显著差异。
垫料上层(表8、图6),芽胞杆菌亚群落分化为4个组,第1组为微含量组,数量(reads)总和为18.67,包含了9个芽胞杆菌属,即Ammoniibacillus(氨芽孢杆菌属)、Amphibacillus(兼性芽孢杆菌属)、Aneurinibacillus(解硫胺素杆菌属)、Caldalkalibacillus(热碱芽孢杆菌属)、Desulfuribacillus(脱硫芽孢杆菌属)、Roseibacillus(玫瑰杆菌属)、Sinibacillus、Solibacillus(土芽孢杆菌属)、Ureibacillus(脲芽孢杆菌属);第2组为高含量组,数量(reads)总和为1494.99,包含了3个芽胞杆菌属,即Bacillus(芽孢杆菌属)、Geobacillus(地芽孢杆菌属)、Ornithinibacillus(鸟氨酸芽孢杆菌属);第3组为中含量组,数量(reads)总和为553.48,包含了8个芽胞杆菌属,即Gracilibacillus(纤细芽胞杆菌属)、Halothiobacillus(盐硫杆状菌属)、Lactobacillus(乳杆菌属)、Oceanobacillus(海洋芽孢杆菌属)、Paucisalibacillus(微盐杆菌属)、Rummeliibacillus(鲁梅尔芽孢杆菌属)、Sulfobacillus(硫芽孢杆菌属)、Thermobacillus(热芽孢杆菌属);第4组为低含量组,数量(reads)总和为154,包含了4个芽胞杆菌属,即Halolactibacillus(盐乳杆菌属)、Paenibacillus(类芽孢杆菌属)、Tuberibacillus(肿块芽胞杆菌属)、Vulcanibacillus(武尔坎努斯杆菌属)。
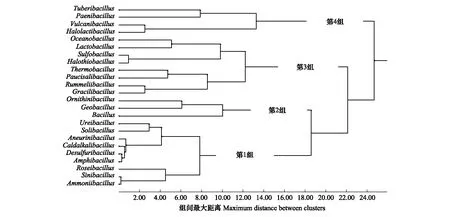
图6 上层垫料芽胞杆菌亚群落分化Fig.6 Cluster on subcommunity polarization for the Bacillus-like genera in the upper layer litters in the MFBTuberibacillus(肿块芽胞杆菌属)、Paenibacillus(类芽孢杆菌属)、Vulcanibacillus(武尔坎努斯杆菌属)、Halolactibacillus(盐乳杆菌属)、Oceanobacillus(海洋芽孢杆菌属)、Lactobacillus(乳杆菌属)、Sulfobacillus(硫芽孢杆菌属)、Halothiobacillus(盐硫杆状菌属)、Thermobacillus(热芽孢杆菌属)、Paucisalibacillus(微盐杆菌属)、Rummeliibacillus(鲁梅尔芽孢杆菌属)、Gracilibacillus(纤细芽胞杆菌属)、Ornithinibacillus(鸟氨酸芽孢杆菌属)、Geobacillus(地芽孢杆菌属)、Bacillus(芽孢杆菌属)、Ureibacillus(脲芽孢杆菌属)、Solibacillus(土芽孢杆菌属)、Aneurinibacillus(解硫胺素杆菌属)、Caldalkalibacillus(热碱芽孢杆菌属)、Desulfuribacillus(脱硫芽孢杆菌属)、Amphibacillus(兼性芽孢杆菌属)、Roseibacillus(玫瑰杆菌属)、Sinibacillus、Ammoniibacillus(氨芽孢杆菌属)
垫料下层(表9、图7)芽胞杆菌亚群落分化为4个组,第1组为微含量组,数量(reads)总和为57.27,包含了11个芽胞杆菌属,即Ammoniibacillus(氨芽胞杆菌属)、Amphibacillus(兼性芽孢杆菌属)、Aneurinibacillus(解硫胺素杆菌属)、Caldalkalibacillus(热碱芽孢杆菌属)、Desulfuribacillus(脱硫芽孢杆菌属)、Halolactibacillus(盐乳杆菌属)、Halothiobacillus(盐硫杆状菌属)、Roseibacillus(玫瑰杆菌属)、Rummeliibacillus(鲁梅尔芽孢杆菌属)、Sinibacillus、Solibacillus(土芽孢杆菌属);第2组为中含量组,数量(reads)总和为756,包含了7个芽胞杆菌属,即Bacillus(芽孢杆菌属)、Geobacillus(地芽孢杆菌属)、Gracilibacillus(纤细芽孢杆菌属)、Oceanobacillus(海洋芽孢杆菌属)、Ornithinibacillus(鸟氨酸芽孢杆菌属)、Paenibacillus(类芽孢杆菌属)、Thermobacillus(热芽孢杆菌属);第3组为低含量组,数量(reads)总和为451.75,包含了4个芽胞杆菌属,即Lactobacillus(乳杆菌属)、Paucisalibacillus(微盐杆菌属)、Sulfobacillus(硫芽孢杆菌属)、Vulcanibacillus(武尔坎努斯杆菌属);第4组为高含量组,数量(reads)总和为823.5,包含了2个芽胞杆菌属,即Tuberibacillus(肿块芽孢杆菌属)、Ureibacillus(脲芽孢杆菌属)。
2.5 微生物发酵床空间生态位芽胞杆菌数量(reads)与垫料营养特性的相关性
2.5.1微生物发酵床垫料营养特性主成分分析
基于微生物发酵床垫料营养特性测定数据矩阵,以欧氏距离为尺度,进行聚类分析和主成分析,结果见表10、表11、图8。垫料营养特性的第1主成分特征值达96.15,包含了主要信息;主成分分析得分可以看出,垫料水分、有机质得分较高,为正值,全氮及其其他因子得分为负值,形成了3个分支,这与聚类分析结果相符合,形成3个主成分,即水分主成分、有机质主成分、营养主成分(图8)。

表8 上层垫料芽胞杆菌属亚群落分化Table 8 Subcommunity polarization for the Bacillus-like genera in the upper layer litters in the MFB
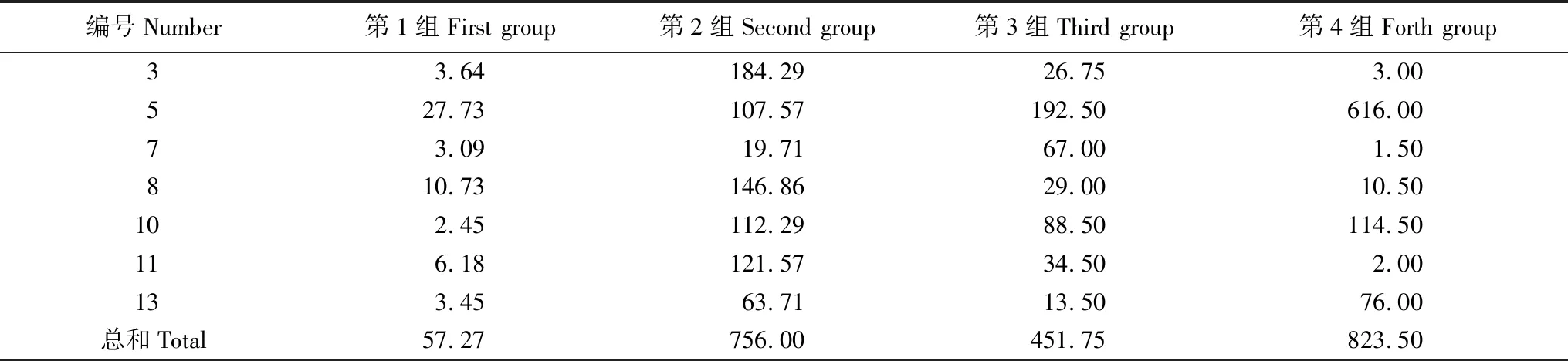
表9 下层垫料芽胞杆菌属亚群落分化Table 9 Subcommunity polarization for the Bacillus-like genera in the under layer litters in the MFB

图7 下层垫料芽胞杆菌亚群落分化Fig.7 Cluster on subcommunity polarization for the Bacillus-like genera in the under layer litters in the MFB Ureibacillus(脲芽孢杆菌属)、Tuberibacillus(肿块芽孢杆菌属)、Paucisalibacillus(微盐杆菌属)、Vulcanibacillus(武尔坎努斯杆菌属)、Sulfobacillus(硫芽孢杆菌属)、Lactobacillus(乳杆菌属)、Paenibacillus(类芽孢杆菌属)、Gracilibacillus(纤细芽孢杆菌属)、Ornithinibacillus(鸟氨酸芽孢杆菌属)、Oceanobacillus(海洋芽孢杆菌属)、Thermobacillus(热芽孢杆菌属)、Geobacillus(地芽孢杆菌属)、Bacillus(芽孢杆菌属)、Solibacillus(土芽孢杆菌属)、Sinibacillus、Roseibacillus(玫瑰杆菌属)、Halolactibacillus(盐乳杆菌属)、Rummeliibacillus(鲁梅尔芽孢杆菌属)、Halothiobacillus(盐硫杆状菌属)、Aneurinibacillus(解硫胺素杆菌属)、Desulfuribacillus(脱硫芽孢杆菌属)、Caldalkalibacillus(热碱芽孢杆菌属)、Ammoniibacillus(氨芽胞杆菌属)、Amphibacillus(兼性芽孢杆菌属)

表10 微生物发酵床垫料营养特性主成分特征值Table 10 Principal component eigenvalues for nutrition characteristics of the litters in the MFB
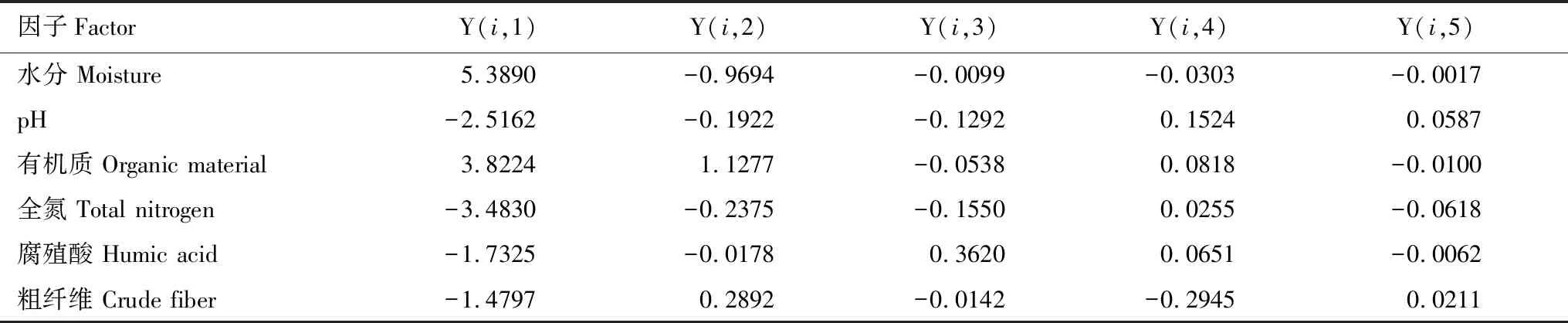
表11 微生物发酵床垫料营养特性主成分分析得分Table 11 Principal component analysis score for nutrition characteristics of the litters in the MFB
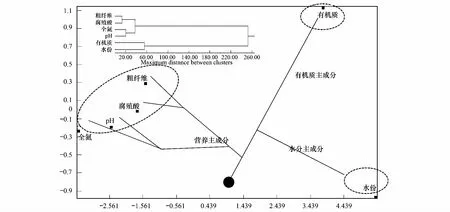
图8 微生物发酵床垫料营养特性聚类分析与主成分分析Fig.8 Cluster and principal component analyses of nutrition characteristics of the litters in the MFB
2.5.2芽胞杆菌数量与垫料成分特性相关性分析
以芽胞杆菌数量(reads)和垫料营养特性为样本,垫料空间样本为指标,构建矩阵(表12),进行相关性分析,芽胞杆菌与营养条件的相关系数见表10。相关系数显著检验的临界值a=0.05时,r=0.5324(显著),a=0.01时,r=0.6614(极显著);结果表明水分主成分提供了芽胞杆菌生存条件,不同的属存在差异,与Geobacillus(-0.6825)、Gracilibacillus(-0.6804)、Lactobacillus(-0.6636)呈显著负相关;基质主成分(有机质)提供了芽胞杆菌生存基质,对所有芽胞杆菌相关系数不显著,都是需要的;营养主成分提供了芽胞杆菌营养条件,不同属存在差异,与Vulcanibacillus(0.7063)极显著相关,全氮与Sinibacillus(0.6021)显著相关,腐殖酸与Ureibacillus(0.6898)极显著相关,其余相关性不显著。

表12 表2(营养特性)和表6(芽胞杆菌含量(reads))合并Table 12 Merging of table 2 and table 6

续表
表13 芽胞杆菌数量(序列数)与垫料营养条件的相关系数Table 13 Correlation coefficient between number(reads)of theBacillus-like genera and nutrition characteristics of the litters in the MFB
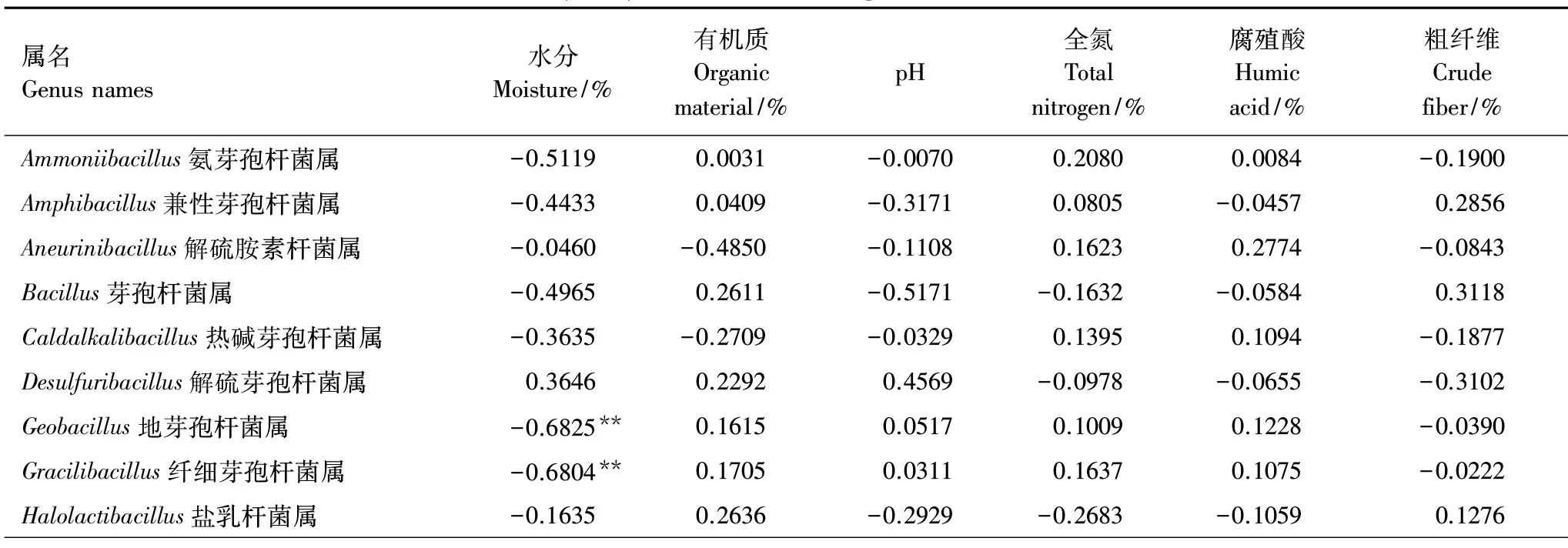
属名Genus names水分Moisture/%有机质Organic material/%pH全氮 Total nitrogen/%腐殖酸 Humic acid/%粗纤维Crude fiber/%Ammoniibacillus氨芽孢杆菌属-0.51190.0031-0.00700.20800.0084-0.1900Amphibacillus兼性芽孢杆菌属-0.44330.0409-0.31710.0805-0.04570.2856Aneurinibacillus解硫胺素杆菌属-0.0460-0.4850-0.11080.16230.2774-0.0843Bacillus芽孢杆菌属-0.49650.2611-0.5171-0.1632-0.05840.3118Caldalkalibacillus热碱芽孢杆菌属-0.3635-0.2709-0.03290.13950.1094-0.1877Desulfuribacillus解硫芽孢杆菌属0.36460.22920.4569-0.0978-0.0655-0.3102Geobacillus地芽孢杆菌属-0.6825∗∗0.16150.05170.10090.1228-0.0390Gracilibacillus纤细芽孢杆菌属-0.6804∗∗0.17050.03110.16370.1075-0.0222Halolactibacillus盐乳杆菌属-0.16350.2636-0.2929-0.2683-0.10590.1276Halothiobacillus盐硫杆状菌属0.05610.0388-0.16430.4625-0.3250-0.0310Lactobacillus乳杆菌属-0.6636∗∗0.4257-0.0396-0.0688-0.03720.0091Oceanobacillus海洋芽孢杆菌属-0.5776∗0.3603-0.09040.3544-0.04850.1048Ornithinibacillus鸟氨酸芽孢杆菌属-0.2911-0.0543-0.22790.26080.34300.0803Paenibacillus类芽孢杆菌属-0.39840.1706-0.34800.1436-0.29830.2823Paucisalibacillus微盐杆菌属0.04050.19420.21500.14630.5207-0.2058Roseibacillus玫瑰杆菌属0.3363-0.2423-0.0506-0.0955-0.3635-0.3112Rummeliibacillus鲁梅尔芽孢杆菌属-0.05110.3706-0.1736-0.3029-0.3868-0.0823Sinibacillus0.22150.03760.10730.6021∗0.3211-0.0314Solibacillus土芽孢杆菌属0.0195-0.03680.37550.3017-0.0992-0.1824Sulfobacillus硫芽孢杆菌属-0.1057-0.6388∗-0.20520.39060.5682∗0.2463Thermobacillus热芽孢杆菌属-0.0306-0.4414-0.13350.15550.3590-0.0438Tuberibacillus肿块芽孢杆菌属-0.24680.2253-0.4478-0.2551-0.04690.2254Ureibacillus脲芽孢杆菌属0.21790.08930.23240.29110.6898∗∗-0.0464Vulcanibacillus武尔坎努斯杆菌属0.4947-0.14130.7063∗∗-0.1112-0.1374-0.4899

续表
*相关系数临界值Correlation coefficient critical value,a=0.05时,r=0.5324,a=0.01时,r=0.6614
2.6 微生物发酵床芽胞杆菌空间生态位宽度
2.6.1芽胞杆菌生态位宽度
分析结果见表14,空间生态位宽度Levins测度范围为10.5159(Bacillus)—1.3178(Tuberibacillus),前5个营养生物位较宽的属有:Bacillus(10.5159)、Ornithinibacillus(8.6094)、Paenibacillus(7.8463)、Oceanobacillus(6.9927)、Rummeliibacillus(5.7417)、Vulcanibacillus(4.9111);可利用资源数最大的是5(Paenibacillus),最小的是1(Roseibacillus);当截断比例为0.10—0.18时,Paenibacillus拥有最多的常用资源,分别为S2=9.98%、S6=14.15%、S11=14.39%、S12=12.76%、S14=21.58%,Roseibacillus的常用资源仅为1个,S2=62.50%。

表14 芽胞杆菌空间生态位宽度Table 14 Space ecological niche breath of the Bacillus-like genera
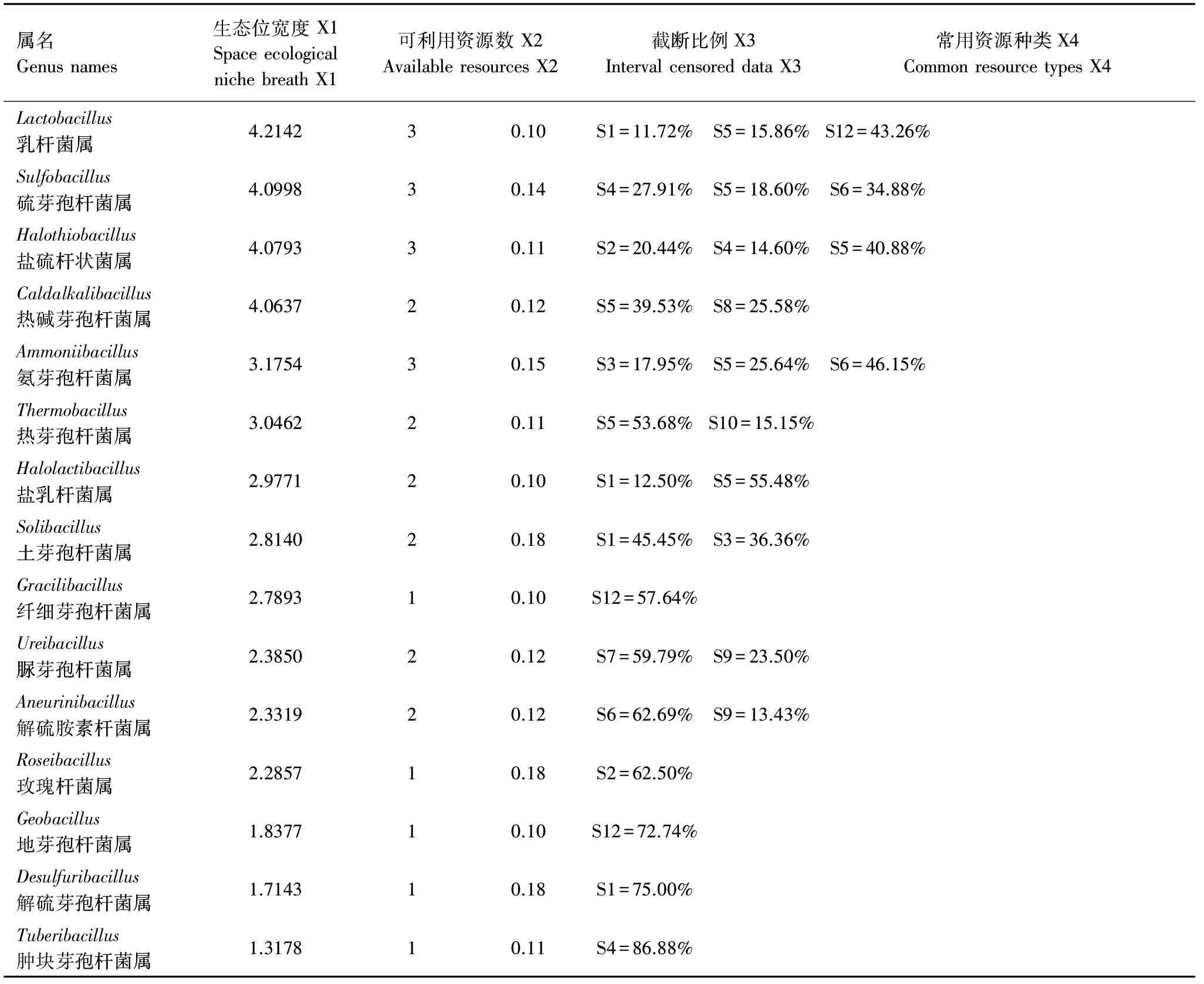
续表
2.6.2生态位宽度与垫料营养相关性
结合芽胞杆菌数量与垫料营养条件相关性表12和芽胞杆菌生态宽度表13进行分析,空间生态位较宽的属,其与垫料营养因子相关性较弱,如Bacillus(10.5159)、Ornithinibacillus(8.6094)、Paenibacillus(7.8463)、Oceanobacillus(6.9927)、Rummeliibacillus(5.7417)等,与垫料营养因子(水分、pH、有机质、全氮、腐殖酸等)之间相关性不显著,即对营养要求不高,适应性更广;空间生态位较窄的属,其与垫料营养因子相关性较强,如Gracilibacillus(2.7893,与水分呈反比)、Geobacillus(1.8377,与水分呈反比)、Ureibacillus(2.3850,与腐殖酸呈正比)等,与垫料某些营养因子之间相关性显著,即对营养要求较高,适应性窄。
2.7 微生物发酵床芽胞杆菌空间生态位重叠
2.7.1芽胞杆菌生态位重叠
分析结果见表15,分析表明空间生态位重叠Pianka测度范围为0.00—0.99。空间生态位重叠>0.90的属有:Gracilibacillus和Ammoniibacillus,Thermobacillus和Aneurinibacillus,Gracilibacillus和Geobacillus,Lactobacillus和Geobacillus,Lactobacillus和Gracilibacillus,Tuberibacillus和Halolactibacillus,这些属之间生态位重叠很高;空间生态位重叠=0.00的属有:Desulfuribacillus和Aneurinibacillus,Tuberibacillus和Desulfuribacillus,Tuberibacillus和Roseibacillus*,它们之间生态位几乎不重叠。
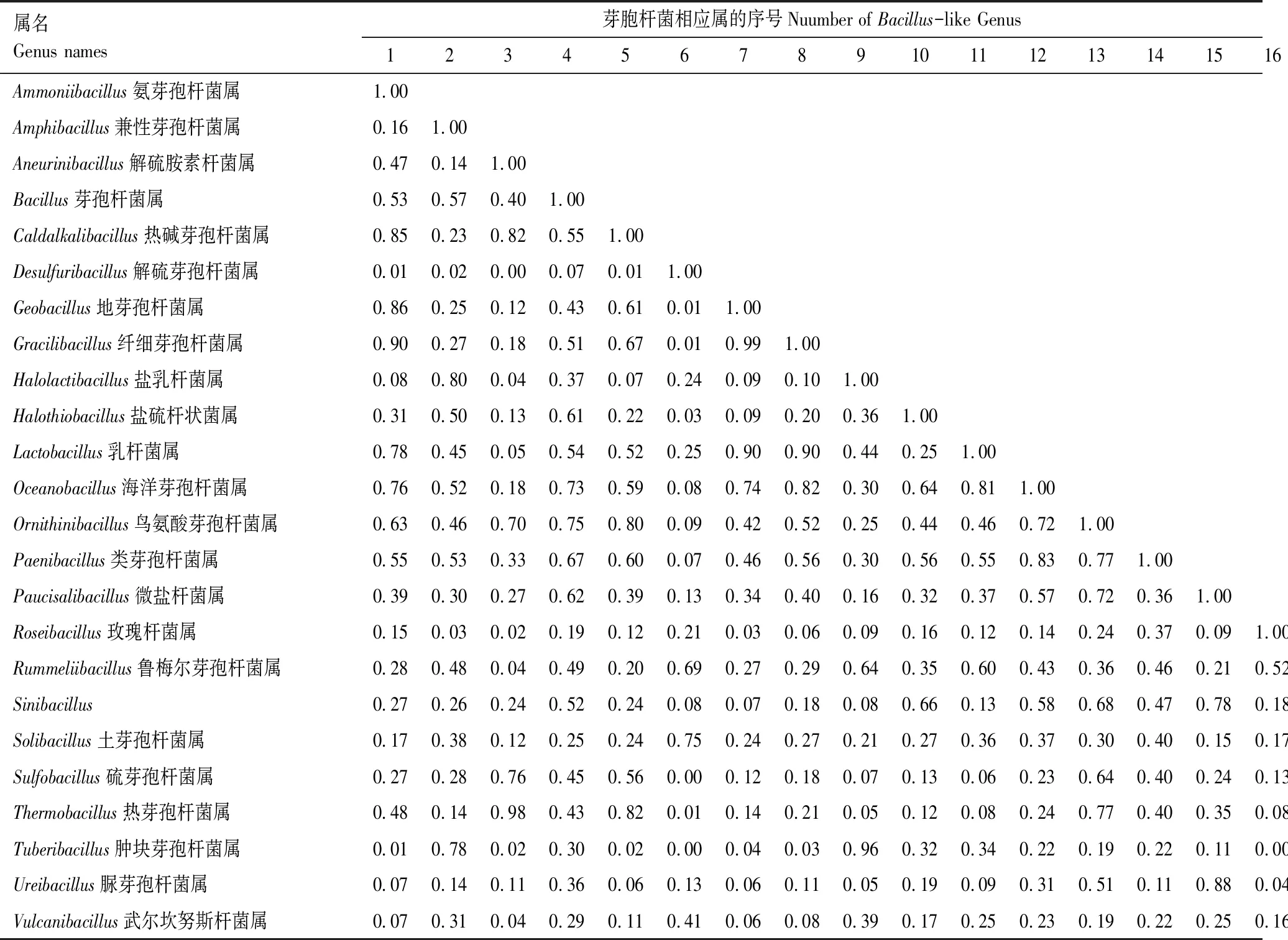
表15 芽胞杆菌空间生态位重叠Table 15 Correlation coefficient between space ecological niche overlap for Bacillus-like genera in the litter from the MFB
2.7.2种群数量与生态位重叠关系
结合芽胞杆菌数量(表6)和生态位重叠(表15)进行分析,芽胞杆菌含量与其生态位重叠分为3种形式,即非极端重叠型(生态位重叠介于0.20—0.80之间)、全程重叠型(0.00—1.00之间)、极端重叠型(<0.20或>0.80);高含量的芽胞杆菌属(Bacillus))(reads=8020)除了与Desulfuribacillus生态位重叠在0.07之外,与其他属生态位重叠范围在0.19—0.75之间,生态位重叠没有超过0.75,低于0.20的也少,属于非极端重叠型;高含量的乳杆菌属(Lactobacillus)(reads=4565)与其他属生态位重叠超过0.8的有Geobacillus和Gracilibacillus;低于0.20的有Aneurinibacillus(0.05)、Roseibacillus(0.12)、Sinibacillus(0.13)、Sulfobacillus(0.06)、Thermobacillus(0.08)、Ureibacillus(0.09),大部分在0.20—0.80之间,属于全程重叠型;高含量的肿块芽胞杆菌属(Tuberibacillus)(reads=1418)与其他属生态位重叠在0.320—0.80之间的只有2个属,即Amphibacillus(0.78)、Rummeliibacillus(0.48),大部分生态位重叠<0.20或>0.80,属于极端重叠型。
2.7.3生态位宽度与生态位重叠关系
结合表14和表15进行分析,芽胞杆菌空间生态位宽度与生态位重叠存在着相互关系,生态位较宽的属,如芽胞杆菌属(Bacillus)与鸟氨酸芽胞杆菌属(Ornithinibacillus)、与类芽胞杆菌属(Paenibacillus),它们与其他属之间的空间生态位重叠集中在0.30—0.70之间,较少出现<0.20或>0.80极端重叠;空间生态位较窄的属,如Roseibacillus、Geobacillus、Desulfuribacillus、Tuberibacillus与其他属之间的空间生态位重叠经常出现极端重叠状况,即生态位重叠主要分布在<0.20或>0.80。
3 讨论
芽胞杆菌能够产生芽胞,是一类能在多种环境尤其是极端环境下生存的微生物,具有很强的抗逆性[58]。芽胞杆菌在养殖废弃物处理方面具有重要作用,如臭味分解、有机质降解等。本研究采用活菌分离培养及宏基因组技术,从养猪微生物发酵床垫料中分析到芽胞杆菌24个属(其中2个属具有芽胞杆菌种名特性,不属于芽胞杆菌),相对含量最高的前3个属为Bacillus(芽胞杆菌属,芽胞杆菌科)(reads=8020)、Lactobacillus(乳杆菌属,芽胞杆菌纲)(reads=4565)、Tuberibacillus(肿块芽胞杆菌属,芽胞乳杆菌科)(reads=1418),成为优势属。尽管未见在微生物发酵床类似研究报道,但有报道表明这3个芽胞杆菌纲的属也是某些环境中的优势属,Hatayama等报道了Tuberibacillus(肿块芽胞杆菌属)为堆肥过程的优势属[59];Mowlick 等报道了肿块芽胞杆菌属具有耐酸和耐高温的特性,在温室栽培经过三氯甲烷消毒的土壤中成为优势属[60];乳杆菌属是猪肠道微生物的优势属[61]。微生物发酵床空间生态位中芽胞杆菌优势属保持着较高的种群数量,对猪粪降解和除臭消除起着重要作用,这一结果与徐庆贤等报道的芽胞杆菌属对于发酵猪粪和分解臭味起到重要作用一致[62]。研究发现微生物发酵床中Ammoniibacillus(氨芽胞杆菌属,类芽胞杆菌科)、Desulfuribacillus(脱硫芽胞杆菌属,待建立新科)、Tuberibacillus(肿块芽胞杆菌属,芽胞乳杆菌科),在国内未见报道,为中国新记录属,微生物发酵床中分布着如此多的芽胞杆菌属及其近缘属,未见相关研究报道。采用活菌计数和宏基因测序两种方法研究发现,将微生物发酵床整体作为一个生态位考察,不同空间采样的芽胞杆菌分布的数量差异较大,活菌计数空间样本芽胞杆菌含量范围4.3—26.7×106cfu/mL之间,相差6.2倍;宏基因测序含量(reads)范围在424—4130之间,相差9.7倍;活菌计数无法统计不可培养的芽胞杆菌,两种方法检测出的芽胞杆菌差异在同一个数量级;王香君等利用实时荧光定量PCR法和活菌计数定量鱼露和虾细菌,两种方法相差1—2个数量级[63];屠腾等利用细胞计数手段和DGGE技术分析松花江干流部分地区的细菌种群多样性[64];活菌计数和宏基因测序测定芽胞杆菌数量与之异曲同工,检测精度更高。
将微生物发酵床上层(0—20 cm)和下层(40—60 cm)不同深度的作为生态位考察,尽管微生物发酵床上下层垫料空间生态位营养特性差异显著,上层垫料的水分、pH值、全氮、腐殖酸低于下层,而好氧条件(上层2天翻耕1次,下层不翻耕)、有机质(猪粪增加在上层)、粗纤维(补充垫料在上层)含量高于下层,两种检测方法的芽胞杆菌总量上下层差异不显著;这种生态位差异要保持芽胞杆菌总数的平衡,是以发酵床上、下层生态位中芽胞杆菌种类分布变化差异为依据,上层生态位前5位高含量芽胞杆菌优势属(数量平均值)分别为Bacillus(532.86)、Lactobacillus(480.43)、Geobacillus(88.86)、Gracilibacillus(70.00)、Paenibacillus(40.86),而下层为Bacillus(612.86)、Tuberibacillus(188.57)、Lactobacillus(171.71)、Paucisalibacillus(60.00)、Ureibacillus(46.71),表明上下层不同芽胞杆菌优势种类选择不同营养特性的垫料生态位,维持着数量平衡;从而导致垫料上下层生态位中芽胞杆菌亚群落分化,构建了发酵床生态位中特异性芽胞杆菌亚群落。微生物发酵床芽胞杆菌空间生态位宽度是由发酵床营养和环境条件与芽胞杆菌生物学特性相互作用的结果。那些对发酵床环境条件适应范围较宽、对营养条件要求较低的种类,其空间生态位宽度较宽,可利用的资源数较多,反之亦然;芽胞杆菌空间生态位较宽的属,其与垫料营养和环境因子相关性较弱,如Bacillus(生态位宽度=10.5159)、Ornithinibacillus(8.6094)、Paenibacillus(7.8463)、Oceanobacillus(6.9927)、Rummeliibacillus(5.7417)等,与垫料营养和环境因子(水分、pH、有机质、全氮、腐殖酸等)之间相关性不显著(P>0.05),即对营养要求不高,适应性更广;空间生态位较窄的属,其与垫料营养和环境因子相关性较强,如Gracilibacillus(生态位宽度=2.7893,相关系数=-0.6804,与水分呈反比)、Geobacillus(1.8377,—0.6825,与水分呈反比)、Ureibacillus(2.3850,0.6898,与腐殖酸呈正比)等,这种与垫料某些营养和环境因子之间相关性显著,表明对营养和环境要求较高,适应性窄;由芽胞杆菌生物学特性适应环境条件形成的生态位特征,决定了其生境选择性;如芽胞杆菌属(Bacillus)能很好地适应许多不同类型生境,生态位宽度很广,成为生境内的优势种。芽胞杆菌属这种营养和环境适应性在其他的研究中有过报道,张福特等自佳西热带雨林土壤中分离到147株芽胞杆菌,其中芽胞杆菌属(Bacillus)是优势属,形成热带雨林土壤生态位芽胞杆菌特征种群[65];朱碧春等自南极土壤中分离到23株芽胞杆菌,主要为芽胞杆菌属(Bacillus),形成南极土壤生态位芽胞杆菌特征种群[66]。另一些种类如地芽胞杆菌属(Geobacillus)要求生存条件比较苛刻,生态位宽度较窄,只能在特定生境下生存,Sung等自堆肥系统中分离到一株Geobacillustoebii,此后多种耐热的地芽胞杆菌属细菌被分离鉴定,此属细菌在45℃以上温度下生存,最适生长温度为60℃,对生长环境要求高,是高温生态位的优势属[67]。
微生物发酵床芽胞杆菌空间生态位重叠研究发现,有些属之间的空间生态位重叠度很高(>0.90),如:Gracilibacillus和Ammoniibacillus,Thermobacillus和Aneurinibacillus,这些属之间生态位重叠超过0.90,享有共同的资源,存在竞争关系;有些属之间的空间生态位重叠度很低(0.00),如Desulfuribacillus和Aneurinibacillus,Tuberibacillus和Desulfuribacillus,它们之间生态位几乎不重叠,对资源的要求不同,不存在竞争关系。芽胞杆菌生态位重叠与其生态位宽度存在着相关关系,生态位较宽的属,如芽胞杆菌属(Bacillus),与鸟氨酸芽胞杆菌属(Ornithinibacillus)、类芽胞杆菌属(Paenibacillus)之间的空间生态位重叠集中在0.20—0.80之间,为常规重叠,较少出现<0.20或>0.80的极端重叠;空间生态位较窄的属,如Roseibacillus、Geobacillus、Desulfuribacillus、Tuberibacillus,与其他属之间的空间生态位重叠经常出现极端状况,即生态位重叠主要分布在<0.20或>0.80,要么重叠度很低(竞争关系弱),要么重叠度很高(竞争关系强),相关的研究未见报道,这一特性的研究对于了解芽胞杆菌在生态位中的资源利用具有重要意义。
微生物发酵床中芽胞杆菌种类根据生态位特性天然地形成了多菌株共存的微生物体系,共同完成猪粪消纳和臭味降解过程,这与EM菌群人工培养的复合微生物菌剂系统的功能具有相似性[68]。微生物有各自特定的生活环境,微生物分解功能在其适合的生长环境中得到发挥,因此,菌群生长环境的营养条件和生存条件形成的生态位特征选择了微生物;范瑞娟等发现受混合烃污染的土壤选择了由芽胞杆菌属、嗜氢菌属及鞘脂菌属等组成的复合微生物菌群,其能显著降低土壤中混合烃的含量[69]。李丹红等揭示了白蚁肠道环境适合于包含沙雷氏菌属(Serratia)和类芽胞杆菌属(Paenibacillus)的降解纤维素的混合菌群生存,对纤维素实施协同降解[70-71]。芽胞杆菌是环境中重要的有机物降解菌,王小英等自青海可可西里土壤特定生态位中分离嗜碱芽胞杆菌,环境胁迫和驯化使之能够产生蛋白酶、纤维素酶及木聚糖酶等多种酶系,在满足自身生长的同时发挥着生态功能[72]。对微生物发酵床生猪粪污降解系统中的芽胞杆菌生态位的研究,有助于理解养殖粪污形成的生态位环境,选择特定的芽胞杆菌种类,发挥特定的生态功能,为阐明微生物发酵床猪粪降解、臭味消除、猪病防控、资源化利用等提供科学数据。

