圈养条件下新疆马鹿两个亚种的肠道菌群比较分析
徐尚华, 吴家慧, 张宝峰, 石明慧, 王一晨, 胡 昕, 胡德夫*
(1.北京林业大学 生态与自然保护学院,北京 100083;2.北京动物园 圈养野生动物技术北京市重点实验室,北京 100044)
马鹿(Cervuselaphus)为鹿科大型兽类,广泛分布于欧亚大陆北部森林带,存在众多亚种,在我国均为国家二级重点保护动物。天山马鹿(Cervuselaphussongaricus)见于我国及哈萨克斯坦的天山森林带,具有耐严寒及适应能力强等特点[1]。塔里木马鹿(Cervuselaphusyarkandensis)仅见于我国新疆塔里木河流域的胡杨林,是我国特有的马鹿亚种,具有耐炎热干燥、耐粗饲、抗病能力强等特点[2]。马鹿是重要的药用动物,具有很高的经济价值,在我国新疆,天山马鹿和塔里木马鹿都有规模化的饲养种群。肠道菌群是指生活在宿主体内复杂且处于动态平衡的微生物群落[3],是处理食物的关键[4],从而影响宿主能量的获取和储存,进而影响宿主的健康、免疫、代谢等功能[5-6]。许多研究人员对鹿类动物(如麋鹿、马鹿等)的肠道菌群进行了研究,发现厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)在肠道菌群中占主导地位[7-9]。大量证据表明菌群稳定是肠道稳态的基础,菌群的失调易导致消化道疾病。例如,志贺氏菌(Escherichia-Shigella)和梭杆菌属(Fusobacterium)丰度的显著升高会导致林麝腹泻[10],梭杆菌门(Fusobacteria)丰度的显著上升会导致羔羊腹泻[11],早期肠道菌群的失调可能是导致鸵鸟幼鸟高死亡率的重要原因[12],人体肠道内正常细菌与致病菌的比例失调可能是宿主肠道发生炎症的触发点[13]。迄今天山马鹿肠道菌群鲜有研究,而塔里木马鹿菌群的研究主要集中在瘤胃微生物。研究表明,普雷沃式菌属(Prevotella)是塔里木马鹿瘤胃内的优势菌属,是瘤胃中最丰富的菌属之一,表现出遗传多样性和代谢多样性,该菌属所含有的活性半纤维素降解酶在植物纤维的分解中发挥着潜在的作用[14-15]。然而天山马鹿与塔里木马鹿的肠道菌群组成至今仍不明确。本研究通过16S rRNA基因测序技术对圈养天山马鹿与塔里木马鹿的肠道菌群进行比较分析,旨在了解两种马鹿亚种肠道菌群的核心菌群、微生物组成以及多样性,获得马鹿种群的基础菌群数据,为两种马鹿亚种间肠道菌群的差异,以及我国马鹿养殖业的发展和鹿场饲养管理的改善提供参考。
1 材料与方法
1.1 材料
1.1.1 实验动物 2021年10月分别于新疆乌鲁木齐天山马鹿养殖中心和新疆库尔勒塔里木马鹿养殖中心选取年龄、体型相近的健康成年雄性马鹿各7只,用耳标区分每只马鹿个体。天山马鹿及塔里木马鹿的食物组成按《马鹿饲养技术》[16]和《马鹿的养殖技术》[17]的饲料配比:精饲料玉米30%,豆饼(油渣)20%,糠麸50%,钙30~40 g,盐20~30 g;粗饲料为干草、野草、农作物茎叶及苜蓿等。
1.1.2 主要试剂与仪器设备 MN NucleoSpin®96 Soil试剂盒(德国 MACHEREY-NAGEL公司);Qubit dsDNA HS测定试剂盒(美国 Life Technologies公司);E.Z.N.A. Gel &PCR Clean Up Kit试剂盒(美国 OMEGA公司);Monarch DNA Gel Extraction Kit试剂盒(美国 NEB公司);KOD FX Neo酶(上海东洋纺管理有限公司)。微型离心机(1795,北京天根生化科技有限公司);振荡器(G560E,美国 SI公司);96 well PCR仪(9902,美国 ABI公司);24孔离心机(5424EQ766751,德国 Eppendorf公司);高速离心机(Legend Micro 21,德国 Eppendorf公司);真空泵(ZK-26/100,杭州米欧仪器有限公司);酶标仪(SynergyHTX,香港基因有限公司)。
1.2 方法
1.2.1 样品采集 每日6:30(北京时间)进入圈舍采集新鲜粪便样本。观察个体排便后,迅速使用无菌乳胶手套收集放入自封袋中,密封后记录采集日期、耳标等信息,并立即保存于液氮中运送回实验室,-80 ℃冷冻保存直至提取DNA。新疆库尔勒天山马鹿简称CES(C.e.songaricus),新疆乌鲁木齐塔里木马鹿简称CEY(C.e.yarkandensis)。
1.2.2 DNA提取、16S rRNA基因扩增和测序 使用MN NucleoSpin 96 Soil提取细菌DNA。通过Qubit dsDNA HS测定试剂盒测量DNA的浓度和纯度。使用引物 338F(5′-ACTCCTACGGGAGGCAGCA-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)从14份粪便样本中扩增出细菌16S rRNA基因的V3~V4区。聚合酶链反应(polymerase chain reaction,PCR)体积为10 μL,包含5 μL KOD FX Neo Buffer,0.2 μL KOD FX Neo,2 μL dNTP,10 μmol/L正向和反向引物各0.3 μL,50 ng基因组DNA,其余体积为ddH2O。PCR条件:95 ℃持续5 min,然后进行25个循环,分别为95 ℃持续30 s,50 ℃持续30 s,72 ℃持续40 s和72 ℃持续7 min。PCR产物用OMEGA DNA 纯化柱进行过滤柱纯化。最终,在Biomarker Technologies Corporation(中国北京)进行Illumina HiSeq 2500平台(Illumina,Inc.,圣地亚哥,美国加利福尼亚)的高通量测序。
1.2.3 生物信息学分析 对原始数据进行拼接(FLASH,version 1.2.11),将拼接得到的序列进行质量过滤(Trimmomatic,version 0.33),并去除嵌合体(UCHIME,version 8.1),得到高质量的 Tags 序列。在相似性97%的水平上对序列进行聚类(USEARCH,version 10.0),以测序所有序列数的0.005%作为阈值过滤操作分类单元(operational taxonomic unit,OTU)。细菌数据库参考SILVA。在Mothur(version 1.30)软件中计算得到的α多样性指数,来表明细菌群落的丰富性和多样性。α多样性是指一个特定区域或者生态系统内的多样性,常用的度量菌群丰度的指标有Chao1丰富度估计量(Chao1 richness estimator);度量菌群多样性的指标有香农-威纳多样性指数(Shannon-wiener diversity index)、辛普森多样性指数(Simpson diversity index)等,Simpson指数值越小,说明群落多样性越高;Shannon指数越大,说明群落多样性越高。β多样性反映两个种群间细菌群落的差异,使用加权和非加权unifrac距离度量进行计算。采用单向相似性分析(analysis of similarities,ANOSIM)来确定细菌群落之间的组间差异。使用R语言中的vegan包进行分析,使用python绘制ANOSIM分析图。LefSe分析,即组间差异显著物种分析(可以称作生物标记物分析),采用线性判别分析(linear discriminant analysis,LDA)来估算每个组分(物种)丰度对差异效果影响的大小,该分析主要用于在丰度上找到组间有显著差异的物种(LDA>4.0 为差异显著)。
1.2.4 统计分析 应用SPSS 21.0软件对数据进行独立样本t检验,数据结果以均值±标准差表示,P≤0.05具有统计学意义。
2 结果与分析
2.1 测序水平
从7头天山马鹿与7头塔里木马鹿的粪便样本中共获得516 902个有效序列,单个样本的序列为27 361~46 487(平均36 921.57±1 681.75),平均长度为(418.07±0.85) bp。在97%的序列相似性水平共鉴定出617个OTU,样本的平均OTU个数为455.21±8.61(范围:414~529,图1A)。检测到的OTU的稀疏曲线,随着测序深度的增加,观察到的物种数量也在增加(图1B)。最终,曲线开始趋于平稳,表明随着提取序列数量的增加,检测到的OTU数量减少。

图1 天山马鹿和塔里木马鹿粪样OTU数目图(A)和稀释性曲线(B)Fig.1 OTU number diagram(A) and rarefaction curves (B) of fecal samples from Tianshan red deer and Tarim red deer
韦恩图和花瓣图显示了天山马鹿和塔里木马鹿粪样中共有和独有的分类单元,两组中所有个体共有的细菌类群被视为马鹿肠道中的核心菌群。两组马鹿粪样中共有579个OTU,天山马鹿独有25个OTU,塔里木马鹿则独有13个OTU(图2A),共享OTU占天山马鹿的95.86%;占塔里木马鹿的97.80%。天山马鹿个体共有299个OTU,而塔里木马鹿个体共有230个OTU(图2B、C),其中天山马鹿共有OTU占平均单个样本所有OTU的比例(98.82%)高于塔里木马鹿(96.99%)。利用微生物参考数据库对OTU的代表序列进行比对归类,可将检测到的主要细菌归类至14个门、22个纲、41个目、85个科、195个属。
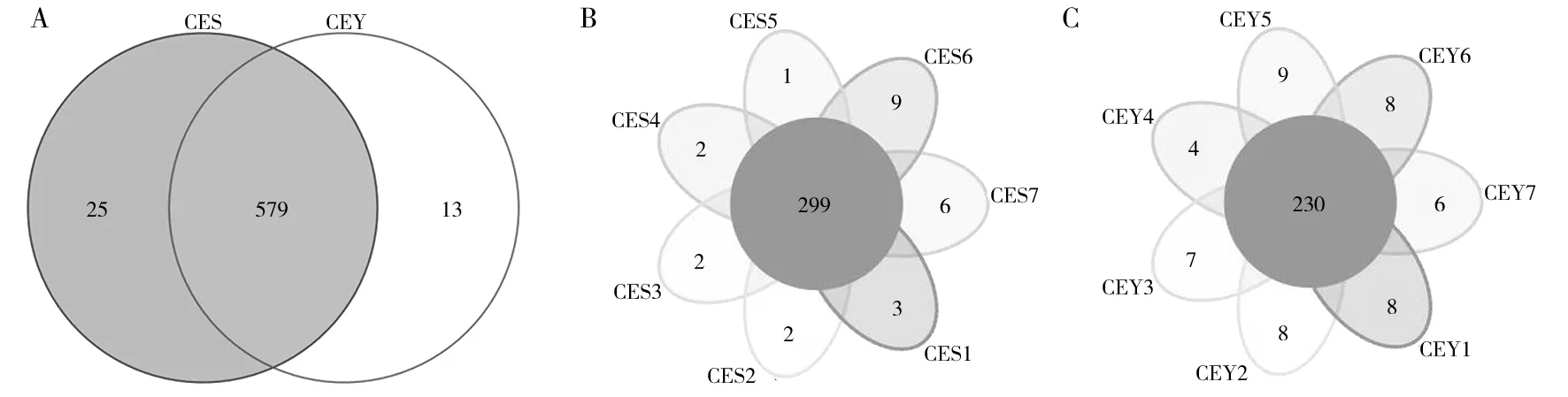
图2 天山马鹿和塔里木马鹿粪样韦恩图和花瓣图Fig.2 Venn plot and flower plot of fecal samples from Tianshan red deer and Tarim red deerA:韦恩图;B:天山马鹿花瓣图;C:塔里木马鹿花瓣图A:Venn plot; B:Flower plot of Tianshan red deer; C:Flower plot of Tarim red deer
2.2 α多样性分析
通过α多样性计算,检验两个亚种之间肠道菌群的差异,OTU反映物种的丰富程度,天山马鹿与塔里木马鹿两个亚种之间存在着显著的差异(图3)。Chao1、Shannon和Simpson等指数均在天山马鹿与塔里木马鹿两组之间存在显著差异,天山马鹿的肠道菌群多样性显著高于塔里木马鹿。
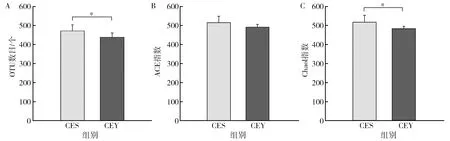
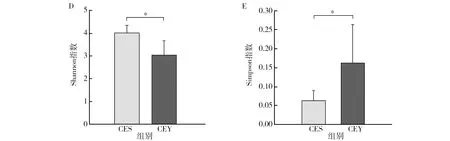
图3 天山马鹿和塔里木马鹿肠道菌群α多样性分析Fig.3 α diversity analysis of Tianshan red deer and Tarim red deer*表示存在显著差异*Idicates that there is a significant difference
2.3 β多样性分析
使用QIIME软件进行β多样性分析,比较不同样本在物种丰度分布的相似程度。β多样性分析主要采用加权unifrac、 非加权unifrac算法计算样本间的距离从而获得样本间的β值。非度量多维标度(non-metric multidimensional scaling,NMDS)图显示,基于加权unifrac距离度量,样本种群可清晰的聚类(图4A),ANOSIM结果显示天山马鹿和塔里木马鹿两组微生物群落之间存在显著差异 (R=0.423,P<0.05,图4B);而基于非加权unifrac方法无法清晰地将两组样本种群区分开(图4C),ANOSIM结果显示天山马鹿和塔里木马鹿两组微生物群落之间差异不显著(R=0.141,P=0.058,图4D)。

图4 天山马鹿和塔里木马鹿肠道菌群β多样性分析Fig.4 β diversity analysis of Tianshan red deer and Tarim red deerA:基于加权unifrac算法的NMDS分析;B:基于加权unifrac算法的相似性分析;C:基于非加权unifrac算法的NMDS分析;D:基于非加权unifrac算法的相似性分析A:NMDS analysis based on weighted unifrac;B:ANOSIM based on weighted unifrac;C:NMDS analysis based on unweighted unifrac;D:ANOSIM based on unweighted unifrac
2.4 不同分类水平优势菌群组成分析
马鹿的肠道优势菌群在门水平上,两组马鹿的优势菌门为厚壁菌门Firmicutes(CES:53.74%;CEY:53.95%)、放线菌门Actinobacteria(CES:7.99%;CEY:24.71%)、变形菌门Proteobacteria(CES:19.30%;CEY:12.60%)、拟杆菌门Bacteroidetes(CES:16.36%;CEY:7.47%)、螺旋体门Spirochaetes(CES:1.59%;CEY:0.77%)、髌骨细菌门Patescibacteria(CES:0.32%;CEY:0.24%)、疣微菌门Verrucomicrobia(CES:0.36%;CEY:0.10%)、蓝藻菌门Cyanobacteria(CES:0.13%;CEY:0.06%)、绿弯菌门Chloroflexi(CES:0.10%;CEY:0.000 3%)、软壁菌门Tenericutes(CES:0.01%;CEY:0.08%)(图5 A、B)。


图5 天山马鹿和塔里木马鹿肠道菌群组成图Fig.5 Composition of intestinal microbiota of Tianshan red deer and Tarim red deer A: 两组之间在门水平上的对比图;B: 各样本在门水平上的对比图;C: 两组之间在属水平上的对比图;D: 各样本在属水平上的对比图A: Comparison at phylum level between two groups; B: Comparison of samples at phylum level; C: Comparison at genus level between two groups; D: Comparison of samples at genus level
在属水平上,两组马鹿的优势菌为不动杆菌属Acinetobacter(CES:10.47%;CEY:10.48%)、双歧杆菌属Bifidobacterium(CES:0.59%;CEY:17.37%)、森林土源芽胞杆菌属Solibacillus(CES:12.71%;CEY:4.80%)、狭义梭菌属1Clostridiumsensustricto1(CES:2.08%;CEY:9.07%)、瘤胃球菌科UCG菌属RuminococcaceaeUCG005(CES:5.66%;CEY:4.57%)、索氏梭菌属Paeniclostridium(CES:6.27%;CEY:3.93%)、罗斯氏菌属Romboutsia(CES:3.70%;CEY:5.41%)、理研菌科RC9肠道菌群RikenellaceaeRC9gutgroup(CES:5.47%;CEY:2.20%)、苏黎氏菌属Turicibacter(CES:0.75%;CEY:5.82%)、节杆菌属Arthrobacter(CES:1.65%;CEY:4.87%)(图5C、D)。
2.5 菌群差异分析
通过LEfSe分析(图6),天山马鹿和塔里木马鹿肠道中有24个菌群存在差异。塔里木马鹿Actinobacteria、RuminococcaceaeUCG014的相对丰度显著高于天山马鹿;天山马鹿Proteobacteria、Bacteroidetes、类芽胞杆菌属(Paenibacillus)、RikenellaceaeRC9gutgroup、Solibacillus、Acinetobacter的相对丰度显著高于塔里木马鹿。
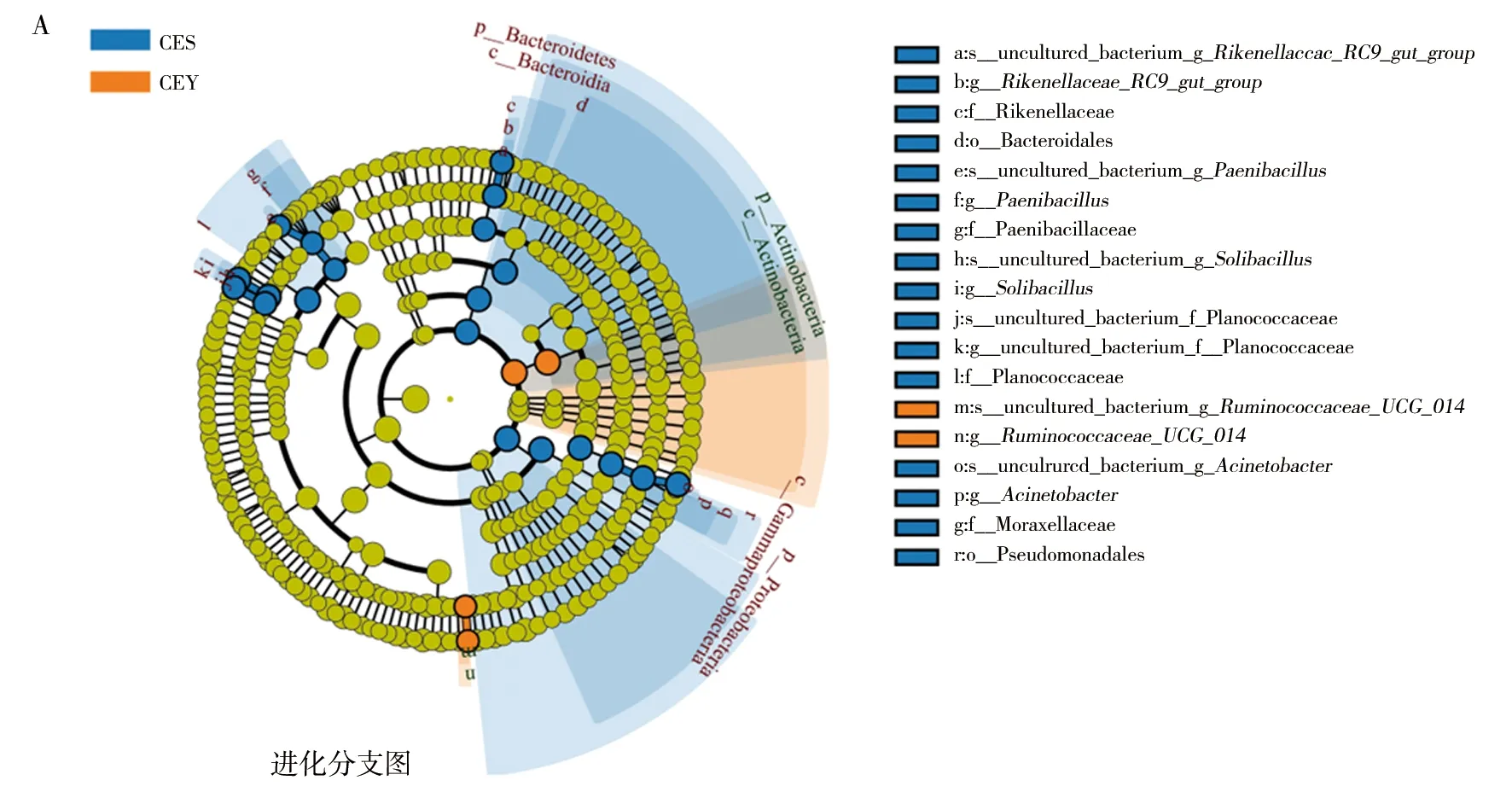
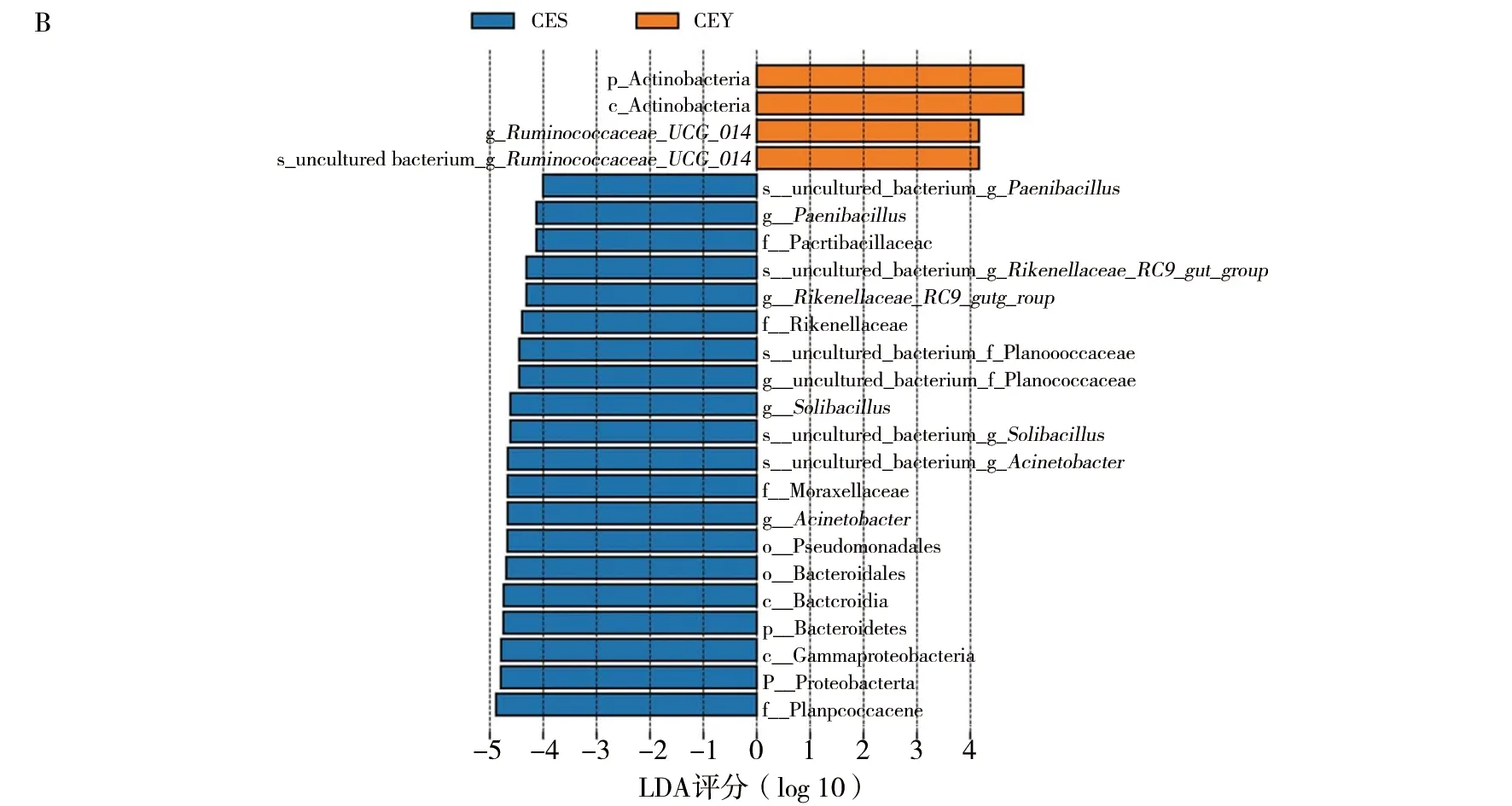
图6 天山马鹿和塔里木马鹿肠道菌群LEfSe分析Fig.6 LEfSe analysis about intestinal microbiota of Tianshan red deer and Tarim red deerA:进化分支图;B:LDA值分布柱状图(LDA>4.0)A:Cladogram diagram; B:LDA value distribution histogram (LDA>4.0)
3 讨 论
本研究采用16S rRNA基因测序技术首次对比分析天山马鹿与塔里木马鹿两个马鹿亚种肠道菌群。OTU稀疏曲线(图1B)表明本研究测序数据充足,能够体现样本中的绝大部分物种。韦恩图和花瓣图表明两个马鹿亚种共享OTU占天山马鹿的95.86%,占塔里木马鹿的97.80%。一项关于羊亚科三个不同属的研究结果表明,三个属之间共享OTU达74%以上[18]。这表明近源的反刍动物共享相似的核心菌群[19]。
此外,天山马鹿的共有OTU占平均单个样本所有OTU的比例高于塔里木马鹿,且α多样性指数比较显示(图3),天山马鹿菌群多样性和丰度显著高于塔里木马鹿。研究者普遍认为,健康的肠道菌群系统具有细菌多样性和丰度高的特点,具备更高的结构稳定性和抵抗力[20-21]。因此天山马鹿肠道菌群结构稳定性高于塔里木马鹿,同一饲养条件下天山马鹿肠道抵抗力和恢复力更高,塔里木马鹿更易罹患消化道疾病。另一方面,样本之间的差异也表明菌群结构的复杂性,这与不同品种的羊的菌群结构具有显著差异的研究结果一致[22]。
β多样性结果显示马鹿亚种间的差异不显著(非加权的unifrac距离结果显示P=0.058>0.05)。基于非加权unifrac方法分析,主要比较物种的有无,若两个群体的β多样性距离越小,则物种类型越相似。这表明天山马鹿所具有的菌群种类与塔里木马鹿基本相同,仅是丰度存在差异,即在相同饲养条件下,天山马鹿与塔里木马鹿肠道菌群的基本结构一致。推测其菌群之间的差异源自于长期生活在不同环境下所产生的亚种间菌群的适应性变化。自然状态下天山马鹿的生存环境为山地森林和林间草地[23],食源植物种类较多,包括雪岭云杉、禾本类植物、莎草科植物、苜蓿和苔藓植物等;而塔里木马鹿的生存环境为荒漠河岸林[24],较为干燥,主要食物为芦苇、胀果甘草及胡杨等。因此,天山马鹿肠道菌群的高多样性可能是在适应中保留下来的。
天山马鹿和塔里木马鹿菌群结构中优势菌门包括厚壁菌门、放线菌门、变形菌门和拟杆菌门,与前人研究一致[25]。其中厚壁菌门和拟杆菌门被认为是反刍动物的核心菌门,与马鹿[26]、黇鹿[27]、麋鹿[7]等研究一致。厚壁菌门是主要的纤维素分解细菌,可以将纤维素分解为挥发性脂肪酸,供宿主使用[28]。拟杆菌门可降解碳水化合物和蛋白质,参与肠道免疫调节[29]。二者在粗纤维消化过程中发挥着重要作用,因此在马鹿及其他草食动物肠道菌群中处于优势地位[30]。此外,厚壁菌门与拟杆菌门比值(F/B ratio)是研究肠道菌群的重要指标,与肠道菌群从食物中提取能量的效率成正比[18,31]。天山马鹿拟杆菌门丰度显著高于塔里木马鹿,F/B比值(3.28)小于塔里木马鹿(7.22),表明塔里木马鹿肠道菌群从食物中获取能量的效率高于天山马鹿。这可能是由于塔里木马鹿从环境中摄取的食物相比天山马鹿较为粗糙,所含能量较少,所以其肠道菌群需从相对较少的资源中获取尽可能多的能量,从而满足自身及宿主的能量需求。同时有研究表明,高淀粉饮食可提高拟杆菌门的丰度[29]。因此,可适当提高塔里木马鹿的精饲料比例,促进拟杆菌门的富集。
放线菌门是维持肠道屏障稳态的必要参与者,在维持肠道稳态中起着关键作用,可发酵碳水化合物并产生短链脂肪酸,为机体提供能量。放线菌门产生的脂肪酸经一定反应后形成的盐(如乙酸盐等)可以保护宿主免受肠道病原体(如肠出血性大肠埃希菌、志贺氏菌)感染[32],在免疫系统中起着至关重要的作用。塔里木马鹿肠道中的放线菌门丰度显著高于天山马鹿,且放线菌门下的双歧杆菌属也高于天山马鹿。有研究表明宿主双歧杆菌丰度在高纤维食物条件下会显著升高,在高脂肪食物条件下丰度下降[33-34]。这意味着对天山马鹿而言,目前饲料中的粗饲料水平还有待提升。
变形菌门对木质素的消化起着重要作用[35]。因此在以植物纤维为主的饲养环境下,变形菌门在天山马鹿和塔里木马鹿的肠道菌群中占有优势地位。本研究中,天山马鹿肠道中变形菌门丰度显著高于塔里木马鹿。有研究表明,摄入高脂高蛋白食物的宿主肠道菌群中,变形菌门相对丰度高[36],这可能意味着目前圈养马鹿的饲料配方对天山马鹿来说精饲料比例过高(所饲精饲料含玉米淀粉、豆粕及麸皮等),应适当降低精饲料配比。
在属水平上,二者共同优势菌属为不动杆菌属。该菌属部分细菌为条件致病菌,在环境中广泛分布,是医院内感染主要原因,对公共卫生具有重要意义[37]。也有研究表明,该菌具有代谢多样性,可降解己内酰胺、除草剂、有机磷农药和多种石油烃组分等[38]。推测不动杆菌属的优势地位可能源自饲料中的农药残留或者是从环境中摄入。本研究中,天山马鹿肠道中不动杆菌属丰度显著高于塔里木马鹿。该菌高丰度表明在之后的饲养管理中需要关注动物身体状况,否则在罹患消化道疾病时该菌很可能会导致病情的恶化。
此外,塔里木马鹿的RuminococcaceaeUCG014相对丰度高于天山马鹿。Ruminococcaceae属于厚壁菌门,该科的细菌可将植物细胞壁分解成营养基质,供其他微生物利用[19,39-41]。这表明塔里木马鹿在分解植物细胞壁获得的能力强于天山马鹿,在同等食物条件下,塔里木马鹿可获取更高的能效。
天山马鹿的理研菌科RC9(RikenellaceaeRC9gutgroup)、类芽胞杆菌属(Paenibacillus)、Solibacillus相对丰度高于塔里木马鹿。理研菌科RC9的高丰度可能与脂质代谢有关[42]。类芽胞杆菌属可以为食草动物和植物抵御病原体(细菌、真菌、线虫和病毒)侵袭,还可合成多种酶,包括淀粉酶、纤维素酶等,辅助分解饲料中的碳水化合物;另一方面,它还是条件性致病菌[43],当宿主肠道稳态失衡时可能作为致病菌促进病程发展。这与上述推测饲料中精饲料配比过高的结论一致,同时更应关注天山马鹿健康状况。Solibacillus在病变及瘤胃酸中毒的条件下会减少[44-45],目前被认为是有益菌。有益菌丰度也会影响肠道稳态的动态平衡,这提示需更多关注塔里木马鹿的消化状况。
圈养条件下,塔里木马鹿肠道菌群多样性低于天山马鹿,天山马鹿肠道中的条件性致病菌(不动杆菌属、类芽胞杆菌属)相对丰度较高,均不利于肠道菌群的稳定及健康。针对二者不同的菌群组成,认为在现有基础上,可适当减少天山马鹿的精饲料配比,提高塔里木马鹿的精饲料配比,以求改善二者的菌群组成。
本研究通过描述圈养天山马鹿及塔里木马鹿的肠道优势微生物种群,旨在了解不同马鹿亚种肠道微生物组成差异,阐明其肠道菌群的组成及结构,为两个亚种间肠道菌群的差异提供参考,为检测天山马鹿及塔里木马鹿肠道菌群的健康状况提供依据。这些信息为改善圈养马鹿健康饲养管理提供重要依据,为圈养马鹿的肠道菌群健康稳定以及将来进一步为重要野生动物的管理保护提供参考。

