赤眼蜂与柞蚕卵共生细菌群落分析及功能预测
袁伟宁, 魏玉红, 郭建国, 郭致杰
(甘肃省农业科学院 植物保护研究所,甘肃 兰州 730070)
赤眼蜂(Trichogramma)是目前市场化程度最高的一类寄生性天敌昆虫,已被普遍应用于多种农业害虫的综合治理,如稻纵卷叶螟(Cnaphalocrocismedinalis)、亚洲玉米螟(Ostriniafurnacalis)、松毛虫(Dendrolimus)和棉铃虫(Helicoverpaarmigera)等[1-4]。在防治应用过程中,不同环境因子对赤眼蜂生物学特性、适应性和寄生率等诸多方面有显著影响[5-7],因此需要对赤眼蜂进行抗逆性筛选,以使其适应本地小气候环境。赤眼蜂对逆境的适应不仅仅表现为功能基因的表达和体内物质调节,其内共生菌群落和功能也极大地影响着宿主对环境因子的适应性[8]。内共生菌与宿主昆虫的趋利关系是双向的,昆虫内环境及特殊组织在为共生菌提供优越生存条件的同时,共生菌也为宿主反馈诸多益处[9]。例如,抵御外源有害生物侵入及非生物胁迫[10-11],提高昆虫对化学农药的抗性[12-13],增强宿主对寄主植物的适应性[14],调控宿主营养代谢与生殖代谢等[15-16]。可见,内共生菌对昆虫生物学特性及环境适应等多方面的调控发挥着重要作用。内共生菌主要分布在昆虫中肠[17]、卵巢以及特殊细胞或组织中[18],通常以变形菌门(Proteobacteria)细菌丰度最高,其次为拟杆菌门(Bacteroidetes)、放线菌门(Actinomycetes)、衣原体门(Chlamydiae)和厚壁菌门(Firmicute)等[19]。与宿主关联最为密切的内共生菌主要有α-变形菌、β-变形菌、γ-变形菌、拟杆菌门,以及厚壁菌门乳酸杆菌属(Lactobacillus)、芽胞杆菌属(Bacillus)、放线菌属(Actinomyces)、螺旋菌属(Heliobacillus)等[20],这些内共生菌在营养供应及消化方面起着关键作用,可提升昆虫对摄食营养的吸收,促进生长发育[21-24],尤其以合成并供给氨基酸和胆固醇等功能最为重要[25]。另外,内共生菌还对调节昆虫内环境有积极作用,例如宿主通过中肠上皮细胞感知细菌信号,进而促进细胞稳态提升,此过程主要依赖细菌与肠道上皮细胞交互接触进行调节,或者通过扩散性分子与代谢物进行调节[26-28]。除此之外,内共生菌还可以激活多种昆虫的免疫致敏效应,提升宿主对病原物的抵抗力。例如大肠埃希菌(Escherichiacoli)等能够有效激活昆虫的Toll和Imd免疫通路,诱导抗菌肽在宿主内环境中表达,从而快速清除异源致病菌[29-30]。另外在昆虫耐热性和抗药性等方面,内共生菌也有突出贡献,可以在一定范围内调节宿主昆虫的抗逆性,从而增强对环境的适合度[31-32]。昆虫内共生菌除了影响宿主的机体免疫功能、内环境调节、营养平衡和生长发育外,还影响昆虫的生殖与性别。例如肠杆菌科杀雄菌属(Arsenophnus)[33-34],能通过抑制宿主中心体的形成使有丝分裂期纺锤体功能缺失[35],最终迫使雄性被消除;类似具有杀雄作用的还有沃尔巴克氏菌(Wolbachia),其能引起宿主细胞质不相容,使雄虫(携带沃尔巴克氏体)与雌虫交配产生的受精卵发生胚胎期死亡,甚至可以使雄性个体丧失基因型特征,进而致使雄性个体消亡[36-37]。综上所述,昆虫内共生微生物直接或间接对宿主发挥着多方面的重要作用,因此对昆虫内共生菌的研究,有利于从这一特殊生物群体出发而获得对特殊条件具有耐性的天敌昆虫。赤眼蜂作为一种重要的天敌,目前国内工厂化繁殖技术主要依赖于“大卵繁殖”方式,即利用非自然寄主柞蚕(Antereaeapernyi)、蓖麻蚕(Philosamiacynthia)等鳞翅目昆虫的大型卵进行扩繁。“大卵”作为赤眼蜂的食物,其中内共生菌平行传递对赤眼蜂生理生化等各方面有重要影响。因此,为了探明柞蚕卵与赤眼蜂内共生菌的相互联系,本研究对柞蚕卵和赤眼蜂的内共生菌进行了测定,并进行了生物群落功能分析,以期为赤眼蜂扩繁实践提供数据参考。
1 材料与方法
1.1 材料
1.1.1 样本提取 ①柞蚕卵:柞蚕(Antheraeapernyi)购自大连龙祥丝棉有限责任公司(辽宁庄河)。将初羽化的柞蚕雌蛾腹部剖开,取出柞蚕卵置于灭菌的蒸馏水中进行多次清洗,直至柞蚕卵表面无黏液、无杂质。滤出柞蚕卵后用4% NaCl溶液冲洗1次,冲洗后的卵浸泡在质量分数为1%的次氯酸钠溶液中1 min,后转入70%酒精中1 min,然后用5%硫代硫酸盐清洗3 min,再用蒸馏水冲洗1次,最后在无菌条件下滤出晾干,剔除未成熟或破损的卵。共剖取约100 mL卵备用。通过“圆锥四分法”从中随机取10 mL供提取DNA,-80 ℃保存;剩余90 mL用于接种松毛虫赤眼蜂备用。②赤眼蜂:松毛虫赤眼蜂(Trichogrammadendrolimi)蜂种由甘肃省农业科学院植物保护研究所提供。将备用的柞蚕卵按照蜂卵比1∶10进行接蜂,接蜂24 h后筛去种蜂,将接蜂后的卵装在培养盒内,置于(25±1) ℃、相对湿度为75%、24 h全暗的人工气候箱内培养,培养第8天后12 h剖卵观察赤眼蜂发育进程,在蛹初羽化未咬破柞蚕卵卵壳时置于-20 ℃终止发育。通过“圆锥四分法”随机从终止发育的柞蚕卵中提取出赤眼蜂3 mL,用4% NaCl溶液冲洗1次,冲洗后的卵浸泡在质量分数为1%的次氯酸钠溶液中1 min,转入70%酒精中1 min,然后用5%硫代硫酸盐清洗3 min,再用蒸馏水冲洗1次,最后在无菌条件下滤出晾干,置于-80 ℃下保存备用。③DNA提取:将保存备用的赤眼蜂和柞蚕卵样本30 mg,置于灭菌的1.5 mL的离心管中进行DNA混合提取。用研磨棒于液氮冷冻条件下将样品研磨成粉末状,按照血液/组织、细胞基因组提取试剂盒(DP304)说明书提取总DNA,总DNA溶解于50 μL TE缓冲液中,用NanoDrop微量分光光度计测定OD260/280值,当比值为1.8~2.5时则为合格,-80 ℃保存,送至百迈克生物公司(http:// www. biomarker. com.cn/)进行建库测序。
1.1.2 主要试剂与仪器设备 血液/组织,细胞基因组提取试剂盒(DP304,天根生化科技(北京)有限公司),4%NaCl,1%次氯酸钠,75%酒精,5%硫代硫酸盐。智能人工气候箱(RXZ-500D-LED,宁波海曙赛福实验仪器厂);高速离心机(3K15,博劢行仪器有限公司);漩涡仪(X-HC,国旺实验仪器厂);数显恒温水浴锅(HH-4,金坛市佳美仪器有限公司);NanoDrop微量分光光度计(NanoDrop 2000c,赛默飞世尔科技(中国)有限公司)。
1.2 方法
1.2.1 建库测序 提取样品总DNA后,以混合样品为模板,利用16S rRNA通用引物进行PCR扩增,所选引物:16S-F: 5′-AGAGTTTGATCCTGGCTCAG-3′,16S-R:5′-GGTTACCTTGTTACG-ACTT-3′,目标片段约为1 500 bp。反应条件:94 ℃变性5 min,94 ℃ 30 s,56 ℃退火1 min,72 ℃ 1 min,35个循环,72 ℃延伸7 min。反应体系:10×PCR Buffer 3 μL;10 mmol/L dNTPs 1 μL;50 mmol/L MgCl21 μL;Platinum TMTaqDNA polymerase (Thermo Fisher Scientific) 0.5 μL;引物各0.5 μL;DNA模板1 μL;ddH2O补足至30 μL。对其产物进行纯化和定量,使形成测序文库,建好的文库先进行文库质检,OD260/280大于1.8时为合格。文库用Illumina HiSeq 2500平台进行测序,高通量测序得到的原始图像数据文件经碱基识别分析转化为原始测序序列(Sequenced Reads)。高通量测序及数据处理部分均由百迈克生物公司(http://www.biomarker.com.cn/)完成。
1.2.2 数据预处理 根据PE reads之间的Overlap关系,将Hiseq测序得到的双端序列数据拼接成一条序列Tags,同时对Reads的质量和拼接效果进行质控过滤。主要有以下三个步骤:①PE reads拼接:使用 FLASH v1.2.7软件,通过overlap对每个样品的 reads 进行拼接,得到的拼接序列即原始 Tags 数据(Raw Tags);②Tags过滤:使用Trimmomatic v0.33软件,对拼接得到的 Raw Tags进行过滤,得到高质量的Tags 数据(Clean Tags);③去除嵌合体:使用UCHIME v4.2软件,鉴定并去除嵌合体序列,得到最终有效数据(Effective Tags)。
1.2.3 OTU分析 根据不同的相似度水平,对所有序列进行OTU划分,如果序列之间的相似性高于97%就可以把它定义为一个分类操作单元(OTU),每个OTU对应于一种代表序列。使用QIIME(version 1.8.0)软件中的 UCLUST对Tags在97%的相似度水平下进行聚类、获得OTU,并基于Silva和UNITE分类学数据库对OTU进行分类学注释。
1.2.4 Alpha多样性指数统计 使用Mothur(version v.1.30)软件,对样品Alpha多样性指数进行评估。
1.2.5 Shannon指数曲线 利用 Mothur 软件和R语言工具依据各样品的测序量在不同测序深度时的Shannon指数(反映样品中微生物多样性的指数)绘制Shannon多样性指数稀释曲线,以此反映各样本在不同测序数量时的微生物多样性。
1.2.6 系统进化分析 用QIIME软件挑选出属分类学水平上丰度最高的OTU的序列作为代表序列,进行多重序列比对并构建系统进化树,然后通过Python语言工具绘制图形。进化树中每个分支代表一个物种,分支长度为两个物种间的进化距离,即物种的差异程度。
1.2.7 16S功能基因预测分析 使用PICRUSt软件通过比对16S测序数据获得的物种组成信息,推测样本中的功能基因组成,从而分析不同样本间在功能上的差异。首先对生成的OTU-table进行标准化;然后通过每个OTU对应的Greenge-ne ID获得OTU对应的KEGG和COG家族信息,从而计算该KEGG和COG的丰度。在属水平对不同样本间的物种丰度使用STAMP中的G-TEST(大样本:注释到的功能基因数目大于20)和Fisher(小样本:注释到的功能基因数目小于20)检验方法进行样本间的显著性差异检验,对组间进行T-test检验,P-value阈值为0.05。
2 结果与分析
2.1 测序结果与质量评估
样品测序结果如表1所示,共获得柞蚕卵共生微生物原始序列33 504条;赤眼蜂共生微生物原始序列140 147条,过滤后的优化序列数分别为31 697和132 853。获得柞蚕卵有效序列数30 571个,平均序列长度417 bp;获得赤眼蜂有效序列数130 719个,平均序列长度411 bp,二者有效序列数分别占原始总序列数的91.26%和93.29%。根据样品稀释性曲线(图1)和香农指数曲线(图2),二者均较早达到了平台期,因此样本量继续增加不会引起内共生菌物种数量的增加,样品序列充分,可以进行数据分析。
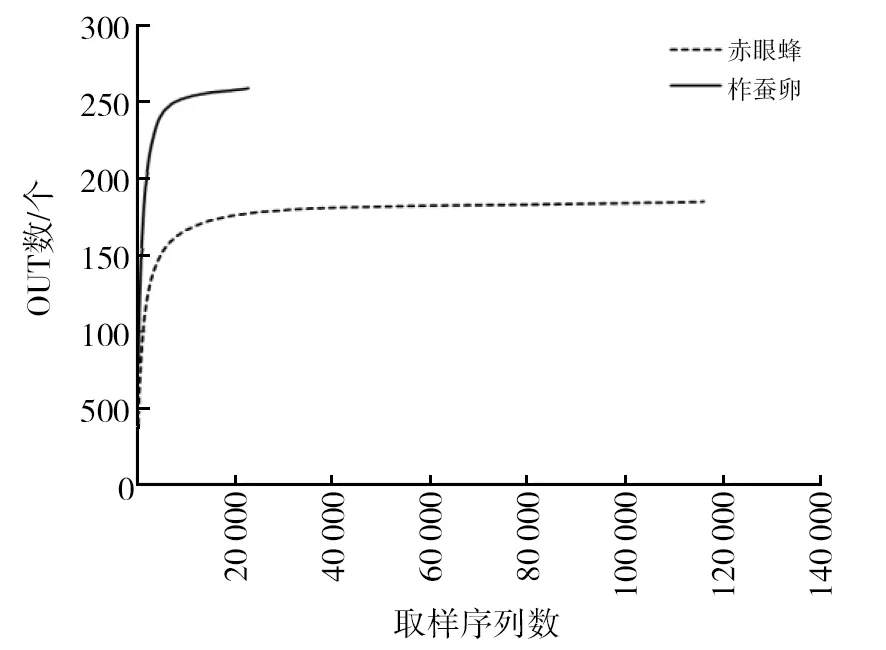
图1 多样本稀释曲线 Fig.1 Multi-sample rarefaction curves
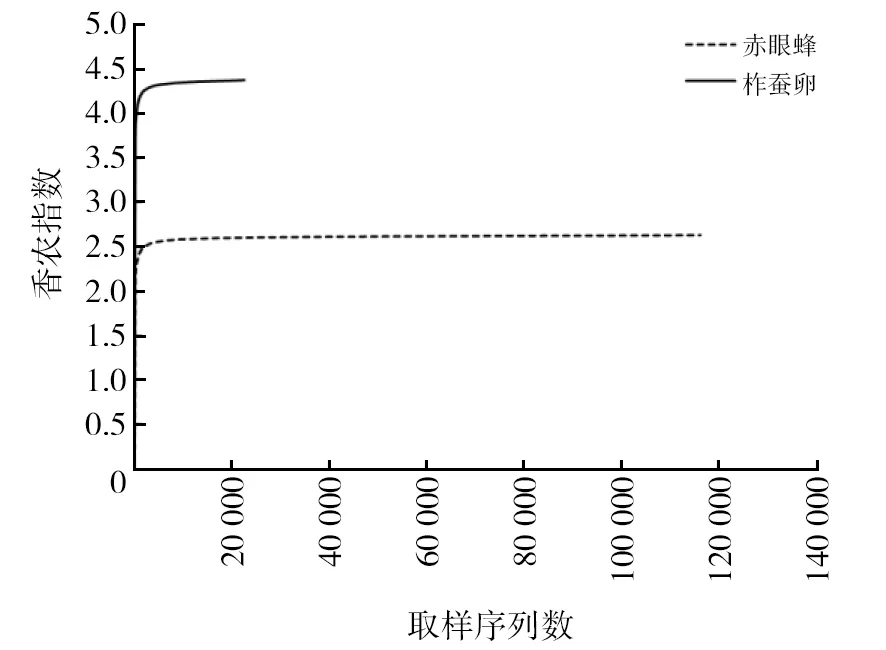
图2 多样本香农曲线 Fig.2 Multi-sample shannon curves

表1 柞蚕卵和赤眼蜂样品高通量测序基本信息Table 1 Basic information of high-throughput sequencing of tussah egg and Trichogramma sample
2.2 OTU分析
对Tags在97%的相似度水平下进行聚类,获得赤眼蜂和柞蚕卵内共生菌的OTU个数。由图3可知,赤眼蜂内共生菌聚类获得185个OTU,柞蚕卵内共生菌聚类获得259个OTU,混合共有373个OTU,因此二者共同享有 71个OTU,其中赤眼蜂特有114个OTU,柞蚕卵特有188个OTU。

图3 OTU数分布 Fig.3 OTU numbers distribution在97%的相似度水平下,通过聚类tags获得OTU数OTUs were obtained by clustering tags at 97% similarity level
2.3 内共生菌物种分类与多样性分析
对OTU进行去低含量筛除,得到最终的OTU,并统计出各分类单元下注释物种的tags数(表2)。在属分类阶元下,柞蚕卵有22 855 tags被鉴定,赤眼蜂有116 143 tags被鉴定。柞蚕卵内共生菌被鉴定的物种数量在各级分类单元上均高于赤眼蜂,分别隶属于17门,35纲,62目,109科,186属;赤眼蜂内共生菌分别隶属于11门,20纲,48目,84科,133属。

表2 聚类结果统计Table 2 Clustering results statistics
对属分类水平上丰度前15的共生菌进行相对丰度分析(图4)。赤眼蜂相对丰度大于1%的内共生菌主要为葡萄球菌属(Staphylococcus)、沙雷氏菌属(Serratia)、芽胞杆菌属、肠杆菌属(Enterobacter)、假单胞菌属(Pseudomonas)、泛菌属(Pantoea)、鞘氨醇单胞菌属(Sphingobium)、埃希氏杆菌-志贺氏菌属(EscherichiaShigella)和中生根瘤菌属(Mesorhizobium),其中葡萄球菌所占比例最大,相对丰度为61.18%;柞蚕卵相对丰度大于1%的内共生菌主要为不动杆菌属(Acinetobacter)、假单胞菌属、副球菌属(Paracoccus)、肠杆菌属、微小杆菌属(Exiguobacterium)、鞘氨醇单胞菌属、短波单胞菌属(Brevundimonas)、微杆菌属(Microbacterium)、埃希氏杆菌-志贺氏菌属、芽胞杆菌属、短杆菌属(Brevibacterium) 和泛菌属,其中不动杆菌属所占比例最大,相对丰度为12.72%。二者共有菌群为肠杆菌属、假单胞菌属、泛菌属、埃希氏杆菌-志贺氏菌属、芽胞杆菌属和鞘氨醇单胞菌属,除芽胞杆菌属分布在厚壁菌门外,其他均分布在变形菌门γ-变形菌纲。Alpha多样性分析表明柞蚕卵内共生菌数量和物种丰富度均高于赤眼蜂(表3),同时Shannon指数表明,柞蚕卵的内共生菌均匀度较赤眼蜂高。由于赤眼蜂内共生菌均匀度较低,导致群落多样性也相对较低。总体来看,赤眼蜂和柞蚕卵OTU覆盖率趋近于1,表明统计结果真实反应了样本中微生物的分布情况。

图4 属水平的物种分布Fig.4 Distribution of species at genus level在属分类单元上对赤眼蜂和柞蚕卵内丰度前15的共有内共生菌进行分析,统计时剔除未分类的物种Endosymbiotic bacteria of top 15 shared within Trichogramma and Tussah-egg were analyzed on genus category,the unclassified species was discarded when it was for statistics

表3 Alpha多样性指数Table 3 Alpha diversity index
2.4 物种系统进化分析
对内共生菌进行不同分类阶元下的物种分析表明(图5),丰度比例高于0.1%的物种主要分布在变形菌门、厚壁菌门(Firmicutes)、拟杆菌门、放线菌门、螺旋体菌门(Saccharibacteria)、芽单胞菌门(Gemmatimonadetes)、酸杆菌门(Acidobacteria)和异常球菌门(Deinococcus)。其中变形菌门物种多样性较其他门分类阶元下的物种多样性高,但是厚壁菌门的物种丰度最高,以葡萄球菌属占据主要丰度。总体来看,属分类阶元下,厚壁菌门内共生菌主要分布在赤眼蜂体内,其他门下内共生菌主要分布在柞蚕卵内。丰度分析表明,赤眼蜂体内葡萄球菌属分布量最高,而柞蚕卵内不动杆菌属分布量最高。

图5 属水平GraPhlAn树Fig.5 GraPhlAn tree under genera cluster level对属分类水平上丰度大于0.1%的OTU序列进行多重序列比对,并构建GraPhlAn系统进化树。进化树中每种颜色的区域代表一个门,每条树枝代表一个物种,树枝长度为两个物种间的进化距离,树枝上的节点大小代表物种在该分类介元下的相对丰度,节点越大相对丰度越高。进化树外每个环代表一个样品组,环上的柱代表一种内共生菌在属分类介元上两个样本间相对丰度的高低,红色代表该物种在两个样本间的相对丰度较高,蓝色相反。环外面不同颜色的柱代表属分类水平下一个物种在总物种中的丰度,并注释了丰度大于1%的物种Multiple sequence alignments were performed for OTU sequences with abundance greater than 0.1% at the genus level, and then the GraPhlAn tree was constructed. In the evolutionary tree, each color region represents a Phylum, each branch represents a species, the length of branch is the evolutionary distance between two species, and the size of a node on a branch represents the relative abundance of a species under each classification element, the bigger node, the higher relative abundance. Each circle in the evolutionary tree represents a sample, and the column on the outside circle represents the relative abundance of endosymbiotic bacteria between two samples. Red represents the higher relative abundance of sample, while blue represents the opposite. Different colored columns represent the abundance of endosymbiotic bacteria at the genus level in the total species; finally annotate species with the abundance greater than 1%
系统进化分析表明,放线菌门丰度高于1%的白杆菌属(Leucobacter)和微杆菌属遗传距离较近;厚壁菌门丰度高于1%的三种内共生菌遗传距离相同,分别为芽胞杆菌属、微小杆菌属和葡萄球菌属;拟杆菌门丰度高于1%的内共生菌中弯杆菌属(Flectobacillus)和噬纤维细菌科(Cytophagaceae)的一种不可培养的内共生菌遗传距离较近,此两种内共生菌与黄杆菌属(Flavobacterium)和拟杆菌科的一种不可培养的内共生菌遗传距离较远;变形菌门丰度高于1%的内共生菌中肠杆菌属(Enterobacter)、埃希氏杆菌属(Escherichia)、泛菌属和沙雷氏菌属遗传距离较近,不动杆菌属和水栖菌属(Enhydrobacter)遗传距离较近,溶杆菌属(Lysobacter)和寡养单胞菌属(Stenotrophomonas)遗传距离较近,其他内共生菌遗传距离均较远。
2.5 内共生菌群落在代谢途径和蛋白质功能上的差异性分析
通过KEGG分析柞蚕卵和赤眼蜂之间共生微生物群落的功能基因在代谢途径上的差异和变化(图6)。

图6 KEGG代谢途径差异分析Fig.6 Difference analysis of KEGG metabolic pathway左侧柱图为不同功能基因在两组样品中的丰度,中间所示为95%置信度区间内功能基因的丰度差异,右侧为P值The figure, the bar on the left represents the abundance of different functional genes in the two samples, the middle part represents the differences of abundance within the 95% confidence interval, and the number on the right part was the P value
共观测了微生物群落的40种基因功能,代谢功能差异最显著的为胞膜转运功能。为了适应环境,赤眼蜂内共生菌群落的胞膜转运功能显著强于柞蚕卵内共生菌,其次为碳水化合物代谢功能。而柞蚕卵内共生菌群落氨基酸代谢功能明显强于赤眼蜂,其次为异生物降解和代谢功能。在所有生物功能当中,微生物群落功能主要为氨基酸代谢功能和碳水化合物代谢功能,但是二者在赤眼蜂和柞蚕卵中的功能强弱有差异,在赤眼蜂体内,碳水化合物代谢功能较强,而在柞蚕卵内,氨基酸代谢功能较强。
通过COG对微生物群落蛋白质功能进行分类,共预测了微生物群落的23种蛋白质功能(图7)。除普通功能和未知功能外,赤眼蜂和柞蚕卵内共生菌群落蛋白质的氨基酸转运代谢功能最强,其次为碳水化合物转运代谢功能。赤眼蜂内共生菌群落蛋白质的氨基酸转运代谢功能显著强于柞蚕卵,但是柞蚕卵内共生菌群落蛋白质的脂质转运代谢功能和信号传导功能显著强于赤眼蜂。相较于其他蛋白质功能,细胞骨架功能、胞外结构功能、RNA加工修饰功能和染色质结构动态功能均非常弱。

图7 COG蛋白功能预测分析Fig.7 Functional prediction of COG protein左侧柱图为不同功能蛋白在两组样品中的丰度,中间所示为95%置信度区间内蛋白丰度的差异,右侧为P值As shown As shown in the figure, the bar on the left represents the abundance of different functional protein in the two samples, the middle part represents the differences of abundance within the 95% confidence interval, and the number on the right part was the P value
3 讨 论
共生菌与昆虫互利依存且相互影响的现象广泛存在,柞蚕卵在生产中作为赤眼蜂的营养基质和生活场所,其内共生菌极大地影响着赤眼蜂的生存、生长和发育等诸多方面。本研究通过16S rRNA高通量测序技术研究了赤眼蜂和柞蚕卵的内共生菌。研究表明,赤眼蜂和柞蚕卵内丰度或多样性较高的内共生菌主要分布在变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)和放线菌门(Actinobacteria),其次还有螺旋体菌门(Saccharibacteria)、芽单胞菌门(Gemmatimonadetes)、酸杆菌门(Acidobacteria)和异常球菌门(Deinococcus),这与其他昆虫共生菌群落的研究报道相似,例如褐飞虱(Nilaparvatalugens)和桔小实蝇(Bactroceradorsalis)等[20,38-39]。内共生菌物种分类与多样性分析表明,柞蚕卵的内共生菌物种多样性较赤眼蜂高,二者共同享有71个OTU,属分类水平上丰度前15且大于1%的共有共生菌为肠杆菌属、假单胞菌属、泛菌属、埃希氏杆菌-志贺氏菌属、芽胞杆菌属、鞘氨醇单胞菌属,除芽胞杆菌属外,其他均分布在变形菌门γ-变形菌纲。变形菌门是昆虫共生细菌中最大的门类,可在昆虫的中肠中生存,对宿主的生物学特性、存活率、抗逆性、碳氮循环、营养代谢和免疫等方面有重要影响[40]。例如肠杆菌属能够相对促进逆境胁迫中桔小实蝇寿命延长[41]。另外,对黑腹果蝇(Drosophilamelanogaster)的研究表明,肠道共生菌对PGRP-SCs(Peptidoglycan recognition protein SC)分子活性有影响,PGRP-SC表达上调又对共生菌平衡具有修复作用,并限制干细胞增殖,降低宿主细菌性炎症反应,从而延长果蝇寿命[42];假单胞杆菌属能分泌蛋白酶,消化并利用蛋白质,并将氨基酸或能量提供给宿主[43];或直接降解脂肪酸和碳水化合物[44-45],帮助宿主消化食物;鞘氨醇杆菌属对烷烃、杂环芳香烃具有很强降解能力,其糖苷水解酶等碳水化合物活性酶能够促进碳源物质降解和吸收[46],因此猜测,此类共生菌可能与肠杆菌属相似,对赤眼蜂消化食物和生长发育具有积极的促进作用;泛菌属对昆虫遭受氧化胁迫引起的损伤具有良好的修复作用,能显著提高宿主在逆境胁迫的耐受性,例如盐胁迫[47],这可能对赤眼蜂适应逆境至关重要。研究表明,昆虫的内共生菌在种群间或种群内的传播方式主要为垂直传递和水平传递,其中初级共生菌多为垂直传递,次级共生菌多为水平传递[48]。本研究中的肠杆菌属等共有共生菌为次级共生菌,因此极有可能在赤眼蜂和柞蚕卵之间进行水平传播,即通过赤眼蜂取食柞蚕卵卵黄进行传递。
赤眼蜂和柞蚕卵除共有内共生菌外,还有许多特有内共生菌。在赤眼蜂体内,葡萄球菌属所占比例最大,相对丰度达61.18%。葡萄球菌属对宿主昆虫的免疫反应具有调节效应,例如金黄葡萄球菌能诱导家蚕BmToll9-2基因表达上调,这对昆虫保持免疫致敏应答和抵抗外源病原生物具有关键作用[49]。除此之外,金黄葡萄球菌属还能诱导中肠、马氏管和血淋巴碱性磷酸酶活性显著升高,从而增强宿主抵抗外源细菌侵染的免疫防御反应[50]。相对于赤眼蜂,柞蚕卵内共生菌中不动杆菌属所占比例最大,相对丰度为12.72%。不动杆菌属多为鳞翅目昆虫的优势共生菌[51-52],它是一种非发酵糖的革兰阴性球杆菌,广泛分布于自然界和昆虫肠道内,酯酶活性作用强,能促进氨苄西林、青霉素、氯氰菊酯、溴氰菊酯等物质的代谢,有助于提高宿主抗性[53-55]。由此可见,赤眼蜂和柞蚕卵中优势内共生菌均与宿主免疫和抗逆性相关,这可能是长期协同进化过程中为了抵御不良外因而进行的选择性演替。但是值得注意的是,赤眼蜂体内丰度仅次于葡萄球菌属的为沙雷氏菌属,其对昆虫具有致病致死作用,其中粘质沙雷氏菌对亚州玉米螟、三角新卷叶蛾(Olethreutesleucaspis)等具有较高致死性[56]。研究表明,寄生蜂对感病寄主卵有一定的驱避性,感病寄主卵不利于寄生蜂子代的发育[57-58]。赤眼蜂体内的沙雷氏菌属是否影响其对于感病柞蚕卵和健康卵的选择性,需要进一步系统研究。
诸多研究表明,昆虫内共生菌在营养代谢方面可为宿主昆虫提供氨基酸等物质,如布赫纳氏菌属(Buchnera)[59-60],甚至部分昆虫(如白蚁)可通过共生菌弥补氮代谢的缺乏[61]。在碳水化合物代谢方面,内共生菌能将大分子碳源物质转化为短链脂肪酸,包括乙酸、丙酸和丁酸等[62]。例如耐氧乳酸菌可将白蚁体内的单糖发酵为乳酸,而拟杆菌属则能将乳酸发酵为乙酸和丙酸等供宿主吸收利用[63]。通过KEGG和COG分析柞蚕卵和赤眼蜂之间共生微生物群落代谢途径上的功能基因,并对微生物群落蛋白质功能进行了预测。结果显示,微生物群落功能基因主要与氨基酸代谢和碳水化合物代谢相关。对微生物群落蛋白质功能预测显示,赤眼蜂和柞蚕卵内共生菌群落的氨基酸转运代谢功能最强,其次为碳水化合物转运代谢功能,可见COG功能预测与KEGG分析的功能基因量相呼应。上述功能分析结果与Nikoh等[59]、Philipp等[64-65]诸多前人学者对昆虫内共生菌群落功能研究相吻合。尽管赤眼蜂和柞蚕卵内共生菌群落均以氨基酸转运代谢和碳水化合物转运代谢较强,但是二者之间有差异。赤眼蜂内共生菌群落蛋白质的氨基酸转运代谢显著(P<0.05)强于柞蚕卵,而柞蚕卵内共生菌群落蛋白质的脂质转运代谢和信号传导功能显著(P<0.05)强于赤眼蜂,这种差异可能与共生菌的宿主种类相关。赤眼蜂以柞蚕卵为营养来源,需要将柞蚕卵的氨基酸和蛋白质等物质消化吸收,并转化为自身营养物质,因此氨基酸转运代谢功能较强。
本研究从内共生菌物种分类与多样性分析、系统进化、内共生菌群落代谢途径和蛋白质功能分析深刻阐述了赤眼蜂和柞蚕卵内共生菌群落的异同点,以及二者内共生菌群落功能差异,为柞蚕卵与赤眼蜂内共生菌的平行传递奠定了基础,对探索赤眼蜂对寄主选择的适用性具有重要意义。但是本文仅基于16S rRNA高通量测序方法对共生菌群落进行了研究,不同种属内共生菌在柞蚕卵和赤眼蜂之间的平行传递还需要通过“抑菌-接菌”的方法做进一步验证。

