兰州百合粗低聚糖对嗜热链球菌ATCC-14485和保加利亚乳杆菌ATCC-11842产酸及增殖的影响
刘迪茹,唐绍琰,董 尧,符 瀛,马浩民,高琦宽
兰州百合粗低聚糖对嗜热链球菌ATCC-14485和保加利亚乳杆菌ATCC-11842产酸及增殖的影响
刘迪茹1,唐绍琰1,董 尧1,符 瀛1,马浩民1,高琦宽2*
(1. 兰州大学公共卫生学院营养与食品卫生研究所,兰州 730000;2. 甘肃政法大学,甘肃省证据科学技术研究与应用重点实验室,兰州 730070)
益生元在促进益生菌生长、调节肠道微生态平衡方面发挥着重要作用。为探究兰州百合粗低聚糖(crude lily oligosaccharides, CLOs)的益生元特性,以兰州百合干为原料,提取、表征CLOs;以低聚果糖和菊粉作为阳性对照,测定CLOs在人工胃肠溶液的水解度,以及对嗜热链球菌ATCC-14485和保加利亚乳杆菌ATCC-11842的产酸、增殖作用的影响。结果表明:CLOs分子量为1 194 Da,主要由甘露糖、阿拉伯糖和葡萄糖组成,摩尔比为1 : 3.57 : 16.40;CLOs经人工胃肠溶液消化后水解度是26.96%,显著低于菊粉(< 0.05);CLOs促进乳酸菌发酵产酸的效果显著优于菊粉和低聚果糖(< 0.05);当CLOs的添加量为1.0%()时,能有效促进嗜热链球菌和保加利亚乳杆菌的增殖,并减缓二者在货架期的死亡速率。研究结果说明CLOs具有益生元特性,可为新型共生发酵乳的研发提供理论依据。
兰州百合粗低聚糖;益生元特性;嗜热链球菌;保加利亚乳杆菌;产酸;增殖
嗜热链球菌()和保加利亚乳杆菌()在发酵乳制品的生产中用作基础发酵剂,通过针对性添加益生元,一方面可促进二者的增殖和产酸,提高货架期的活菌数[1],另一方面可调节人体肠道微生态、调节免疫、增加机体对矿物质的吸收[2]。益生元的研究初期主要针对低聚糖。20世纪七八十年代,日本首先发现功能性低聚糖不能被人体消化,却能被肠道内细菌选择性利用的特性[3]。此后,根据该特性将其应用于乳制品行业,成为功能性低聚糖的下游产业,具有强大的市场发展动力[4]。目前作为益生元被广泛应用于食品工业中的功能性低聚糖有低聚果糖(fructo-oligosaccharide,FOS)、菊粉(Inulin)、低聚半乳糖、低聚木糖、低聚异麦芽糖、大豆低聚糖[5-7]等,从来源广泛的植物资源中挖掘新型低聚糖对于丰富发酵产品的多样性具有重要意义。
兰州百合(var.)鳞茎属药食同源物品。目前,国内外对百合多糖研究主要集中在多糖的提取、分离纯化、组成分析和药理作用等方面[8-10],而暂无百合低聚糖对乳酸菌发酵、增殖影响的研究。因此,本项目以兰州百合干为原料,提取、表征百合粗低聚糖(CLOs),以FOS和Inulin作为阳性对照,研究CLOs在人工胃肠液中的水解度对嗜热链球菌ATCC-14485和保加利亚乳杆菌ATCC-11842产酸速率以及货架期中活菌数的影响,以期为CLOs在共生发酵乳中的应用提供理论依据。
1 材料与方法
1.1 试材与试剂
兰州百合干,市售;纤维素酶(7 000 U·g-1),北京酷来搏科技有限公司;胰蛋白酶(4 000 U·g-1)、猪胆盐和木瓜蛋白酶(80 000 U·g-1),北京索莱宝科技有限公司;纯牛乳,兰州庄园牧场股份有限公司(蛋白质5%,脂肪5%,非脂乳固体≥4.5%);嗜热链球菌ATCC-14485和保加利亚乳杆菌ATCC-11842,山东中科嘉亿生物工程有限公司;Inulin、FOS(纯度 > 90%,DP < 10%),北京酷来搏科技有限公司;葡萄糖(Glu)等单糖标准品,北京酷来搏科技有限公司(纯度 > 99%);氯仿、三氟乙酸等为色谱纯,其他化学试剂均为分析纯。
1.2 主要仪器与设备
大容量高速冷冻离心机(5910R),德国Eppendorf公司;旋转蒸发仪(A-1000S),上海爱朗仪器有限公司;冷冻干燥机(FD1A-50),北京博医康实验仪器有限公司;可见分光光度计(723N),上海精密科学仪器有限公司;生化培养箱(HPX-150),上海跃进医疗器械有限公司;气相色谱仪(450-GC),美国瓦里安;数控超声波清洗器(KQ-600DE),昆山市超声仪器有限公司;多功能粉碎机(1000 A),东莞房太电器有限公司;pH计(PHS-3C),上海仪电科学仪器股份有限公司;凝胶色谱仪(1515-2707-2414),美国Waters公司;傅里叶变换红外光谱仪(Nexus670),美国Nicolet公司。
1.3 试验方法
1.3.1 CLOs的提取 百合干粉碎、过80目筛,收集备用。本研究采用改良后的超声波协同复合酶法[10]提取CLOs。将百合粉与蒸馏水按照1:25(g·mL-1)的料液比混合,调节溶液pH为7后,加入1.5%()木瓜蛋白酶和2.0%()纤维素酶,超声(242 W,50 ℃,25 min)辅助酶解,然后置于95 ℃水浴10 min灭酶。离心(10 000 r·min-1,10 min)取上清液,在65 ℃下减压浓缩,加入4倍体积的无水乙醇,静置过夜。离心(10 000 r·min-1,15 min)取下层沉淀物,真空冷冻干燥8 ~ 10 h,即可得到CLOs。
CLOs的得率计算如公式(1)所示:
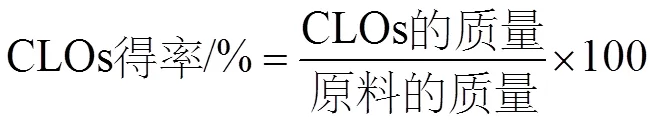
1.3.2 CLOs中还原糖、总糖以及蛋白质含量的测定 采用3, 5-二硝基水杨酸法(3,5-dinitrosalicylic acid method,DNS)测定CLOs中还原糖含量[11];采用SN/T 4260—2015《中华人民共和国出入境检验检疫行业标准出口植物源类食品中粗多糖的测定-苯酚硫酸法》的方法测定CLOs中总糖含量;采用SN/T 3926—2014《中华人民共和国出入境检验检疫行业标准出口乳、蛋、豆类食品中蛋白质的测定-考马斯亮蓝》的方法测定CLOs中蛋白质含量。
1.3.3 CLOs分子量分析 采用凝胶渗透色谱法(GPC)[12]测定CLOs的分子量。
1.3.4 CLOs红外光谱测定 采用傅里叶变换红外光谱的方法(FTIR)[12]测定CLOs的红外光谱。
1.3.5 CLOs单糖组成分析 采用气相色谱法(GC)[13],制备CLOs进样溶液及单糖对照衍生物,色谱参数如下。色谱柱:HP-Innowax(30 m×0.25 mm×0.25 μm);升温程序:230 ℃保持7 min,以3 ℃·min-1升至245 ℃,保持18 min;载气(N2)流速1.2 mL·min-1,进样量1 μL;分流比1 : 20,进样口温度为250 ℃。
1.3.6 人工胃肠液消化试验 将CLOs、FOS(阳性对照1)和Inulin(阳性对照2)分别配置成5.0 g·L-1的溶液,采用Nor等[14]的方法配制人工胃液,采用González等[15]的方法配制人工肠液,按照叶子晨等[16]的方法测定CLOs在人工胃肠液中的水解情况。
还原糖含量如公式(2)所示:
还原糖释放量=测定节点还原糖含量﹣初始还原糖含量 (2)
水解度计算如公式(3)所示:

1.3.7 发酵乳的制备 1)CLOs最适添加量的探索试验。将巴氏消毒后的鲜牛乳冷却至43 ℃,接种适当比例的嗜热链球菌和保加利亚乳杆菌,混合均匀后分为试验组和空白对照组,试验组分别添加0.5%、1.0%、1.5%、2.0%和2.5%()的CLOs;空白对照组不添加任何碳水化合物。将各组置于43 ℃培养至凝乳,然后置于4 ℃冰箱中冷藏,待检。
2) CLOs与FOS、Inulin间益生元特性的对比试验。按照1.3.7中的1)中接种发酵剂后,将牛乳分成试验组、阳性对照FOS组、阳性对照Inulin组和空白对照组,试验组添加最适比例的CLOs,阳性对照组分别添加等量的FOS、Inulin,对照组不添加任何碳水化合物。将各组置于43 ℃培养至凝乳,然后置于4 ℃冰箱中冷藏,待检。
1.3.8 pH及酸度测定 发酵过程中,每隔0.5 h测定1次pH与酸度值,直至发酵终点(pH < 4.6,°T>80)。酸碱滴定时,吸取10 mL发酵乳,用20 mL蒸馏水稀释,以酚酞作指示剂,用0.1 mol·L-1的NaOH溶液滴定,以吉尔涅尔度(°T)表示滴定酸度。
1.3.9 菌落计数的方法 按照GB4789.35—2016《食品安全国家标准食品微生物学检验》的方法进行菌落计数。增殖率计算如公式(4)所示:

货架期增殖率计算如公式(5)所示:

1.3.10 数据处理 研究结果表示为平均值±标准差,所有数据均用Origin 2021(OriginLab,USA)软件绘图,SPSS 26.0(IBM,USA)软件进行ANOVA单因素方差分析。
2 结果与分析
2.1 CLOs的理化性质
本研究从4 500 g百合干原料中提取得百合粗低聚糖575 g,得率为(12.78±3.41)%,总糖含量为(78.66±4.76)%,其中还原糖的含量为(24.60±1.39)%,蛋白质含量为(0.26±0.35)%。
2.1.1 分子量 由图1可知,CLOs的重均分子量(w)为 1 194 Da,数均分子量(n)为558 Da,多分散性指数(D)为2.139 8。
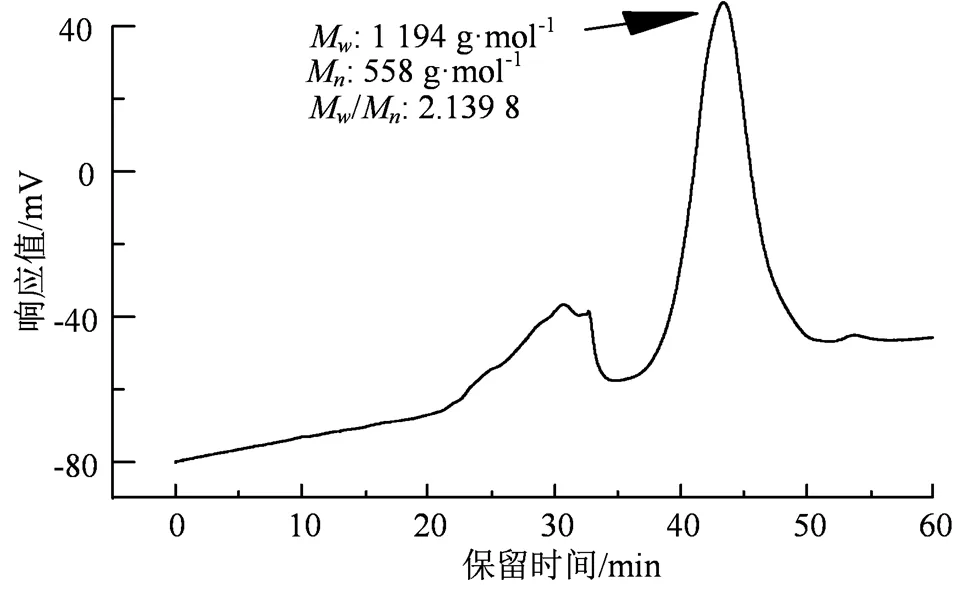
图1 CLOs的凝胶渗透色谱图
Figure 1 GPC chromatogram of CLOs
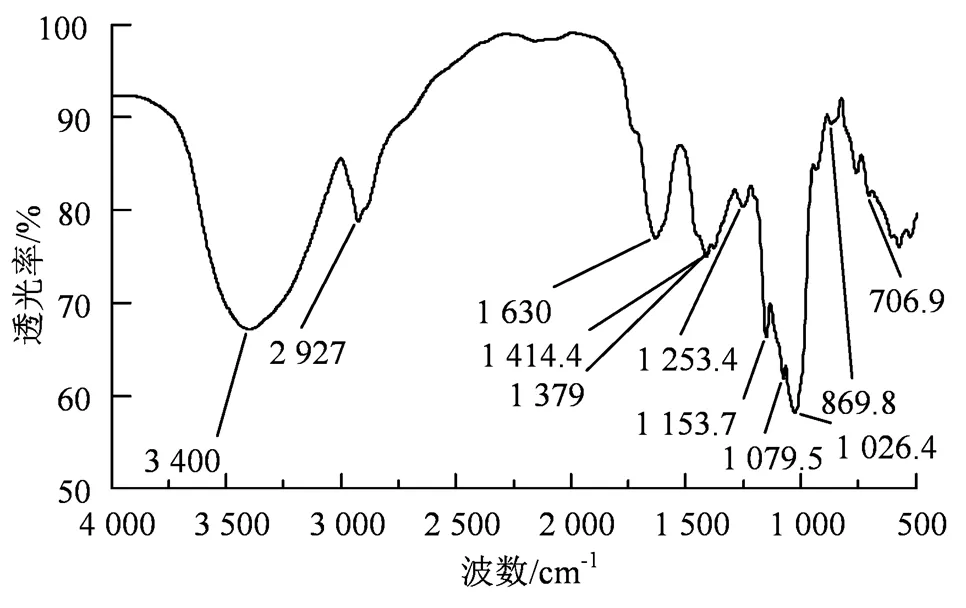
图2 CLOs傅里叶红外光谱图
Figure 2 FTIR spectrum of CLOs
2.1.2 红外光谱 FTIR图谱(图2)显示,CLOs具有糖的特征吸收峰[17],在3 400 cm-1处为羟基(-OH)的伸缩振动,2 927 cm-1处为亚甲基的CH2的伸缩振动,1 630和1 414.4 cm-1处的吸收峰分别为羰基(C=O)和羧基(HO-C=O)的伸缩振动,1 379和1 253.4 cm-1处吸收峰为C-H变角振动;1 153.7、1 079.5和1 026.4 cm-13个吸收峰分别为糖类吡喃环上醚结构C-O-C和CHO的伸缩振动,表明CLOs中存在吡喃糖苷[18]。此外,869.8 cm-1处吸收峰属于β糖苷键的特征峰[18-19]。
2.1.3 单糖组成 由图3可知,CLOs由甘露糖(Man)、阿拉伯糖(Ara)与葡萄糖(Glu)3种单糖组成,其摩尔比为1 : 3.57 : 16.40。
2.2 CLOs在人工胃肠液中的水解情况
益生元能抵抗人体消化液的水解,进而作为益生菌能量来源并促进其增殖[20]。由图4(a)至图4(e)可知:在较低的pH条件下,糖苷键更容易断裂,水解度更高[18];随着时间延长,CLOs、FOS和Inulin在人工胃液中的水解程度显著增加(< 0.05)。低聚糖的水解度与单糖组成、糖苷键的类型以及提取方式不同有关[21],当pH<3时,CLOs的水解程度显著低于Inulin而高于FOS(< 0.05),这可能是由于Inulin在微酸性或中性环境中的凝胶结构更稳定[19],在pH < 3的环境中更容易发生水解反应。胃液的pH通常为2 ~ 4,只有未被胃酸水解的低聚糖,才能进入肠道作用于肠道菌群[18]。CLOs在pH = 2的人工胃液水解4 h后的水解度为14.13%,表明至少有85.87%的CLOs可抵抗胃液水解。当CLOs在肠液消化6 h后(图4(f)),其水解程度为12.83%,显著高于阳性对照组(< 0.05)。综上,可认为至少约有73.04%的CLOs能抵抗胃肠溶液的消化,具有潜在的益生元特性。
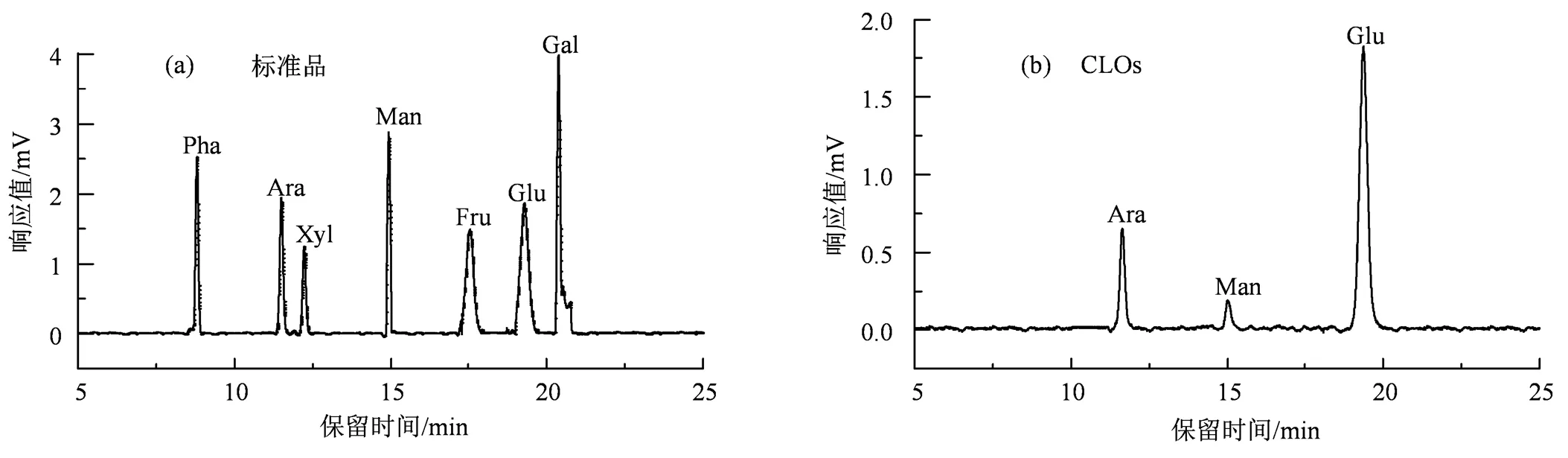
图3 单糖标准品(a)和CLOs(b)的GC谱图
Figure 3 GC chromatograms of monosaccharide standards (a) and CLOs (b)

(a)—(e):人工胃液 pH=1、2、3、4、5; (f):人工肠液。
Figure 4 Hydrolysis of crude CLOs by artificial human gastrointestinal fluid
2.3 CLOs对嗜热链球菌和保加利亚乳杆菌产酸的影响
乳酸菌发酵期间能利用碳水化合物产生乳酸及短链脂肪酸等有机酸,导致体系pH值下降,酸度上升[22]。图5体现了等量的CLOs、FOS和Inulin对嗜热链球菌ATCC-14485和保加利亚乳杆菌ATCC-11842发酵牛乳过程中的pH值、滴定酸度的影响。在发酵过程中,CLOs组的pH值下降速率和滴定酸度上升速率最快(< 0.05),最先到达发酵终点(< 0.05),其后依次为FOS组、Inulin组和空白组;说明CLOs能促进嗜热链球菌ATCC-14485和保加利亚乳杆菌ATCC-11842产酸,促进效果显著优于FOS和Inulin(< 0.05),两种乳酸菌对CLOs的利用程度更高。
2.4 CLOs对嗜热链球菌和保加利亚乳杆菌增殖作用的影响
图6展示了CLOs对嗜热链球菌ATCC-14485(图6(a))及保加利亚乳杆菌ATCC-11842 (图6(b))增殖率的影响。当CLOs的添加量为1.0%()时,嗜热链球菌的增殖率达到最大值35.95%,保加利亚乳杆菌的增殖率达到最大值146.35%,显著高于空白对照组(< 0.05),同等质量的CLOs、FOS和Inulin对嗜热链球菌ATCC-14485和保加利亚乳杆菌ATCC-11842在货架期的活菌数的影响如图7所示。
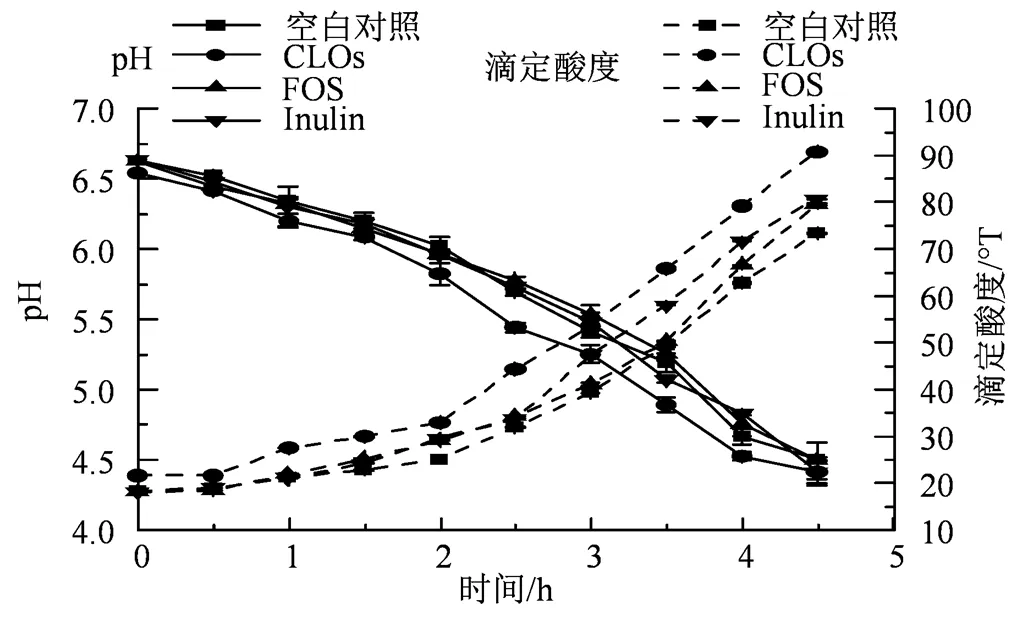
图5 CLOs、FOS和Inulin对嗜热链球菌和保加利亚乳杆菌产酸作用的影响
Figure 5 Effects of CLOs, FOS and inulin on acidifying activity ofand
由图7(a)和7(b)可知,各组在货架期内的菌落总数均在108数量级以上,在第1至第7天逐渐增多,第7至第21天逐渐减少(< 0.05)。因嗜热链球菌与保加利亚乳杆菌在蛋白质代谢、糖代谢、氧化性应激等方面之间的互惠共生作用[23],以及培养体系中益生元等碳源物质的补充,在货架期早期,活菌数增长迅速;在货架后期,随着体系中营养物质的大量消耗,乳酸菌菌体的生长受到其代谢产物的抑制,体系中有机酸含量逐渐升高,导致菌体细胞膜电荷变化,其通透性改变,进而影响乳酸菌对营养物质的吸收、利用及酶活性,抑制其生长繁殖,加之菌株老化、死亡[24-25],因此,活菌数减少。
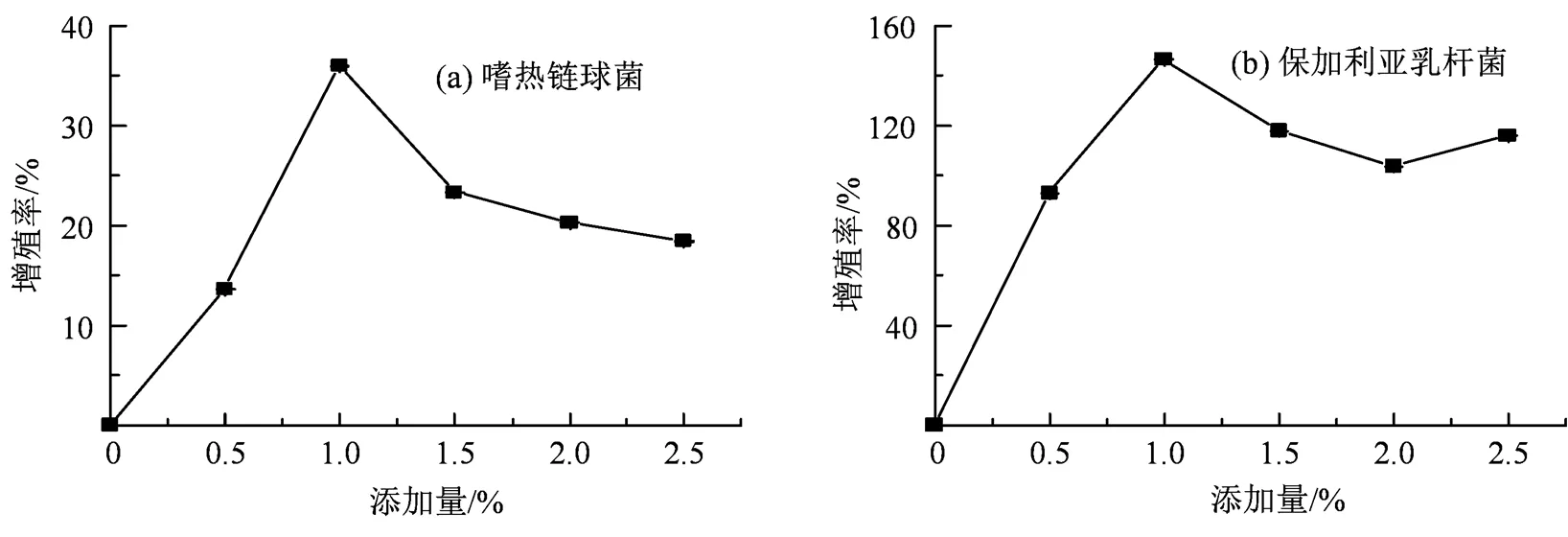
图6 CLOs对嗜热链球菌(a)与保加利亚乳杆菌(b)增殖率的影响
Figure 6 Effects of CLOs on proliferation rates of(a)and(b)
图7(c)和7(d)反映了嗜热链球菌ATCC-14485及保加利亚乳杆菌ATCC-11842在货架期中的活菌增殖率变化情况。由图7(c)可知,在第7天,CLOs、FOS、Inulin和空白组中的嗜热链球菌的增殖率分别为21%、30%、16%和14%,CLOs对嗜热链球菌的促进作用低于FOS,但高于Inulin(0.05);在第14天,CLOs、FOS和Inulin组中的嗜热链球菌的增殖率分别为26%、19%和13%,此时,CLOs组的增殖率超过FOS组(< 0.05),达到最大值,而空白组的活菌落数减少了9%(< 0.05);在第21天,各组的活菌数显著降低(< 0.05),减少比例无显著性差异(0.05)。由图7(d)可知,在第7天,CLOs、FOS、Inulin和空白组中保加利亚乳杆菌的增殖率分别为19%、22%、13%和12%,CLOs组的增殖率仍低于FOS组而高于Inulin组(< 0.05);从第14天开始,CLOs、FOS、Inulin和空白组的菌落数呈下降趋势,在第14天分别减少了12%、20%、14%和32%,此时CLOs与Inulin对保加利亚乳杆菌死亡的延缓效果无统计学差异(> 0.05),但优于FOS(< 0.05);在第21天分别减少了62%、60%、57%和67%,无显著性差异(> 0.05)。综上所述,在嗜热链球菌ATCC-14485及保加利亚乳杆菌ATCC-11842增殖过程中,CLOs组的最大增殖率显著高于空白组和Inulin组,低于FOS组(< 0.05);在乳酸菌活菌数减少过程中,CLOs组的菌落减少速率显著低于FOS组和空白组(0.0),说明CLOs具有促进嗜热链球菌和保加利亚乳杆菌增殖并减缓二者在货架期死亡的作用。
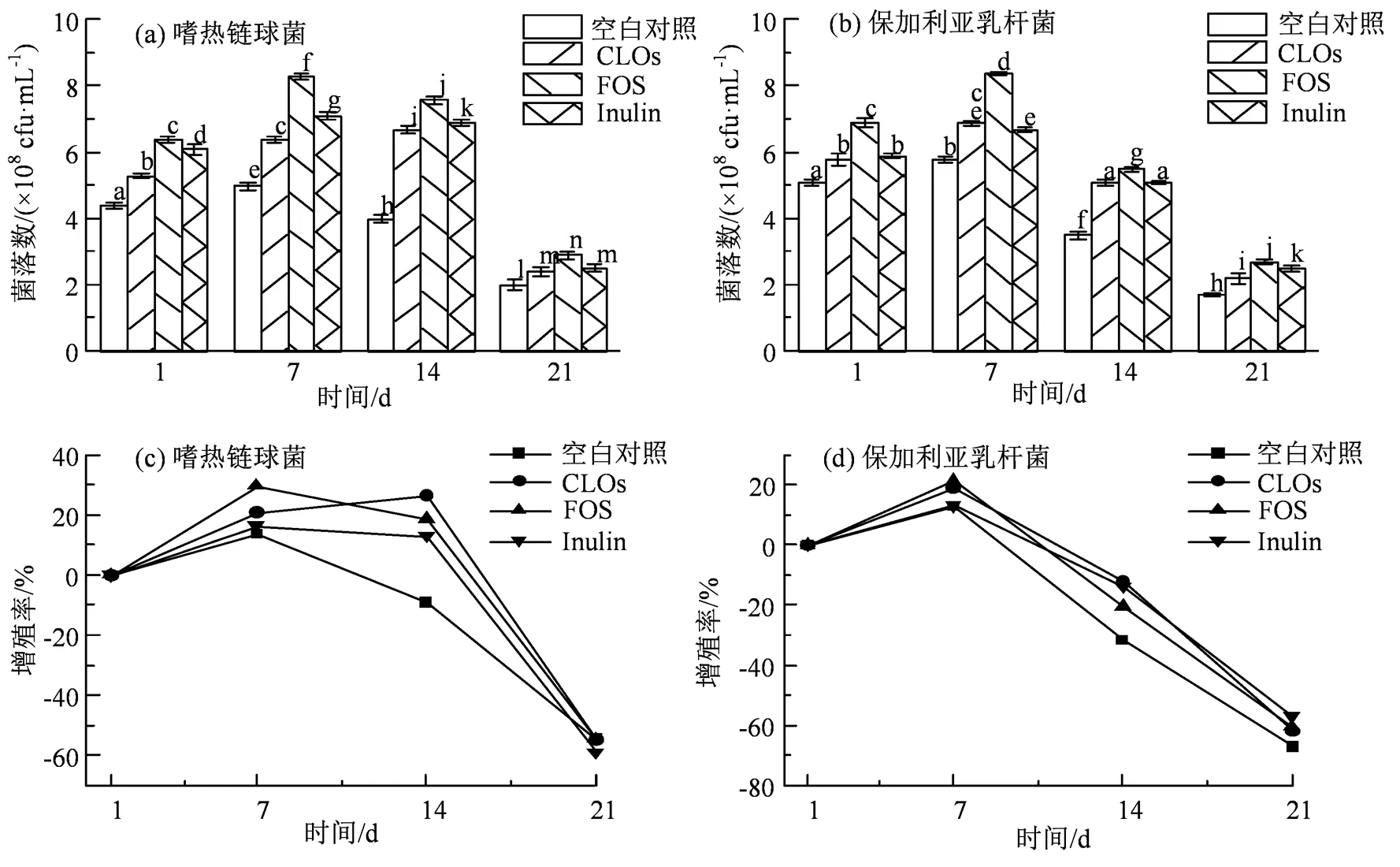
组间多重比较采用LSD法;同一柱状图上方不同的小写英文字母,表示差异显著(P < 0.05),反之差异不显著。
Figure 7 Viable cell counts and proliferation rates ofandduring shelf life
3 结论
CLOs主要由甘露糖、阿拉伯糖和葡萄糖组成,其摩尔比为1 : 3.57 : 16.40;CLOs在人工胃肠溶液中的水解度为26.96%;当CLOs的添加量为1.0%()时,菌落计数中嗜热链球菌和保加利亚乳杆菌的增殖率均达到最高值,分别为35.95%和146.35%。CLOs促进乳酸菌产酸的效果明显优于FOS和Inulin,能显著提高货架期内的乳酸菌活菌数,减缓乳酸菌的衰亡速率。因此,可以推测CLOs是一种潜在的益生元,但其益生元特性还需要结合体内实验进一步验证。
[1] 李雅丽, 王默涵, 赵雯, 等. 益生菌与益生元组合的筛选及体外发酵特性研究[J]. 食品与发酵工业, 2022, 48(7): 50-57
[2] 李楠, 刘振民. 益生菌与功能发酵乳开发研究进展[J]. 乳业科学与技术, 2020, 43(3): 31-38.
[3] GIBSON G R,RASTALL R A. Prebiotics: Development & Application[M]. England: John Wiley & Sons Ltd,2012: 24-26,73-76.
[4] 姜竹茂. 功能性低聚糖的发展及应用[J]. 食品安全导刊, 2010(9): 58-60.
[5] 尚晋伊, 刘丽萍. 益生元营养及应用研究现状[J]. 现代食品, 2018(4): 52-55.
[6] 李烜, 罗登林, 向进乐, 等. 菊粉的性质、功能及在食品中的应用进展[J]. 中国粮油学报, 2021, 36(4): 185-192.
[7] CATENZA K F, DONKOR K K. Recent approaches for the quantitative analysis of functional oligosaccharides used in the food industry: a review[J]. Food Chem, 2021, 355: 129416.
[8] 杨宇琴, 王丽丽, 柯尊晖, 等. 百合多糖的研究进展[J]. 西北民族大学学报(自然科学版), 2017, 38(4): 60-64, 84.
[9] 朱泉. 百合多糖分离纯化、结构鉴定及其生物活性研究[D]. 南京: 南京农业大学, 2012.
[10] 高清雅, 赵保堂, 尚永强, 等. 超声波协同复合酶提取兰州百合多糖[J]. 食品与发酵工业, 2014, 40(8): 263-267.
[11] 师改琴, 李心怡, 孙雅琪, 等. 分光光度法测定葡萄糖含量的研究[J]. 云南化工, 2020, 47(10): 53-55, 58.
[12] WANG T, YE Z, LIU S, et al. Effects of crudepolysaccharides as potential prebiotics on acidifying activity and growth of probiotics in fermented milk[J]. LWT, 2021, 149: 111882.
[13] 刘玉明, 钱甜甜, 李珂娴, 等. 气相色谱法分析方格星虫多糖的单糖组成[J]. 药物分析杂志, 2012, 32(8): 1362-1364, 1369.
[14] NOR N ’ N M, ABBASILIASI S, MARIKKAR M N, et al. Defatted coconut residue crude polysaccharides as potential prebiotics: study of their effects on proliferation and acidifying activity of probiotics[J]. J Food Sci Technol, 2017, 54(1): 164-173.
[15] GONZÁLEZ-CÓRDOVA F, BELTRAN- BARRIENTOS A M, SANTIAGO- LOPEZ L, et al. Phytate-degrading activity of probiotic bacteria exposed to simulated gastrointestinal fluids[J]. LWT, 2016, 73: 67-73.
[16] 叶子晨, 王腾, 杨云, 等. 黄参粗多糖对植物乳杆菌CGMCC-15801和鼠李糖乳杆菌CGMCC-16103增殖的影响[J]. 食品与发酵工业, 2022, 48(4): 207-212.
[17] 潘桂芳. 卷丹百合多糖的提取纯化、结构分析及其免疫活性研究[D]. 合肥: 安徽农业大学, 2017.
[18] ZHANG Y F, ZHOU M L, WANG X X, et al. Rapeseed polysaccharides as prebiotics on growth and acidifying activity of probiotics[J]. Carbohydr Polym, 2015, 125: 232-240.
[19] 许威, 罗登林, 陈瑞红, 等. 菊粉酸降解动力学研究[J]. 食品科学, 2012, 33(15): 95-98.
[20] VALCHEVA R, DIELEMAN L A. Prebiotics: Definition and protective mechanisms[J]. Best Pract Res Clin Gastroenterol, 2016, 30(1): 27-37.
[21] GLIBOWSKI P, BUKOWSKA A. The effect of pH, temperature and heating time on inulin chemical stability[J]. Acta Sci Polonorum Technol Aliment, 2011, 10(2): 189-196.
[22] HE Z M, WANG X H, LI G F, et al. Antioxidant activity of prebiotic ginseng polysaccharides combined with potential probioticC88[J]. Int J Food Sci Technol, 2015, 50(7): 1673-1682.
[23] 包维臣, 陈霞, 邵玉宇, 等. 保加利亚乳杆菌与嗜热链球菌共生机理的研究进展[J]. 中国乳品工业, 2011, 39(12): 20-23.
[24] THAMBIRAJ S R, PHILLIPS M, KOYYALAMUDI S R, et al. Yellow lupinL.) polysaccharides: antioxidant, immunomodulatory and prebiotic activities and their structural characterisation[J]. Food Chem, 2018, 267: 319-328.
[25] 陈红霞, 德亮亮, 任艳, 等. 嗜热链球菌产酸特性及其发酵乳中有机酸组分分析[J]. 乳业科学与技术, 2015, 38(2): 1-5.
Effects of Lanzhou lily (var.) crude oligosaccharides on acid production and proliferation ofATCC-14485 andATCC-11842
LIU Diru1, TANG Shaoyan1, DONG Yao1, FU Ying1, MA Haomin1, GAO Qikuan2
(1. Institute of Nutrition and Food Hygiene, School of Public Health, Lanzhou University, Lanzhou 730000; 2. Gansu Province Key Laboratory of Evidence Science Techniques Research and Application, Gansu University of Political Science and Law, Lanzhou 730070)
Prebiotics play an important role in promoting the growth of probiotics and regulating the intestinal microflora balance. To explore the prebiotic characteristics of crude Lanzhou Lily (var.) oligosaccharides (CLOs), the CLOs were extracted and characterized from dried Lanzhou lily, and the hydrolysis of CLOs in artificial gastrointestinal solution as well as the effects on acid production and proliferation ofATCC-14485 andATCC-11842 were determined by using FOS and inulin as positive controls. The results showed: the molecular weight of CLOs was 1 194 Da, and mainly consisted of mannose, arabinose and glucose with a molar ratio of 1 : 3.57 : 16.40; the hydrolysis ratio of CLOs in artificial gastrointestinal solution was 26.96%, which was significantly lower than that of inulin (< 0.05); the promotion effects of CLOs on acid production by lactic acid bacteria was significantly better than that of inulin and FOS (< 0.05); the addition of CLOs at 1.0%()could effectively promote the proliferation ofand, and slow down the death rate of both during the shelf life. These findings suggested that CLOs possess prebiotic characteristics, and can provide a theoretical basis for developing a novel symbiotic fermented milk.
Lanzhou lily crude oligosaccharides; prebiotic properties;;; acid production; proliferation
TS201.3
A
1672-352X (2023)05-0904-07
10.13610/j.cnki.1672-352x.20231030.003
2023-10-31 09:50:27
[URL] https://link.cnki.net/urlid/34.1162.S.20231030.0948.006
2022-11-03
甘肃省科技计划项目(No.22JR5RA465)资助。
刘迪茹,博士,副教授。E-mail:liudiru@lzu.edu.cn 唐绍琰,本科生。E-mail:tangshy18@lzu.edu.cn 董 尧,本科生。E-mail:2496661481@qq.com
高琦宽,博士,副教授。E-mail:gqk7196@gsupl.edu.cn

