多重PCR快速检测槟榔黄化植原体和槟榔隐症病毒1体系的建立
彭春霖,黄丽云,朱 辉,魏红宇,郑 馨,赵正武*,刘立云*
多重PCR快速检测槟榔黄化植原体和槟榔隐症病毒1体系的建立
彭春霖1, 2,黄丽云2,朱 辉2,魏红宇1,郑 馨2,赵正武1*,刘立云2*
(1. 重庆师范大学生命科学学院,重庆 401331;2. 中国热带农业科学院椰子研究所,文昌 571339)
由槟榔黄化植原体(areca palm yellow leaf phytoplasma, AYLP)引起的黄化病和槟榔隐症病毒1(, APV1)引起的黄叶病毒病是危害槟榔树最严重的两种病害,对海南槟榔产业造成了巨大的经济损失,建立快速的检测技术对于两种病害的预警防控具有重要意义。利用多重PCR(Multiplex PCR)技术同时检测AYLP和APV1,即AYLP巢式PCR第一轮结束后,再使用一次多重PCR对两种病原同时进行扩增,最后进行电泳观察结果。结果显示,通过对多重PCR浓度体系和退火温度进行优化,在一个体系中成功扩增出AYLP和APV1,得到525和311 bp 两条特异性大小条带。多重PCR检测与单一PCR检测结果完全一致,并且与单一PCR检测方法比较,多重PCR方法精简了操作步骤,提高了检测效率,显著降低了检测成本,为槟榔黄化病和黄叶病毒病的常规诊断提供了新方法。因此,该技术在AYLP和APV1常规检测中具有重要的应用价值。
槟榔黄化病;植原体;APV1;多重PCR;新方法
槟榔(L.)是我国“四大南药”(槟榔、砂仁、益智、巴戟)之首,药用价值很高。据有关报道,槟榔原产于马来西亚或菲律宾,主要种植于热带太平洋、亚洲和东非的大部分地区,中国95%的槟榔树都种植在海南省,是海南农民主要的经济来源之一,槟榔种植国中印度的产量居世界首位。在印度,槟榔主要分布于卡纳塔克邦等地方[1-5]。20世纪80年代,海南省屯昌县首次发现槟榔黄化病[6],而截至2022年,该病已几乎覆盖海南省各市县。该疾病的特点是叶面黄化、叶尖坏死和叶冠缩小、未成熟果实脱落和核仁变色,果实不宜食用,从而降低了其经济重要性[7]。重病槟榔园发病率高达90%,以致减产了78%~ 80%,甚至绝产,大量本应在盛果期的槟榔树大规模减产、绝收[8]。研究发现,除槟榔黄化植原体(areca palm yellow leaf phytoplasma,AYLP)外,槟榔隐症病毒1(1,APV1)也是引起槟榔大面积黄化的一种病原[9]。因此,急需建立一种快速、高效的病原检测AYLP和APV1的新方法。
聚合酶链式反应(PCR)技术已经运用到各个研究领域,但传统的检测方法灵敏度不高,而且都只针对单一病原的检测,因此检测样品数量较多时,需要耗费较多的时间和试剂[10]。AYLP是寄生在植物韧皮部上的原核病原体,没有细胞壁,暂未有人工培养繁殖成功的研究[11]。植原体在病株体内含量低、分布不均匀等特点,使其检测和鉴定技术的发展也受到阻碍[12]。单一聚合酶链式反应(PCR)方法只能在一次反应中检测一种病原,对一个目标序列使用一对特异性引物。多种病原需要建立多个单一的PCR扩增,多次建立PCR体系操作麻烦,且增加了交叉污染的风险[13]。多重PCR是在单一PCR的基础上加以改进,单一PCR只允许扩增一个DNA模板,而多重PCR可以在一个试管中扩增多个DNA模板,从而缩短了实验时间和工作量[14-15]。多重PCR技术在动植物研究中已有很多成功的案例,如:匡猛等[16]建立起我国棉花的DNA指纹图谱,利用荧光毛细管电泳检测结合多重PCR,对种质资源的利用做出了巨大贡献;李明骏等[17]首次建立了可同时检测甘蔗花叶病毒(,SCMV)、玉米褪绿斑驳病毒(virus,MCMV)、水稻黑条矮缩病毒(,RBSDV)、玉米黄化花叶病毒(,MaYMV)和留尼旺玉米线条病毒(,MSRV)5种玉米病毒的多重PCR检测体系,可以及时发现田间病株,防止病毒蔓延。
如今,多重PCR方法已应用于大多数植物病原的检测。本研究对感病植株进行采样,通过对比分析,优化多重PCR反应体系浓度及反应程序,对传统单一聚合酶链式反应(PCR)方法进行改进,以期运用多重PCR,高效、快速、经济地检测出AYLP和APV1。
1 材料与方法
1.1 材料
供试材料:试材来自感病槟榔园黄化植株,所采槟榔叶片样品均为感病植株,同时采摘健康样品作为对照。采样时选择槟榔植株末端2 ~ 3片黄绿相间的叶片,采集的样品放入无菌采样袋中,于当天送回实验室置于﹣80℃冰箱保存以防叶片DNA和RNA降解。
仪器:耶拿Tone PCR仪,德国耶拿分析仪器(北京)有限公司;高速离心机,河南北弘实业有限公司;琼脂糖凝胶电泳仪,北京六一仪器厂;高速低温组织研磨仪,武汉赛维尔生物科技有限公司。
药品:植物基因组DNA提取试剂盒、RNAprep Pure多糖多酚植物总RNA提取试剂盒、Fast King一步法除基因组cDNA第一链合成预混试剂20 μL×100次购自天根生化科技(北京)有限公司,75%酒精等消毒试剂、β-巯基乙醇、GelStain核酸染料、三氯甲烷、50×TAE。PCR Mix 预混液(2X,含蓝染料)和聚合酶链式反应(PCR)引物由上海生工生物工程股份有限公司合成。
1.2 AYLP总DNA和APV1总RNA提取
1.2.1 AYLP总DNA提取 槟榔叶片总DNA提取采用天根生化科技(北京)有限公司生产的植物基因组DNA提取试剂盒进行总DNA提取。首先将叶片样品用科研用纸擦掉叶片上虫卵以及残留灰尘以免影响实验数据,取槟榔叶片黄绿相间的部分剪成2 mm×3 mm组织块,称取0.1 g放进2.0 mL无菌无酶离心管中,加入5 mm钢珠和适量GP1在高速低温组织研磨仪中进行研磨,其余详细步骤参考天根生化科技(北京)有限公司植物基因组DNA提取试剂盒。
1.2.2 APV1总RNA提取 称取0.05 g槟榔黄绿相间的叶片组织,用剪刀剪碎并缓慢放入无酶无菌离心管中,加入3颗4 mm钢珠在高速低温组织研磨仪中进行研磨。其余详细步骤参考天根生化科技(北京)有限公司RNAprep Pure多糖多酚植物总RNA提取试剂盒。
1.3 引物选择
从AYLP和APV1常用检测引物中挑选槟榔植原体高效引物F4/R1/F2/R2[3]和槟榔APV1高效引物YLDV-2F/YLDV-2R[1](表1)。
1.4 单一PCR
APV1检测使用Fast King一步法除基因组cDNA第一链合成预混试剂进行反转录。20 µL反转录体系条件如下:4 µL 5×FastKing-RT Super Mix,2 µL Total RNA,14 µL RNase-Free ddH2O。混样过程中,试剂始终置于冰上。简短离心后,42 ℃反应15 min以去除基因组及反转录反应,95 ℃反应3 min以进行酶灭活过程,置于冰上待用。APV1扩增体系为20 µL:PCR Master Mix(2X,含蓝染料)17 μL,上下游引物各0.5 μL,cDNA模板2.0 μL。扩增条件:95 °C,4 min;95 °C,30 s;退火,30 s;72 °C,1 min;35个循环,最后72.0 ℃延伸8 ~ 10 min。
AYLP检测反应体系为25 µL:1 µL正向引物和反向引物(10 µmol·L-1),12.5 µLPCR Master Mix(2X,含蓝染料),2 µL DNA模板,8.5 µL ddH2O。第一轮PCR扩增产物1: 20倍稀释用作第二轮PCR模板。PCR反应循环参数为94.0 ℃,4 min;94.0 ℃,30 s;退火,30 s;72.0 ℃,1 min;循环35次;最后72.0 ℃延伸8 ~ 10 min;PCR产物用GelStain核酸染料染色,用1%琼脂糖凝胶电泳检测分析并对比结果。

表1 用于多重PCR扩增AYLP和APV1高效引物
1.5 多重PCR
多重PCR体系建立:筛选3个植原体浓度高的病株叶片提取总DNA,使用F4/R1引物扩增AYLP巢式第一轮PCR产物放入冰箱,以便后续实验取用。再筛选3个高浓度的APV1的病株叶片提取总RNA并反转录合成cDNA。将第一轮产物稀释后和反转录合成的cDNA按照样品顺序进行混样并记录。多重PCR反应体系:将两种特异性病原引物F2/R2、YLDV-2F/YLDV-2R和PCR Master Mix(2X,含蓝染料)加入到1.5 mL无菌无酶离心管中进行混样。在实验过程中,反应体系分别设体系1:PCR Master Mix 14.5 µL,F2/R2各1 µL,2F/2R各0.5 µL,ddH2O 2.5 µL, DNA/cDNA各2.5 µL;体系2:PCR Master Mix 15 µL,F2/R2各1 µL,2F/2R各1 µL,ddH2O 2 µL,DNA/cDNA各2µL;体系3:PCR Master Mix 15.5 µL,F2/R2各1 µL,2F/2R各1 µL,ddH2O 1.5 µL,DNA/cDNA各2 µL;体系4:PCR Master Mix 16 µL,F2/R2各1 µL,2F/2R各1 µL,ddH2O 1 µL, DNA/cDNA各2 µL;体系5:PCR Master Mix 17 µL,F2/R2各1 µL,2F/2R各0.5 µL, DNA/cDNA各2.5 µL;体系6:PCR Master Mix 18 µL,F2/R2各1 µL,2F/2R各0.5 µL,DNA/cDNA各2 µL。分别选择46、48、50、52和54 ℃退火温度进行多重PCR体系的优化。利用1%琼脂糖凝胶电泳并根据其扩增效果,最终筛选出能同时扩增出AYLP和APV1并且条带清晰的反应程序和浓度。
2 结果与分析
2.1 单一PCR检测结果
以植原体DNA和APV1反转录成的cDNA为反应模板,经过PCR反应分别扩增3个样品,再利用1%琼脂糖凝胶电泳检测,可以分别得到在525 bp和311 bp处的特异性条带(图1)。

M: DNA Marker DL2000;泳道 1 ~ 3: APV1样品;4 ~ 6: AYLP样品;7: 健康样品;8: 空白对照。
Figure 1 Detection of APV1 and AYLP by simplex-PCR
2.2 多重PCR检测结果
2.2.1 反应体系浓度对多重PCR的影响 通过对6组浓度体系进行试验对照(图2),当ddH2O含量大于2 µL以上时,PCR Master Mix(2X,含蓝染料)含量下降,对应的病毒条带较弱,病毒含量低可能导致该程序跑不出条带;ddH2O含量在1 µL时植原体和病毒条带清晰。当ddH2O含量降低,DNA和cDNA模板加样体积增加,体系5病毒条带较弱,当DNA和cDNA模板含量设置为2 µL,PCR Master Mix含量增加到18 µL,体系6跑出条带较弱。
本研究6组体系对植原体检出率影响不大,因此,反应体系各参数最终确定为:16 µLPCR Mix(2X,含蓝染料)、1 µL F2、1 µL R2、1 µL YLDV-2F、1 µL YLDV-2R、1 µL ddH2O、2 µL DNA、2 µL cDNA。
2.2.2 反应程序中退火温度对多重PCR的影响 本研究对多重PCR退火温度进行试验,结果发现,退火温度在48和50 ℃扩增出来的目标条带达到理想的实验数据。当退火温度低于46 ℃时,扩增出来的病毒条带较弱;退火温度高于54 ℃时,扩增出来的病毒条带的清晰度逐渐降低(图3)。说明该引物不适合在高温下进行多重PCR扩增,因此,最终选择50 ℃为最佳温度,且扩增出的AYLP和APV1条带均达到了理想的结果。
2.3 单一PCR和多重PCR扩增效果比较
以含有AYLP的DNA和APV1的RNA反转录成的cDNA作为PCR扩增模板,实验使用多重PCR反应程序对样品进行扩增。结果表明,多重PCR和单一PCR检测结果完全一致(图4)。
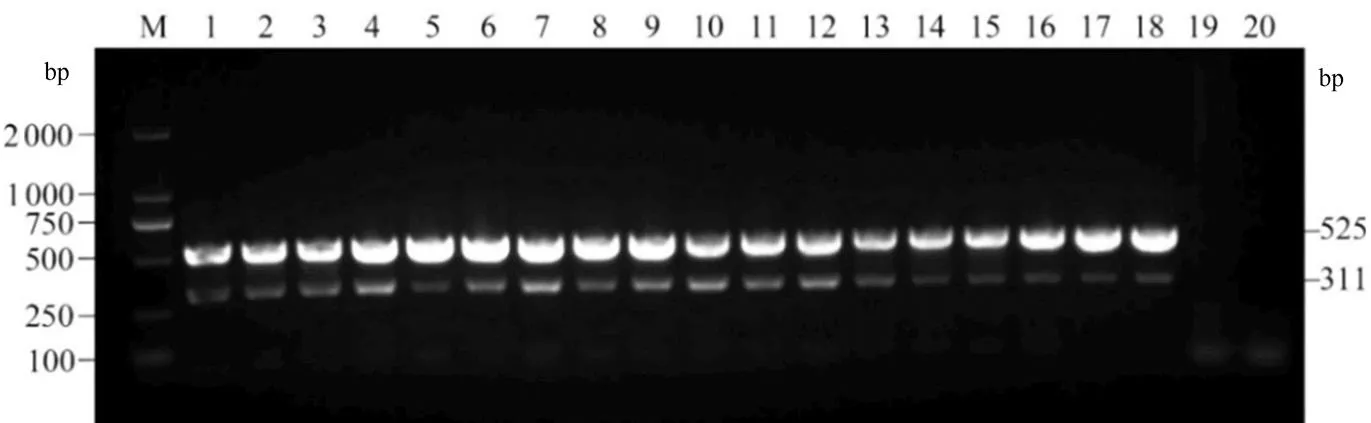
M: DNA Marker DL2000; 泳道1 ~ 3: 体系1;4 ~ 6: 体系2;7 ~ 9: 体系3;10 ~ 12: 体系4;13 ~ 15: 体系5;16 ~ 18: 体系6;19: 健康样品;20: 空白对照。
Figure 2 Effects of different reaction systems on multiplex PCR

M: DNA Marker DL2000; 泳道1 ~ 3: 46 ℃;4 ~ 6: 48 ℃;7 ~ 9: 50 ℃;10~12: 52 ℃;13~15: 54 ℃;16: 健康样品; 17: 空白对照。
Figure 3 Effects of annealing temperature on multiplex PCR

M: DNA Marker DL2000; 泳道1~3: APV1样品; 4 ~ 6: AYLP样品; 7 ~ 9: 多重PCR; 10: 健康样品。
Figure 4 Comparison of pathogen detection by single PCR and multiple PCR
3 讨论与结论
伴随着分子生物学的发展,PCR技术的不断更新换代,多重PCR被广泛应用于植物病原菌的检测,其具有提高检测通量的优点。如岳红妮等[12]建立了可以同时检测大麦条纹花叶病毒(,BSMV)、大麦黄矮病毒 PAV 株系(,BYDV-PAV)、小麦黄花叶病毒(,WYMV)和小麦蓝矮植原体(,WBD)的多重PCR技术体系。同时在麦冬((Linn. f.) Ker-Gawl)、甘薯((Lour.) Burkill)、草莓(Duch)等多种病害检测中也被广泛应用[18-20]。在多重PCR扩增过程中影响扩增效果的因素有很多,如核酸模板含量、反应条件、引物、ddH2O、PCR Master Mix(2X,含蓝染料)含量等[21]。研究发现,对实验影响比较大的因素是引物含量和ddH2O含量。引物的选择对实验的成败起着关键作用,既要使引物具有特异性,还要避免引物之间的相互影响,同时要尽量设置各对引物的退火温度一致。
本研究发现,体系浓度中ddH2O含量、病毒引物含量、cDNA模板含量对PCR扩增结果影响很大,ddH2O含量过高导致APV1检出率大大降低,病毒引物含量和cDNA模板含量同时增加时,APV1检测率也极低。降低cDNA模板含量至2 µL和增加ddH2O含量至1 µL时,APV1的检出率显著提高。研究发现,AYLP引物各1 µL时检出率最好,因此在实验中只需要调整其他浓度含量。此外,退火温度高于54 ℃和低于46 ℃时,多重PCR病毒检出率也会降低。
因此,25 µL体系的多重PCR中,最佳反应的体系分别为:16 µLPCR Master Mix(2X,含蓝染料),1 µL F2,1 µL R2,1 µL YLDV-2F,1 µL YLDV-2R,1 µL ddH2O,2 µL DNA和2 µL cDNA;最佳的反应程序设置为:94.5 ℃预变性4 min,94.5 ℃变性30 s,50 ℃退火30 s,延伸50 s,循环35次。以此就可以在一个体系中同时扩增出AYLP和APV1。槟榔产业作为海南地区农村人口主要经济来源,槟榔黄化病和黄叶病毒病是危害槟榔的重大病害,传播速度快,危害性大,急需探索出快速、经济、高效的检测方法,以便迅速采取相应的防治措施。截止目前,能同时快速检测出两种槟榔病原体系暂还鲜见报道。本研究通过对引物体系、PCR Mix(2X,含蓝染料)、ddH2O、模板DNA、退火温度等方面进行多次优化,首次建立了同时检测AYLP和APV1的多重PCR检测新方法。该方法检测速度快,检测成本相对于单一PCR有所降低,具有更广泛的应用前景。
[1] 王洪星. 海南槟榔黄化相关病原筛选鉴定研究[D]. 海口: 海南大学, 2020.
[2] 车海彦, 吴翠婷, 符瑞益, 等. 海南槟榔黄化病病原物的分子鉴定[J]. 热带作物学报, 2010, 31(1): 83-87.
[3] 孟秀利, 唐庆华, 林兆威, 等. 开发高效引物检测槟榔黄化病叶片及种果内植原体[J]. 分子植物育种, 2022, 20(14): 4624-4633.
[4] 车海彦, 曹学仁, 罗大全. 槟榔黄化病病原及检测方法研究进展[J]. 热带农业科学, 2017, 37(2): 67-72.
[5] MUDDUMADIAH C, MADHUPRIYA, KUMAR S, et al. Detection and characterization of 16SrI-B phytoplasmas associated with yellow leaf disease of arecanut palm in India[J]. Phyt Moll, 2014, 4(2): 77-82.
[6] 金开璇, 孙福生, 陈慕容,等. 槟榔黄化病的病原的研究初报[J]. 林业科学,1995, 31(6): 556-558.
[7] RAJEEV G, PRAKASH V R, VAGANAN M M, et al. Microscopic and polyclonal antibody-based detection of yellow leaf disease of arecanut (L.)[J]. Arch Phytopathol Plant Prot, 2011, 44(11): 1093-1104.
[8] 车海彦, 罗大全. 槟榔黄化病研究进展[J]. 中国热带农业, 2022(2): 36-42.
[9] 唐庆华, 宋薇薇, 黄惜, 等. 槟榔主要病虫害原色图谱[M]. 北京: 中国农业科学技术出版社, 2021.
[10] 王冲, 陈集双, 洪健, 等. 以18S rRNA为内参照的多重RT-PCR检测3种百合病毒[J]. 植物病理学报, 2006, 36(3): 204-211.
[11] DOI Y, TERANAKA M, YORA K, et al. Mycoplasma- or PLT group-like microorganisms found in the phloem elements of plants infected with mulberry dwarf, potato witches' broom, Aster yellows, or Paulownia witches' broom[J]. Jpn J Phytopathol, 1967, 33(4): 259-266.
[12] 岳红妮, 吴云锋, 李毅然, 等. 小麦3种病毒病BSMV、BYDV-PAV、WYMV及WBD植原体病害的多重PCR同步检测[J]. 中国农业科学, 2008, 41(9): 2663-2669.
[13] LIU H, WU K, WU W, et al. A multiplex reverse transcription PCR assay for simultaneous detection of six main RNA viruses in tomato plants[J]. J Virol Meth, 2019, 265: 53-58.
[14] 陈明洁, 方倜, 柯涛, 等. 多重PCR—一种高效快速的分子生物学技术[J]. 武汉理工大学学报, 2005, 27(10): 33-36.
[15] QUINTERO-VÁSQUEZ G A, BAZÁN-TEJEDA M L, MARTÍNEZ-PEÑAFIEL E, et al. Multiplex PCR to detect four different tomato-infecting pathogens[J]. Folia Microbiol, 2013, 58(4): 269-276.
[16] 匡猛, 王延琴, 周大云, 等. 棉花DUS测试标准品种的SSR指纹数据库构建[J]. 棉花学报, 2015, 27(1): 46-52.
[17] 李明骏, 廖萌, 蒋开蓉, 等. 五种玉米病毒多重PCR检测体系的建立[J]. 植物保护学报, 2021, 48(2): 465-466.
[18] 杨怡华, 王明郧, 曹瑱艳, 等. 麦冬主要病害病原菌巢式多重PCR检测方法的建立[J]. 植物保护学报, 2021, 48(4): 742-747.
[19] 王爽, 田雨婷, 乔奇, 等. 侵染甘薯的菜豆金色花叶病毒属病毒和甘薯褪绿矮化病毒多重PCR检测方法的建立与应用[J]. 植物保护学报, 2018, 45(6): 1427-1428.
[20] 韩晓玉, 陈思宇, 李刚, 等. 河南省草莓病毒病病原的鉴定及5种草莓病毒多重PCR体系的建立[J]. 植物保护学报, 2020, 47(1): 219-220.
[21] 肖远辉, 曾继吾, 张秋明, 等. 柑橘衰退病、裂皮病和碎叶病的多重RT-PCR检测方法研究[J]. 植物病理学报, 2007, 37(1): 31-35.
Establishment of a multiplex PCR system for the rapid detection of areca palm yellow leaf phytoplasma and areca palm velarivirus1
PENG Chunlin1, 2, HUANG Liyun2, ZHU Hui2, WEI Hongyu1, ZHENG Xin2, ZHAO Zhengwu1, LIU Liyun2
(1. College of Life Sciences, Chongqing Normal University, Chongqing 401331;2. Coconut Research Institute, Chinese Academy of Tropical Agricultural Sciences, Wenchang 571339)
Yellow leaf disease caused by areca palm yellow leaf phytoplasma(AYLP) and the yellow leaf virus disease caused by(APV1) are two of the most serious diseases affecting areca palm trees, causing huge economic losses to the areca palm industry in Hainan, and the establishment of rapid detection techniques is of great importance for the early warning and prevention and control of both diseases. In this study, multiplex PCR was used to detect areca AYLP and APV1 simultaneously, i.e. after the first round of nested PCR for AYLP, the multiplex PCR was used to amplify the two pathogens simultaneously, and the results were finally observed by electrophoresis. As results, by optimizing the multiplex PCR concentration system and annealing temperature, AYLP and APV1 were successfully amplified in one system, and two specific size bands of 525 bp and 311 bp were obtained. The results of multiplex PCR were in complete agreement with the results of single PCR, and compared with the single PCR assay, the multiplex PCR method streamlined the operation steps, improved the detection efficiency and significantly reduced the detection cost, providing a new method for the routine diagnosis of areca palm yellow leaf disease and yellow leaf virus diseases. Therefore, this technique has important applications in the routine detection of AYLP and APV1.
yellow leaf disease of areca palm; phytoplasma; APV1; multiplex PCR; new approach
S792.91; S763
A
1672-352X (2023)05-0772-05
10.13610/j.cnki.1672-352x.20231030.017
2023-10-31 08:23:21
[URL] https://link.cnki.net/urlid/34.1162.S.20231030.1110.032
2022-10-28
海南省槟榔现代农业产业技术体系(HNARS-1-G2)资助。
彭春霖,硕士研究生。E-mail:chunlinpeng@yeah.net
赵正武,教授。E-mail:zhaozhengwu513@sina.com 刘立云,研究员。E-mail:lly1995@126.com

