可注射型富血小板纤维蛋白促进人脐静脉内皮细胞成血管能力的体外实验研究
罗琳涓, 潘 菁, 厉超元, 蒋备战
(1. 同济大学口腔医学院·同济大学附属口腔医院儿童口腔科,上海牙组织修复与再生工程技术研究中心,上海 200072; 2. 同济大学口腔医学院·同济大学附属口腔医院种植科,上海牙组织修复与再生工程技术研究中心,上海 200072)
牙髓再生是治疗牙髓感染或牙髓坏死的一种新方法,其中血管再生可以恢复牙齿的营养供应,被认为是功能性牙髓再生的关键[1]。可注射型富血小板纤维蛋白(injectable platelet-rich fibrin, iPRF)是第二代血小板浓缩制品富血小板纤维蛋白的新型衍生物,其三维纤维蛋白支架结构中富含Ⅰ型胶原,一定程度上模拟了细胞外基质的成分和结构,同时含有可以调节细胞增殖、迁移和分化行为的各种生长因子[2-3]。此外,iPRF还在调节炎症反应、抗菌和促进成骨发生方面发挥作用[2,4-5],其液体形态便于临床操作,可能是用于诱导牙髓再生的一种理想的支架材料。
但是目前iPRF成血管作用的相关研究较少,因此本研究利用人脐静脉内皮细胞(human umbilical vein endothelial cells, HUVECs)探究iPRF促进血管生成的能力,为使用iPRF进行再生性牙髓治疗提供理论基础。
1 材料与方法
1.1 主要试剂和仪器
高糖DMEM不完全培养基、青霉素/链霉素、胰蛋白酶、PBS缓冲液、CCK-8试剂盒(凯基,中国);胎牛血清(Gibco,美国);钙黄绿素(Sigma,美国);Matrigel基质胶、细胞培养皿、离心管、细胞培养板(Coring,美国);滤器(Millipore,日本);血管生成载玻片(ibidi,意大利);TRIzol细胞裂解液、RNA逆转录试剂盒(TaKaRa,日本);低温离心机(Thermo,美国);倒置显微镜(Nikon,日本)。
1.2 可注射型富血小板纤维蛋白提取液(injectable platelet-rich fibrin extract, iPRFe)的制备
本实验经过同济大学伦理委员会批准(伦理审查编号: [2021]-DW-70),所有志愿者知情同意。根据已经报道的实验方案[6],抽取5名健康男性志愿者(年龄18-35岁,不吸烟,不喝酒,无血液系统疾病,近期没有服用影响血液系统的药物)10 mL静脉血,在4 ℃条件下离心(离心半径10 cm,700 r/min,3 min),吸取上层黄色液态物质即为iPRF。参考课题组前期研究方案并进行改良[7],将iPRF冻干并研磨成粉,每80 mg iPRF粉末用40 mL高糖DMEM不完全培养基浸提24 h。在细胞超净台中使用0.22 μm滤器过滤浸提液后得到iPRFe,保存于-20 ℃冰箱。
1.3 细胞培养
HUVECs从中国科学院细胞库中获得,常规培养液为添加了10%胎牛血清和1%青霉素/链霉素的高糖DMEM不完全培养基,置37 ℃、5%CO2细胞培养箱中培养,每2 d更换1次培养液。
1.4 CCK-8实验检测细胞增殖能力
将iPRFe用高糖DMEM不完全培养基稀释,并添加10%胎牛血清和1%青霉素/链霉素,使iPRFe的浓度分别为1.6 mg/mL、0.8 mg/mL、0.4 mg/mL和0.2 mg/mL。实验分为5组,对照组为常规培养液,实验组分别另外添加上述4种不同浓度的iPRFe,每组设置5个复孔。将HUVECs以2×103个/孔接种于96孔板,待细胞贴壁后更换为条件培养液,置细胞培养箱中培养。分别于第1、3、5 d弃去原培养液,加入含有10% CCK-8液的100 μL高糖DMEM不完全培养基避光孵育1 h,用酶标仪测定各孔在450 nm处的吸光度值(A450)。
1.5 划痕实验检测细胞迁移能力
实验分为2组,对照组培养液为含有1%青霉素/链霉素的高糖DMEM不完全培养基,实验组另外添加最佳浓度的iPRFe,两组培养液均不含胎牛血清,每组3个复孔。将HUVECs以1×105个/mL接种于6孔板,待细胞完全融合后,用无菌枪头在孔板底部做出划痕标记,各组更换为无血清条件培养液,置细胞培养箱中培养。分别于0、12、24 h在显微镜下拍照,用Image J软件处理图像,比较各组划痕愈合情况。
1.6 小管形成实验检测细胞成血管能力
实验分组同1.5。血管生成载玻片每孔加入10 μL复温可流动的Matrigel基质胶于底部,置细胞培养箱中30 min使其凝固。调整HUVECs密度为2×105个/mL,每孔加入经无血清条件培养液重悬的50 μL细胞悬液于基质胶表面,置细胞培养箱中孵育。6 h后,弃去原培养液,每孔加入50 μL浓度为6.25 μg/mL的钙黄绿素,避光孵育30 min,PBS洗3次后荧光显微镜下拍照,用Image J软件分析各组小管形成情况。
1.7 实时定量PCR(real-time quantitative polymerase chain reaction, RT-qPCR)检测成血管相关基因的mRNA表达水平
实验分组同1.5。将HUVECs以1×105个/mL接种于6孔板,待细胞贴壁后更换为无血清条件培养液。分别于12、24 h弃去原培养液,PBS洗3次,每孔加入1 mL TRIzol裂解细胞,根据试剂盒的说明书提取总RNA,再使用TaKaRa试剂盒逆转录得到cDNA,检测血管生成素(angiogenin, ANG),C-X-C基序趋化因子受体4(C-X-C motif chemokine receptor 4, CXCR4),血小板衍生生长因子受体A(platelet-derived growth factor receptor A, PDGFRA)和血管内皮生长因子(vascular endothelial growth factor, VEGF)mRNA的表达水平,甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)作为内参基因。所用引物序列见表1。

表1 用于RT-qPCR的引物序列
1.8 统计学处理
2 结 果
2.1 iPRFe对HUVECs增殖能力的影响
用不同浓度的iPRFe处理HUVECs 12 h后发现,0.4 mg/mL浓度的iPRFe促进细胞增殖效果最佳,0.2 mg/mL浓度的iPRFe也有一定促进作用(图1A,P<0.05)。24 h后,所有浓度的iPRFe对HUVECs增殖能力均有促进作用,其中0.4 mg/mL iPRFe组细胞增殖率高于1.6 mg/mL iPRFe组和0.2 mg/mL iPRFe组,差异具有统计学意义(图1B,P<0.05)。因此,0.4 mg/mL浓度的iPRFe被认为是促进HUVECs增殖的最佳浓度,并被选择用于后续实验。
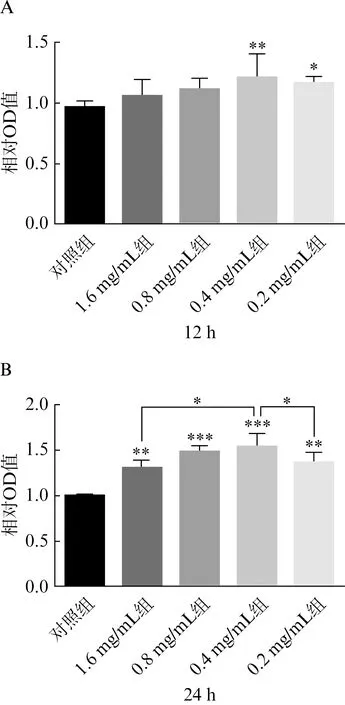
图1 不同浓度iPRFe处理12 h(A)和24 h(B)后对HUVECs增殖能力的影响
2.2 iPRFe对HUVECs迁移能力的影响
用最佳浓度的iPRFe处理HUVECs,观察细胞迁移情况。如图2所示,培养12 h时,iPRFe组的细胞迁移率均大于对照组,24 h时差异更为显著,差异具有统计学意义(图2,P<0.05)。

图2 iPRFe对HUVECs迁移能力的影响
2.3 iPRFe对HUVECs成血管能力的影响
小管形成实验的结果显示,HUVECs经iPRFe处理6 h后形成小管结构的连接点数、分支数、总长度和相对面积均大于对照组,差异具有统计学意义(图3,P<0.05)。同时,iPRFe处理12 h和24 h也明显提高了HUVECs中成血管相关基因ANG、CXCR4、PDGFRA和VEGF的表达水平(图4,P<0.05)。
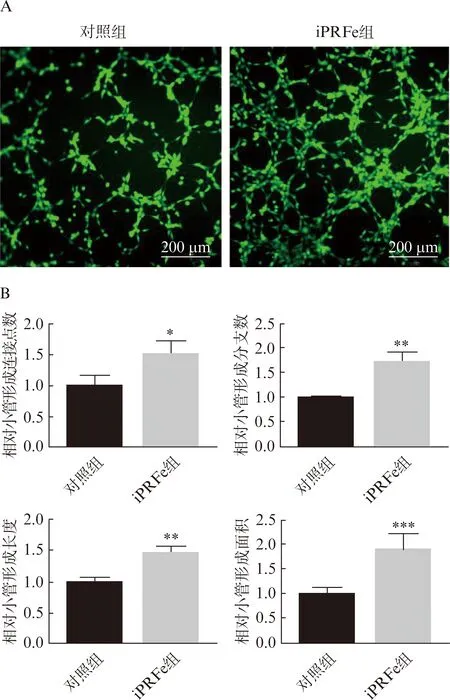
图3 iPRFe对HUVECs成血管能力的影响

图4 iPRFe处理12 h(A)和24 h(B)后对HUVECs成血管相关基因表达的影响
3 讨 论
牙髓再生包括干细胞移植策略和细胞归巢策略,相较于前者,细胞归巢策略不需要在体外培养干细胞,也避免了可能的免疫排斥反应,因此在临床应用上更具优势,但寻找合适的支架材料和生长因子提高牙髓再生的成功率是需要解决的问题[8-9]。血小板浓缩制品是一类天然生物支架材料,其交联纤维蛋白网中含有促进干细胞增殖、迁移和分化的生长因子,高浓度的血小板也在伤口愈合过程中充当关键调节剂,已经被用于促进口腔软、硬组织再生[10]。其中iPRF是静脉血经低速、低温离心后得到的新型血小板浓缩制品,其液体形态的优势便于被注射入复杂细小的根管系统,并在室温下逐渐凝固,为再生医学提供了一种实用形式[11]。
血管生成是胚胎发育、损伤修复和组织再生等生理、病理过程中的重要事件[12]。牙髓是高度血管化的组织,因此血管再生是恢复牙齿活力,维持牙齿正常发育、免疫防御和自我修复功能的基础[1]。体内牙髓再生过程中血管化的发生可以由具有成血管潜能的牙源性干细胞直接实现,也可以是牙源性干细胞在生长因子的诱导下分化为血管内皮细胞,再发生增殖、迁移和成血管等一系列程序性事件[13-14]。本实验选用的HUVECs源自人脐静脉内皮,可以较好模拟生理状态下内皮细胞的特性,常被用于构建体外成血管模型[12]。因此,本研究拟通过细胞增殖、迁移和成血管分化实验分析iPRF对体外培养的HUVECs生物学行为的影响,初步评估iPRF在再生性牙髓治疗中的应用前景。
以往的研究提出,血小板浓缩制品对细胞生物学行为的影响并不完全表现为浓度依赖性[15]。同时,课题组前期在研究iPRF对人根尖牙乳头干细胞(human stem cells from apical papilla, hSCAPs)生物学行为的影响时也发现0.4 mg/mL的iPRFe促进hSCAPs增殖效果最佳,0.4 mg/mL的iPRFe还能明显提高hSCAPs的迁移和矿化能力[7]。因此,本研究参考前期研究方案并进行改良,设置了1.6 mg/mL、0.8 mg/mL、0.4 mg/mL和0.2 mg/mL共4个浓度梯度用于筛选促进HUVECs增殖的最佳浓度。综合分析12 h和24 h之后各组细胞的增殖情况后,0.4 mg/mL浓度的iPRFe被认为是促进HUVECs增殖的最佳浓度。iPRFe中被检测到许多与细胞增殖、迁移和分化有关的生长因子[6,16],本实验结果提示适宜浓度的生长因子对细胞增殖的促进效果最佳,过高的浓度反而达不到最好的效果。内皮细胞发生迁移是血管生成的标志行为之一,参与血管生成的早期过程[12]。划痕实验常用于量度细胞横向2D迁移的能力,体外培养的细胞完全融合后,在无血清的条件下人为制造的划痕愈合情况可以反映细胞的迁移活性。在本研究中,划痕制造12 h后iPRFe组细胞迁移率明显大于对照组,24 h后两组差异更为明显,证明iPRFe可以有效促进HUVECs的迁移能力。然而,既定的细胞行为可能是多种细胞因子和信号通路相互作用的结果,其作用机制有待进一步研究。
本研究通过小管形成实验和成血管相关基因的检测来探究iPRFe对HUVECs成血管的作用。本实验使用的Matrigel基质胶是最简单常用的体外血管生成模型,可以评估细胞在无血清条件下与基质胶中的生长因子和细胞外基质成分相互作用而形成小管样结构的能力[17]。荧光图片清晰展示了iPRFe组形成的小管样结构明显多于对照组,与软件定量分析结果一致。同时,iPRFe也显著提高HUVECs中成血管相关基因ANG、CXCR4、PDGFRA和VEGF的mRNA表达水平。CXCR4参与细胞内稳态,在血管生成早期招募细胞有助于血管再生[18];ANG、PDGFRA和VEGF通过激活血管内皮细胞的系列反应刺激血管生成[19-21]。这些血管生成标志物在iPRFe组的高表达也证明了iPRF的促血管生成能力。据报道,iPRF内含有可以调节血管生成的多种生长因子,包括高浓度的血小板衍生生长因子(platelet derived growth factor, PDGF)、转化生长因子(transforming growth factor, TGF)和VEGF等,可以缓慢释放长达10 d以上[6,16]。以往的一项体外共培养模型也发现,iPRF可以上调促血管生成因子VEGF的表达[22]。iPRF联合明胶纳米颗粒也被报道可以促进血管生成和成骨,有利于拔牙后的牙槽嵴保存[23]。总的来说,iPRF在促进血管生成的多个事件中都发挥了促进作用,其促血管生成和组织再生的能力得到初步验证。然而,本研究还有很大的局限性,因为HUVECs不存在于生理状态下的牙髓组织中,不能完全代表牙髓再生过程中干细胞的生物学行为。因此,基于本研究的结论,本课题组计划进一步探究iPRF对牙髓内固有细胞成血管分化能力的影响,更好地阐明iPRF用于临床牙髓再生的可行性。
综上所述,本研究结果表明iPRF对体外培养的HUVECs增殖、迁移和成血管分化能力具有促进作用,为可注射型富血小板纤维蛋白应用于再生性牙髓治疗提供了一定理论基础,但其分子机制及临床转化的效果有待进一步探究。

