人脐带间充质干细胞在脊髓损伤修复中的研究进展
李永超, 冯晓飞, 苏启航, 谭 军, 李立钧
(同济大学附属东方医院脊柱外科,上海 200120)
脊髓损伤(spinal cord injury, SCI)发病率和致残率高,给患者家庭和社会带来了沉重的负担,其治疗和康复现已成为医学研究的一大难点[1-2]。临床上,治疗SCI的常见方法包括药物、手术和康复锻炼,但只能部分改善症状,很难从根本上恢复损伤的脊髓。大多数SCI患者仍然失去神经功能,部分原因是脊髓自身再生能力非常有限[1,3]。因此,迫切需要一种新颖、有效的SCI治疗方法,以挽救丧失的脊髓功能[4]。
近年来,干细胞移植技术的进步和对SCI病理生理学机制的深入研究,给SCI患者带来了新的希望[5-8]。目前,已发现多种可用于修复SCI的种子干细胞,见表1[5]。在众多干细胞中,人脐带间充质干细胞(human umbilical cord mesenchymal stem cells, hUC-MSCs)移植可能是修复损伤脊髓极具吸引力的治疗选择之一[9-11]。hUC-MSCs具有取材方便、易于运输、低免疫原性、无伦理争议、无成瘤性、快速增殖和多向分化等优点[12]。临床前动物研究已证实hUC-MSCs修复SCI的巨大潜力,但临床转化并不顺利[6,13-14]。其临床最佳移植途径、剂量、时间窗,以及hUC-MSCs脊髓修复机制、临床安全性和有效性等仍需进一步探索。本文就hUC-MSCs治疗SCI的最新研究进展进行综述。
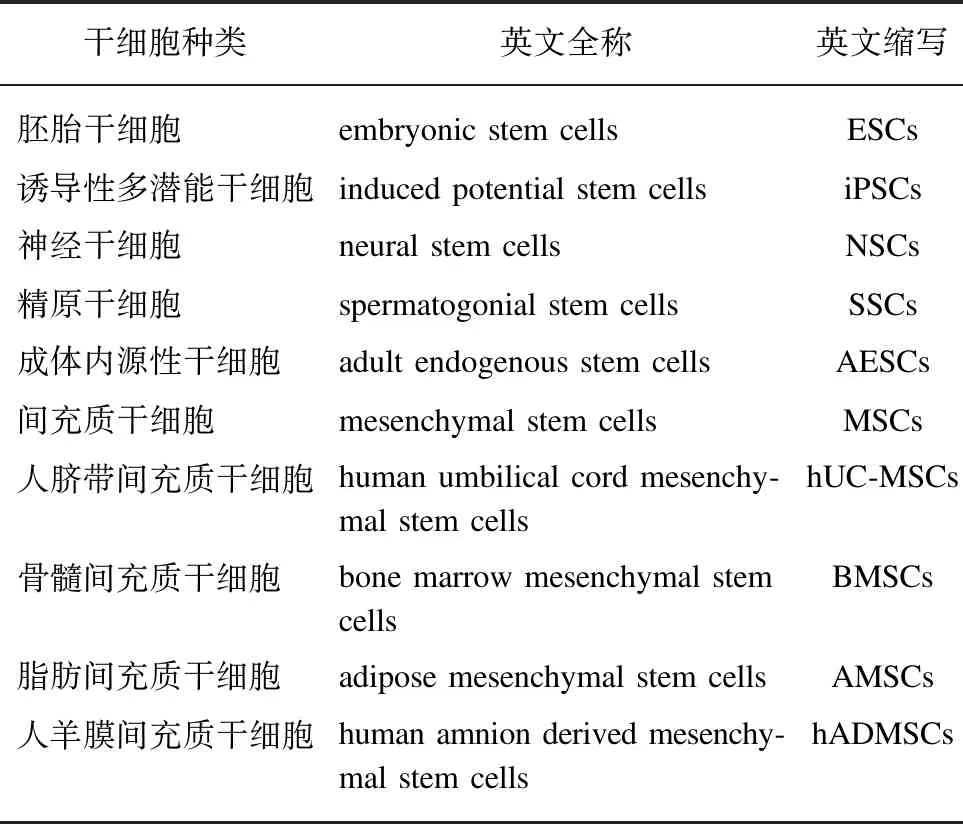
表1 用于修复SCI的干细胞分类
1 SCI的病理生理和分子病理机制
损伤脊髓神经功能的恢复与不同病理生理时期密切相关[1]。SCI急性期(2周内)以免疫炎症反应为主;亚急性期(2周-2个月)表现为神经元坏死及神经抑制因子表达升高;慢性期(>2个月)表现为轴突变性、空洞和胶质瘢痕形成,导致神经功能永久丧失[1,10]。在分子病理机制层面,SCI也可分为原发性脊髓损伤和继发性脊髓损伤[9,15]。继发性脊髓损伤包括炎性反应、神经细胞死亡和微环境失衡等在内的一系列复杂的病理反应[9]。在继发性脊髓损伤中,微环境失衡是限制脊髓修复的关键因素[9]。目前,针对SCI后不同分子病理特点和病理生理时期,通过抗炎、神经营养和免疫调节等作用,以改善失衡的脊髓微环境是治疗SCI的关键[9-10,15]。
2 hUC-MSCs的生物学特性
脐带具有来源广泛,取材方便无创等优点,其动静脉之间含有特殊的胚胎黏液样结缔组织(沃顿胶),而从中分离得到的基质细胞即为hUC-MSCs[16-17]。hUC-MSCs表达具有干细胞特性的标志,且具有自我更新、大量增殖和多向分化潜能,其诱导培养能向神经元细胞、骨细胞等多种成体细胞分化[12,16]。hUC-MSCs除了具有向神经细胞分化的潜能,也有很强的自分泌与旁分泌功能[18]。此外,hUC-MSCs很少表达人类白细胞Ⅰ类抗原、缺乏人类白细胞DR抗原和共刺激分子CD40和CD80,且拥有较低的免疫原性和良好的移植后受体耐受性[19]。
3 hUC-MSCs对SCI的神经修复机制
目前,hUC-MSCs对SCI的详细神经修复机制尚未完全的阐明,可大致概括为3个方面[10,14,20-25]。
(1) 通过分泌各种因子保护神经元,促进残存神经元轴突的再生和突触形成,并促使损伤脊髓局部的血管再生。Xie等[14]大鼠SCI动物模型发现,移植hUC-MSCs可分泌神经生长因子,维持细胞在高活性氧微环境中的活力,使损伤脊髓得到有效恢复。此外,Xiao等[21]通过体外研究证实hUC-MSCs分泌的外泌体可通过miR-29b-3p/PTEN轴激活PI3K/AKT通路减少SCI神经元的凋亡。与此同时,Cao等[26]研究发现,在亚急性SCI大鼠模型中,hUCMSCs有效剂量移植可促进γ-氨基丁酸A型(γ-aminobutyric acid A, GABAA)受体表达的部分恢复,提示GABAA受体可能是SCI的治疗靶点。
(2) 改善损伤脊髓局部微环境,减轻炎症反应,并减少脊髓空洞、胶质瘢痕的形成和瘢痕的屏障阻碍作用。Liu等[22]研究发现大鼠SCI造模后血清中促炎细胞因子IL-1β、IFN-γ、IL-6和TNF-α升高。而鞘内注射hUC-MSCs治疗3、7 d后,IFN-γ、IL-6和TNF-α呈明显下降趋势。Zhu等[27]研究发现hUC-MSCs移植治疗小鼠急性脊髓损伤可促进运动功能的恢复,且与对小胶质细胞的抑制作用密切相关。他们认为hUC-MSCs移植治疗急性SCI的效果取决于其对神经损伤后炎症反应的抑制能力。此外,Li等[23]发现hUC-MSCs可能通过抑制Ⅰ型胶原蛋白、Ⅲ型胶原蛋白、FGF 2、p-p38、TRPV1、TLR4和p-NF-κB的表达,在急性SCI后膀胱功能重建中发挥关键作用。
(3) 可多向分化为神经元和少突胶质细胞,促进轴突再生、髓鞘化和重建神经环路。Cao等[25]发现hUC-MSCs移植通过调节损伤脊髓的继发性免疫炎症反应和PTBP-1表达,调节瘢痕形成和神经元再生,促进SCI小鼠功能恢复。
此外,hUC-MSCs还可释放含有大量生物活性分子的微泡和外泌体,刺激神经轴突再生、抑制瘢痕形成,同时加速血管再生和重建,发挥抗炎、抗凋亡作用,促进脊髓损伤的恢复[17,20]。Kang等[24]发现来自hUC-MSCs的外泌体可通过激活Wnt信号通路,降低小鼠小胶质细胞和星形胶质细胞的激活,抑制了神经元的凋亡,增强SCI小鼠的运动功能。
4 hUC-MSCs治疗SCI的最佳移植途径、剂量和时机
目前,hUC-MSCs的移植途径主要有鞘内注射、损伤局部注射和静脉输注。损伤局部注射可将hUC-MSCs直接注射至损伤脊髓周围,但也有导致脊髓二次损伤和出血风险。而静脉输注简单易行,风险相对较小,但多数hUC-MSCs迁移到肺、脾脏和肾脏,很少迁移至脊髓损伤部位。蛛网膜下腔鞘内注射可避免上述问题,简便易行,损伤小,且hUC-MSCs可从蛛网膜下腔迁移至脊髓损伤部位,保障足够的细胞数量[20]。有研究发现,鞘内递送后细胞植入和组织保存明显更好,并且蛛网膜下腔鞘内注射降低了宿主免疫反应。相较于其他细胞输送方法,鞘内注射能更好地恢复脊髓功能[28]。2022年,Liu等[22]发现相比静脉注射,鞘内注射hUC-MSCs对SCI大鼠具有剂量依赖的神经保护作用,可减少移植所需的细胞数量,是治疗需要控制炎性细胞因子或组织修复的SCI的更合适的方法。Lu等[10]基于动物研究的系统综述和Meta分析发现局部hUC-MSCs移植(鞘内注射或损伤局部注射)的治疗效果明显优于静脉移植。Chen等[29]通过Meta分析发现鞘内注射移植入路对脊髓损伤患者的神经功能改善最大。因此,微创蛛网膜下腔鞘内注射被认为是最安全、最有效的hUC-MSCs输送方法[1]。
hUC-MSCs的移植剂量决定了到达损伤部位的有效干细胞的数量,且与SCI的修复密切相关。与骨髓间充质干细胞相比,hUC-MSCs体积更小,在宿主环境中更具移动性,更容易通过体内的各种屏障,更小的体积可以容纳更多的细胞。因此,hUC-MSCs的剂量依赖效应更为明显。然而,过大的移植剂量可能导致细胞团的形成,导致器官和组织栓塞,从而影响干细胞的功能。反之,过低剂量的干细胞不能充分发挥修复作用,因为没有足够剂量的干细胞到达损伤部位。为了保证足够的干细胞发挥修复作用,必须增加干细胞的移植剂量[10]。Cao等[26]研究发现,在亚急性SCI大鼠模型中,1×106hUC-MSCs/kg的剂量(而不是0.25×106hUC-MSCs/kg的较低剂量)与4×106hUC-MSCs/kg一样有效地改善功能恢复。因此,他们认为鞘内植入1×106hUC-MSCs/kg是治疗亚急性脊髓损伤的替代方法。有研究表明,过高剂量的细胞移植可引发强烈的炎症反应,从而降低干细胞的修复效果[12]。最近,Lu等[10]基于动物研究的系统综述和Meta分析发现无论何种移植途径和时机,都得到了相同的结果,即高剂量≥1×106hUC-MSCs移植优于低剂量<1×106hUC-MSCs移植。此外,由于鞘内注射的hUC-MSCs生存时间有限,相同剂量的hUC-MSCs移植后,重复移植的效果明显优于单次移植。因此,多次重复注射hUC-MSCs可能是提高干细胞修复效果的一种潜在策略,值得未来继续探索[10]。
hUC-MSCs在体内容易受损伤脊髓局部微环境的影响,因此选择最佳的移植时机非常重要。hUC-MSCs移植过早会导致细胞坏死,过晚容易受胶质瘢痕影响,阻碍神经纤维再生[10]。此外,hUC-MSCs可分泌多种因子,更早期移植利于消除或减轻继发性脊髓损伤。Lu等[10]基于动物研究的Meta分析发现亚急性hUC-MSCs移植的治疗效果明显优于急、慢性移植。因此,他们认为SCI亚急性期(2周-2个月)移植是hUC-MSCs的最佳移植时机。也有研究发现,hUC-MSCs的最佳移植时机是损伤后3-4周内,既可避免脊髓损伤急性期炎性因子对hUC-MSCs的损害,也可避免慢性期胶质瘢痕形成对轴突再生的阻碍[20]。因此,hUC-MSCs的最佳移植时机仍需进一步探索,尤其需开展临床研究以验证最佳的移植时机。
5 hUC-MSCs移植治疗SCI的临床安全性和有效性
虽然多项动物研究支持hUC-MSCs移植修复损伤的脊髓,但临床应用却取得了不一致的结果[6,13-14]。Dai等[30]将自体hUC-MSCs直接移植到SCI部位,发现18例患者中仅有8例感觉和运动功能轻度恢复,干细胞移植可能引起发热、头痛、神经性疼痛等不良反应。Oh等[31]的三期临床试验也显示,在接受干细胞移植的16例患者中,只有2例患者神经功能略有改善。但在Yao等[32]的研究中,25例外伤性脊髓损伤(损伤时间>6个月)患者通过静脉和鞘内注射hUC-MSCs后随访1年,可发现部分患者自主神经得到恢复。Zhu等[33]研究报道了20例SCI慢性期患者经hUC-MSCs移植后,13例改善了运动和括约肌功能,且5例从完全转化为不完全SCI。而刘静等[20]长期随访研究采用hUC-MSCs蛛网膜下腔注射治疗35例SCI患者,输注剂量为每次1×106cells/kg,1周1次,1疗程4次,共完成46个疗程。结果发现25例不完全性SCI患者有效率达88%,10例完全性SCI患者均无效。最后,她们认为hUC-MSCs鞘内注射治疗安全可靠,且能改善大多数脊髓不完全性损伤患者的神经功能,多疗程治疗有可能使患者疗效得到进一步提高。上述临床研究结果差异较大,主要原因是未采用一致的hUC-MSCs移植途径、剂量和时机。2022年,石尧等[6]开展的一项hUC-MSCs治疗SCI有效性与安全性的Meta分析,共纳入6篇随机对照试验和4篇队列研究,结果发现hUC-MSCs治疗SCI安全有效,患者的感觉和运动功能以及日常生活能力可得到显著改善,不良反应较少。他们认为具有高等级证据支持hUC-MSCs治疗SCI,值得在临床中进行更大规模研究。但值得注意的是,该Meta分析所纳入研究的hUC-MSCs移植途径、剂量和时机存在着不同,可能会对结论产生一定的影响。
6 展 望
目前,大量的基础实验和临床研究发现hUC-MSCs移植是治疗SCI的一个有前景的治疗方法,但仍存在一些问题亟待解决: (1) 受损脊髓局部炎性环境可导致所移植的hUC-MSCs大量死亡,并影响其发挥正常功能。因此,采用综合治疗方法如联合应用水凝胶或纳米材料支架,以最大发挥hUC-MSCs的生物活力。Chen等[34]发现3D打印的胶原蛋白/丝素蛋白携带hUC-MSCs分泌蛋白质组支架可以通过桥接脊髓损伤来部分重建脊髓损伤后的神经回路,从而改善神经功能障碍,这表明植入携带MSCs分泌蛋白质组的3D打印胶原蛋白/丝素蛋白支架有可能成为一种新的、更安全的脊髓损伤修复治疗方法。(2) 需进一步阐明hUC-MSCs的生物学特点,采用小分子活性肽、生长因子等新方法以更好诱导hUC-MSCs向神经细胞分化。(3) 急需建立临床级、标准化的hUC-MSCs体系,助于同质化地开展基础实验和临床研究。(4) 目前,仅局限临床研究应用hUC-MSCs移植治疗SCI患者,进一步仍需开展大样本的随机对照临床研究,以验证hUC-MSCs最佳的移植途径、剂量和时机[2]。

