基于高通量技术分析粉防己不同组织内生细菌多样性及功能预测
杨立军 徐源 高涵 贾艳娇 陈琼 叶润 段鸿斌

摘要:为了探究粉防己内生细菌的多样性,挖掘粉防己内生细菌资源,采用Illumina MiSeq测序技术对粉防己根、茎、叶内生细菌的16S区进行测定,并分析群落组成、多样性、差异化及功能等生物学信息。结果表明,从粉防己不同组织中共获得212 928个有效序列,1 130个操作分类单元(OTU),隶属于23门、38纲、78目、148科、304属、290种。α多样性分析结果表明,根部内生细菌的群落丰富度最高,叶部内生细菌的多样性最高,茎部内生细菌的丰富度、多样性最低。在门水平上,变形菌门在不同组织中的丰度均最高,为最优势菌门。在纲水平上,根部内生细菌的优势菌纲为放线菌纲;茎部、叶部内生细菌的优势菌纲均为γ-变形菌纲。在属水平上,根部内生细菌的优势菌属为拟无枝酸菌属(Amycolatopsis);茎部内生细菌的优势菌属为泛菌属(Pantoea);叶部内生细菌的优势菌属有泛菌属、金黄杆菌属。热图结果表明,同类型组织样本群落结构相似,不同组织样本间的群落组成差异显著。LEfSe分析结果表明,引起不同组织差异显著的菌门主要为变形菌门、放线菌门、TM7菌门,菌属主要为假诺卡氏菌属、酸杆菌属、慢生根瘤菌。PICRUSt2功能预测发现,粉防己内生细菌功能基因丰富,其中与新陈代谢、环境信息处理、遗传信息处理相关的基因数量相对最多。综上,粉防己内生细菌具有丰富的群落多样性及功能多样性,可为进一步开发利用粉防己内生细菌资源奠定基础。
关键词:粉防己;内生细菌;多样性;高通量测序;功能预测
中图分类号:S182 文献标志码:A 文章编号:1002-1302(2023)17-0019-10
粉防己(Stephania tetrandra S. Moore)是防己科千金藤属植物,以根茎入药,主要药用成分为生物碱,其中粉防己碱(C38H42N2O6)、防己诺林碱(C37H40N2O6)作为《中华人民共和国药典》2020年版规定的粉防己的质量标志物,具有抗肿瘤、抗炎、抗痛风、抗细胞纤维化等药理活性[1]。粉防己作为一种宝贵的中药材,近年来逐渐发展为经济作物,在农业种植上占有优势地位[2]。植物内生细菌在促进植物体生长繁殖、有效物质合成、抵御病虫害等方面发挥着重要作用[3-4]。植物中不同组织由于生存环境及自身结构的差异,造成菌落物种多样性、丰富度差异显著[5]。不同组织中菌群的丰度变化可为挖掘粉防己中具有特定应用价值的微生物种质资源指明方向。因此,掌握粉防己内生细菌资源分布规律及功能,对粉防己的农业可持续发展及内生细菌资源的充分利用具有重要意义。
近年来,植物内生菌作为国内外迅速受到关注的微生物类群,逐渐受到研究者的喜爱。大量研究发现,植物内生菌广泛分布于植物根、茎、叶、花、果实、种子中[4]。由于植物体受到环境因素、自身生长状态及物种基因型的影响[6-8],其分布在不同组织中的菌落组成结构和功能有所差异。尹秀等研究发现,手掌茎部、叶部、果荚组织中的内生真菌组成具有相似性,而根中的内生菌与其他组织的内生菌之间存在差异[9]。李佳琪等研究发现,由于知母叶部生长旺盛,与环境接触较密切,其多样性最高。该研究还发现,较高菌株比例的发酵产物对浅表感染真菌表现出良好的拮抗活性[10]。Purushotham等研究发现,霍罗皮托组织类型对内生细菌多样性的影响显著,并且多数可培养内生细菌对植物病原菌高度拮抗[3]。刘蓬蓬等研究发现,黄芪内生细菌群落多样性较低,参与有效成分生物合成和代谢的基因较多[11]。众多研究结果表明,内生菌的基因型在揭示宿主植物生理特性方面具有重要意义。顾美英等发现,黑果枸杞内生细菌中与新陈代谢相关的功能基因相对丰度较高,验证了黑果枸杞本身含有豐富的氨基酸、脂肪、维生素、花青素、多糖和总黄酮等活性成分[12]。杨多等发现,胡杨内生细菌群落中细胞壁、细胞膜、外排泵、氧化应激、相容性溶质、能量代谢等相关通路表达丰度较高,与多盐碱胁迫环境下胡杨表现出较强的抗逆性相契合[13]。
目前,对于植物内生菌的分离多集中于体外培养,但由于大多数内生菌受外界因素的影响,仅有少部分内生菌能够被分离获得[14]。因此,传统的组织分离方法对研究微生物多样性具有极大的局限性。高通量技术因具备测序基数大、测序深度广等特点,已广泛应用于微生物多样性研究[15]。本研究采用Illumina MiSeq第二代测序技术全面系统地分析粉防己根、茎、叶内生细菌群落分布规律,并对不同组织中内生细菌群落功能进行预测,以期从整体上把握粉防己内生细菌多样性及功能群结构,为粉防己内生细菌资源的开发利用提供理论基础。
1 材料与方法
1.1 样品
新鲜粉防己于2022年11月采集自中国河南省信阳市信阳农林学院中药材种植示范基地[全球定位系统(GPS)坐标:114°01′~114°06′E,31°46′~31°52′N],由信阳农林学院陈琼教授鉴定。在试验中设置3组样品进行处理,每组样品设3个生物学重复,即根样品(FG):FG1、FG2、FG3;叶样本(FY):FY1、FY2、FY3;茎样本(FJ):FJ1、FJ2、FJ3。
1.2 样品预处理
将新鲜植物根、茎、叶上的杂物冲洗干净,每种组织材料取5.0 g,用无菌水冲洗3次,并用无菌滤纸吸收表面水分。依次用75%乙醇浸泡3 min、3%次氯酸钠溶液浸泡2 min、75%乙醇处理30 s,最后用无菌水清洗5次,并用无菌滤纸吸收植物组织表面的水分。取最后1次漂洗液涂布于营养琼脂平板上,于28 ℃培养2~3 d,以检测各组织表面是否消毒彻底。将消毒后的样品置于-80 ℃超低温冰箱中,待进行下一步的DNA提取。
1.3 DNA提取
分别取3.0 g前期处理的根、茎、叶样本进行DNA处理,用蛋白酶K裂解结合苯酚三氯甲烷的方法抽提DNA片段,抽提的DNA用1.2%琼脂糖凝胶电泳检测。
1.4 PCR扩增与测序
选取16S区序列进行高通量测序分析。采用两步PCR扩增方法,以纯化的DNA为模板,利用16S区通用引物(799F 5′-AACMGGATTAGATACCCKG-3′;1193R 5′-ACGTCATCCCCACCTTCC-3′)将含有特异性barcode和部分测序引物的融合引物进行PCR扩增,取3 μL PCR产物进行1.2%琼脂糖凝胶电泳检测,观察条带是否单一、片段长度是否与预期片段一致,并将PCR扩增产物用2%琼脂糖凝胶电泳切胶回收,用AXYGEN公司的AxyPrep DNA凝胶回收试剂盒回收PCR产物,并对回收产物进行定量分析,将样品按照等摩尔比混匀后进行二次PCR扩增,添加测序所需的特异性接头,完成文库构建,通过Novaseq 6000 SP 500 Cycle Reagent Kit(Illumina USA)平台,在微基生物科技(上海)有限公司完成测序。
1.5 数据统计与分析
将原始数据通过barcode分配样品reads,得到有效序列,并通过Trimmomatic(Version 0.35)软件去除末端的低质量序列,用cutadapt(version 1.16)软件进行测序接头和引物的处理,用Flash(version 1.2.11)软件对样品中的reads进行拼接,用mothur(Version 1.33.3)软件对序列质量进行质控、过滤,去除嵌合体,得到优化序列,按照97%的序列相似度,对所得序列采用uParse软件进行操作分类单元(OTU)聚类,并统计分析门、纲、属分类水平上的群落结构信息。用R语言(Version 3.6.3)对数据进行可视化分析,并绘制稀释曲线、Venn图、群落结构柱形图、heatmap。用R语言vegan分析每组的α多样性水平。用R语言中的pheatmap(version:1.0.12)进行群落差异性分析,用python(2.7.13)进行LEfSe组间优势内生细菌差异分析。利用PICRUSt2软件进行功能预测,参照KEGG数据库进行功能注释。
2 结果与分析
2.1 PCR扩增结果
所有植物样品的对照平板培养1周后没有菌落长出,表明样品表面已完全消毒。如图1所示,经电泳检测,所有样品的PCR扩增产物条带具有良好的特异性和亮度,无副带或拖带,表明PCR扩增条件合适,各样品纯度较高,可用于后续高通量测序分析。
2.2 测序样本数据统计
通过高通量测序,获得粉防己不同组织样品的原始DNA序列,对序列进行处理后,最终从9个测试样本中共获得212 928个有效序列、137 680个优化序列、51 855 756个优化序列碱基(表1)。从优化序列的平均长度得分来看,3组优化序列的长度均分布在300~400 bp,与16S区域的序列长度吻合。
2.3 粉防己不同组织内生细菌的OTU分布
由图2可知,经过聚类分析,粉防己的不同组织中共有1 130个OTU,根、茎、叶3个组织样品中分别检测到796、346、723个OTU。根、茎、叶中独立的OTU数分别是330、44、228个,分别占内生细菌总OTU数的29.20%、3.89%、20.18%。由此可见,根、叶中内生细菌多样性较高,茎中最低。根、叶中共有的OTU有433个,根、茎中共有的OUT有240个,叶、茎共有的out有269个,仅有207个OTU同时分布在根、茎、叶中,占OTU总数的18.32%。上述结果说明,不同组织之间的物种组成差异较大,表现出组织差异性。
2.4 α多样性分析
α多样性通常用于研究样本的群落多样性,通过α多样性指数来评估样本菌群组成情况。Chao指数、Ace指数反映了样品的群落丰富度,PD_whole_tree指数、香农指数和辛普森指数反映了样品群落的多样性,覆盖率能够表明样本排序的深度[16]。由表2可知,不同组织样本中的微生物覆盖率均大于99%,表明本检测能够反映样品中微生物的真实情况。Chao指数、Ace指数均表现为在根、茎、叶3个部位差异显著,且表现出根中内生细菌丰富度最高、叶中次之、茎中最低。叶中的香农指数最高,辛普森指数最低,表明叶中微生物群落多样性最高,茎中的微生物群落多样性最低。
由图3-A可以看出,在一定范围内,随着样本量的增大,曲线急剧上升,表示群落中有大量物种被发现, 需要增加抽样量;若曲线趋于平缓,则表明抽样合理可行[17]。从图3-A还可以看出,该曲线趋于平缓,表明此样本抽样充分。从图3-B可以看出,该曲线是在样本中按OTU丰度从大到小排序而成的,用于解释物种丰度、物种均匀度。在水平方向,物种丰富度越高,曲线在横轴上的范围越大;曲线越平缓,反映样本中物种分布越均匀[18]。从图3-B还可以看出,不同组织的丰富度表现为叶>根>茎。随着OTU数的增多,根、叶表现出较高的均匀度,而茎中有明显的优势菌群,均匀度最低。
2.5 粉防己不同組织中内生细菌的群落组成和群落结构
种群归类结果显示,粉防己根、茎、叶样品中共检测到23门、38纲、78目、148科、304属、290种细菌。在不同组织中,各类细菌的分类阶层总数存在差异,其中从根部检测到22门、35纲、69目、116科、204属、193种细菌,从叶部检测到19门、31纲、67目、131科、257属、236种细菌,从茎部检测到18门、31纲、58目、96科、169属、140种细菌。
由图4可以看出,在门水平上,粉防己不同组织中可归类细菌群落(OTU至少在1个组织中的丰度≥1%)共分布9门细菌,包括变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、异常球菌-栖热菌门(Deinococcus-Thermus)、TM7菌门(Saccharibacteria)、绿弯菌门(Chloroflexi)、绿菌门(Chlorobi)、酸杆菌门(Acidobacteria)。其中,变形菌门作为不同组织中共同的优势菌门,在根、茎、叶中的丰度分别为41.93%、95.97%、49.21%。不同组织中的内生细菌群落组成及丰度有一定差异,根中的优势菌门为变形菌门、放线菌门、TM7菌门,叶中的优势菌门为变形菌门、放线菌门、厚壁菌门。
茎中变形菌门的丰度最高,其他菌门仅占5%左右。除此之外,拟杆菌门、异常球菌-栖热菌门在叶中的丰度较高,而在根、茎中的丰度低于1%。
由图5可以看出,在纲水平上,粉防己不同组织中共有的优势菌纲包括γ-变形菌纲(Gammaproteobacteria)、放线菌纲(Actinobacteria)、α-变形菌纲(Alphaproteobacteria)、β-变形菌纲(Betaproteobacteria)、杆菌纲(Bacilli)等。而其他菌类的丰度较低,如酸微菌纲(Acidimicrobiia)、鞘氨醇杆菌纲(Sphingobacteriia)、绿菌纲(Chlorobia)、变形菌纲(Deltaproteobacteria)、不动杆菌纲(Acidobacteriia)、Solibacteres纲、丹毒丝菌纲(Erysipelotrichia)、迷踪菌纲(Elusimicrobia)。其中根、茎、叶中的优势菌纲差异较大,放线菌纲作为根的优势菌纲,丰度为41.53%;γ-变形菌纲作为茎、叶中的优势菌纲,丰度分别为91.27%、25.50%。由图5还可以看出,根、叶中的内生细菌物种组成较为丰富,在纲水平上的物种种类较多,茎中的内生细菌多样性较低,呈现出组织特异性。
由图6可以看出,在属水平上,粉防己不同组织中共有的优势菌属包括泛菌属(Pantoea)、酸杆菌属(Acidibacter)、拟无枝酸菌属(Amycolatopsis)等。拟无枝酸菌属、酸杆菌属作为根中的优势菌属,两者在根中占比高达50%以上,分别占30.97%、21.54%。泛菌属作为茎中的绝对优势菌属,占比高达89.70%。从图6中还可以看出,叶中的内生细菌菌落组成较均匀,说明叶中的内生细菌群落较稳定。除未分类的细菌外,在叶中内生细菌丰度排名前5的菌种主要分布在泛菌属、金黄杆菌属(Chryseobacterium)、Exiguobacterium(尚无统一的中文名)、雷尔氏菌属(Ralstonia)、假单胞菌属(Pseudomonas)。
2.6 粉防己不同组织内生细菌的差异分析
基于各样品序列间的进化关系来比较微生物群落的显著性差异。通过非加权UniFrac分析可知,基于进化关系,粉防己不同组织的内生细菌总体可以分为2类,根和叶聚为一类,茎单独聚为一类,表明根、叶部含有的内生细菌物种具有较高的相似性;从热图的颜色可以看出,根、茎、叶的组间差异明显(图7)。
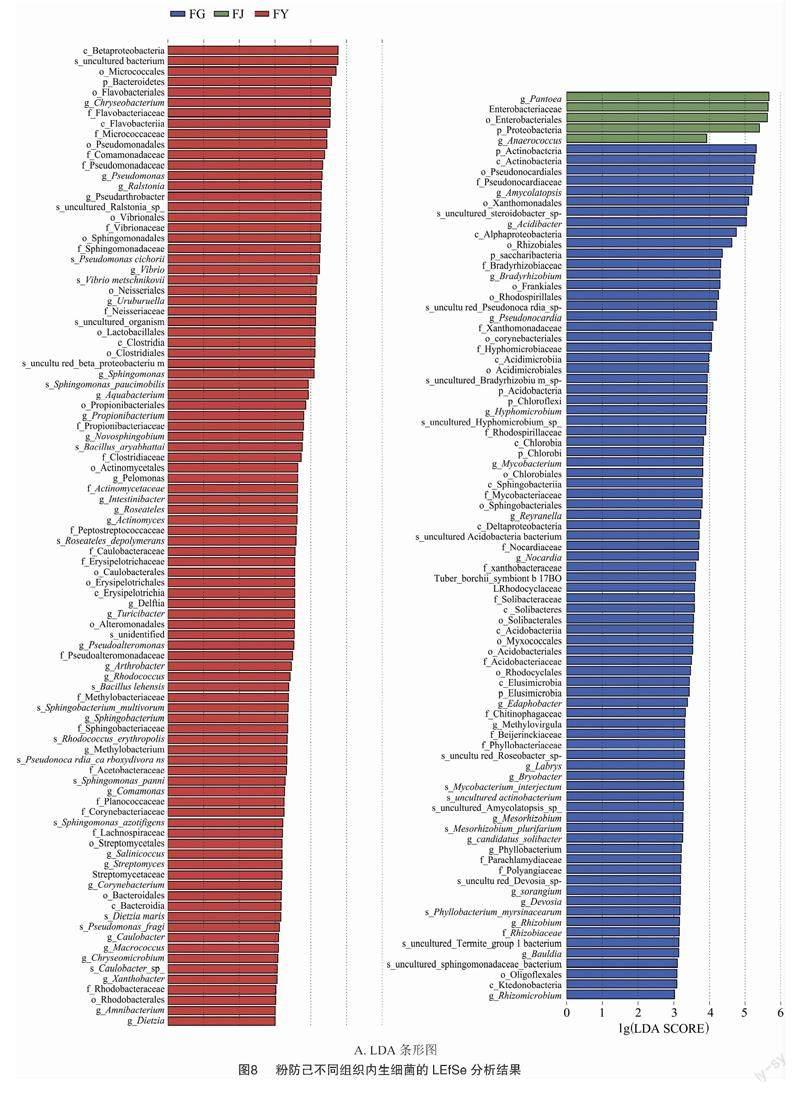
为了进一步分析粉防己不同组织中内生细菌的差异,对根、茎、叶样品进行LEfSe分析。图8-A为差异物种的LDA分布结果,颜色代表不同的分组,长度代表差异物种的贡献度大小,即LDA score[19]。图8-B为差异物种进化分支树。设定LDA score>3有显著差异。根中有82个差异显著单元,茎中有5个差异显著单元,叶中共有94个显著单元。由图8-A可知,β-變形菌纲在组间差异显著,且在根中丰度最高;β-变形菌纲的LDA值大于其他分类单元,表明对组间差异影响最大。同理,泛菌属在组间差异显著,在茎中丰度最高。放线菌门在组间差异显著,在叶中丰度最高。在门水平上,具有显著差异的门包括变形菌门、放线菌门、TM7菌门、厚壁菌门、拟杆菌门。在属水平上,具有显著差异的菌属共有12个,包括假诺卡氏菌属、酸杆菌属、慢生根瘤菌属、泛菌属、Uruburuella(尚无统一的中文名)、假节杆菌属(Pseudarthrobacter)、雷尔氏菌属、金黄杆菌属、弧菌属(Vibrio)、鞘氨醇杆菌属[JP4](Sphingomonas)、假单胞菌属、水杆菌属(Aquabacterium)。
2.7 功能预测分析
为了探究粉防己不同组织内生细菌的功能,本研究用PICRUSt2软件对内生细菌的功能进行预测。基于KEGG数据库比对,发现粉防己内生细菌所有基因序列注释的功能共分为六大类,分别为细胞过程、环境信息处理、遗传信息处理、人类疾病、生物体系统及新陈代谢。其中,新陈代谢、环境信息处理、遗传信息处理相关的基因数量最多,相对丰度分别为60.51%~67.44%、7.85%~13.66%、8.25%~9.91%。在KEGG二级分类的功能通路中,共有45个代谢通路,其中丰度占比排名前25的代谢通路如表3所示。在新陈代谢方面,碳水化合物代谢的相对丰度最大,占总数的15.56%~16.02%;在环境信息处理方面,膜运输、信号传导为主要功能;在遗传信息处理方面,主要涉及复制和修复、翻译、折叠、分类和降解等功能。此外,在人类疾病相关的通路中,以耐药抗菌、细菌性传染病、细胞异常生长为主。不同组织在各代谢通路中表现出差异性。在细胞过程、环境信息处理和人类疾病3个方面,其相对丰度均表现为茎部高于根部、叶部。在生物体系统、新陈代谢方面,根部的相对丰度最高。遗传信息处理方面,叶部的相对丰度最高。
3 讨论
本研究首次采用高通量技术对粉防己不同组织的内生细菌多样性展开分析,结果表明,根、茎、叶内生细菌丰富度及多样性呈显著差异。粉防己根部内生细菌的丰富度显著高于茎部、叶部,表现为根>叶>茎,而粉防己内生细菌的多样性则表现为叶>根>茎。该结果与其他研究中报道的在苹果砧木T337[20]、牛至[21]、三倍体毛白杨[22]中的研究结果相似,均表现为根部内生细菌多样性最高。土壤是根部内生细菌的重要来源,土壤中细菌通过自然孔口或伤口进入根部,经过长时间的特定选择机制使大量细菌移动并定殖于适宜的植物根部组织,可能是根部内生细菌多样性较高的原因[23-24]。粉防己叶部内生细菌的多样性最高,与喙核桃[16]、铁皮石斛[25]的研究结果一致。由此说明,粉防己叶部生长旺盛,与空气接触较紧密。内生菌经过与宿主长期进化,不同组织之间丰富度和多样性也随之呈现出差异性。
在门水平上,变形菌门为粉防己不同组织内生细菌的最优势菌门,在根、茎、叶中占比分别为41.93%、95.97%、49.21%。由此可以看出,茎部内生细菌主要为变形菌门,表现出茎部菌落分布不均一。除此之外,根中的优势菌门还包括放线菌门、TM7菌门。叶中的优势菌门还包括放线菌门、厚壁菌门。有研究结果显示,变形菌门在植物体中广泛分布,如甜樱桃[26]、烟草[27]、淫羊藿[19]等。有研究发现,变形菌门丰度越大,其中的有机质和C、N养分含量就越多[28]。目前,变形菌门在氮肥利用[29-30]、生物防治[31]、污染物降解[32]等方面具有相关应用。TM7菌门作为候选门级辐射类群中唯一成功获得的可培养菌株,普遍存在于人类口腔及消化道中,与口腔疾病与消化道疾病存在紧密联系[33-34]。厚壁菌门细菌具有嗜热、耐盐的特性[35],厚壁菌门作为叶部的优势菌门,能通过产生芽孢来抵抗脱水和极端环境[36-37],说明当叶部受到恶劣环境的影响时,具备抵御胁迫能力的厚壁菌门细菌能够生存下来。
在属水平上,不同组织中的优势菌属具有一定差异。拟无枝酸菌属、酸杆菌属作为根中的优势菌属,两者在根中占比达50%以上。泛菌属作为茎中的绝对优势菌属,占比高达89.70%。叶部各个菌属的丰度较均匀,其中金黄杆菌属、Exiguobacterium(尚无统一的中文名)、雷尔氏菌属、假单胞菌属的丰度较高。不同组织菌群的丰度变化可为挖掘粉防己中具有特定应用价值的微生物种质资源指明方向。拟无枝酸菌作为放线菌门下的菌群,在抗菌、抗癌、抗氧化、抗高血糖和酶抑制活性方面表现出较强的生物活性,具有挖掘新型抗生素的潜力[38]。有研究结果显示,酸杆菌属作为一种有益菌属,因具备环境修复的活性,常被用于制作生物肥料,在维护农业可持续性发展中起着重要作用[39]。酸杆菌属是根部的优势菌属,说明粉防己根部具有改善土壤健康的作用。泛菌属作为茎和叶部的优势菌属,广泛存在于植物中,具有固氮、溶解磷酸盐、分泌植物激素、抵御植物病害等作用[40]。此外,在不同组织中还含有大量未分类菌群,值得进一步研究。
粉防己中不同组织间微生物群落差异较明显,基于进化分析聚类结果可知,根和叶聚在一起,茎单独为一列。该结果说明,根、叶部位内生细菌的群落结果较为相似,而茎与根、叶部位的内生细菌差异较显著。茎部内生细菌可能由于自身结构特征,与外界微生物的交换能力较弱。由LEfSe分析结果可以看出,叶部的放线菌门、茎部的泛菌属及根部的β-变形菌纲对组间差异影响极大。该结果揭示,不同组织由于生存环境的差异造成群落物种多样性不同。
PICRUSt2功能预测结果表明,在粉防己根、茎、叶内生细菌中,新陈代谢通路中的碳水化合物及氨基酸代谢功能丰度较高。该结果与南瓜[41]、三七[42]、毛竹[43]中内生细菌的碳水化合物代谢功能丰度最高相似。碳水化合物代谢作为内生细菌获得营养物质的重要途径,在各个组织中含量均为最高,说明其内生细菌生理代谢状态均比较活跃。碳水化合物通路、内分泌通路在根中的相对丰度最高,说明根部内生细菌次级代谢产物丰富,从而证实粉防己以主根入药的优势。细胞活动性、膜运输、信号传导均在茎部注释到的基因数量最多,印证了茎作为植物的营养器官,起着运输营养物质的作用,也说明植物内生细菌与植物组织相辅相成。复制和修复、翻译、折叠、分类和降解均在叶部注释到的基因数量最多,说明叶生长旺盛,叶部内生细菌生长繁殖能力较强。通过对粉防己根、茎、叶中内生细菌的功能预测,为挖掘植物中功能菌株提供了参考依据。
4 结论
粉防己根、莖、叶部位均含有丰富的内生细菌,其中根部内生细菌物种丰富度最高,叶部内生细菌物种多样性最高,茎部内生细菌物种丰富度及多样性均最低。在群落组成上,变形菌门为3个组织共同的最优势菌门。在属水平上,不同组织部位内生细菌优势菌属存在差异。拟无枝酸菌属、酸杆菌属为根部优势菌属;泛菌属为茎部优势菌属;泛菌属、金黄杆菌属为叶部优势菌属。3个组织受到各种因素的影响,使得根、茎、叶中菌落结构呈现出差异性。LEfSe分析结果显示,放线菌门、β-变形菌纲、泛菌属是引起组间差异的显著单元。功能预测发现,植物内生细菌与植物组织相辅相成,其功能呈现出组织差异性。根、茎、叶内生细菌在新陈代谢、细胞活动、遗传信息处理通路上被注释到的基因数量较多。
参考文献:
[1]莫柳英,张 帆,郝二伟,等. 基于化学成分、药理作用及网络药理学的防己质量标志物(Q-Marker)预测分析[J]. 中草药,2022,53(19):6283-6295.
[2]赵云武,宋 伟,张 斌,等. 十堰地区粉防己种子育苗及林下栽培技术[J]. 黑龙江农业科学,2022(3):121-124.
[3]Purushotham N,Jones E,Monk J,et al. Community structure,diversity and potential of endophytic bacteria in the primitive New Zealand medicinal plant Pseudowintera colorata[J]. Plants,2020,9(2):156-170.
[4]巫 艳,周云莹,朱玺燊,等. 植物内生菌多样性及其病害生防机制研究进展[J]. 云南农业大学学报(自然科学版),2022,37(5):897-905.
[5]姚领爱,胡之璧,王莉莉,等. 植物内生菌与宿主关系研究进展[J]. 生态环境学报,2010,19(7):1750-1754.
[6]Jia T,Oberhofer M,Shymanovich T,et al. Effects of hybrid and non-hybrid epichlo? endophytes and their associated host genotypes on the response of a native grass to varying environments[J]. Microbial Ecology,2016,72(1):185-196.
[7]袁丛军,刘 娜,谢 涛,等. 贵州青钱柳群落结构及物种多样性特征[J]. 江苏农业科学,2022,50(4):131-138.
[8]Chen K L,Huang G,Li Y K,et al. Illumina MiSeq sequencing reveals correlations among fruit ingredients,environmental factors,and AMF communities in three Lycium barbarum producing regions of China[J]. Microbiology Spectrum,2022,10(2):e0229321.
[9]尹 秀,禄亚洲,张二豪,等. 手掌参内生真菌及根际土壤真菌的群落组成[J]. 植物保护学报,2022,49(4):1102-1110.
[10]李佳琪,胡海艳,姚华雄,等. 知母内生真菌多样性及其对浅表感染真菌的体外拮抗活性[J]. 中山大学学报(自然科学版)(中英文),2022,61(5):84-93.
[11]刘蓬蓬,陈江宁,孟 莉,等. 基于Illumina MiSeq高通量测序分析黄芪内生细菌多样性[J]. 中草药,2018,49(11):2640-2645.
[12]顾美英,古丽尼沙·沙依木,张志东,等. 黑果枸杞不同组织内生细菌群落多样性[J]. 微生物学报,2021,61(1):152-166.
[13]杨 多,岳海涛,伍杰毅,等. 胡杨叶片及韧皮部内生细菌多样性及生物学功能分析[J]. 微生物学报,2022,62(1):213-226.
[14]Rappé M S,Giovannoni S J. The uncultured microbial majority[J]. Annual Reviews in Microbiology,2003,57(1):369-394.
[15]Wen C Q,Wu L Y,Qin Y J,et al. Evaluation of the reproducibility of amplicon sequencing with Illumina MiSeq platform[J]. PLoS One,2017,12(4):e0176716.
[16]张桂华,李 旦,何承忠. 基于高通量测序分析喙核桃内生真菌多样性[J]. 山东农业科学,2022,54(11):62-69.
[17]赵 萍,金文刚,兰阿峰,等. 基于Illumina MiSeq测序技术分析大鲵肉冷藏过程中微生物菌群演替规律[J]. 食品科学,2022,43(20):172-182.
[18]王 艳,常 帆,程虎印,等. 重楼根际及药用部位内生真菌多样性与群落结构差异分析[J]. 中草药,2019,50(5):1232-1237.
[19]李巧玲,任明波,曹 然,等. 基于高通量测序的3种淫羊藿叶片内生细菌群落结构研究[J]. 微生物学杂志,2022,42(1):43-53.
[20]程 欢,张东华,张俊忠,等. 苹果砧木T337不同组织内生菌群落及其功能预测[J]. 江苏农业科学,2022,50(14):144-154.
[21]高 磊,刘永红,马金彪,等. 新疆药用植物牛至内生细菌多样性与抗菌活性[J]. 微生物学通报,2021,48(4):1140-1150.
[22]杨敬敬,韩 烁,王 霞,等. 三倍体毛白杨不同组织内生细菌多样性分析[J]. 微生物学通报,2022,49(8):3021-3036.
[23]曹 焜,王晓楠,孙宇峰,等. 植物根部内生细菌多样性及其生防作用研究进展[J]. 农业与技术,2017,37(17):1-3,5.
[24]Torsvik V,vres L. Microbial diversity and function in soil:from genes to ecosystems[J]. Current Opinion in Microbiology,2002,5(3):240-245.
[25]陈泽斌,李 冰,高 熹,等. 铁皮石斛不同部位内生细菌群落高通量分析[J]. 河南农业科学,2017,46(11):98-102,112.
[26]趙柏霞,闫建芳. 高通量技术分析‘砂蜜豆甜樱桃不同组织内生细菌多样性[J]. 中国农业科技导报,2023,25(3):66-77.
[27]林 丽,陈泽斌,何群香,等. 烟草不同部位内生细菌的多样性[J]. 江苏农业科学,2017,45(22):274-278.
[28]张秋玉,陈 晶,周雪妹,等. 莼菜不同组织内生细菌多样性的比较分析[J]. 中南民族大学学报(自然科学版),2022,41(3):285-291.
[29]李 雯,阎爱华,黄秋娴,等. 尾矿区不同植被恢复模式下高效固氮菌的筛选及Biolog鉴定[J]. 生态学报,2014,34(9):2329-2337.
[30]彭玉娇,崔学宇,邵元元,等. 不同树龄沙田柚果园土壤肥力、叶片养分和土壤细菌群落的特征[J]. 江苏农业学报,2021,37(2):348-354.
[31]Bodenhausen N,Horton M W,Bergelson J. Bacterial communities associated with the leaves and the roots of Arabidopsis thaliana[J]. PLoS One,2013,8(2):56329-56338.
[32]宋兆齐,王 莉,刘秀花,等. 云南4处酸性热泉中的变形菌门细菌多样性[J]. 河南农业大学学报,2016,50(3):376-382.
[33]聂 杰,陈宇星,姜 淞,等. 解糖微小寄生菌的研究进展[J]. 中国科学:生命科学,2021,51(11):1523-1531.
[34]Bor B,Bedree J K,Shi W,et al. Saccharibacteria (TM7) in the human oral microbiome[J]. Journal of Dental Research,2019,98(5):500-509.
[35]Seong C N,Kang J W,Lee J H,et al. Taxonomic hierarchy of the phylum firmicutes and novel firmicutes species originated from various environments in Korea[J]. Journal of Microbiology,218,56(1):1-10.
[36]Galperin M Y. Genome diversity of spore-forming firmicutes[J]. The Bacterial Spore(From Molecules to Systems),2016,1(2):1-18.
[37]杨文琦,龙宣杞,崔卫东. 玉米青贮中细菌多样性分析[J]. 新疆农业科学,2013,50(8):1424-1433.
[38]Song Z,Xu T,Wang J,et al. Secondary metabolites of the genus Amycolatopsis:structures,bioactivities and biosynthesis[J]. Molecules,2021,26(7):1884-1919.
[39]Liu X Y,Shi Y,Kong L Y,et al. Long-term application of bio-compost increased soil microbial community diversity and altered its composition and network[J]. Microorganisms,2022,10(2):462-481.
[40]Dutkiewicz J,Mackiewicz B,Lemieszek M K,et al. Pantoea agglomerans:a mysterious bacterium of evil and good. Part Ⅳ. Beneficial effects[J]. Annals of Agricultural and Environmental Medicine,2016,23(2):206-222.
[41]黃子粤,刘文君,覃仁柳,等. 不同品种南瓜内生细菌多样性及PICRUSt基因功能预测分析[J]. 中国农业科学,2021,54(18):4018-4032.
[42]李秋桦,夏体渊,任 禛,等. 基于高通量测序技术解析三七不同部位内生细菌多样性[J]. 西南农业学报,2021,34(10):2182-2190.
[43]朱伟垚,林梦婷,吴仲义,等. 不同竹龄毛竹茎干内生细菌多样性与功能预测[J]. 四川农业大学学报,2022,40(5):766-774.
收稿日期:2023-01-18
基金项目:国家自然科学基金(编号:32002083);河南省科技专项(编号:201111310900);河南省科技攻关项目(编号:222102110247)。
作者简介:杨立军(1993—),男,甘肃庆阳人,硕士,讲师,主要从事天然产物研究与开发工作。E-mail:yanglijun0417@126.com。
通信作者:段鸿斌,硕士,副教授,主要从事微生物与生化药学研究。E-mail:DHB19700102@163.com。

