三裂叶薯KUP/HAK/KT基因家族的全基因组鉴定和表达模式分析
吴胜男 孙凯 张海 刘峰 王凤

摘要:KUP/HAK/KT是植物中最大的钾转运体家族,在K+的吸收和运输及生物和非生物胁迫反应中起着关键作用。为了研究三裂叶薯ItbHAK基因家族的功能特征,利用生物信息学方法对三裂叶薯ItbHAK基因家族成员进行全面的生物信息学分析,包括系统进化、基因结构、染色定位、启动子分析、组织特异性和逆境胁迫下的表达模式分析。结果显示,在三裂叶薯中共鉴定出20个ItbHAK基因,系统进化关系将其分为4个进化簇。染色体定位结果显示,20个ItbHAK基因不均匀地分布在12条染色体上。三裂叶薯基因家族的蛋白质氨基酸数量在348~1 862之间,该家族的蛋白质均被定位到质膜上。基因结构分析结果显示,部分ItbHAK基因存在外显子丢失的情况。启动子分析发现,20个ItbHAK基因均含有参与生长发育、激素和生物/非生物胁迫的响应原件。三裂叶薯ItbHAK复制分析共发现5对大片段复制事件(ItbHAK1/ItbHAK9、ItbHAK3/ItbHAK8、ItbHAK3/ItbHAK19、ItbHAK4/ItbHAK6和ItbHAK8/ItbHAK19)和1对串联复制事件(ItbHAK16/ItbHAK17)。表达模式分析发现,ItbHAK基因在不同组织和逆境胁迫下的表达模式存在差异。研究结果为阐明三裂叶薯ItbHAK 基因家族的进化关系及进一步研究三裂叶薯ItbHAK基因的功能特性提供了有价值的信息。
关键词:三裂叶薯;KUP/HAK/KT基因家族;系统进化;逆境胁迫
中图分类号:S531.01 文献标志码:A 文章编号:1002-1302(2023)17-0052-07
K+是植物细胞中含量最丰富的阳离子,占植物干物质总量的2%~10%[1],它参与了植物的许多生理过程,包括跨膜运输、酶激活、阴离子中和、光合作用、渗透调节和气孔运动,从而调节植物的生长发育和胁迫的响应[2]。植物在长期的进化中形成了高效的K+运输系统,以确保植物在钾离子水平高度变化的条件下保持最佳生长[3]。在植物中,K+首先被根部吸收,然后转运到地上部分,并在细胞内被分配到不同的细胞器中[4],K+跨膜运输主要通过K+通道和转运体来实现[5]。因此,对高亲和力钾转运蛋白的功能和表达模式进行研究具有重要意义。
植物中的钾运体可分为4个主要的蛋白家族,分别是KUP/HAK/KT、TRK/HKT、KEA和CHX[6],其中关于KUP/HAK/KT K+转运蛋白家族的相关研究较多,在植物响应高盐胁迫的调控机制中发挥着重要作用[7]。由于真菌、细菌KUP/HAK/KT基因序列的相似性,KUP/HAK/KT基因首先在拟南芥中被鉴定出来[8]。通过系统发育分析可以将KUP/HAK/KT家族分为4类:ClusterⅠ,其中大多数成员参与高亲和力K+的吸收,如水稻的OsHAK1、谷子的SiHAK1、辣椒的CaHAK1和葡萄的VvKUP1均可促进植物器官对K+的吸收[9-12];ClusterⅡ,其成员参与低亲和力的K+转运,并可以促进植物组织的生长,拟南芥的AtKUP4可以促进根毛的形成和控制种子大小[13];ClusterⅢ,其代表性成员陆地棉的GhKT1可以促进棉纤维的生长,而ClusterⅢ的其他成员可以调节K+、Na+和Rb+的吸收[14];ClusterⅣ,相关研究很少。
甘薯[Ipomoea batatas (L.) Lam.]是世界上重要的糧食、饲料和经济作物。我国是世界上最大的甘薯生产国,其总产量约占全球总产量的60%左右[15]。但是,由于甘薯(2n=6x=90)是异源六倍体,因此遗传背景高度复杂[16]。前人研究结果表明,甘薯近缘二倍体野生种三裂叶薯(I. triloba)具有抗病虫、抗逆等优良基因,对其进行深入研究可为研究甘薯的遗传改良奠定基础[17]。但是,目前有关三裂叶薯ItbHAK基因家族成员的系统发育、基因结构和表达模式的分析尚未见报道。
1 材料与方法
1.1 三裂叶薯KUP/HAK/KT家族成员的鉴定
三裂叶薯的蛋白质序列、编码序列(CDS)和注释文件通过三裂叶薯基因组网站(http://sweetpotato.uga.edu/)获取。通过hmmsearch应用KUP/HAK/KT结构域(PF02705)的隐马尔科夫模型为条件对三裂叶薯蛋白质进行搜索,然后用NCBI-CDD和Pfam数据库验证检索到的蛋白质序列是否含有完整的结构域,去除重复及不完整的序列,得到三裂叶薯ItbHAK基因家族的蛋白质序列。
1.2 系统发育进化分析
利用水稻(http://rice.plantbiology.msu.edu/)、拟南芥(https:/www.arabidopsis.org/)信息网站下载其KUP/HAK/KT蛋白序列,用MEGA 7.0软件的比邻法(neighbor-joining method,NJ)构建系统发育进化树。通过GSDS 2.0、MEME分析基因结构和蛋白质保守基序,进一步结合进化树分析结果整合制图。
1.3 启动子顺式作用元件
利用Perl提取三裂叶薯ItbHAK基因上游 1 500 bp 的序列,然后通过PlantCARE在线软件,对ItbHAK基因的顺式作用元件进行分析。
1.4 染色体定位和基因复制事件分析
利用基因组注释信息获取三裂叶薯ItbHAK基因的位置,通过MCScanX比对发现,三裂叶薯基因组具有潜在重复关系的基因对,并用TbTools进行可视化。
1.5 表达模式分析
利用三裂叶薯基因组网站数据库获取的转录组数据,分析ItbHAK基因在不同组织、激素和逆境胁迫下的表达模式,并用TBtools进行可视化。
2 结果与分析
2.1 三裂叶薯ItbHAK基因家族成员的鉴定
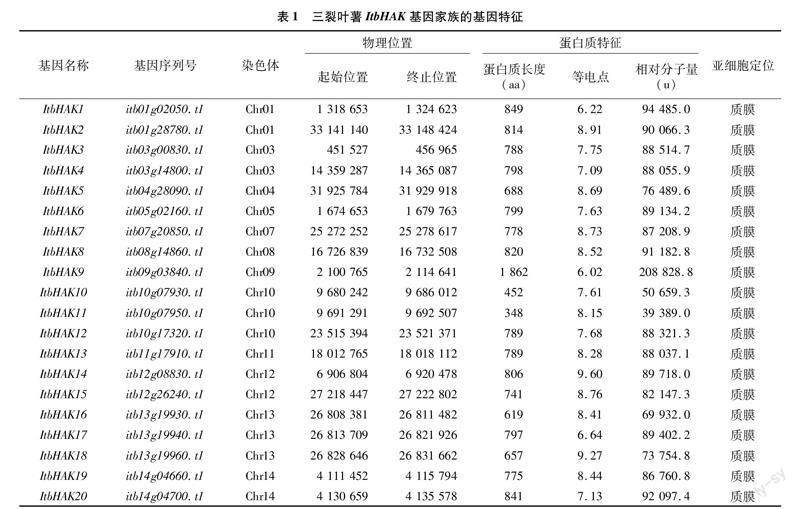
利用KUP/HAK/KT结构域检索三裂叶薯的蛋白数据,除去冗余及不完整的序列,最终在三裂叶薯基因组中得到20条三裂叶薯KUP/HAK/KT候选蛋白序列。蛋白质的理化特性分析结果显示,最长的ItbHAK9含有1 862个氨基酸,而最短的ItbHAK11仅含有348个氨基酸,等电点为6.02~9.60,平均等电点为7.98,20个ItbHAK蛋白的相对分子量为39 389.0~208 828.8 u。亚细胞定位结果显示,三裂叶薯ItbHAK蛋白都位于细胞质膜上,与KUP/HAK/KT家族的主要功能(参与K+转运)一致(表1)。由图1可以看出,ItbHAK蛋白序列均包含5~13个跨膜区。
2.2 ItbHAK家族系统进化树分析和结构域的保守性分析
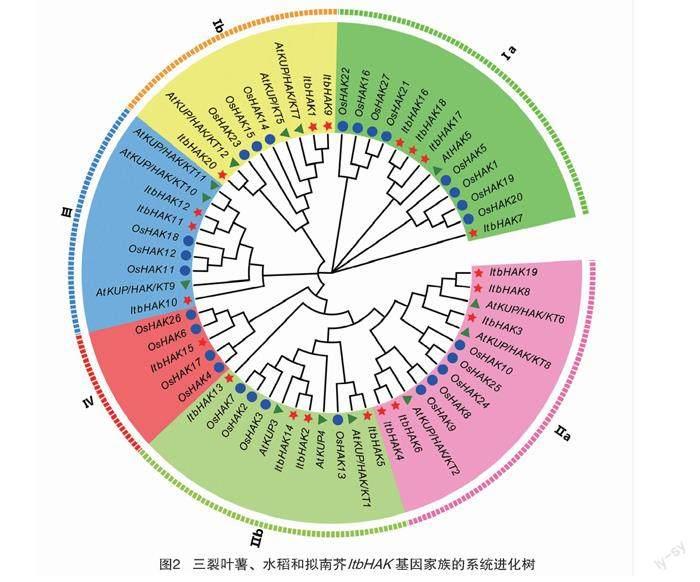
为了解三裂叶薯ItbHAK家族成员在进化上的位置及亲缘关系,用MEGA 7.0软件中的NJ法对三裂叶薯、拟南芥和水稻的ItbHAK蛋白进行系统进化分析,如图2所示,发现三裂叶薯的ItbHAK家族基因大致分为4个进化簇,参照前人对拟南芥、水稻的命名方式,依次命名为Cluster Ⅰ、Cluster Ⅱ、Cluster Ⅲ、Cluster Ⅳ家族,分别包含9、7、3、1个家族成员,其中Cluster Ⅰ、Cluster Ⅱ的每个家族又可分为2个组。三裂叶薯ItbHAK基因在各个家族的分布情况与前人在拟南芥、水稻和小麦中的研究结果类似,都表现为Cluster Ⅰ、Cluster Ⅱ的基因数量远大于Cluster Ⅲ、Cluster Ⅳ中的基因数量。
基因的结构决定了基因的表达和功能,图3是三裂叶薯ItbHAK蛋白质保守基序的分析结果,共在三裂叶薯的ItbHAK基因家族中找到10个保守结构域。大部分ItbHAK家族成员均含有90%以上的保守结构域,其中Cluster Ⅲ中的ItbHAK10仅有Motif1、Motif2、Motif3、Motif4、Motif5、Motif6这6个保守结构域;ItbHAK11仅有Motif8、Motif9和Motif10这3个保守结构域。三裂叶薯ItbHAK家族中基因结构的差异较大,其中最长的ItbHAK基因为ItbHAK17,最短的ItbHAK基因为ItbHAK11。此外,除ItbHAK5、ItbHAK9、ItbHAK10和ItbHAK16外,所有ItbHAK基因均含有内含子和外显子。
2.3 启动子顺式作用元件分析
由图4可知,11个调控因子分别参与生长发育、激素和生物/非生物胁迫,其中分布最广的顺式作用元件是光响应元件,其次是核心启动子元件TATA-box、CAAT-box。对三裂叶薯ItbHAK启动子的分析发现,所有ItbHAK基因都含有多个调控植物生长发育的元件(TATA-box和CAAT-box)及光响应元件;所有ItbHAK基因都含有1~3种逆境响应元件, 其中包含干旱响应元件、低温响应元件、厌氧响应元件、物理伤害响应元件;所有ItbHAK基因都含有1~4种激素响应元件,其中包含茉莉酸甲酯响应元件、脱落酸响应元件、生长素响应元件、赤霉素响应元件和水杨酸响应元件。
2.4 染色体定位、基因复制分析
为了解析ItbHAK基因家族在三裂叶薯基因组中的分布情况,用TBtools对其进行可视化分析。由图5可以看出,20个ItbHAK基因不均匀地分布在12条染色上。其中,第10、13号染色体上各分布了3个ItbHAK基因;第1、3、12、14号染色体上各分布了2个ItbHAK基因;第4号、5号、7号、8号、9号和11号染色体上各分布了1个ItbHAK基因;第2号、6号和15号染色体上没有分布ItbHAK基因。通过对三裂叶薯ItbHAK复制事件的分析,共发现5对大片段复制事件(ItbHAK1/ItbHAK9、ItbHAK3/ItbHAK8、ItbHAK3/ItbHAK19、ItbHAK4/ItbHAK6和ItbHAK8/ItbHAK19)和1對串联复制事件(ItbHAK16/ItbHAK17)。
2.5 表达模式分析
为了进一步揭示ItbHAK基因的潜在作用,利用三裂叶薯4个不同组织的转录组数据分析20个ItbHAK基因的组织差异性表达情况。结果如图6所示,其中一部分ItbHAKs在这4个组织中的表达水平相似,而另一部分ItbHAKs则表现出显著的组织差异性,进一步说明ItbHAKs在三裂叶薯生长发育中具有功能差异。其中ItbHAK17在所有组织中都有较高的表达,而ItbHAK18在所有组织中的表达水平都非常低。此外,ItbHAK11在根中高度表达,表明ItbHAK11与土壤对K+的吸收有关。ItbHAK3在花中高度表达,表明ItbHAK3参与了花的发育。ItbHAK1在三裂叶薯茎中的相对表达量较高,表明该基因可能参与了三裂叶薯体内K+的长距离运输。值得注意的是,ItbHAK17、ItbHAK1、ItbHAK11、ItbHAK2和ItbHAK3在所有组织中都保持了相当高的表达量。
为了研究三裂叶薯ItbHAK基因在不同激素胁迫下的表达模式,对三裂叶薯ItbHAK基因在脱落酸、β-氨基丁酸、6-苄氨基嘌呤、苯并噻二唑、赤霉酸、吲哚乙酸和甘露醇胁迫下的转录组数据进行分析,结果见图7,表明,ItbHAK2、ItbHAK3在所有激素胁迫下均有较高的表达量,而ItbHAK16、ItbHAK18在所有激素胁迫下均有较低的表达量。值得注意的是,ItbHAK7在β-氨基丁酸胁迫下的相对表达量是对照的56倍,在苯并噻二唑胁迫下的相对表达量是对照的5倍,在甘露醇胁迫下的相对表达量是对照的3倍,说明ItbHAK7对于三裂叶薯应对激素胁迫具有积极作用。ItbHAK5在脱落酸胁迫下的相对表达量是对照的4倍,表明ItbHAK5在三裂叶薯响应脱落酸胁迫的过程中有重要作用。
为了研究三裂叶薯ItbHAK基因在逆境胁迫下的表达模式,对三裂叶薯在干旱、冷、热和盐胁迫下的转录组数据进行分析,结果见图7,在干旱、冷胁迫下,三裂叶薯均有40%的ItbHAK基因相对表达量上调,其中ItbHAK4、ItbHAK14在干旱、冷胁迫下的相对表达量均有显著升高,ItbHAK5、ItbHAK8在干旱胁迫下的相对表达量显著提升,而在冷胁迫下的相对表达量升高不明显;在热胁迫下,三裂叶薯有35%的ItbHAK基因相对表达量上调,其中ItbHAK4相对表达量有明显上调;在盐胁迫下,三裂叶薯有55%的ItbHAK基因相对表达量上调。值得注意的是,ItbHAK4、ItbHAK14基因在4种逆境胁迫下的相对表达量均表现出显著升高,说明ItbHAK4、ItbHAK14在三裂叶薯响应逆境胁迫的过程中具有积极作用。
3 討论与结论
KUP/HAK/KT基因在植物的生长、发育和对非生物胁迫的响应中发挥着重要作用[18]。本研究通过对三裂叶薯全基因组进行筛选,共获得20个ItbHAK基因,其数量与拟南芥(13个)、大豆(30个)、玉米(27个)、木薯(21个)和甘蔗(30个)相差不大[19-23]。系统进化分析发现,这些ItbHAK基因与拟南芥、水稻和小麦相似。ItbHAK基因可分为4个亚家族,进化分析可以为挖掘基因的潜在功能提供依据。基因结构和基序分布可以为物种和基因之间的进化分析提供一定的依据,同一亚家族的成员具有相似的基序分布模式和相似的基因结构,说明它们可能具有相似的功能。
植物的KUP/HAK/KT基因广泛分布在各个组织器官中,参与了多种植物的生长发育过程[24-25]。本研究利用转录组数据分析ItbHAK表达模式,发现ItbHAK基因在大多数组织中都有表达,其中部分基因在特定组织中优先表达。前人研究结果显示,拟南芥、水稻、小麦、木薯中KUP/HAK/KT基因也呈现组织差异性表达,其在植物发育过程中表现出较强的调控作用[26-27]。例如ItbHAK11在根中优先表达,这与CsHAK4、CsHAK5、CsHAK19、GmHAK30、GmHAK04、PbHAK2、PbHAK3、PbHAK4、PbHAK12的表达情况一致,表明这些基因促进了根系对土壤中K+的吸收[28-29]。ItbHAK3在花中高度表达,这与GmHAK15[20]、CsHAK16[28]的表达情况一致,说明这2个基因在花的发育中具有积极作用。ItbHAK1在三裂叶薯茎中的表达量较高,这与PbHAK5、PbHAK10的表达情况相似[29],说明这些基因可能参与了植物体内K+的长距离运输。
相关研究结果表明,KUP/HAK/KT基因家族成员在植物逆境胁迫下具有积极的调控作用。本研究发现,在盐胁迫下三裂叶薯有11个ItbHAK基因的表达量上调,在其他植物中也发现类似结果,其中大麦中6个HvHAK基因在盐胁迫下表达上调[30],拟南芥中AtHAK2、AtHAK5、AtHAK6、AtKUP4、AtKUP基因可以积极响应盐胁迫[7],芦苇PhaHAK2在耐盐品系中的转录本显著高于盐敏感品系[31],辣椒CcHAK1在盐胁迫下可增加对K+的吸收能力[32]。上述结果说明,KUP/HAK/KT基因家族部分成员在盐胁迫下通过钾转运体促进K+的相对积累,从而在抵御盐胁迫中发挥重要作用。
参考文献:
[1]Leigh R A,Wyn J R G. A hypothesis relating critical potassium concentrations for growth to the distribution and functions of this ion in the plant cell[J]. New Phytologist,1984,97(1):1-13.
[2]Wang M,Zheng Q S,Shen Q R,et al. The critical role of potassium in plant stress response[J]. International Journal of Molecular Sciences,2013,14(4):7370-7390.
[3]Nieves-Cordones M,Alemán F,Martínez V,et al. K+ uptake in plant roots. The systems involved,their regulation and parallels in other organisms[J]. Journal of Plant Physiology,2014,171(9):688-695.
[4]Gierth M,Mser P. Potassium transporters in plants-involvement in K+acquisition,redistribution and homeostasis[J]. FEBS Letters,2007,581(12):2348-2356.
[5]Song Z Z,Cong Y,Han L,et al. In silico analyses of KUP proteins based on grape genomic data[J]. Genomics and Applied Biology,2011,30(6):728-737.
[6]Véry A A,Sentenac H. Molecular mechanisms and regulation of K+transport in higher plants[J]. Annual Review of Plant Biology,2003,54:575-603.
[7]Maathuis F J M. The role of monovalent cation transporters in plant responses to salinity[J]. Journal of Experimental Botany,2006,57(5):1137-1147.
[8]Santa-María G E,Rubio F,Dubcovsky J,et al. The HAK1 gene of barley is a member of a large gene family and encodes a high-affinity potassium transporter[J]. The Plant Cell,1997,9(12):2281-2289.
[9]Davies C,Shin R,Liu W H,et al. Transporters expressed during grape berry (Vitis vinifera L.) development are associated with an increase in berry size and berry potassium accumulation[J]. Journal of Experimental Botany,2006,57(12):3209-3216.
[10]Horie T,Sugawara M,Okada T,et al. Rice sodium-insensitive potassium transporter,OsHAK5,confers increased salt tolerance in tobacco BY2 cells[J]. Journal of Bioscience and Bioengineering,2011,111(3):346-356.
[11]Martínez-Cordero M A,Martínez V,Rubio F. High-affinity K+uptake in pepper plants[J]. Journal of Experimental Botany,2005,56(416):1553-1562.
[12]Zhang H W,Xiao W,Yu W W,et al. Foxtail millet SiHAK1 excites extreme high-affinity K+ uptake to maintain K+ homeostasis under low K+ or salt stress[J]. Plant Cell Reports,2018,37(11):1533-1546.
[13]Ahn S J,Shin R,Schachtman D P. Expression of KT/KUP genes in Arabidopsis and the role of root hairs in K+ uptake[J]. Plant Physiology,2004,134(3):1135-1145.
[14]Ruan Y L,Llewellyn D J,Furbank R T. The control of single-celled cotton fiber elongation by developmentally reversible gating of plasmodesmata and coordinated expression of sucrose and K+transporters and expansin[J]. The Plant Cell,2001,13(1):47-60.
[15]王 欣,李 強,曹清河,等. 中国甘薯产业和种业发展现状与未来展望[J]. 中国农业科学,2021,54(3):483-492.
[16]马仁罡,孙健英,李宗芸. 基于生物信息学的甘薯基因组学等研究进展[J]. 江苏农业学报,2021,37(2):531-538.
[17]曹清河,张 安,李 鹏,等. 甘薯近缘野生种的抗病性鉴定与新型种间杂种的获得[J]. 植物遗传资源学报,2009,10(2):224-229.
[18]Grabov A. Plant KT/KUP/HAK potassium transporters:single family-multiple functions[J]. Annals of Botany,2007,99(6):1035-1041.
[19]Mser P,Thomine S,Schroeder J I,et al. Phylogenetic relationships within cation transporter families of Arabidopsis[J]. Plant Physiology,2001,126(4):1646-1667.
[20]晁毛妮,温青玉,张晋玉,等. 大豆KUP/HAK/KT钾转运体基因家族的鉴定与表达分析[J]. 西北植物学报,2017,37(2):239-249.
[21]Zhang Z B,Zhang J W,Chen Y J,et al. Genome-wide analysis and identification of HAK potassium transporter gene family in maize (Zea mays L.)[J]. Molecular Biology Reports,2012,39(8):8465-8473.
[22]Ou W J,Mao X,Huang C,et al. Genome-wide identification and expression analysis of the KUP family under abiotic stress in cassava (Manihot esculenta Crantz)[J]. Frontiers in Physiology,2018,9:17.
[23]Feng X M,Wang Y J,Zhang N N,et al. Genome-wide systematic characterization of the HAK/KUP/KT gene family and its expression profile during plant growth and in response to low-K+stress in Saccharum[J]. BMC Plant Biology,2020,20(1):1-17.
[24]李学文,游西龙,王 艳. 钾离子转运载体HAK/KUP/KT家族参与植物耐盐性的研究进展[J]. 植物科学学报,2019,37(1):101-108.
[25]金龙飞,张安妮,滕梦鑫,等. 香蕉钾转运体HAK/KUP/KT家族鉴定及其在果实发育和低钾胁迫下的表达分析[J]. 江苏农业科学,2022,50(2):30-36.
[26]Yang Z F,Gao Q S,Sun C S,et al. Molecular evolution and functional divergence of HAK potassium transporter gene family in rice (Oryza sativa L.)[J]. Journal of Genetics and Genomics,2009,36(3):161-172.
[27]吴胜男,杨 媛,李英壮,等. 小麦KUP/HAK/KT基因家族的全基因组鉴定、系统进化和表达模式分析[J]. 西北农业学报,2021,30(3):351-364.
[28]Yang T Y,Lu X,Wang Y,et al. HAK/KUP/KT family potassium transporter genes are involved in potassium deficiency and stress responses in tea plants (Camellia sinensis L.):expression and functional analysis[J]. BMC Genomics,2020,21(1):1-18.
[29]Li Y,Peng L R,Xie C Y,et al. Genome-wide identification,characterization,and expression analyses of the HAK/KUP/KT potassium transporter gene family reveals their involvement in K+deficient and abiotic stress responses in pear rootstock seedlings[J]. Plant Growth Regulation,2018,85(2):187-198.
[30]Cai K F,Zeng F R,Wang J M,et al. Identification and characterization of HAK/KUP/KT potassium transporter gene family in barley and their expression under abiotic stress[J]. BMC Genomics,2021,22(1):1-14.
[31]Takahashi R,Nishio T,Ichizen N,et al. High-affinity K+transporter PhaHAK5 is expressed only in salt-sensitive reed plants and shows Na+ permeability under NaCl stress[J]. Plant Cell Reports,2007,26(9):1673-1679.
[32]Ruiz-Lau N,Bojórquez-Quintal E,Benito B,et al. Molecular cloning and functional analysis of a Na+-insensitive K+transporter of Capsicum chinense Jacq[J]. Frontiers in Plant Science,2016,7:1980.
收稿日期:2022-10-31
基金項目:吉林省科技发展计划地方科技创新引导项目(编号:20210404013NC)。
作者简介:吴胜男(1993—),男,黑龙江大庆人,硕士,主要从事甘薯遗传育种研究。E-mail:wushengnan666@163.com。
通信作者:王 凤,硕士,研究员,主要从事甘薯遗传育种和栽培技术研究。E-mail:wangfeng3871@163.com。

