番茄发酵液中乳酸杆菌的分离鉴定及对模拟胃肠液耐受性研究
覃志成,周笑犁*,吴承木,管庆林,耿瑞鸿,施英群
(1. 贵阳学院 食品科学与工程学院,贵州 贵阳 550005; 2. 贵州省普通高等学校功能食品重点实验室,贵州 贵阳 550005)
通过微生物发酵水果、蔬菜或其汁水制成的食用酵素产品,在能保留其原有的营养物质的基础上,还能产生一些具有特定保健功能的活性物质[1]。目前食用酵素产品的生产主要有接种益生菌发酵和自然发酵两种方式,其中,自然发酵利用果蔬本身附着及自然环境中的优势菌进行发酵,虽然产生的风味更好,但发酵时间长,且参与菌种复杂难以掌控[2]。 因此,近年来从果蔬自然发酵液中分离并筛选具有益生活性的优势菌种成了研究热点,但根据原料选择,其优势乳酸菌菌种可能存在一定差异。如Taoxiong 等在酸菜中分离得到植物乳杆菌[3];焦媛媛等从苹果和梨的混合发酵液中分离得到植物乳杆菌和副干酪乳酸菌[4];刘文俊等从自然发酵的橄榄汁中分离得到乳酸乳球菌[5]。 此外,赵山山等发现植物乳杆菌A50f7 和副植物乳杆菌A50b9 的耐胆盐和耐盐性能优良,且人工接种后能够改善泡菜品质[6]。 因此,乳酸菌作为果蔬发酵过程的优势菌群,对于提升果蔬发酵制品的品质及发挥益生功能具有较大的潜力。
番茄原产于南美洲,是全球种植最为普遍的果蔬之一,现在我国南北方均有广泛种植。 研究发现,番茄及其制品中含有氨基酸、有机酸、矿物质、酚类化合物、 类胡萝卜素和维生素等多种营养成分,具有降低血脂、降低胆固醇和抗氧化等功效[7-9]。 前期实验发现,自然发酵后的番茄液具有良好的抗氧化活性,且总酚和番茄红素等生物活性物质随着发酵时间的延长而增加[10],但细菌的多样性却逐渐减小,其中乳球菌丰度显著减少,而乳酸杆菌的丰度显著增加,到发酵60 d 时成为发酵液中主要优势菌群[11]。乳杆菌作为一类能利用可发酵碳水化合物产生大量乳酸的细菌[12],在各类发酵食品的品质形成中具有重要作用,在肉制品、乳制品及果蔬发酵食品领域中有着广泛应用,也常被用作益生菌筛选的候选菌群。 但是,人体胃肠道的极端环境在很大程度上会影响乳酸菌的活性[13],如果这些乳酸菌能够通过肠胃消化系统,定植在人体的肠道中,才能真正发挥其生理功能[14]。因此,为了深入挖掘番茄自然发酵液中乳酸杆菌菌种资源并提高番茄等果蔬发酵液的稳定性,作者以乳酸杆菌为优势菌的60 d 自然发酵番茄液为对象,对其中乳酸杆菌进行分离、鉴定,并研究其生长特性,模拟其对胃肠道环境的耐受性、高温及高盐的耐受性,以期为乳酸菌资源库扩充以及果蔬酵素的开发和利用提供理论依据。
1 材料与方法
1.1 材料与试剂
以新鲜番茄为原料,番茄与白砂糖质量比3∶1混匀后置于1 000 mL 已灭菌的玻璃瓶中,封口,发酵初期每隔1 d 排气,发酵10 d 后每隔3 d 排气,室温发酵60 d 后制成发酵液[11]。
氯化钠:购于江苏强盛功能化学股份有限公司;磷酸二氢钾:购于成都金山化学试剂有限公司;胆盐、胰蛋白酶、胃蛋白酶:购于合肥博美生物科技有限责任公司;盐酸:购于国药集团化学试剂有限公司;氢氧化钠:购于天津市石英钟厂霸州市化工分厂;MRS 培养基:购于杭州百思生物技术有限公司。
1.2 仪器与设备
SPX-1508BII 生化培养箱:天津市泰斯特仪器有限责任公司产品;CX21 显微镜、恒温摇床:上海泽仕光电科技有限公司产品;UV2700 紫外分光光度计:日本岛津仪器有限公司产品;DYY-8C 稳压稳流电泳仪、T100 梯度PCR 仪、Biorad chemidoc XRS凝胶成像分析仪:美国BIO-RAD 公司产品。
1.3 实验方法
1.3.1 乳酸杆菌的分离纯化 取番茄发酵液样品10 mL 溶解于100 mL 无菌生理盐水中,并按10 倍梯度稀释法制成6 个浓度稀释液。取稀释10-4,10-5,10-6倍的稀释液0.1 mL 接种于MRS (含碳酸钙)培养基中,37 ℃倒置培养24~36 h,挑取菌落划线2~3次至菌落一致。
1.3.2 乳酸杆菌的鉴定
1)形态学观察及革兰氏染色 将所分离的菌株分别接种到MRS 琼脂培养基上,37 ℃恒温培养48 h。观察菌株的菌落形态,白色、乳白色或淡黄色,中间隆起,菌落呈圆形,边缘整齐,表面湿润,易于挑起的菌株。 将分离得到的细菌进行革兰氏染色实验,观察菌体颜色及形态,具有革兰氏染色阳性、不运动、无芽孢、杆状等特征的初步鉴定为乳酸杆菌[15]。
2)16S rDNA 序列分析 将疑似乳酸杆菌的菌株活化2 次至稳定期,送武汉天一辉远生物科技有限公司进行菌株DNA 提取、PCR 扩增及16S rDNA序列测序。
3)系统发育树构建 将测序得到的基因序列登录NCBI 进行BLAST 同源性比对,并在MEGA7软件中Neighbor-Joining 法构建系统发育树,应用自展法(bootstrap)检验系统发育树,自展数据集为1 000 次。
1.3.3 乳酸杆菌的生长特性分析
1)最适生长温度实验 将体积分数1%的菌液接种到MRS 液体培养基中,摇匀,分别在26、30、34、38、42 ℃下培养12、24 h,测菌悬液OD600值,设置3 个平行,以未接种的培养基做对照。
2)最适生长pH 值实验 将体积分数1%菌液接种至pH 值分别为5.4、6.0、6.6、7.2、7.8 的MRS 肉汤中,置于37 ℃下培养12、24 h,以未接种的培养基做对照,测定菌悬液的OD600值。
1.3.4 乳酸杆菌的耐受性分析
1)高温耐受性实验[16]将体积分数1%菌液接种到MRS 液体培养基中,摇匀,分别在42、46、50 ℃下培养12、24 h,以未接种的培养基作为对照,测定菌悬液OD600值,设置3 个平行,计算菌株存活率。
2)高盐耐受性实验[17]将体积分数1%菌液分别接种到盐质量浓度分别为0、15、30、45、60 mg/mL的MRS 培养基中,37 ℃培养24 h,以未接种的培养基为空白对照,测定菌悬液OD600值,设置3 个平行,计算菌株存活率。
3)人工胃液耐受性实验[18-19]配制胃蛋白酶浓度为10 mg/mL 的人工胃液,分别调节pH 值为2.0和3.0,0.22 μm 滤膜过滤除菌后备用。 然后取二次活化的菌液种,4 000 r/min 离心5 min,弃掉上清液,用等体积无菌水重悬。 以体积分数10%分别接种至pH 2.0 和pH 3.0 的人工模拟胃液中,37 ℃下培养,分别于0、1、2 h 时取样测定菌悬液OD600值,设置3 个平行,并计算菌株存活率。
4)人工肠液耐受性[18-19]取经人工胃液处理后的菌液,以体积分数10%接种至人工肠液中(3.4 g K2HPO4充分溶于250 mL 蒸馏水中,调节pH 值为7.6,稀释后加入胰蛋白酶使其质量浓度达到10 mg/mL,最后0.22 μm 滤膜过滤除菌),37 ℃下培养,分别于0、1、2、4、6 h 时取样测定菌悬液OD600值,设置3 个平行,计算菌株存活率。
5)胆盐耐受性实验[20]取用二次活化的菌种,将种子液以体积分数5%分别接种至不同胆盐质量浓度(0、0.1、0.2、0.3、0.4、0.5 g/dL)的MRS 液体培养基中,于37 ℃培养24 h,测定菌悬液OD600值,设置3 个平行,并计算菌株存活率。
式中:Y 为菌株存活率,%;A1为处理后菌悬液吸光度;A0为处理前菌悬液吸光度。
1.4 数据统计分析
每组试验重复3 次,采用IBM SPSS 22.0 进行统计分析,数据用平均值±标准差表示,使用Duncan等多重方法对数据进行比较,以P<0.05 作为差异显著性判断标准,最后用Graph pad Prism v8.0 进行绘图。
2 结果与讨论
2.1 乳酸杆菌的分离鉴定
2.1.1 形态学观察和革兰氏染色 从番茄自然发酵液中分离得到3 株疑似乳酸杆菌的菌株,分别命名为L1、L2 和L3。3 株菌的菌落均突起,呈圆形,湿润光滑,边缘齐整,见表1。 对菌株分别进行革兰氏染色,均为阳性(G+),无芽孢。 L2 呈短杆状,成对或堆状排列;L1 和L3 均为单生或链状排列。图1 中分别显示了3 株菌的菌落及菌体形态。
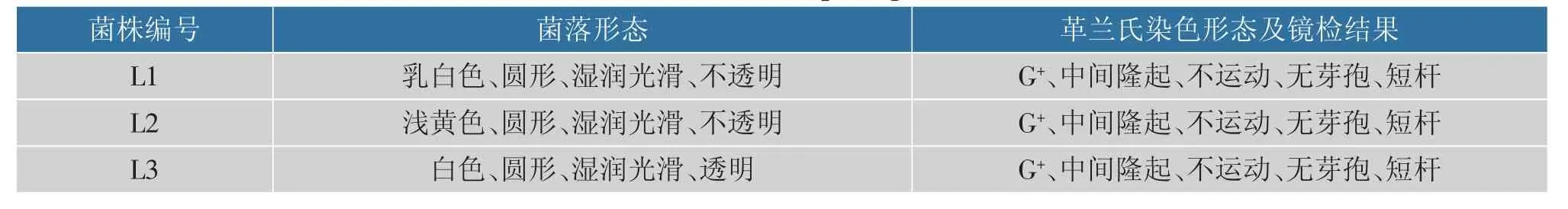
表1 菌体及细胞形态特征Table 1 Colonies and cell morphological characteristics
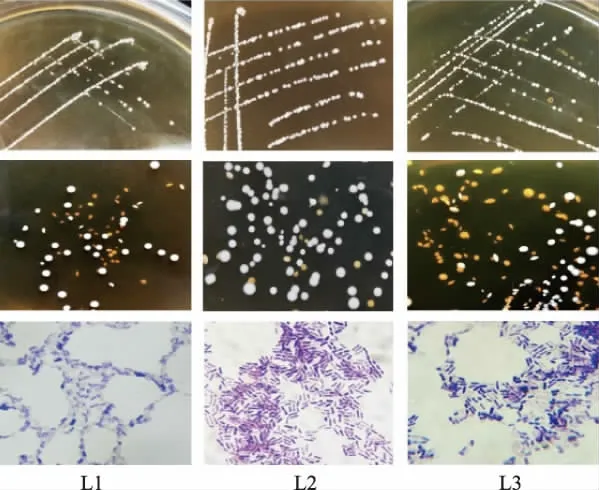
图1 细胞形态特征Fig. 1 Cell morphological characteristics
2.1.2 16S rDNA 序列分析 对分离并经过形态学初步鉴定疑似乳酸杆菌的菌株进行DNA 提取,然后对16S rDNA 基因序列进行PCR 扩增。 如图2 所示,3 株菌株的琼脂糖电泳条带明亮且无明显拖尾,相对分子质量均在1 500 bp 左右,符合测序要求。

图2 16S rDNA 扩增电泳图Fig. 2 Amplification of 16SrDNA
将测序结果输入NCBI 中进行BLAST 同源性比对,结果如图3。 L1 和L3 均为植物乳杆菌属(Lactiplantibacillus),其中L1 与Lactiplantibacillus plantarum Heal19 菌 株 同 源 性 为100% ,L3 与Lactiplantibacillus plantarum SRCM100440 菌株同源性为100%。L2 为乳杆菌属(Lactobacillus brevis),且与Lactobacillus brevis LMT1-73 菌株同源性为100%。国立东等从东北酸菜中分离筛选到1 株乳酸菌,经分析鉴定为植物乳杆菌,并命名为HUCM115[21]。焦媛媛等从梨和苹果混合发酵液中分离得到植物乳杆菌ZG2 和副干酪乳杆菌,从梨和香蕉混合发酵液和木瓜发酵液中分离出魏斯氏菌,在柠檬中分离出明珠串菌[4]。 赵山山等以贵州遵义市11 份不同家庭自制的发酵泡菜制品分离得到5 株植物乳杆菌(Lactobacillus plantarum),6 株 副 植 物 乳 杆 菌(Lactobacillus paraplantarum)[6]。 说明在果蔬发酵过程中,乳酸菌为主要菌种,且随着发酵原料的不同,其种属存在一定差异。

图3 基于16S rDNA 序列系统发育树Fig. 3 Phylogenetic tree based on 16SrDNA sequence
2.2 乳酸杆菌的生长特性分析
2.2.1 最适生长温度 乳酸菌的生长受环境中温度影响较大,且不同乳酸菌的最适生长温度存在一定差异。 图4~5 中不同小写字母表示同一菌株不同生长温度之间存在显著性差异(P<0.05)。 如图4,在不同温度下分别培养12 h 和24 h 后,3 株受试菌的OD600均随着温度的增加呈现先增加后降低的趋势,且3 株菌变化趋势相似,均在30~38 ℃生长较好。其中,L3 培养12 h 和24 h 最适生长温度均为38℃;L1 培养12、24 h 时最适生长温度分别为34 ℃(P>0.05)和38 ℃(P<0.05);而L2 培养12、 24 h 时分别为38 ℃(P>0.05)和34 ℃(P<0.05)。 杨英歌等发现自然发酵泡菜中的副干酪乳杆菌HLAB0143的最适生长温度在35~37 ℃[22],与本实验结果相近,本实验中分离得到的3 株菌的适宜生长范围更宽,但各自最适生长温度略有差异,当温度超过38 ℃后,菌液OD600均显著下降(P<0.05),这可能是由于菌体蛋白质等受到破坏或菌体对营养物质的吸收能力下降所致。
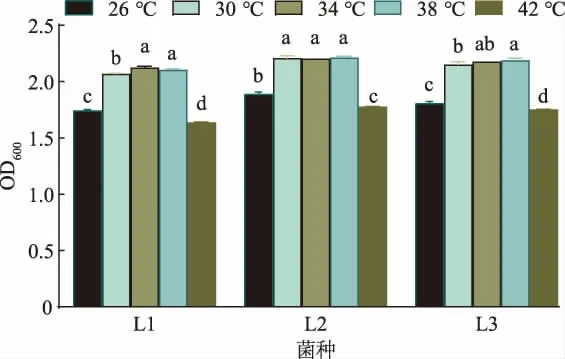
图4 乳酸杆菌在不同温度下12 h 后的生长情况Fig. 4 Growth of Lactobacillus at various temperature
2.2.2 最适生长pH 微生物在最适pH 其新陈代谢可处于最佳状态,并促进代谢产物的积累[22]。如图5 所示,3 株菌株在不同pH 下培养12 h 和24 h 后,OD600随pH 的增加呈现先增加后显著减少的趋势,且3 株菌的变化趋势相近。 其中,L1 在pH 6.6 条件下培养12 h 和24 h 后,其OD600显著高于其他各组(P<0.05);L2 在pH 6.6 条 件 下 培 养12 h 和24 h后,其OD600最高,但与pH 6.0 组差异不显著(P>0.05);L3 仍然是在pH 6.6 条件下,OD600达到最大(P<0.05),但在培养初期(12 h)时,其OD600与pH 6.0 组差异不显著(P>0.05)。 因此,3 株乳酸杆菌生长的最适pH 均为6.6,说明弱酸性环境适宜番茄发酵液中分离的乳酸杆菌生长,pH 过高可能会影响菌体的酶活、细胞膜稳定性等,进而阻碍菌体的生长。 储徐建等从青贮玉米中分离出植物乳杆菌的最适生长pH 为6.5[23];杨静等人的乳酸菌生长实验表明,植物乳杆菌在pH 为5.5~7.0 时生长较好[24]。
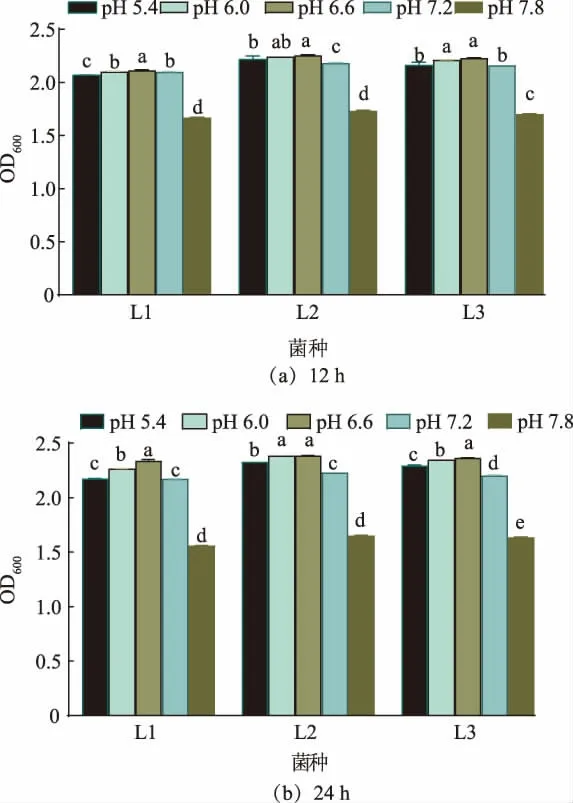
图5 乳酸杆菌在不同pH 值的生长情况Fig. 5 Growth of Lactobacillus at various pH
2.3 乳酸杆菌的耐受性分析
2.3.1 高温耐受性 如图6 所示,3 株菌在高温环境下培养12 h 和24 h 后,存活率随培养温度的持续升高呈现快速下降的趋势(P<0.05)。图6~10 中大写字母不同表示同一条件下不同株菌之间存在显著性差异;小写字母不同表示同一株菌在不同条件下存在显著性差异(P<0.05)。当温度超过46 ℃时,3株菌的存活率受到显著抑制(P<0.05),说明温度升高对3 株菌的生长均起到了显著的抑制作用;尤其L2 生长受到的抑制最强,说明L2 对该温度具有较强的敏感性,而L3 仍能保持一定的存活率,说明L3比其他2 株菌具有更好的高温耐受性。 方芳等在内蒙古传统发酵乳及酸菜汤中分离出一株乳肠球菌WH29-3-1,发现其在45 ℃下仍能保持较高活性,并产生具有较高活性的耐热蛋白酶[25];李志忠等从玉米秸秆和白菜尾菜混贮料中分离出的类干酪副乳杆菌LB-3 对50 ℃的高温有一定耐受能力[16]。 本实验中L1 和L3 对46~50 ℃高温的耐受能力强于L2,说明不同乳酸杆菌的高温耐受能力存在一定的差异,可能与不同菌株的生理功能差异有关。

图6 乳酸杆菌的高温耐受性Fig. 6 High temperature tolerance of Lactobacillus
2.3.2 高盐耐受性 在传统的发酵生产中,为了保证产品的安全性和货架期,往往需要加入大量的食盐。 因此,乳酸菌需要对发酵过程中的高盐环境具有一定的耐受能力。如图7 所示,3 株菌在不同盐质量浓度下培养24 h 后,存活率随着盐质量浓度的增加而逐渐较少。 当盐质量浓度超过15 mg/mL 后,3株菌的存活率明显下降(P<0.05),当盐质量浓度达到60 mg/mL 时,L1 和L3 的存活率分别为75.84%和71.92%,而L2 的生长受到了显著的抑制,其存活率仅有11.34%。说明3 株乳酸杆菌对高盐质量浓度均具有一定的耐受性,其中L1 的耐受性在盐质量浓度超过15 mg/mL 时最好 (P<0.05),L3 的耐受性也显著优于L2(P<0.05)。 付文雯等发现发酵乳中分离出的2 株乳酸杆菌均能在40 mg/mL 的高盐质量浓度下生长[17],本实验中3 株菌的耐受性与之相似,但L1 和L3 还能耐受60 mg/mL 的高盐质量浓度;但L2 的耐受力低于杨静等发现的植物乳杆菌D28,其在0~80 mg/mL 的高盐环境下仍可生长[24]。
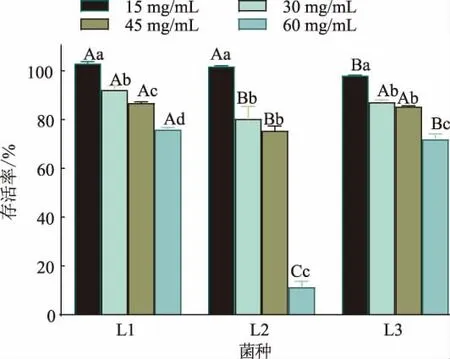
图7 乳酸杆菌高盐耐受性Fig. 7 High salt tolerance of Lactobacillus
2.3.3 人工胃液耐受性 人的胃液pH 值在1.5~4.5,且其pH 因食物摄入不同而波动。 乳酸菌只有具备良好的胃肠道环境耐受性能,才能更好地发挥其益生功能[26]。 如图8 所示,在人工胃液pH 2.0 条件下培养2 h 后,3 株菌的存活率均不低于96%,且与培养1 h 后各组的存活率差异不显著 (P>0.05);而在pH 值3.0 的条件下培养2 h 后,3 株菌的存活率均大于100%,其中L3 显著高于培养1 h 后的存活率 (P<0.05),并且显著高于L1 和L2 的存活率(P<0.05)。 说明3 株菌对人工胃液环境中较低pH值、胃蛋白酶等具有一定的适应能力,为其益生功能特性的研究提供了可能。 研究者发现从香肠中分离出的植物乳杆菌对人体胃消化液3 h 后具有良好的耐受性,与本实验结果类似[26-27];而杨静等发现植物乳杆菌D28 在人工胃液(pH 2.0)消化2 h 后存活率低于60%[24],较本实验结果低;说明本实验从番茄发酵液中分离得到的乳酸杆菌,尤其是L3 具有较好的人工胃液耐受能力。
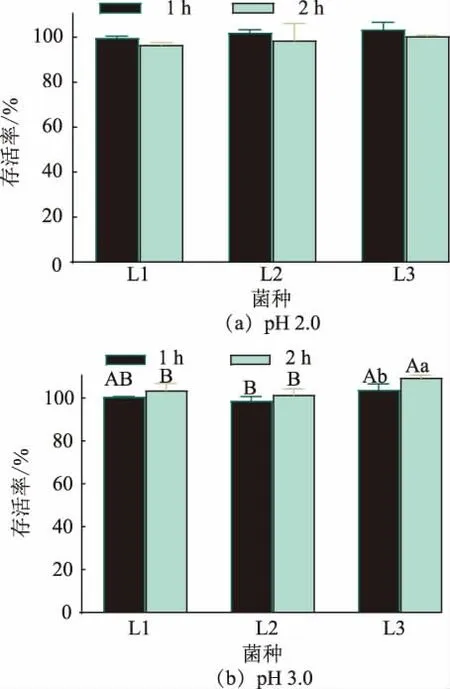
图8 乳酸杆菌人工胃液耐受性Fig. 8 Artificial gastric juice tolerance of Lactobacillus
2.3.4 人工肠液耐受性 小肠内的pH 一般在7.6左右,食物在小肠内会停留3~8 h[28],因此益生菌要发挥益生功能,需要能耐受肠液中胰蛋白酶、胆盐等。 作者分离所得的3 株乳酸杆菌对肠液的耐受能力见图9。 随着3 株菌在人工肠液中培养时间的延长,其存活率逐渐下降,其中L1 和L2 在肠液环境4 h 内的存活率差异不显著 (P>0.05);6 h 时,L1、L2和L3 存活率下降,但仍不低于90%。 刘珊娜等从酸菜中分离5 株乳杆菌在肠液中培养4 h 的存活率为89%~100%[29],与本实验结果相似;龙峻瑶等探究六堡茶渥堆发酵过程中乳酸菌多样性发现,戊糖乳杆菌L131 在人工肠液中的存活率为77%[30],较作者分离得到乳酸杆菌的存活率低;可能是由于原料的不同,对菌株的种属和耐受特性也会有差异。 证明3株乳酸杆菌具有较好人工肠液耐受性,可能在与食物一同食用后能够保持一定的存活率并发挥其益生功能。
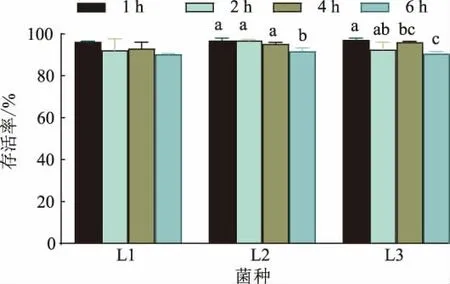
图9 乳酸杆菌人工肠液耐受性Fig. 9 Tolerance of Lactobacillus in artificial intestinal fluid
2.3.5 胆盐耐受性 机体肠道中胆盐质量浓度一般为0.03~0.30 g/dL,因此乳酸菌等菌株要进入肠道定殖并发挥作用,除要具有良好的耐胃肠道酶系消化能力外,还应具有一定的胆盐耐受能力[26]。 如图10所示,3 株菌的存活率均随胆盐质量浓度的增加而呈显著下降(P<0.05)。 当胆盐质量浓度为0.03 g/dL时,L1、L2 和L3 的存活率分别为59.55%、85.31%和44.45%; 胆盐质量浓度为0.03~0.12 g/dL 时,L2 的存活率均显著高于L1 和L3(P<0.05);而胆盐质量浓度达到0.15 g/dL 时,3 株菌的存活率≤3.3%,这说明高质量浓度的胆盐显著抑制了乳酸杆菌的生长。 这同王翔宇等的研究相似,菌株的存活率均随着胆盐质量浓度的增加而下降[17]。 而从发酵牦牛乳中分离的植物乳杆菌在胆盐浓度浓度0.15 g/dL 以内均保持了较高的存活率[18];发酵香肠源乳酸菌在5 mg/mL 的高胆盐环境中培养4 h 后的存活率可高达91.45%[26]; 自然发酵泡菜中分离的乳酸菌在0.3%胆盐溶液培养3 h 后其存活率依然可维持在60%[12]。 本实验分离得到的3 株乳酸杆菌具有一定的胆盐耐受性,其中L2 的耐受性更好,但都弱于泡菜、 发酵香肠或牦牛乳中乳酸杆菌的胆盐耐受力,这可能与菌株功能特性及种类有关,本实验为后续乳酸菌的功能特性及生产应用研究提供了理论基础。
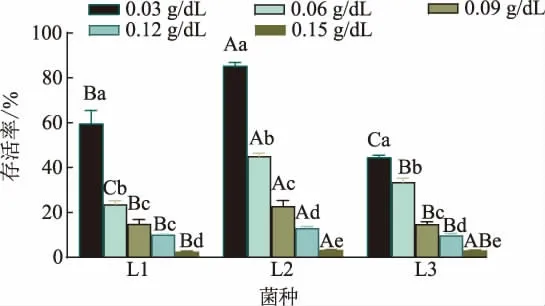
图10 乳酸杆菌胆盐耐受性Fig. 10 Bile salt tolerance of Lactobacillus
3 结 语
作者从60 d 自然发酵的番茄液中分离得到3株乳酸杆菌,其中L1 和L3 株菌均为植物乳杆菌属(Lactiplantibacillus):L1 与Lactiplantibacillus plantarum Heal19 的 菌 株 同 源 性 为 100% ,L3 与Lactiplantibacillus plantarum SRCM100440 的菌株同源性为100%; 而L2 为乳杆菌属(Lactobacillus brevis),且与Lactobacillus brevis LMT1-73 的菌株同源性为100%。生长特性实验表明,L3 最适生长温度是38 ℃; 培养12 h 和24 h 时,L1 最适生长温度分别为34 ℃和38 ℃,而L2 分别为38 ℃和34 ℃;3株菌的最适生长pH 值均为6.6。耐受性研究发现,3株菌对高温、高盐及人工胃肠环境均具有一定的耐受性,其中,L2 具有较好的胆盐耐受性,L1 和L3 具有较好的高盐耐受性,L3 具有良好的高温耐受性;3株乳酸杆菌尤其是L3 对人工胃液环境具有良好的耐受能力,存活率均高于96%,在人工肠液环境下3株菌的存活率超过90%,尤其L1 表现出更好的稳定性。 这对它们益生功能的发挥具有潜在影响,研究结果可为果蔬发酵剂的研制及其发酵制品的开发提供参考。 此外,后续实验还需进一步关注真实胃肠环境中还存在的基础代谢、肠道菌群和肠道蠕动等多方面复杂因素的影响及益生功能的特性,以期为可定植胃肠环境的功能乳酸杆菌资源开发提供理论支撑。

