蜡样芽孢杆菌高密度发酵条件与过程的优化
胥聆铭,朱 莉,詹晓北*,高泽鑫,尹忠伟
(1. 江南大学 糖化学与生物技术教育部重点实验室,江苏 无锡 214122; 2.江南大学 生物工程学院,江苏 无锡 214122; 3. 无锡格莱克斯生物科技有限公司,江苏 无锡 214125)
蜡样芽孢杆菌(Bacillus cereus)是一种常见的革兰氏阳性菌,能够产生芽孢,具有较强的抗逆性[1]。其在自然界中广泛分布于水、土壤、空气中,且与大多数动植物具有密切的共生关系[2]。
近年来,生物防治在农业与环境保护方面都成了研究热点,越来越多的人利用微生物处理动植物疾病与环境问题[3]。 蜡样芽孢杆菌凭借其优异性质吸引了许多研究者的兴趣,李生樟等利用蜡样芽孢杆菌拮抗水稻条斑病,表明蜡样芽孢杆菌能够抑制水稻条斑病菌的生长,限制条斑病症状的扩展[4]。 此外,蜡样芽孢杆菌在代谢物合成[5-7]、益生菌剂制备[8-9]、废水处理[10]、土壤修复[11]等方面都有良好的表现。 于平等利用蜡样芽孢杆菌高密度发酵生产新型中性蛋白酶,获得了酶活力为702.21 U/mL 的中性蛋白酶[12]。综上所述,蜡样芽孢杆菌是一种很有前景的微生物菌株,可以广泛应用于农业、食品、医药等领域。
目前关于提高蜡样芽孢杆菌产量的报道相对较少[13],已有报道的蜡样芽孢杆菌产量最高只有1.2×1010CFU/mL[14],不足以满足工业化生产的需求。通常认为发酵条件优化是影响生物过程中细菌生长与芽孢形成的关键因素[15]。 因此可以对蜡样芽孢杆菌的发酵条件与过程进行优化,以提高其产量,满足工业化需求。
高密度发酵(High Cell-Density Culture,HCDC)又称高密度培养,是一种相较于常规培养够显著提高产物产量的培养技术[16],对降低生产成本与工业化扩大生产具有重要意义。 刘开放等利用高密度发酵技术对布拉酵母培养工艺进行优化,摇瓶阶段酵母产量达8.21 g/L,比优化前提高1.39 倍,于50 L发酵罐进行扩大培养,酵母产量达到51.21 g/L[17]。因此利用高密度发酵技术培养蜡样芽孢杆菌来促进其工业化生产切实可行。 此外,蜡样芽孢杆菌的芽孢具有多种优良特性,在利用高密度发酵技术提高蜡样芽孢杆菌产量的同时,也需提高其芽孢率,以最大化利用蜡样芽孢杆菌。
作者以Bacillus cereus ATCC 14579 为实验菌株,通过单因素实验对蜡样芽孢杆菌培养基成分进行优化,获得最适宜蜡样芽孢杆菌生长的碳源与氮源。 在此基础上,于7 L 发酵罐进行深层扩大培养,探究最佳发酵调控策略,以期提高蜡样芽孢杆菌产量与芽孢率,为其工业化生产和应用提供参考依据。
1 材料与方法
1.1 实验菌株
蜡样芽孢杆菌 (Bacillus cereus):编号ATCC 14579,来源于作者所在实验室保藏的菌种。
1.2 主要仪器与设备
尼康TI-S-EJOY 型倒置显微镜:日本Nikon 公司产品; 英诺聚Enology Y15 型全自动葡萄酒分析仪:西班牙Biosystems 公司产品;Eppendorf New Brunswick BioFlo/CelliGen115 型全自动发酵罐:美国Eppendorf 公司产品。
1.3 培养基
LB 培养基(组分g/L):胰蛋白胨10,酵母提取物5,氯化钠10;pH 7.0。
NA 固体培养基(组分g/L):胰蛋白胨10,牛肉浸粉3,氯化钠5,琼脂20;pH 7.3。
种子培养基(组分g/L):胰蛋白胨10,酵母提取物5,氯化钠10,葡萄糖10;pH 7.0。
1.4 主要试剂
酵母粉:购自Oxoid 公司;其他试剂:均为国产分析纯,购自国药化学试剂有限公司。
1.5 单因素实验
1)蜡样芽孢杆菌活化培养 将实验室保存的蜡样芽孢杆菌转接到NA 固体培养基中,于30 ℃的恒温培养箱中培养24 h,传代2 次后置于4 ℃保存。
2)种子液制备 用接种环挑取1 环活化2 次后的菌苔,接入种子培养基,于30 ℃、200 r/min 条件下培养14~16 h,获得种子液。
3)250 mL 摇瓶中营养物质筛选 在LB 培养基基础上,通过单因素实验,探究不同碳源、氮源对蜡样芽孢杆菌生长情况的影响,通过测定各因素下发酵液OD600与活菌数来判断菌体生长情况,采用双染色法监控芽孢形成情况。
1.6 深层高密度发酵扩大培养
根据摇瓶阶段优化的培养基配方与发酵条件,在7 L 发酵罐上进行扩大培养,初始装液量为3 L,将蜡样芽孢杆菌种子液按体积分数10%接种至发酵培养基。 初始培养基(组分g/L):葡萄糖12.5,水溶性淀粉12.5,大豆蛋白胨10,酵母提取物10,MgSO4·7H2O 3,(NH4)2SO43,MnCl20.2;初始通气量为3 L/min,搅拌转速为250 r/min,温度30 ℃,初始pH 恒定为6.5,在发酵过程中流加碳源和氮源,改变转速与通气量,自动流加2 mol/L NaOH 与1 mol/L磷酸调控pH。 发酵过程中以泡敌消泡,每隔3 h 取一次样,测定OD600、pH、活菌数与芽孢数。
1.6.1 补料分批发酵
1)间歇流加碳源 当培养基中残糖质量浓度低于5 g/L 时开始流加碳源,流加液为75 mL 200 g/L葡萄糖与200 g/L 水溶性淀粉混合液,每隔3 h 测定一次残糖质量浓度。
2)间歇流加碳氮源 当培养基中残糖质量浓度低于5 g/L 时开始流加碳源与氮源,流加液中碳源为75 mL 200 g/L 葡萄糖与200 g/L 水溶性淀粉混合溶液,氮源为75 mL 100 g/L 酵母提取物与100 g/L 大豆蛋白胨混合溶液,每隔3 h 测定1 次残糖与残留伯胺氮质量浓度。
3)恒速流加碳氮源 当培养基中残糖质量浓度低于5 g/L 时开始流加碳源与氮源,流加液中碳源为200 g/L 葡萄糖与200 g/L 水溶性淀粉混合液,氮源为100 g/L 酵母提取物与100 g/L 大豆蛋白胨混合液。 碳源与氮源流加速率为0.45 mL/min。
1.6.2 分段pH 调控 0~18 h 时恒定pH 为6.5,18 h 时将pH 调至7.5,直至整个发酵过程结束。
1.6.3 分段搅拌转速与通气量调控 0~9 h 保持搅拌转速为250 r/min,通气量为3 L/min;9~18 h 调高搅拌转速与通气量至350 r/min 与4.5 L/min,18 h时将搅拌转速与通气量调至150 r/min 与2.25 L/min,直至发酵结束。
1.7 检测方法
1.7.1 菌体质量浓度测定 发酵液的菌体质量浓度采用比浊法(OD600)测定。
1.7.2 pH 测定 取一定量发酵液,10 000 r/min 离心5 min,取上清液于pH 计上测定pH。
1.7.3 活菌与芽孢计数 参见GB 4789.14—2014[18],芽孢率Y 通过芽孢数A 和活菌数B 计算,公式如下:
1.7.4 芽孢形成过程监控 取样后涂片,干燥固定,滴加孔雀绿染液盖满菌膜,置于酒精灯上加热5 min,倾去染液,待玻片冷却至室温后,用细水流冲洗玻片,再用番红复染1~2 min 后,倾去染液,干燥后,显微镜镜检。
1.7.5 残糖质量浓度 采用蒽铜-硫酸比色法测定发酵液中残糖质量浓度[19]。
1.7.6 伯胺氮质量浓度 取一定量发酵液,10 000 r/min 离心5 min,取上清液,使用英诺聚Enology Y15 型全自动葡萄酒分析仪测定发酵液中伯胺氮质量浓度。
1.8 数据处理
以上每个实验重复3 次。 采用SPSS 25.0 软件对实验数据进行统计分析Origin 2021 制图。
2 结果与分析
2.1 碳源对蜡样芽孢杆菌生长的影响
在LB 培养基的基础上,分别以葡萄糖(10 g/L)和相同质量浓度的水溶性淀粉、麦芽糖、玉米糊精、糖蜜和蔗糖为碳源,探究不同碳源对菌体生长的影响,实验结果如图1(a)所示。以10 g/L 葡萄糖和10 g/L 水溶性淀粉为碳源,菌体生长情况最好。 分别测定这2 种发酵液中的活菌数、 芽孢数、pH 与OD600的变化情况,实验结果如图1(b)、(c)所示。 以葡萄糖为碳源,菌体生长情况最好,以水溶性淀粉为碳源,芽孢最早出现。 基于上述结果,选择将葡萄糖与水溶性淀粉进行复配,复配结果如图1(d)所示。 当葡萄糖与水溶性淀粉的质量比为1∶1 时,发酵液OD600最高。 且葡萄糖与水溶性淀粉价格低廉,以葡萄糖和水溶性淀粉为碳源,不仅能获得较高产量与芽孢率,还能大大降低生产成本,故以质量比1∶1 葡萄糖与水溶性淀粉为碳源。
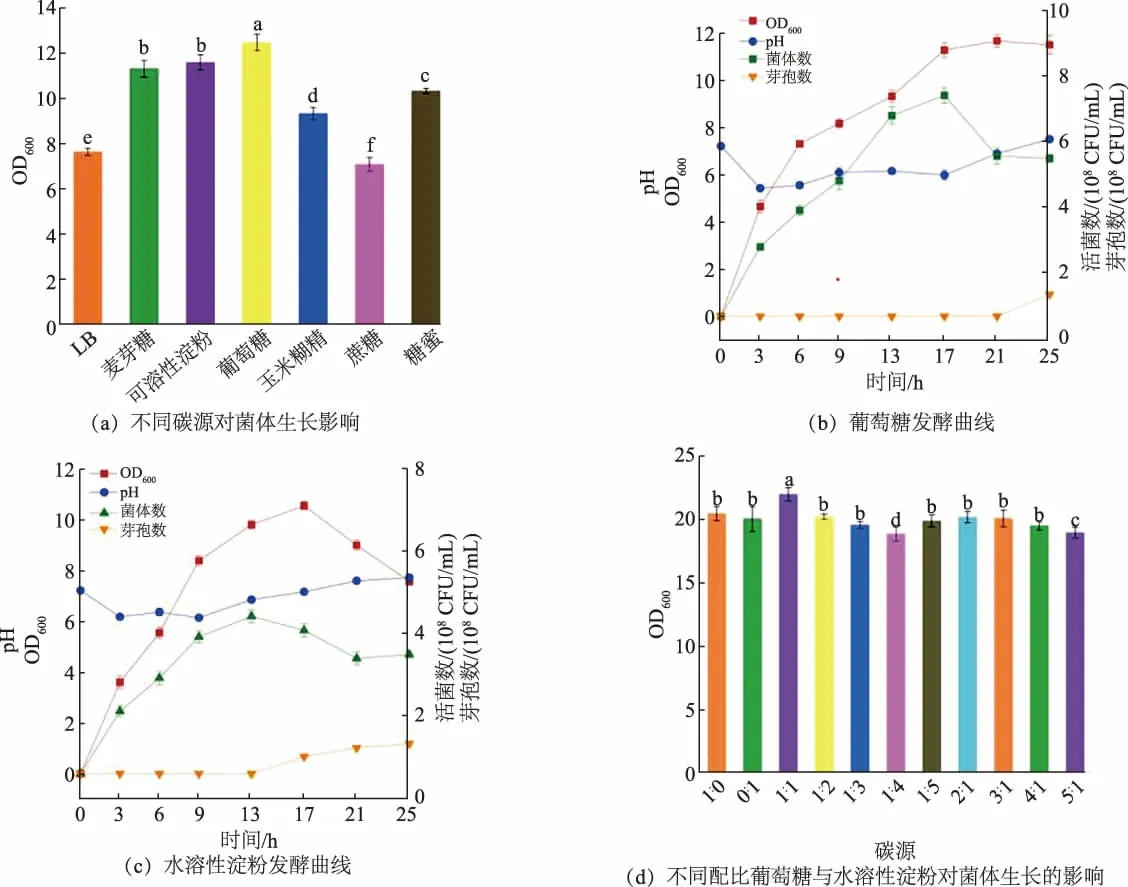
图1 碳源对蜡样芽孢杆菌生长的影响Fig. 1 Effect of carbon source on the growth of Bacillus cereus
2.2 氮源对蜡样芽孢杆菌生长的影响
氮源对菌体生长具有重要影响,蛋白质是细胞结构的组成成分,也是菌体生长不可或缺的营养物质。 分别以酵母提取物(10 g/L)与等质量浓度的胰蛋白胨、大豆蛋白胨、牛肉膏、尿素与氯化铵为氮源,探究不同氮源对菌体生长的影响。 实验结果如图2(a),以大豆蛋白胨与酵母提取物为氮源,菌体生长情况最好。 代书玲等的报道中发现,复配氮源比单一氮源更有利于菌体生长[10],因此进一步探究了氮源复配比例对菌体生长的影响。 如图2 (b)所示,当大豆蛋白胨与酵母提取物的添加质量比为1∶1 时,发酵液OD600最高,菌体生长情况最好。 酵母提取物来源于微生物,大豆蛋白胨来源于植物,以二者为共同氮源,能提供更丰富的营养物质,有利于菌体的生长。 故选择质量比为1∶1 的酵母提取物与大豆蛋白胨为氮源。
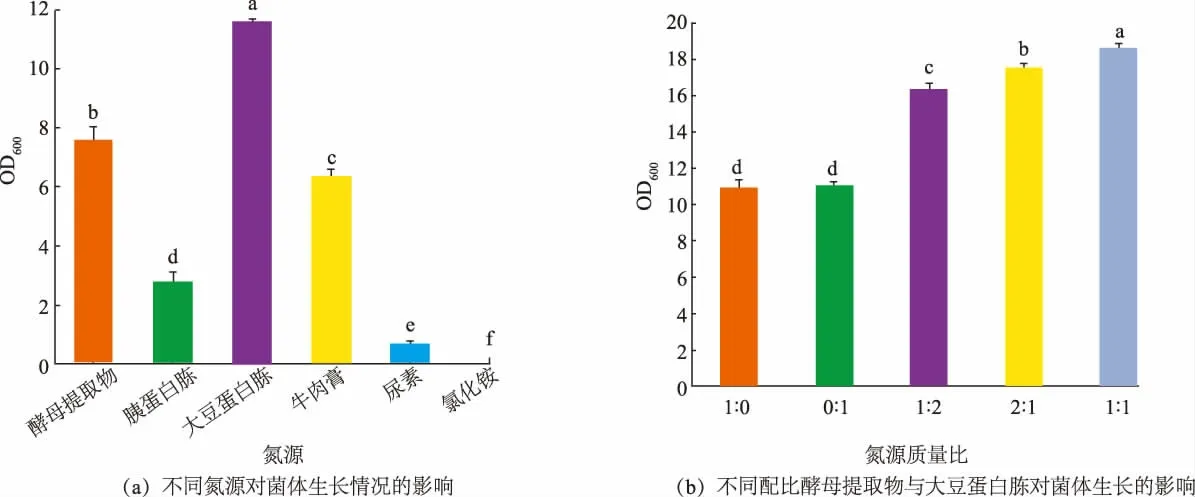
图2 氮源对蜡样芽孢杆菌生长的影响Fig. 2 Effect of nitrogen source on the growth of Bacillus cereus
2.3 发酵罐深层扩大培养
2.3.1 流加策略的影响 补料分批发酵是通过间歇或连续补加一定量新鲜培养基,排出废料,使菌体能在生长阶段获得足够的营养物质并减缓菌种老化,可以让菌体保持较高且较稳定的生长速率,从而获得高产物产量[20-22]。 目前补加单一营养物质的补料分批发酵策略较常见,邹孟琳等通过连续流加葡萄糖,获得了较高产量丁酸梭菌及芽孢[23]。但补加单一营养物质,可能导致发酵液中部分营养物质过剩,使菌体产生过多代谢副产物,不利于菌体生长发育。 刘景阳等通过全营养流加,获得了较高产量的谷氨酸[24]。杨文革等也通过流加多种营养物质,获得了高产量的蜡样芽孢杆菌[25]。 作者在此基础上稍加修改,探究间歇流加碳源、间歇流加碳氮源与恒速流加碳氮源3 种策略对蜡样芽孢杆菌生长及芽孢形成情况的影响。 间歇流加碳源结果见图3(a),发酵液中氮源在9~12 h 时耗尽,由于缺乏氮源,菌体的生长速率减缓。 同时流加碳氮源结果如图3(b)所示,菌体生长速率在整个对数生长阶段未出现明显减缓,表明同时流加碳氮源有利于菌体的快速生长繁殖。 如图3(c)所示,恒速流加碳氮源后发酵液中活菌数明显增多,但芽孢率没有显著提升,考虑到恒速流加策略更加简单易操作,因而选择以恒速流加方式,同时流加碳氮源作为蜡样芽孢杆菌高密度发酵的流加策略。
图3 不同流加方式对蜡样芽孢杆菌生长的影响Fig. 3 Effect of different feeding methods on the growth of Bacillus cereus
2.3.2 分段pH 的影响 通过摇瓶阶段的实验发现,pH 会影响蜡样芽孢杆菌的生长与芽孢形成产生,弱酸性条件适合菌体生长,弱碱性条件适合芽孢形成,这与Hue 等的研究结果[26]相符合。 故在7 L发酵罐扩大培养阶段,将恒速流加碳氮源流加策略与分段pH 调控策略相结合,在菌体生长达到稳定期前,使用弱酸性环境(pH 6.5)进行培养,促进其生长,待菌体生长进入稳定期后,将发酵液pH 调至弱碱性环境(pH 7.5)进行培养,促使其转变为芽孢,实验结果见图4。18 h 菌体生长达到稳定期后,将发酵液pH 从弱酸性调至弱碱性,与恒定弱酸性条件相比,发酵液中活菌数无较大差异,但分段pH 调控后芽孢率得到了较大提升,故恒速流加碳氮源与两段pH 调控相结合策略有利于菌体生长及芽孢形成。
图4 分段pH 调控策略结果Fig. 4 Results of segmented pH control strategy
2.3.3 分段搅拌转速与通气量调控策略 溶氧对蜡样芽孢杆菌的生长具有重要影响[27-28],低溶氧条件不利于菌体生长,并会促使其转变为芽孢[29-30]。 发酵罐中的溶氧一般由改变通气量与搅拌转速调控[31]。 故以分段pH 与恒速流加碳氮源为基础,在菌体生长进入稳定期(18 h)时,通过降低搅拌转速与通气量考察低溶氧对芽孢率的影响,结果见图5(a)。 在菌体生长达到稳定期后,将搅拌转速与通气量从250 r/min 与3 L/min 降低至150 r/min 与2.25 L/min。 因而芽孢率从(58.0±0.5)%升至90.0%以上,表明此种溶氧调控方式能够显著提高芽孢率。
图5 分段搅拌转速与通气量调控策略Fig. 5 Control strategy of segmented stirring speed and ventilation ratio
在发酵过程中发现,菌体生长进入对数生长期中期后,发酵液变黏稠,氧气传递速率下降,溶氧快速减少,因而考虑在此时加大搅拌转速与通气量,对发酵液进行充分搅拌,增加发酵液中溶氧,以促进菌体的生长繁殖。 结果如图5(b)所示,在9 h 时调高搅拌转速与通气量至350 r/min 与4.5 L/min;18 h 时,按照图5(a)策略调低搅拌转速与通气量,以此得到三段搅拌转速与通气量调控策略。 在此调控策略下,发酵液中活菌数得到了较大提升,最终达到2.2×1010CFU/mL。
2.4 芽孢率镜检分析
芽孢是细菌的休眠体,一般为内生孢子,在恶劣环境下,细菌形成芽孢,待到条件适宜时,再重新萌发为细菌。 在前面的实验中,通过分段pH、分段搅拌转速与通气量调控,发酵结束时发酵液内的蜡样芽孢杆菌芽孢率超过90.0%。 图6 为实验过程中所观察到的芽孢形成过程图,实验中所使用的染色方法为双染色法,即利用菌体与芽孢对染液的亲和力不同,将菌体染为红色,芽孢染为绿色,以便于观察区分。 从图6 中可以看出,到12 h 开始有菌体转变为芽孢,到18 h 芽孢开始逐渐增多,但此时主要还处于芽孢形成阶段,芽孢作为内生孢子,还未脱离菌体。 18 h 后进行的一系列调控使发酵液中的芽孢率开始快速上升,到24 h 时芽孢率达到50%以上;到30 h 时发酵液中芽孢率达90.0%以上。 以上结果表明本实验所使用的发酵调控策略能有效提升芽孢率。
图6 蜡样芽孢杆菌芽孢形成过程(×100)Fig. 6 Bacillus cereus spore formation process(×100)
3 结 语
作者通过摇瓶阶段的研究,筛选出最利于蜡样芽孢杆菌生长的碳源为葡萄糖与相同质量浓度的水溶性淀粉,氮源为大豆蛋白胨与相同质量浓度的酵母提取物。通过7 L 发酵罐扩大培养,分别探究了流加方式、pH 与溶氧对蜡样芽孢杆菌生长情况和芽孢率的影响。 结果表明,0~9 h 恒定搅拌,转速、通气量与pH 分别为250 r/min、3 L/min 与6.5;9 h 时以0.45 mL/min 速率流加碳氮源,并提高搅拌转速至350 r/min,通气量为4.5 L/min;18 h 时停止流加碳氮源,调高pH 至7.5,搅拌转速与通气量分别降至150 r/min 与2.25 L/min。 在此调控策略下,18 h时蜡样芽孢杆菌的活菌数达到2.2×1010CFU/mL,是未优化前的4.8 倍,发酵结束时,芽孢率超过90.0%。
利用流加碳氮源与分段pH、 搅拌转速与通气量调控相结合策略对蜡样芽孢杆菌进行高密度发酵,是本研究的一个创新点,实验结果也表明此调控策略确实有效,与未优化结果相比,蜡样芽孢杆菌生物量与芽孢率均有了较大提高,研究结果为蜡样芽孢杆菌工业化生产提供了新思路。

