西索米星生产菌株的诱变选育及工艺优化
沈淑琳,李 会,张晓梅,徐建国,史劲松,许正宏*
(1. 江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122;2. 江南大学 生物工程学院,江苏 无锡 214122;3. 江南大学 药学院,江苏 无锡 214122;4. 无锡福祈制药有限公司,江苏 无锡 214122)
西索米星(sisomicin)是一种含有双键的多元弱碱性第二代氨基糖苷类抗生素,中文别名西苏霉素和紫苏霉素等,为小单孢菌的次级代谢产物[1-2],它对大多数革兰氏阳性和部分如金黄色葡萄球菌等的革兰氏阴性菌有很强的抗菌作用。 以西索米星为前体可以合成抗菌活性强、毒性小、抗耐药性的奈替米星和plazomicin 等,市场需求较大。西索米星最先由美国先令公司Weinstein 等在1970 年从伊尼奥 小 单 孢 菌 (Micromonospora inyoensis,M.inyoensis)中取得[3]。小单孢菌是其主要产生菌[4-5],但由于其野生菌株发酵西索米星效价低 (最高只有400 U/mL),国内外研究者一直尝试采用不同的诱变方法来选育西索米星高产菌株,以满足抗生素市场需求。 Testa 等用亚硝基胍、硫酸二乙酯和紫外复合诱变处理西索米星产生菌(M. inyoensis),得到一定条件下能合成西索米星的菌株[6]。廖爱芳等对伊尼奥小单孢菌澄江变种T-125(M. inyoensis var.dengjiangensis T-125) 进行紫外和亚硝基胍诱变[7],获得一株比原始菌株效价提高了17 倍的高产菌株NS8-30。赵敏等用紫外结合氯化锂和甲胺等诱变棘孢小单孢菌JIM-202 变株,得到一株西索米星单组分阻断型新菌株JIM-121[8]。利用紫外诱变和化学诱变等传统诱变选育方法可有效提高西索米星的效价,但由于长期重复地使用相同诱变因子,诱变效果降低,而且由于小单孢菌细胞壁结构特殊,诱变研究进展不大,迫切需要寻找一种提高西索米星效价的有效诱变方法。
伊尼奥小单孢菌属于放线菌的小单孢菌属[9],其形态为菌丝体,无气生菌丝,其菌丝分散不均匀,直接诱变处理效果不佳。 此外,孢子壁结构致密牢固,不利于诱变剂进入核内起作用,进而导致孢子诱变假阳性较多,给后期诱变菌株的筛选带来干扰。 原生质体作为单个的分散细胞,接触诱变剂的面积更大,有利于诱变剂向核内渗透,而且诱变后稀释涂布于培养基能形成单个菌落,有利于分离筛选。 管玉霞等对庆大霉素产生菌绛红色小单孢菌的原生质体进行紫外和硫酸二乙酯诱变和融合[10],结合庆大霉素抗性筛选获得一株效价较原始菌株提高了73.49%的高产菌株。洪文荣应用单亲灭活种内原生质体融合技术[11],并施加西索米星压力的筛选手段,从伊尼奥小单孢菌细胞融合研究中筛选到菌株S96,西索米星效价达到1 600 U/mL,较原始菌株提高了近30 倍。 因此,采用原生质体选育方法是解决诱变效率低的有效方法之一[12]。
常压室温等离子体 (atmospheric and room temperature plasma,ARTP) 是一种新开发的诱变工具,其致突变效率高于紫外线或化学诱变剂[13-14]。ARTP 诱变除诱变率高外,还有操作简单、安全且对环境无污染等优点。 郑明坤等利用ARTP 诱变结合巴龙霉素抗性筛选,获得一株比原始菌株西索米星效价提高38.18%的高产菌株M.inyoensis SAAP22[15]。余飞对新霉素产生菌弗氏链霉菌进行6 轮ARTP 诱变,结合链霉素抗性筛选,最终获得一株新霉素高产菌株,摇瓶效价比原始菌株高出1.45 倍[16]。 因此ARTP 诱变成为工业微生物的菌种选育的一种有效且常用的方法[17-18]。 M. inyoensis OG-1 是无锡福祈制药有限公司保藏的一株能够生产西索米星的菌株,但其生产西索米星的效价偏低(约1 026 U/mL),制约着其进一步工业利用,作者采用ARTP 对伊尼奥小单孢菌原生质体进行诱变以取得西索米星生物效价提高的菌株;进而对筛选获得的高效菌株进行发酵优化并初步探究其高产西索米星的机制,为西索米星生产条件的进一步优化和工业化应用奠定基础。
1 材料与方法
1.1 材料
原始菌伊尼奥小单孢菌(Micromonospora inyoensis OG-1)和指示菌短小芽孢杆菌:由无锡福祈制药有限公司保存;溶菌酶(20 000 U/mg):购于麦克林生化科技有限公司。
1.2 培养基
斜面、分离培养基(组分g/L):可溶性淀粉10,蔗 糖 5,KNO31,NaCl20.5,K2HPO40.5,CaCO33,FeSO4·7H2O 0.5,琼脂粉20,麸皮30;pH 7.2~7.3。
种子培养基(组分g/L):玉米淀粉30,经热处理的黄豆饼粉20,玉米浆1,CaCO33,MgSO4·7H2O 1;pH 7.2~7.4。
发酵培养基(组分g/L):玉米淀粉20,白糊精40,黄豆饼粉40,玉米浆干粉6,DL-蛋氨酸2.5,MgSO4·7H2O 0.3,CoCl2·6H2O 0.02,K2HPO40.5,CaCO33;pH 7.0~7.2。
肉汤培养基(组分g/L):蛋白胨5.0,牛肉浸取物3.0,NaCl 5.0。
再生培养基(组分g/L):可溶性淀粉10,蔗糖68.46,KNO31,NaCl20.5,K2HPO40.5,CaCO33,FeSO4·7H2O 0.5,CaCl2·2H2O 3.67,MgCl2·6H2O 5,琼脂粉20。
西索米星鉴定培养基(组分g/L):蛋白胨5.0,牛肉浸取物3.0,NaCl 5.0。
P 缓冲液:蔗糖103 g、K2SO40.25 g 和MgCl2·6H2O 2.02 g 加入800 mL 的水中,分装成10 等分样品,然后高温灭菌。 使用前加入质量分数0.5%的KH2PO41 mL,质量分数3.68%的CaCl2·2H2O 10 mL,质量分数5.73%的TES 缓冲液10 mL。
1.3 方法
1.3.1 原生质体ARTP 诱变 原生质体的制备[19]:按体积分数10%将菌液接种到含质量分数0.3%的甘氨酸的肉汤培养基中,在260 r/min、34 ℃的条件下培养48 h。 培养好的菌液转移至离心管中于3 000 r/min 离心10 min,收集菌体。用0.3 mol/L 的蔗糖溶液和P 缓冲液分别洗涤菌体2 次,3 000 r/min 离心5 min。 收集菌体并加入一定浓度的溶菌酶(用P 缓冲液配制)重悬,将重悬液放置在水浴锅中恒温酶解一定时间,4 000 r/min 离心10 min,收集原生质体,洗涤重悬于P 缓冲液中。
取10 μL 伊尼奥小单孢菌的原生质体悬浮液均匀涂布于金属载片上,采用氦气作为ARTP 的工作气体,设置处理参数:电源的功率为100 W,照射距离为2 mm,通气量为10 L/min。 选择不同的处理时间(0、30、60、120、150、180、210 s),诱变结束后将金属载片放入盛有1 mL P 缓冲液的1.5 mL 无菌离心管中,充分振荡洗脱1 min,将洗脱液稀释涂布于含1 mg/mL 西索米星抗性的再生培养基,34 ℃培养14 d,计算致死率,绘制致死率曲线[20-21]。
1.3.2 诱变株的筛选 琼脂扩散法初筛:选取再生的单菌落转接到发酵培养基加琼脂配制成的固体培养基平板上进行密集划线培养,待菌体长满区域后,分别用5 mm 的打孔器挑取相同大小的菌块进行琼脂扩散实验,将菌块转接到带有短小芽孢杆菌孢子液的筛选培养基平板上,在37 ℃培养箱中培养14~16 h 后,测量抑菌圈直径大小。
摇瓶复筛:选取初筛中抑菌圈相对较大的菌株接种到种子培养基中,并进行揺瓶水平的西索米星发酵,用生物鉴定法测定效价[22]。
1.3.3 遗传性稳定性验证 将复筛中获得的高产菌株进行斜面保藏,经过连续5 代摇瓶发酵,检测西索米星生物效价,考察高产菌株的遗传稳定性。
1.3.4 碳氮源优化 在原始发酵培养基的基础上,使用等量(40 g/L)碳源(可溶性淀粉、玉米淀粉、蔗糖和葡萄糖)分别代替白糊精制备发酵培养基,其他成分不变,考察不同碳源对西索米星发酵的影响。
在原始发酵培养基的基础上,使用等量(6 g/L)氮源(牛肉粉、蛋白胨、酵母粉和花生饼粉)分别代替玉米浆干粉制备发酵培养基,其他成分不变,考察不同氮源对西索米星发酵的影响。
1.3.5 响应面实验设计优化发酵培养基组分 在碳氮源优化的培养基组分基础上,利用Design-Expert 8.0 软件,设计Plaekett-Burman 实验,筛选重要影响因素[23],根据PB 实验结论,进行最陡爬坡实验,确定西索米星发酵效价最高范围后,采用中心复合实验设计(central composite design,CCD)方法设计响应面实验,并对所得数据进行统计分析,拟合得到一个二次模型,并预测和验证西索米星发酵最优培养基组分。
1.3.6 实时荧光定量PCR 收集不同发酵时期的发酵液,收集菌丝体,分别提取RNA,进行浓度测定并 稀 释 至40 ng/μL 备 用。 利 用 软 件Beacon Designer 7 设计用于RT-qPCR 的引物,见表1。 以16s rDNA 为管家基因,以RNA 逆转录所得cDNA为模板,检验引物特异性,结果显示特异性良好后可继续进行后续RT-qPCR 研究。 将上述逆转录所得cDNA 进行RT-qPCR,实验步骤及结果的计算方法参考文献[24] 。 每次实验各组设3 个平行样,实验重复3 次。
1.3.7 西索米星生物效价的检测 用质量分数98%的浓硫酸调节发酵液pH 至1.5~2.0,静置20 min 后过滤取滤液,参照中国药典[22],采用管碟法测定西索米星的生物效价。
2 结果与分析
2.1 ARTP 诱变选育
2.1.1 最佳ARTP 诱变时间的确定 将伊尼奥小单孢菌OG-1 的原生质体进行不同时间的ARTP 诱变,然后稀释涂布于再生培养基计算其致死率。 由图1 可见,随着ARTP 诱变时间的增长,致死率逐渐升高,当诱变时间为210 s 时,致死率达100%。当致死率在80%~90%时,更容易发生正向突变[24],因此选择处理时间为150 s(致死率为85%)的诱变菌株进行后续诱变研究。
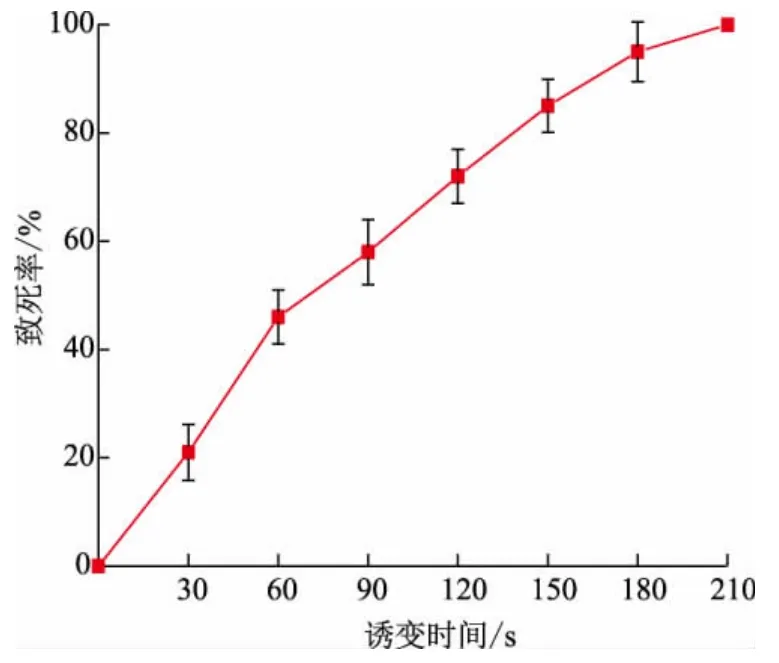
图1 ARTP 不同处理时间的致死率曲线Fig. 1 Lethality curve of ARTP for different treatment time
2.1.2 ARTP 诱变菌株的选育 将ARTP 诱变处理后的原生质体悬液稀释涂布于再生培养基上,34 ℃培养14 d。 挑选300 多株诱变菌株单菌落进行琼脂扩散法初筛,挑选抑菌圈相对较大的14 株突变菌株进行复筛。 如图2 所示,在14 株突变株中,M.inyoensis I4-10 的西索米星生物效价最高,达到(1 389±32) U/mL,较原始菌株提高了35.4%。

图2 ARTP 诱变菌株与对照菌株的摇瓶复筛结果对比Fig. 2 Comparison of shake flask rescreening results between ARTP mutagenic strain and control strain
2.1.3 高产菌株的遗传稳定性研究 为了检验突变菌株I4-10 的遗传稳定性,采用斜面传代的方法,连续进行5 次传代,检测每代摇瓶发酵的西索米星效价,结果如图3 所示。 突变菌株I4-10 株经5 次传代后的西索米星摇瓶发酵效价基本稳定,生物效价稳定在(1 389±67) U/mL,表明突变菌株I4-10 遗传稳定性良好,最终将其命名为M. inyoensis I4-10。

图3 突变菌株I4-10 的遗传稳定性Fig. 3 Genetic stability of mutant strain I4-10
2.2 碳源氮源的优化
2.2.1 碳源种类对西索米星发酵的影响 发酵培养基中的碳源为伊尼奥小单孢菌的生长以及产物代谢提供能量,为西索米星的合成输送碳骨架。 采用不同的碳源,对西索米星的效价具有较大影响。 因此筛选了不同种类的碳源如白糊精、 玉米淀粉、可溶性淀粉、葡萄糖、蔗糖对伊尼奥小单孢菌发酵产西索米星生物效价的影响进行研究。 如图4 所示,当采用可溶性淀粉作为伊尼奥小单孢菌的碳源时,西索米星的生物效价最高,达到(1 476±38) U/mL。

图4 不同碳源对西索米星发酵的影响Fig. 4 Effects of different carbon sources on the fermentation of sisomicin
2.2.2 氮源种类对西索米星发酵的影响 培养基的氮源对于微生物生长和产物合成具有较大影响。作者筛选了不同种类的氮源如玉米浆干粉、 牛肉粉、蛋白胨、酵母粉、花生饼粉对伊尼奥小单孢菌发酵产西索米星生物效价的影响进行研究。 如图5 所示,当采用花生饼粉作为氮源时西索米星的生物效价最低,蛋白胨作为氮源时西索米星的生物效价也较低。 当采用牛肉粉替代玉米浆干粉作为伊尼奥小单孢菌的氮源时,西索米星的生物效价最高,达到(1 419±60) U/mL,说明牛肉粉作为氮源可以满足伊尼奥小单孢菌的生长所需及合成西索米星的需要。
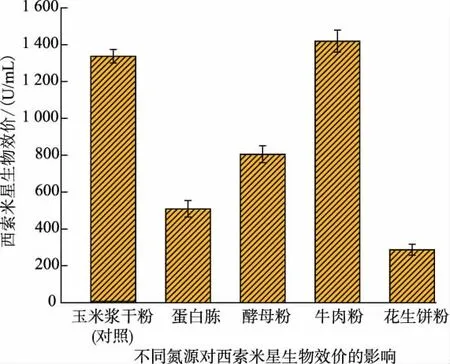
图5 不同氮源对西索米星发酵的影响Fig. 5 Effects of different nitrogen sources on the fermentation of sisomicin
碳源和氮源单因素优化实验结果表明,突变菌株I4-10 发酵培养基的最适碳源、 氮源分别为可溶性淀粉和牛肉粉。 优化后的发酵培养基发酵西索米星效价为(1 597±48)U/mL,较对照提高了15%。 菌种选育和发酵工艺优化是提高抗生素效价的重要手段,在选育得到的高产菌株的基础上对其进行发酵工艺的优化可明显提高效价[25-26]。
2.3 响应面法优化发酵培养基
2.3.1 Plackett-Burman 实验 以优化后发酵培养基组分为基础,对玉米淀粉(A)、可溶性淀粉(B)、黄豆饼粉(C)、牛肉粉(D)、DL-蛋氨酸(E)、MgSO4·7H2O (F)、CaCO3(G)、K2HPO2(H) 和CoCl2·6H2O(I)9 个因素进行考察,选用N=12 的PB 实验设计,每个因素取高、低两个水平,响应值为西索米星生物效价。PB 实验具体设计和各因素水平与效应见表2 和表3。由表3 中显示的P 值大小可知,黄豆饼粉(热)和DL-蛋氨酸质量浓度是对西索米星生物效价有显著影响的两个重要因素,两者皆存在显著的负效应。 在西索米星发酵工艺优化的相关文献中可以看出选用优质的黄豆饼粉对西索米星的发酵至关重要[27],DL-蛋氨酸也是影响西索米星发酵的重要因素。 陈剑锋等发现蛋氨酸在西索米星发酵中处于高消耗状态[28],其具有作为甲基化辅因子的特殊作用,所以添加适量蛋氨酸有助于提高西索米星效价。
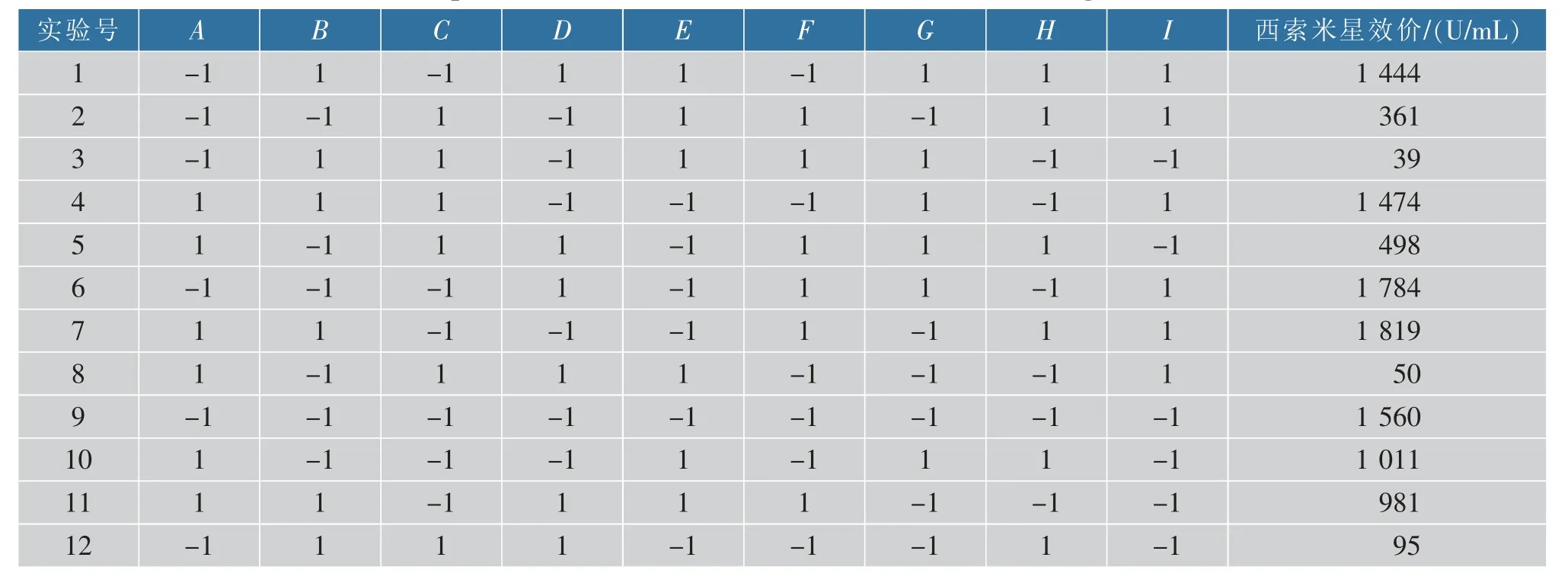
表2 Plackett-Burman 实验与结果(N=12)Table 2 Experimental and results of the Plackett-Burman design for 12 trials
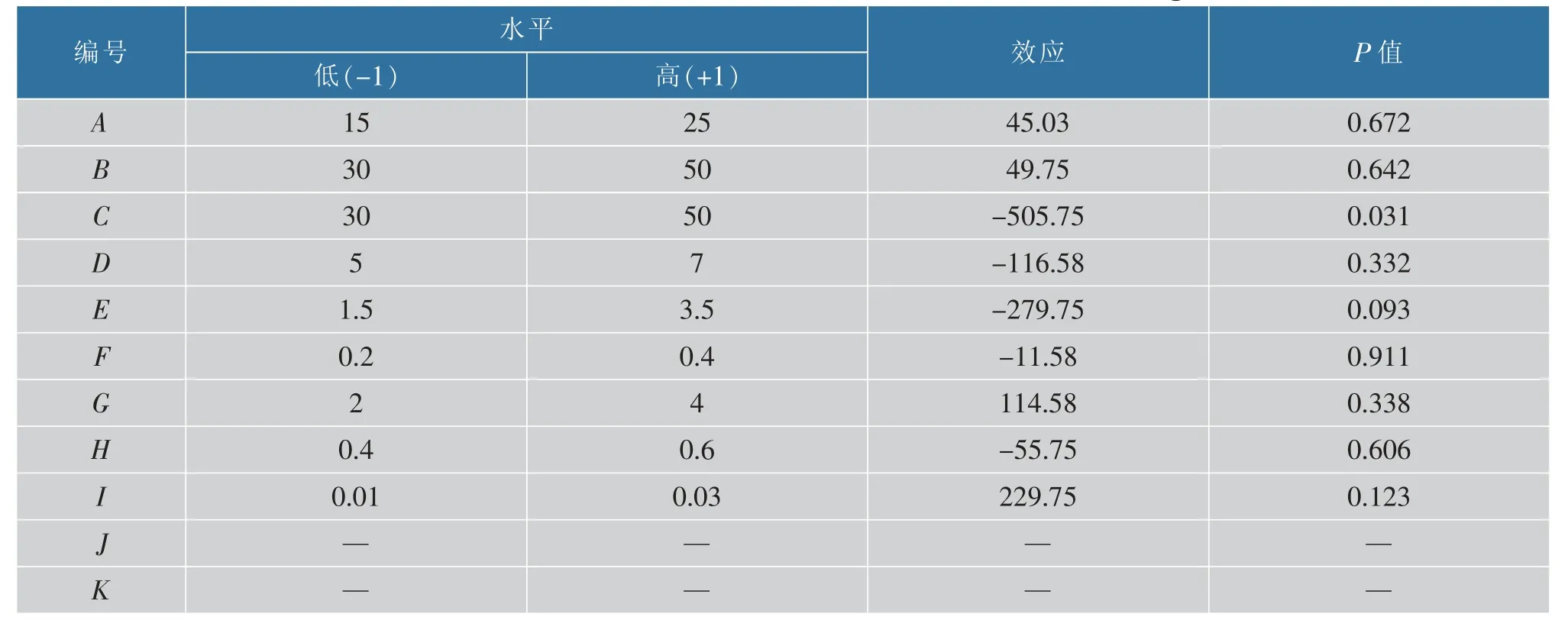
表3 Plackett-Burman 设计各因素水平及效应Table 3 Levels and effect of variables for Plackett-Burman design
2.3.2 最陡爬坡实验 在以上PB 实验结果基础上,进行最陡爬坡实验,确定黄豆饼粉和DL-蛋氨酸的最优质量浓度。 由PB 实验结果可知,黄豆饼粉和DL-蛋氨酸质量浓度对西索米星的效价具有显著影响,两者质量浓度过高时西索米星的生物效价反而下降,故应降低发酵培养基中两者的质量浓度。 根据表3 中设计的这两个显著影响因素的水平和西索米星效应值,实验设计及结果见表4。 实验4中西索米星效价最高,为1 728 U/mL,此时黄豆饼粉和DL-蛋氨酸的质量浓度为30 g/L 和1.5 g/L,因此选取第4 组实验为中心点设计下一步实验。
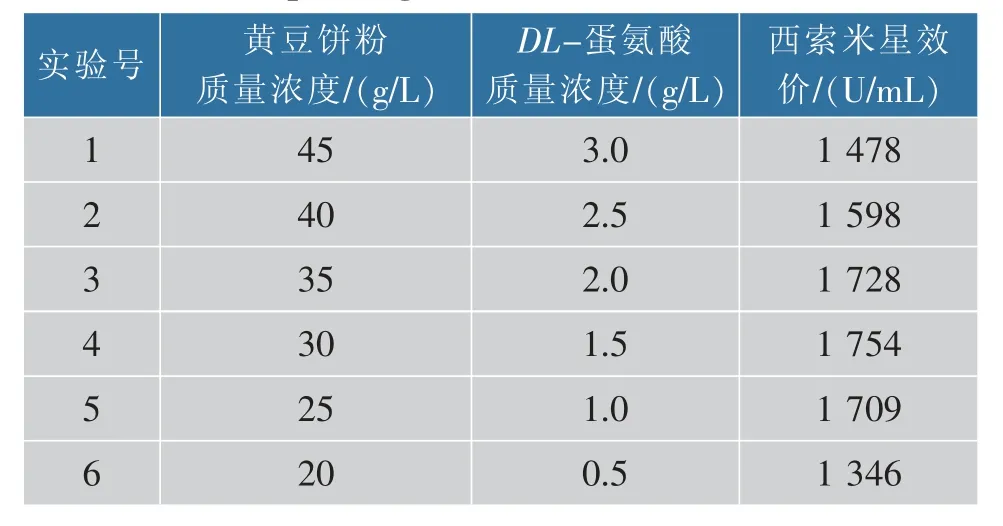
表4 最陡爬坡实验设计及结果Table 4 Experimental design of steepest ascent and the corresponding results
2.3.3 响应面设计优化培养基组分 根据最陡爬坡实验结果,选取第4 组实验为中心点进行二因素五水平的中心复合法实验方案设计,表5 是具体实验设计方案及响应值。 根据研究结果,用Design-Expert 8.0 软件进行拟合获得黄豆饼粉 (热)(A)、DL-蛋氨酸(B)和西索米星生物效价(Y)间二次回归方程为Y =1 811 +59.67A -2.21B +41.00AB -90.00A2-23.50B2。 利用软件对二次回归方程进行方差分析:该模型P 值小于0.001,说明该模型显著性好,具有统计学意义;校正决定系数Radj2=1,表示该模型能较准确反映西索米星的响应值变化;相关系数R2=1,说明该模型的拟合度好。综上所述,该模型可以用来预测西索米星的生物效价。 利用Design-Expert 8.0 软件分析可知,当黄豆饼粉质量浓度为32.78 g/L、蛋氨酸质量浓度为1.75 g/L 时,西索米星的生物效价的理论预测值最高,为1 834 U/mL。 图6 是黄豆饼粉(热)和DL-蛋氨酸影响西索米星生物效价的响应面及等高线图。
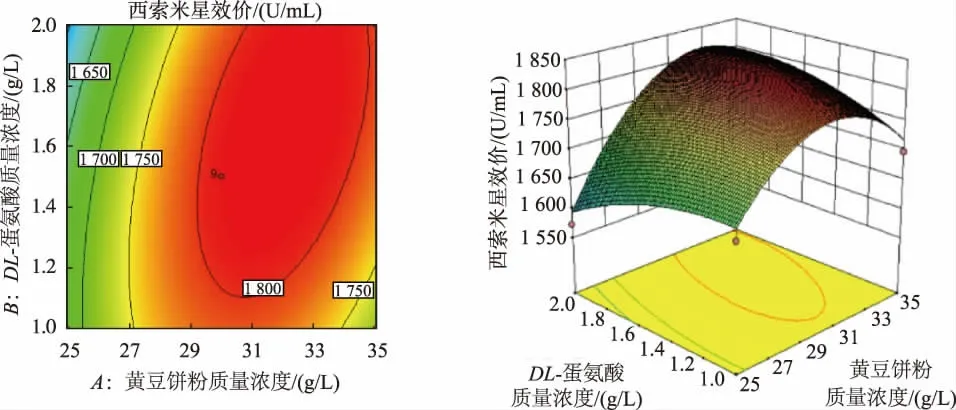
图6 黄豆饼粉和DL-蛋氨酸对西索米星生物效价影响的响应面及等高线图Fig. 6 Surface and contour plots of mutual-influence for tuna Ottelia alismoides concentration and DL-mertioninon the titer of sisomicin
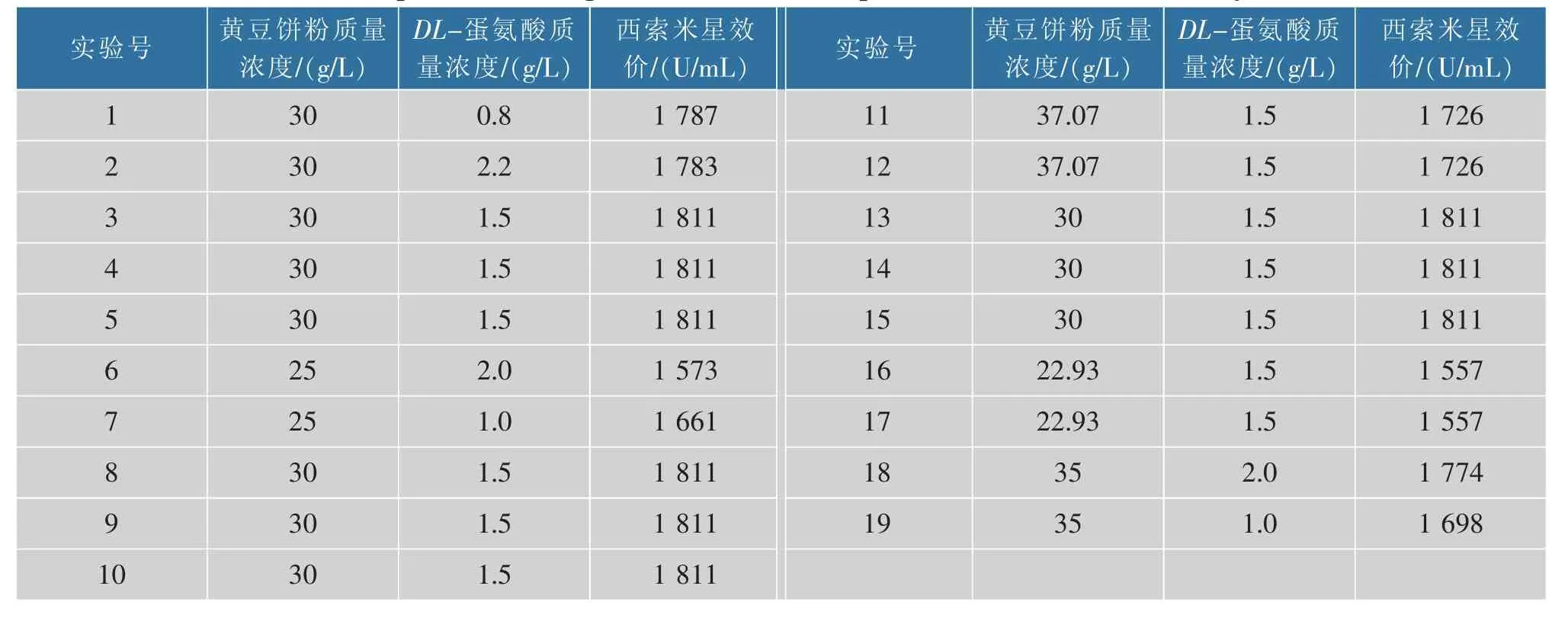
表5 中心复合实验设计及其响应值Table 5 Experimental design and the actual and predicted values of sisomicin by CCD
进一步对响应面实验设计优化得到的最适发酵培养基配方进行验证,以最适发酵培养基组分重复实验3 次。 在此条件下实际西索米星的平均生物效价达到(1 849±61) U/mL,与理论预测值99%符合。 验证该模型准确性较好,可用于西索米星发酵工艺优化。 郑明坤等将伊尼奥小单孢菌(M.inyoensis-12)作为出发菌株,经诱变后西索米星在摇瓶水平的生物效价达到1 658 U/mL[15]。 洪文荣应用单亲灭活种内原生质体融合技术筛选到突变菌株S96,使西索米星在摇瓶水平的生物效价由52 U/mL 提高到1 600 U/mL[11]。 本研究中筛选获得的诱变菌I4-10 产西索米星的生物效价在国内外同类研究报道中处于较高水平。
2.4 突变株高产西索米星的机制探索
为了探究诱变菌株高产西索米星的机理,以原始菌株伊尼奥小单孢菌OG-1 为对照,采用RT-qPCR 法对表6 所示的西索米星合成途径相关的酶基因及菌株生长代谢相关的关键酶基因进行转录水平差异分析。 分别在发酵过程的48、72、96、120 h 时取样提取菌株RNA,逆转录成cDNA,将其作为RT-qPCR 的模板,以16s rDNA 为管家基因,使用表1 中各酶基因引物进行RT-qPCR 研究。

表6 西索米星代谢途径转录水平差异分析相关基因Table 6 Genes of sterol metabolism pathways of sisomicin metabolic pathway
图7 是突变菌与原始菌西索米星代谢途径相关酶的转录水平分析热图。与原始菌OG-1 相比,在高产菌株I4-10 发酵西索米星过程中,2-脱氧青蟹肌糖合成酶、2-脱氧青蟹肌糖氨基转移酶、 甲基转移酶、3’,4’-脱羟基的磷酸转移酶、SAM 依赖性N-甲基转移酶等西索米星合成途径关键酶基因转录水平明显上调。其中2-脱氧青蟹肌糖氨基转移酶基因sis10 在发酵中的转录水平上调最显著。 而戊糖磷酸途径的葡萄糖-6-磷酸脱氢酶基因g6pd 在发酵过程中转录水平明显下调,表明在高产菌株中此途径减弱。 2-脱氧青蟹肌糖氨基转移酶与葡萄糖-6-磷酸脱氢酶具有相同的底物葡萄糖-6-磷酸,推测磷酸戊糖途径的减弱使更多的葡萄糖-6-磷酸用于次级代谢产物西索米星的合成,继而在2-脱氧青蟹肌糖氨基转移酶催化作用下产生更多的西索米星合成前体2-脱氧青蟹肌糖,这可能是突变菌株高产西索米星的原因。此外突变菌中TCA 循环的两个关键酶基因idh1 和kgdh 均表现为转录水平上调,该途径的增强可能加快了高产菌株的生长,进而促进了西索米星的合成。 基于以上分析,推测2-脱氧青蟹肌糖合成酶、2-脱氧青蟹肌糖氨基转移酶、甲基转移酶、3’,4’-脱羟基的磷酸转移酶、SAM 依赖性N-甲基转移酶、葡萄糖-6-磷酸脱氢酶、异柠檬酸脱氢酶和ɑ-酮戊二酸脱氢酶可能是影响菌株合成西索米星的关键酶。

图7 突变菌与原始菌西索米星代谢途径相关酶的转录水平分析热图Fig. 7 Heat map of transcription levels of enzymes related to metabolic pathways of mutant and original sisomicin
3 结 语
作者以M. inyoensis OG-1 为原始菌株,对其原生质体进行ARTP 诱变及工艺优化。 结果表明,当ARTP 诱变的处理时间为150 s 时,诱变效果最好。经过多轮筛选获得了高产且遗传稳定性良好的菌株M. inyoensis I4-10,西索米星的生物效价达到(1 389±67) U/mL,较原始菌株提高了34.7%。 进一步通过对高产菌株的发酵培养基组分优化,西索米星在摇瓶水平上的生物效价得到明显提高,最终达到(1 849±61)U/mL。本研究中获得的菌株M.inyoensis I4-10 在西索米星高效合成方面呈现出了较大潜力,今后可继续对该菌株进行发酵罐规模放大研究,以促进其在工业生产中的应用。 此外,原始菌和高产菌株中西索米星合成及与菌株生长相关酶基因转录水平差异分析表明,2-脱氧青蟹肌糖合成酶、2-脱氧青蟹肌糖氨基转移酶、 甲基转移酶、3’,4’-脱羟基的磷酸转移酶、SAM 依赖性N-甲基转移酶、葡萄糖-6-磷酸脱氢酶、异柠檬酸脱氢酶和ɑ-酮戊二酸脱氢酶可能是影响菌株合成西索米星的关键酶,未来可基于这些关键酶对突变菌株I4-10 进行代谢工程改造,从分子水平提升菌株的西索米星合成能力。

