鼠李糖脂对梨采后黑斑病的抑制机理
卢玉慧,刘志恬,李永才,毕 阳,杨阳阳
(甘肃农业大学 食品科学与工程学院,甘肃 兰州 730070)
早酥梨(Pyrus bretchneideri cv. Zaosu) 是1956年由中国农业科学院果树研究所以“苹果梨”为母本、“身不知”为父本进行杂交后选育而成的一个新型的梨品种[1]。 因其果肉细腻雪白、酥脆香甜[2],具有生津止咳、润肺化痰等保健功效,深受消费者的喜爱,有很高的经济效益和社会效益[3]。 互隔交链孢(Alternaria alternata) 侵染可引起梨、柑橘、甜椒、杏等多种果蔬采后黑斑病害[4],贮藏后期发病率高达37%[5]。 化学杀菌剂是目前控制采后病害的主要手段,但其残留量高、降解周期长、毒性大、环境污染严重且危害人体健康[6]。 研发安全的采后病害防腐剂或控制手段已势在必行。
鼠李糖脂(rhamnolipids,RLS)是一种糖脂生物表面活性剂,已有研究表明其对多种作物病原菌具有抗菌活性[7]。 因其无毒、两亲、潜在活性高、可生物降解、在极端条件(温度、pH 和盐度)下稳定等性质成为环境友好的“绿色”化学品,其食用安全性已通过美国国家环境保护局(EPA)的食用安全认证[8]。鼠李糖脂是由一个或两个鼠李糖分子与C8 和C12之间饱和或不饱和烷基链上的一个或两个脂肪酸相 连 形 成 的[9]。 在 对 灰 霉 菌(Botrytis sp.)、丝 核 菌(Rhizoctonia sp.)、镰 刀 菌(Fusium sp.)、链 格 孢 菌(Alternaria sp.)、腐霉(Pythium sp.)等真菌和卵菌的研究中发现,RLS 能够溶解游动孢子、抑制孢子萌发和菌丝生长等[10-11]。 Varnier 等发现,0.1、1 mg/mL的RLS 对灰霉病菌的孢子萌发和菌丝生长均有明显的抑制作用,且能有效诱导并增强葡萄的防御反应,保护植物免受灰霉病的侵染[12]。 Jonghe 等发现,在10、20 μg/mL 的RLS 质量浓度下,对菊苣孢子囊的形成、游动孢子的产生具有明显的影响,当质量浓度达到100 μg/mL 时,对隐孢子菌的菌丝生长影响更显著[13]。 RLS 在菊苣水培胁迫系统中具有很好的抑制隐孢霉传播的潜力,可作为防治褐根腐病的有效措施。 刘菊发现1.0 g/L 的RLS 对西瓜枯萎病菌的孢子萌发和菌丝生长均有抑制作用,且随着RLS 质量浓度的增加,对病原菌的抑制作用越强[14],鼠李糖脂处理还会影响孢子内部结构,细胞壁出现不同程度的消融,原生质分布不均匀,孢子内部出现泡化现象,且浓度越高,这些现象越明显。 Yan 等发现500 μg/mL 的鼠李糖脂能显著抑制致樱桃番茄腐烂的互隔交链孢[15]。Goswami 等发现2 g/L 的鼠李糖脂对甘蔗镰孢霉菌引起的病害有明显的抑制作用,且能抑制菌丝生长[16]。 有关鼠李糖脂对梨果黑斑病菌A. alternata 的抑制作用及其机理尚未见报道。 作者研究了鼠李糖脂对A. alternata 生长的抑制作用以及对黑斑病的控制作用,并探讨其可能的抑菌机理,为鼠李糖脂替代化学合成药物在果蔬采后病害控制上的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
供试早酥梨:于2020 年9 月18 日采摘自甘肃省白银市景泰县条山农场,挑选无病虫害、机械损伤,且大小形状均匀的健康果实,当天下午运至实验室,去除田间热后,于4 ℃冷库中贮藏待用。
供试链格孢A. alternata(JT-3):分离自条山农场自然发病的早酥梨果实,在PDA 培养基中纯化3代后保存待用;鼠李糖脂(纯度≥95%):购于西安瑞捷生物科技有限公司。
1.2 仪器与设备
SW-CJ-2FD 超净工作台:苏州安泰空气技术有限公司产品;CX21FSIC 光学显微镜:奥林巴斯工业有限公司产品;1510-0408 型酶标仪:美国赛默飞世尔科技有限公司产品;U-LH100-3 型荧光显微镜:上海永科光学仪器公司产品;JEM-1400FLASH 透射电子显微镜:日本电子有限公司 (JEOL) 产品;Inspect 扫描电子显微镜:美国FEI 公司产品。
1.3 试验方法
1.3.1 A. alternata 孢子悬浮液的配制 参照高春丽等的方法[17],并略做修改。 在无菌条件下将10 mL无菌水注入培养5 d 后的A. alternata 菌落中,用无菌涂布器轻刮后用4 层纱布过滤到三角瓶中,无菌水稀释、混匀后,用血球计数板计数,配制成1×106个/mL 孢子悬浮液。
1.3.2 RLS 对A. alternata 生长的影响
1)RLS 对A.alternata 孢子萌发的影响 将上述浓度为1×106个/mL 的A. alternata 孢子悬浮液准确吸取1 mL 于2 mL 无菌离心管,在5 000 g 条件下离心5 min 后弃上清液,向沉淀中加入1 mL 质量浓度分别为0、10、20、30 mg/mL 的鼠李糖脂溶液,28 ℃温育,分别在0、2、4、6、8 h 取出,加20 μL 药处理后的孢子悬浮液于9 mm 的质量浓度2 g/dL 无菌水琼脂上,然后与蒸馏水润湿的滤纸同时放置于培养皿中,28 ℃恒温培养,在光学显微镜下观察A. alternata 的孢子萌发率。 孢子萌发率计算公式如下:
式中:Y 为孢子萌发率,%;A 为孢子萌发数;B 为孢子总数。
2)RLS 对A. alternata 菌落生长的影响 参照岑春艺等的方法测定鼠李糖脂的抑菌效果[18],并略做修改。无菌条件下将质量浓度为10、20、30 mg/mL的鼠李糖脂加入无菌融化的PDA 培养基中,混匀,倒入直径为7 cm 的培养皿中。 吸取2 μL 的1×106个/mL A. alternata 孢子悬浮液滴到培养基中,28 ℃恒温培养。通过十字交叉法分别测量第3、5、7、9天的菌落直径,以无添加RLS 的PDA 组作为对照组。
3)RLS 对A. alternata 生物量的影响 分别将0、10、20、30 mg/mL 的鼠李糖脂溶液加入无菌融化的PDA 培养基中混匀,待其凝固后在培养基表面铺一层无菌玻璃纸,然后在培养基表面接种培养5 d的1×106个/mL A. alternata 孢子悬浮液2 μL 于28 ℃恒温培养箱中培养,4 d 后取下玻璃纸,称质量并记录数据。
1.3.3 RLS 对早酥梨黑斑病的控制 参照Moscoso-Ramírez 等的方法[19],并略做修改。 果实用质量分数2%的次氯酸钠溶液消毒处理好后用无菌铁钉(直径3 mm)在果实赤道部位均匀地打3 个孔(深3 mm),待其晾干后接种1×106个/mL 的A. alternata 孢子悬浮液,待孢子悬浮液晾干后向各个孔中接入20 μL 质量浓度为30、40、50 mg/mL 的鼠李糖脂溶液。无菌水处理作为对照。室温晾干后,置于规格为45 cm×31 cm×16.5 cm 的市售保鲜盒,在保鲜盒4 个角落放浸湿蒸馏水的滤纸,以保证环境湿度。通过十字交叉法,每3 d 测量一次果实的病斑直径,并记录数据,测量至第12 天。 每个处理为9 个梨。
1.3.4 RLS 对A. alternata 膜完整性的影响
1) PI 染色检测对A. alternata 孢子细胞膜完整率的测定 参照董玉鹏等的方法[20],并略做修改。准确吸取1 mL 的1×106个/mL A. alternata 孢子悬浮液于2 mL 无菌离心管中,离心弃上清液后,加入1 mL 质量浓度分别为0、10、20、30 mg/mL 的鼠李糖脂溶液,28 ℃温育2 h,离心,弃上清液,向孢子沉淀中加入1 mL PBS(pH 7.0)溶液,室温下避光静置30 min 后,继续离心,弃上清液,加入1 mL PBS(pH 7.0) 溶液洗涤2 次,接着加入20 μL 的PI(20 ng/mL) 染液,振荡15 s,28 ℃温育15 min,离心,弃上清液,同样再加入1 mL PBS(pH 7.0)溶液洗涤2 次,最后加1 mL PBS (pH 7.0) 溶液制片,Olympus 荧光显微镜下进行观察拍照并统计染色率。
2)RLS 处理对A. alternata 细胞膜电导率的影响 细胞膜电导率参照刘志恬等的方法[21],并略做修改。取1 mL 孢子悬浮液(1×106个/mL)于100 mL无菌PDB 培养基中,(25±1) ℃恒温振荡36 h(150 r/min),过滤收集1 g 菌丝,分别加入0、10、20、30 mg/mL 鼠李糖脂溶液8 mL 至15 mL 无菌离心管中,28 ℃温育,等梯度测定30~180 min 内6 个时间段的电导率。
3)RLS 处理对A. alternata 线粒体的影响 线粒体测定参照Shi 等的方法[22],并做修改。 孢子培养同1.3.4 节。 28 ℃温育后,分别在第2、4 小时取出,离心5 min,用1 mL PBS(pH 7.0)溶液洗涤3 次,加入20 μL JC-1(10 μg/mL)染料工作液,室温下避光静置30 min,离心,加入1 mL PBS(pH 7.0)溶液洗涤2 次,离心,最后加入1 mL PBS(pH 7.0)溶液制片,立即置于上述荧光显微镜下观察拍照。
4)RLS 处理对A. alternata 核酸渗漏的影响参照Carson 等的方法[23],并略做修改。 在PDB 中培养菌丝后过滤收集1 g 于2 mL 无菌离心管中,加入剂量为0、10、20、30 mg/mL 鼠李糖脂溶液,分别处理0、1、2、3、4 h 后取样,离心收集上清液,检测波长260 nm,对照组用PBS(pH 7.0)溶液进行校正。
5)RLS 处理对A. alternata 蛋白质渗漏的影响蛋白质含量测定方法同文献[23] ,加入剂量为0、10、20、30 mg/mL 鼠李糖脂溶液,分别处理0、1、2、3、4 h后取样,离心收集上清液,检测波长280 nm,并记录吸光度值。
6)RLS 处理对A. alternata 可溶性糖的影响参照Dubois 等的方法[24],并略做修改。 可溶性糖测定方法同文献[23] ,加入0、10、20、30 mg/mL 鼠李糖脂溶液,分别处理0、1、2、3、4 h 后取样,离心收集上清液0.5 mL,依次加入1.5 mL 蒸馏水、1 mL 苯酚溶液(90 g/L)和5 mL 浓硫酸,室温下反应30 min,检测波长485 nm。
1.3.5 RLS 对A. alternata 活性氧的影响 参照刘佳怡等的方法[25],并略做修改。孢子培养同1.3.4 节。2 h 后8 000 g 离心3 min,加入PBS(pH 7.0)溶液1 mL 洗涤3 次,加30 μL,10 μg/mL DCFH-DA 染色液,28 ℃温育15 min,离心,弃上清液,再次加入PBS(pH 7.0)溶液1 mL 洗涤2 次,立即置于荧光显微镜下观察拍照并统计染色率。
1.3.6 RLS 对A. alternata 菌丝形态的影响 在扫描电子显微镜下,样本用刀片挑取部分菌丝,将样本轻轻粘在导电胶上,临界点干燥,真空喷镀,最后在镜下选择合适位置,调整到适当倍数,在扫描电镜下进行观察。
1.3.7 RLS 对A. alternata 孢子显微结构的影响取于20、30 mg/mL 的RLS PDA 培养基上培养5 d的A. alternata,无菌水作为对照。 样品分别经体积分数3%戊二醛和质量分数1%四氧化锇固定。 丙酮逐级脱水。 脱水后将样品进行处理。 将处理后的样品进行包埋,紧接着进行切片后,漂浮于刀槽液面上,再捞至铜网。 醋酸铀和枸橼酸铅染色15~20 min后,于透射电镜下观察。
1.3.8 数据处理 数据采用Microsoft Excel 2013计算,并用Origin 2017 制图,用SPSS 26.0 软件对得到的数据进行方差分析,采用Duncan’s 多重差异显著分析。以上实验均做3 个平行实验,重复3次。
2 结果与分析
2.1 RLS 对A. alternata 生长的影响
2.1.1 RLS 对A.alternata 孢子萌发的影响 外源RLS 处理显著抑制了A. alternata 孢子萌发 (P<0.05),见图1,其抑制效果具有浓度效应,其中30 mg/mL RLS 处理6 后A. alternata 孢子萌发较对照组降低了88.69%。
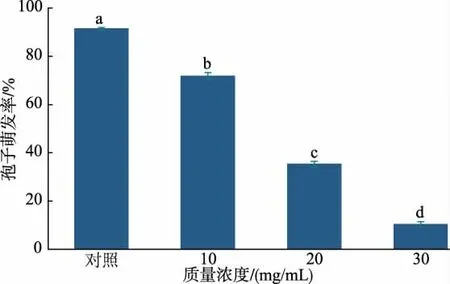
图1 RLS 对A.alternata 孢子萌发的影响Fig. 1 Effect of Rhamnolipids treatment on spore germination
2.1.2 RLS 对A. alternata 菌落生长的影响 RLS处理对A. alternata 的菌丝生长有明显的抑制作用(P<0.05) ,且抑制效果随处理质量浓度的增加而显著增强(图2)。如图2(a),RLS 不仅抑制了菌丝的扩展,而且只形成白色菌落,菌丝隆起,不形成孢子。其中30 mg/mL RLS 处理7 d 后,其菌落直径仅为对照组的19.22%。
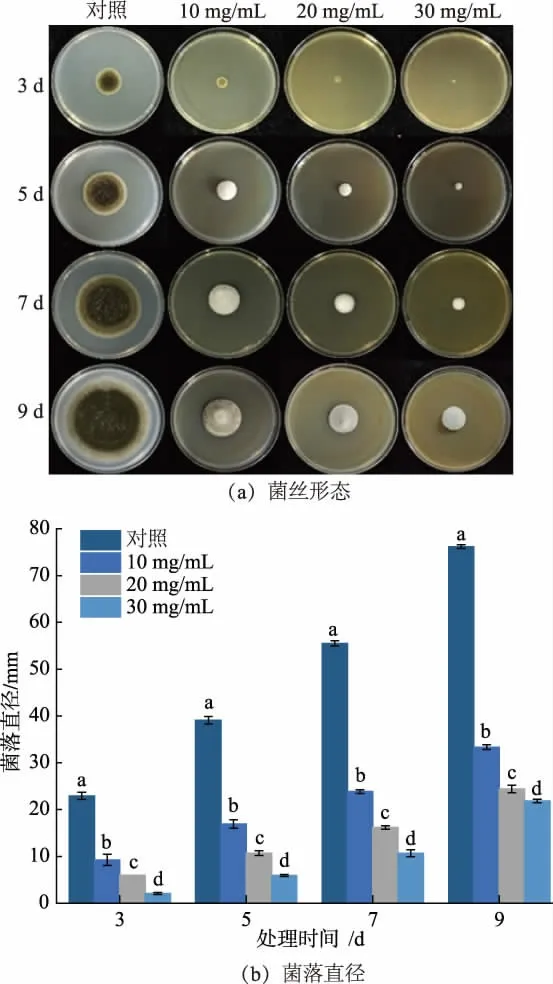
图2 RLS 处理对A.alternata 菌丝形态和菌落直径的影响Fig. 2 Effect of RLS treatment on mycelium morphology and colony diameter of A. alternata
2.1.3 RLS 对A. alternata 生物量的影响 RLS 处理对A. alternata 的生物量有显著的抑制作用(P<0.05),其生物量随着处理质量浓度增加呈现下降趋势(图3)。 培养4 d 后用30 mg/mL RLS 处理A.alternata 的生物量较对照降低了86.67%。
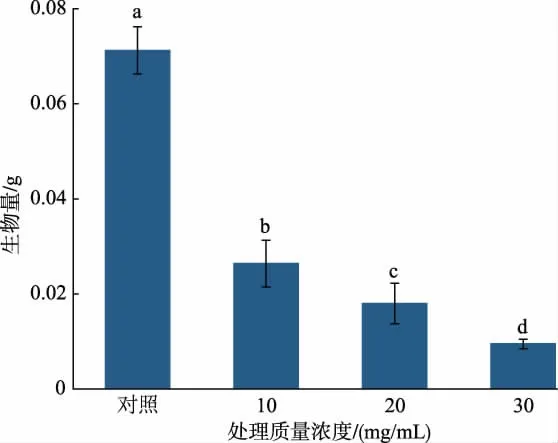
图3 RLS 处理对A.alternata 生物量的影响Fig. 3 Effect of RLS treatment on biomass of A. alternata
2.2 RLS 对早酥梨黑斑病的控制
外源RLS 处理显著抑制了早酥梨黑斑病的扩展,且随着浓度的增加,抑制效果越明显,见图4(a),贮藏到12 d 时,50 mg/mL 的RLS 处理组果实的病斑直径是对照组的21.42%,见图4(b)。

图4 RLS 处理对早酥梨黑斑病扩展及病斑直径的影响Fig. 4 Effects of RLS treatment on the development of black spot disease and lesion diameter of Zaosu pear
2.3 RLS 对A. alternata 膜完整性的影响
2.3.1 RLS 改变A. alternata 孢子细胞膜完整性由图5 可知,对照组中极少A. alternata 孢子的细胞膜发出较弱的红色荧光,而RLS 处理质量浓度增加时,其荧光强度随之增强,30 mg/mL RLS 处理组是对照的7.2 倍,说明RLS 处理会严重破坏A.alternata细胞膜的通透性。
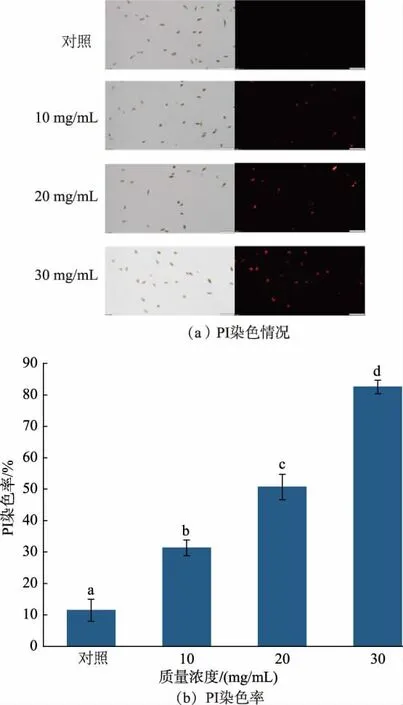
图5 RLS 处理后PI 染色检测细胞膜完整性Fig. 5 Examination of cell membrane integrity after RLS treatment by propidium iodide(PI) staining and PI staining percentage
2.3.2 RLS 对A. alternata 细胞膜电导率的影响RLS 处理显著提高了A. alternata 细胞膜的电导率,且处理质量浓度越大,其电导率增加越明显,见图6,尤其在处理前30 min 变化最为明显,30 mg/mL RLS 处理30 min 后其电导率为对照37.37 倍,随后各处理A.alternata 细胞膜电导率虽显著高于对照,但变化平稳。

图6 RLS 处理对A. alternata 细胞膜电导率的影响Fig. 6 Effect of the RLS on treatment on cell membrane electrical conductivity of A. alternata
2.3.3 RLS 对A. alternata 核酸渗透的影响 由图7可知,RLS 处理显著加速了A. alternata 核酸外渗,处理质量浓度越高培养液中核酸质量浓度越高(P<0.05),表明细胞膜被破坏后核酸外渗。 30 mg/mL 的RLS 处理4 h 后,A. alternata 培养液中核酸质量浓度为对照组的1.1 倍。
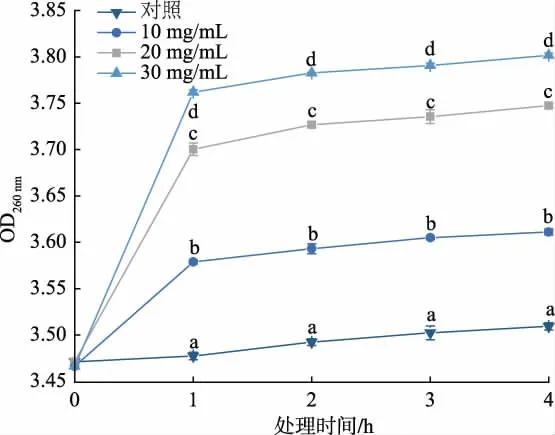
图7 RLS 处理对A. alternata 核酸渗漏的影响Fig. 7 Effect of the RLS treatment on leakage of nucleic acid from A. alternata
2.3.4 RLS 对A. alternata 蛋白质渗漏的影响 由图8 可见,RLS 处理前1 h 培养液中蛋白质质量浓度明显增加,随后变化逐渐平稳,30 mg/mL 的RLS处理4 h 后,A. alternata 后蛋白质质量浓度为对照组的1.16 倍。而对照组培养后期蛋白质质量浓度虽略有增加,但随培养时间不存在显著性差异 (P<0.05)。

图8 RLS 处理对A. alternata 蛋白质质量浓度的影响Fig. 8 Effect of the RLS treatment on protein content from A. alternata
2.3.5 RLS 对A. alternata 可溶性糖渗漏的影响由图9 可知,随着RLS 质量浓度增加,处理组的可溶性糖质量浓度明显增加,1 h 后对照组与处理组的差距明显,30 mg/mL RLS 处理A. alternata 4 h后,可溶性糖质量浓度为对照组的6.1 倍。
2.3.6 RLS 对A. alternata 线粒体的影响 由图10可见,对照组线粒体大小形态正常、结构完整、具有较强的荧光强度。 而处理组的荧光强度明显减弱,质量浓度越高,破坏越严重,线粒体分解越快,且随着处理时间的延长,线粒体形态逐渐变模糊。
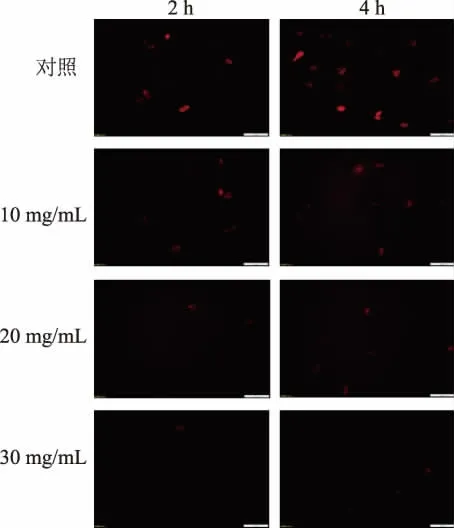
图10 RLS 处理对线粒体形态的影响Fig. 10 Effect of RLS treatment on mitochondrial morphology of A. alternata
2.4 RLS 对A. alternata 活性氧的影响
采用DCFH-DA 探针对A. alternata 细胞内活性氧进行染色,见图11。 培养2 h 后,细胞内荧光强度随着处理质量浓度增加而增强,染色率也随之逐渐增大,30 mg/mL RLS 处理的A. alternata细胞染色率较无菌水处理增加了55.96%。
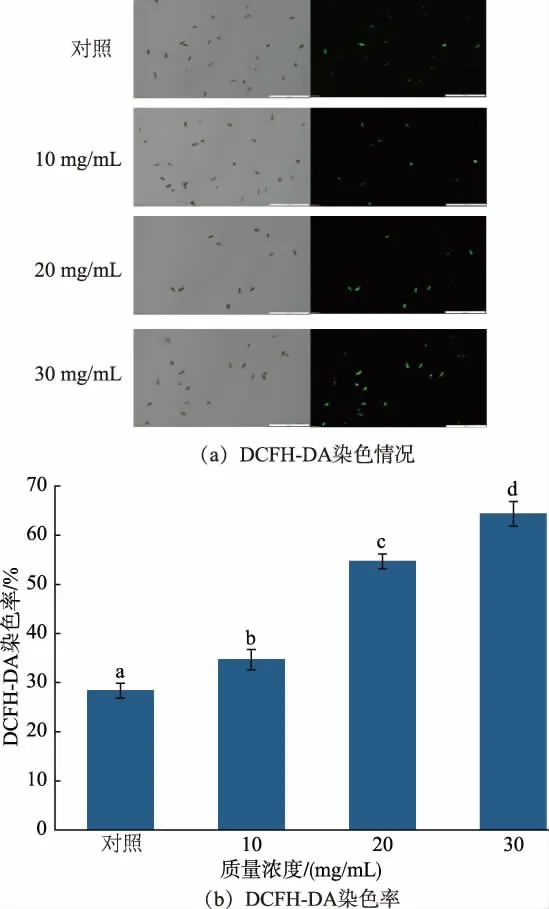
图11 RLS 处理后DCFH-DA 染色情况Fig. 11 Staining after RLS treatment and DCFH-DA staining percentage
2.5 RLS 对A. alternata 菌丝形态的影响
扫描电镜观察发现未经RLS 处理的A.alternata的菌丝粗细均匀、表面光滑,菌丝较为稀疏,而RLS处理后部分菌丝变细,且相互缠绕、卷曲,表面凹凸不平,有断裂现象,见图12。
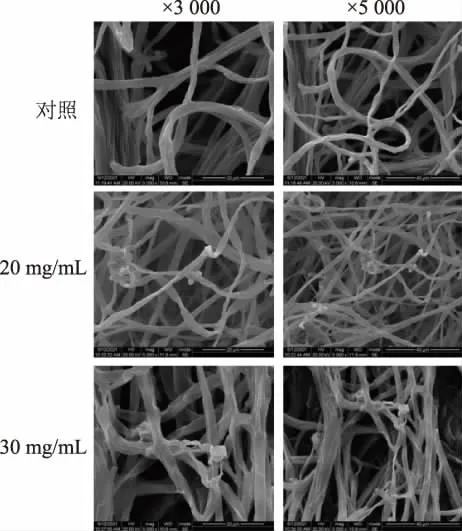
图12 RLS 处理对菌丝形态的影响Fig. 12 Effect of RLS treatment on mycelium morphology
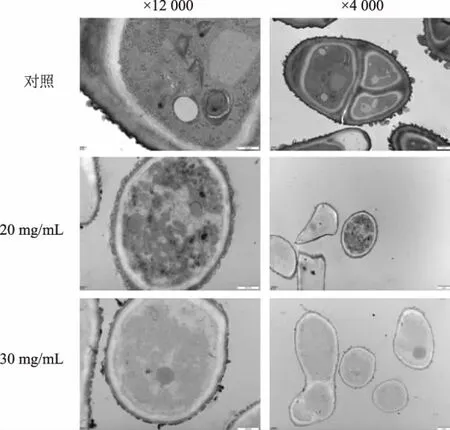
图13 RLS 处理后对孢子结构的影响Fig. 13 Effect of RLS treatment on spore structure
2.6 RLS 对A. alternata 孢子显微结构的影响
透射电镜观察发现对照组A. alternata 细胞壁结构均匀连续,胞内隔膜清晰可见,染色质分布均匀,胞浆内可见清晰完整的线粒体和核糖体等细胞器。 20 mg/mL RLS 处理的A. alternata 菌体型较小,且胞体内无明显分隔,部分菌体已畸变,呈不规则多边形,但细胞壁和细胞膜结构依旧连续,细胞壁外还附着有一层絮状物,部分A. alternata 胞浆内容物外渗,菌体内部结构模糊不清。 30 mg/mL RLS 处理的A. alternata 胞浆内容物丢失严重,多数菌体已接近空泡化,细胞壁结构变薄,细胞膜严重破坏。
3 讨 论
已有报道称鼠李糖脂具有明显的抑菌活性,包括对革兰氏阳性和革兰氏阴性细菌的抗菌作用,但其抑菌浓度在不同菌株中存在较大差异,其对几乎所有的革兰氏阴性菌均有良好的抗菌活性,包括粘质沙雷氏菌、肺炎克雷伯氏菌和产气肠杆菌的最低抑菌浓度(MIC)分别为4、0.5、8 μg/mL[26],而对革兰氏阳性菌包括枯草芽孢杆菌、表皮葡萄球菌的MIC分别高达16 μg/mL 和32 μg/mL。Siddhartha 等发现RLS 对黄色微球菌、金黄色葡萄球菌和蜡样芽孢杆菌也具有抗菌活性[27],而对病原真菌辣椒疫霉、黑曲霉、青霉菌、灰霉菌和球毛壳菌,RLS 的MIC 分别为10、16、16、18、32 μg/mL[26]。 作者发现鼠李糖脂处理能显著抑制A. alternata 的孢子萌发以及菌丝生长,30 mg/mL 的RLS 处理培养7 d 时菌落直径仅为对照组19.22%,表明不同病原物对RSL 的敏感性存在差异,其具体机理尚需进一步阐明。 同时还发现RSL 能够有效控制梨果黑斑病的扩展,这一结果与Jiumoni 等在生物防治辣椒炭疽病中的研究结果一致,其发现500 mg/L 的RLS 处理可以显著降低辣椒炭疽病的发病率,同时对病原菌也有明显的抑制作用[28]。Borah 等也发现50 mg/L 的RLS 可以完全抑制由轮状镰刀菌引起的玉米茎腐病和穗腐病[29]。 可见RLS 具有广谱的抑菌活性,但其控制作用因病原物和寄主而异。
细胞膜是保证细胞内环境相对稳定的屏障,大多数抑菌活性物质的靶点为细胞膜。 肖鹏飞等发现0.1 g/L 的RLS 破坏了细胞质膜的结构并使其裂解,还可通过引起膜活性的改变,干扰微生物正常的摄取同化功能[31]。Stanghellini 等研究发现30 μg/mL 的RLS 能使辣椒疫霉病和黄瓜腐霉病孢子在1 min 内水解完全[32]。 本研究中30 mg/mL 的RLS 处理严重破坏了A. alternata 细胞膜,改变膜通透性,提高细胞膜电导率,并导致蛋白质、核酸、可溶性糖的渗漏,诱导产生大量活性氧。 同样,Yan 等研究发现RLS 能有效抑制菌丝生长,改变细胞形态,破坏细胞膜磷脂双层结构,显著影响A. alternata 菌丝体的细胞通透性,使上清液电导率增加,大量DNA 和蛋白质从细胞质中渗出,原生质体收缩,细胞膜和细胞壁发生了改变[33],这与本实验的结果相似。Sotirova等还发现RLS 通过破坏微生物细胞膜、减少孢子移动和导致孢子破溃来抑制病原体,从而保护植物宿主免受进一步入侵[34]。 鼠李糖脂的分子结构具有亲水性头部和亲脂性尾部,其可能会插入细胞(没有细胞壁)的外膜而直接裂解游动孢子[35]。同时根据膜的脂质成分和浓度的不同,鼠李糖脂也能够透过膜而导致其溶解[36-37]。 鼠李糖脂与其他表面活性剂一样也能增溶和降低界面张力,改变细胞表面性质,介入或溶解细胞膜的磷脂层,诱导细胞膜组成和结构变化[38]。 另外,作者还发现RLS 处理会促进A.alternata 胞内活性氧的积累,但RLS 的具体抑菌机理尚需进一步揭示。
4 结 语
RLS 能显著抑制A. alternata 孢子萌发和菌丝生长,并有效控制梨果黑斑病的扩展,且其作用效果存在浓度依赖性。 RLS 处理严重破坏了A.alternata细胞膜的完整性,提高了膜电导率,增加了细胞膜透性,导致核酸、蛋白质、可溶性糖等细胞内容物外渗,诱导孢子内活性氧的产生与积累,破坏了A. alternata 的形态结构。

