以甘油为底物鼠李糖脂高产菌株的诱变选育
顾生辉,朱 莉,詹晓北,吴剑荣
(江南大学生物工程学院 教育部糖化学与糖生物技术重点实验室,江苏 无锡 214122)
以甘油为底物鼠李糖脂高产菌株的诱变选育
顾生辉,朱 莉,詹晓北,吴剑荣
(江南大学生物工程学院 教育部糖化学与糖生物技术重点实验室,江苏 无锡 214122)
通过诱变选育,将铜绿假单胞菌(Pseudomonas aeruginosa)RG-14利用甘油发酵生产鼠李糖脂产量由13.6 g/L提高到16.5 g/L。突变株经过5次连续传代培养,菌株仍维持稳定的鼠李糖脂产量,表明该菌株具有较好的遗传稳定性。利用基质辅助激光解析电离飞行时间质谱(MALDI-TOF-MS)技术分析诱变后菌株发酵甘油生产鼠李糖脂的组成,结果显示鼠李糖脂由Rha-C8-C8、Rha-C8-C10、Rha-C10-C10、Rha-C10-C12∶1、Rha-C10-C12、Rha2-C8-C10、Rha2-C10-C10、Rha2-C10-C12∶1和Rha2-C10-C12组成,其中单、双鼠李糖脂的相对丰度分别为54.8%和45.2%。当以工业粗甘油代替精甘油为底物时,该菌株鼠李糖脂产量达到14.2 g/L,表明其具有较好的应用潜力。
铜绿假单胞菌;鼠李糖脂;亚硝基胍诱变;粗甘油
鼠李糖脂是一种研究较为广泛的阴离子生物表面活性剂,一般由1~2个鼠李糖与1~2个β-羟基脂肪酸连接组成。鼠李糖脂可以作为乳化剂、乳化稳定剂、破乳剂、保湿剂和防腐剂等应用于食品、日化工业、农业及环保等领域[1]。相对于化学表面活性剂,鼠李糖脂具有低毒性和良好的生物降解性等优点。同时,鼠李糖脂的抑菌特性也使其具有成为环境友好灭菌剂的潜力[2-3]。虽然近年来鼠李糖脂的研究引起了广泛关注,但其生产受限于较高的底物成本和昂贵的提取纯化工艺[4]。
鼠李糖脂发酵一般以油料作为底物,例如Zhu等[5]以大豆油为底物,通过两阶段pH调控手段在5 L发酵罐中发酵生产鼠李糖脂,产量达到70.56 g/L。但以植物油等作为底物发酵生产鼠李糖脂时,发酵液乳化严重,同时由于游离脂肪酸、单甘油酯和甘油二脂等副产物的存在,鼠李糖脂的分离纯化过程复杂且成本较高。高昂的底物成本和复杂的分离提取工艺使得寻找一种廉价易得且分离纯化方便的替代C源成为研究热点。目前世界范围内生物柴油产业的蓬勃发展使其生产过程中产生的副产物甘油大量积累,每生产10 t生物柴油就会产生约1 t粗甘油;同时利用甘油发酵生产鼠李糖脂的下游提取过程也较为简单,甘油发酵鼠李糖脂时的发酵液只需经过简单的离心或过滤除去菌体即可得到澄清透明的鼠李糖脂发酵液。因此,以甘油作为鼠李糖脂发酵的替代C源极具前景。但是目前甘油发酵生产鼠李糖脂的产量较低,工业化大规模生产还难以实现[6-7],如Silva等[8]利用甘油为唯一C源发酵生产鼠李糖脂的产量仅达到8.0 g/L。
作为一种常用的菌株改良方法,诱变选育被应用于鼠李糖脂生产菌株的改良。沈薇等[9]利用紫外诱变及紫外、LiCl复合诱变成功将P.aeruginosa BS-03鼠李糖脂产量从4.1 g/L提高到6.8 g/L。Lotfabada等[10]通过γ-线诱变获得1株突变株,鼠李糖脂产量是出发株的1.5倍。本文中笔者所选用的菌株经历过低温常压等离子诱变和低温常压等离子加LiCl复合诱变,对诱变剂已具有一定的抗性。所以将使用公认诱变效果显著的亚硝基胍(NTG)作为诱变剂,通过诱变选育的方法来提高甘油发酵鼠李糖脂的产量。
1 材料与方法
1.1 材料
1.1.1 出发菌株
铜绿假单胞菌(Pseudomonas aeruginosa RG-14),购于中国典型培养物保藏中心(CCTCC)。
1.1.2 培养基
种子培养基(g/L):牛肉膏3.0,NaCl 5.0,胰蛋白胨5.0;pH 7.0。
发酵培养基(g/L):甘油 40.0,NaNO36.0,KH2PO41.0,Na2HPO4·12H2O 1.0,FeSO4·7H2O 0.01,MgSO4·7H2O 0.1;pH 7.0。
蓝色凝胶筛选培养基(g/L):牛肉膏3.0,NaCl 5.0,胰蛋白胨5.0,琼脂20.0,十六烷基三甲基溴化铵0.001,亚甲基蓝0.02。
1.1.3 试剂
NTG溶液:在通风橱中称取100 mg NTG于棕色瓶中,加1 mL丙酮使其溶解,溶解后加磷酸盐缓冲液19 mL,配制成5 g/L NTG溶液。
蒽酮-硫酸试剂:取0.2 g蒽酮溶于100 mL体积分数75%H2SO4溶液,现配现用。
1.2 方法
1.2.1 鼠李糖脂高产菌株诱变筛选
从斜面培养基中挑取1环P.aeruginosa RG-14,接种至50 mL种子培养基,37℃、200 r/min培养24 h后,8 000 r/min离心10 min,收集菌体,用生理盐水冲洗2次,制成菌悬液(细胞密度控制在108~109个/mL),加入一定量NTG溶液,37℃诱变处理0.5 h,大量稀释终止反应后涂布于筛选平板。
诱变后在筛选平板上挑取产生变色较大的菌株进行初筛,再通过摇瓶发酵后测定发酵液中鼠李糖脂浓度进行复筛。
1.2.2 致死率及突变率测定
按诱变处理方法,用不同浓度的NTG溶液处理菌悬液,处理时间0.5 h,稀释并涂布于筛选平板上,37℃恒温培养箱培养5 d后,计数,计算致死率。以出发菌株鼠李糖脂产量±10%计算正负突变率。

1.2.3 突变株遗传稳定性测定
对挑选出的菌株连续传代5次,分别进行发酵培养,测定鼠李糖脂产量、生物量和发酵结束时的pH。
1.2.4 鼠李糖脂含量及生物量的测定
发酵液8 000 r/min离心20 min,取1 mL上清液用3 mL乙醚萃取3次,收集乙醚相,蒸干乙醚后加水复溶得到样品。取1 mL适当稀释后的样品,加5 mL蒽酮-硫酸试剂,沸水浴10 min,冷却至室温后在620 nm下测定OD620,测得鼠李糖含量,乘以系数3即得到鼠李糖脂含量。发酵液离心后得到的菌体于105℃烘干至恒质量,确定其生物量[11]。
1.2.5 鼠李糖脂的提取
发酵液8 000 r/min离心20 min,取上清液加入3倍体积乙醚分别萃取3次,收集乙醚相,蒸干乙醚后加水复溶即得到鼠李糖脂粗品[11]。
1.2.6 鼠李糖脂组成分析
使用基质辅助激光解析电离飞行时间质谱(MALDI-TOF-MS)分析发酵所得鼠李糖脂组成[12]。本实验中所使用的质谱仪为美国 Bruker Daltonics公司UltrafleXtreme型MALDI-TOF质谱仪。使用N2激光(波长337 nm),基质为2,5-二羟基苯甲酸,控制软件为 flexControl,分析软件为flexAnalysis versison 3.3,实验方法为RP200-1500(反射模式为正离子)。
1.2.7 粗甘油发酵生产鼠李糖脂研究
以甘油含量为95%的市售粗甘油(购于河北隆海生物科技有限公司)发酵生产鼠李糖脂,与精甘油发酵生产鼠李糖脂进行比较,探索以粗甘油作为底物发酵生产鼠李糖脂的可能性。
2 结果与讨论
2.1 以甘油为底物的鼠李糖脂高产菌株的诱变选育
选取NTG诱变选育,NTG终质量浓度分别为0.1、0.2、0.3、0.4和0.5 g/L,结果如表1所示。从表1可以看出:随着NTG浓度的增加,致死率也逐渐增加。当NTG质量浓度为0.5 g/L时,致死率达到98%。在NTG质量浓度为0.1 g/L时,正负突变率均相对较低,所筛得的鼠李糖脂高产菌株产量增加幅度也相对较少。随着诱变剂量的增加,正负突变率均有明显的增加。当NTG质量浓度为0.4 g/L时,正突变率达到了38.3%。继续增加NTG浓度,正突变率下降,负突变率急剧上升。在NTG质量浓度为0.5 g/L时,正突变率为18.3%,负突变率高达70.2%,但此时菌株鼠李糖脂产量的变化幅度也较大。对经过质量浓度分别为0.1、0.2、0.3、0.4和0.5 g/L NTG处理过的突变株进行筛选,从250株突变株中筛得1株鼠李糖脂高产菌株P.aeruginosa RG-18,产量达到16.5 g/L,较出发菌株13.6 g/L的鼠李糖脂产量提高了21.3%。
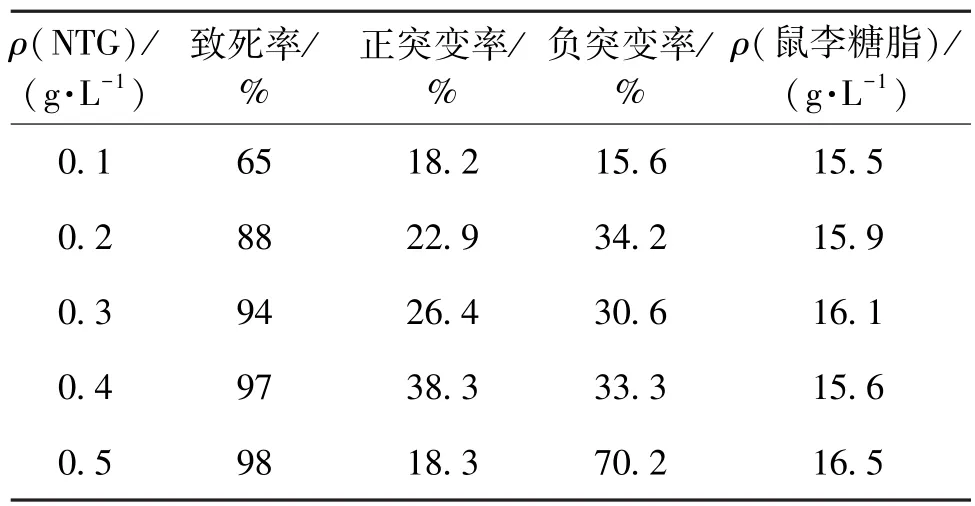
表1 不同NTG浓度诱变效果比较Table 1 Evaluation of NTG-induced mutation
2.2 突变株遗传稳定性
对P.aeruginosa RG-18进行5次传代,分别进行发酵培养并检测鼠李糖脂产量、生物量和发酵结束pH,每次实验进行4次重复,计算平均值和标准差,结果如表2所示。由表2可知:突变株经过5次连续传代培养,菌株仍维持稳定的鼠李糖脂产量,表明该菌株具有较好的遗传稳定性。

表2 遗传稳定性测试Table 2 Genetic stability test
2.3 鼠李糖脂组成
微生物发酵生产得到的鼠李糖脂通常以混合物形式存在。铜绿假单胞菌发酵产鼠李糖脂一般具有4种结构,分别是Rha-C10、Rha-Cl0-C10、Rha2-C10和Rha2-C10-C10。但实际上,根据含有鼠李糖的个数,β-羟基羧酸的个数、长度以及不饱和度的不同,目前已发现约60种不同结构的鼠李糖脂。研究表明:影响发酵生产所得的鼠李糖脂混合物组成的主要因素有菌种本身、培养基、培养条件和培养时间。其中菌种本身是发酵生产鼠李糖脂的基础,对产物组成具有非常重要的影响。鼠李糖脂混合物的组成对其性质也有很大的影响,组成上微小的变化都可能改变其理化性质。比如单鼠李糖脂更不易溶解,具有更低的临界胶束浓度;而双鼠李糖脂具有更好的抑菌效果[13]。
目前,鼠李糖脂混合物结构测定的方法主要有高效液相色谱-质谱联用(HPLC-MS)、气相色谱-质谱联用(GC-MS)、质谱(MS)、核磁共振(NMR)以及红外光谱(IR)。本实验中笔者利用基质辅助激光解析电离飞行时间质谱MALDI-TOF-MS确定鼠李糖脂结构,并利用不同结构鼠李糖脂的相对丰度估算其含量,结果如图1、图2和表3所示。从图1中可以看出,P.aeruginosa R-14所产鼠李糖脂质谱图中最高峰出现在m/z 673.4和695.4处,分别代表了主要产物Rha2-C10-C10的[M+Na]+和[M-H+Na2]+加合离子。其他含量较少的峰出现在m/z 527.3、553.3、555.3、559.6、645.3、699.4和701.4处,它们分别对应产物Rha-C10-C10、Rha-C10-C12∶1、Rha-C10-C12、Rha2-C14、Rha2-C8-C10、Rha2-C10-C12∶1和Rha2-C10-C12。同时,Rha-C10-C10、Rha2C8-C10、Rha2C10-C12∶1、Rha2-C10-C12所对应的[M-H+Na2]+加合离子的峰分别出现在m/z 549.3、667.3、721.4和723.4处。
由图 2可以看出:P.aeruginosa R-18与P.aeruginosa R-14所产鼠李糖脂质谱图有很大的不同。P.aeruginosa R-18所产鼠李糖脂质谱图中最高峰出现在m/z 527.2和673.2处,它们分别代表了鼠李糖脂中的2种主要成分Rha-C10-C10和Rha2C10-C10的[M+Na]+加合离子。其他含量较少的峰出现在m/z 471.1、499.1、553.2、555.2、645.2、699.2和701.2处,它们分别对应产物Rha-C8-C8、Rha-C8-C10、Rha-C10-C12∶1、Rha-C10-C12、Rha2-C8-C10、Rha2-C10-C12∶1和Rha2-C10-C12的[M+Na]+加合离子。同时在 m/z 549.1、695.2和723.2处观察到Rha-C10-C10、Rha2-C10-C10和Rha2-C10-C12的[M-H+Na2]+加合离子。
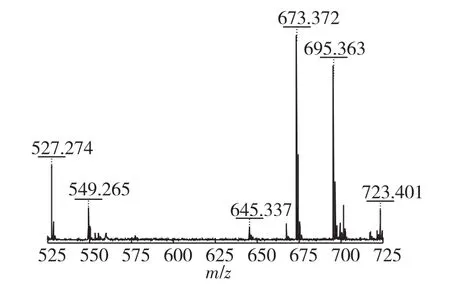
图1 出发菌株P.aeruginosa RG-14产鼠李糖脂粗提物MALDI-TOF-MS图谱Fig.1 MALDI-TOF-MS spectra of rhamnolipids produced by starting strain P.aeruginosa RG-14

图2 NTG突变株P.aeruginosa RG-18产鼠李糖脂粗提物MALDI-TOF-MS图谱Fig.2 MALDI-TOF-MS spectra of rhamnolipids produced by mutant P.aeruginosa RG-18

表3 菌株P.aeruginosa R-14和P.aeruginosa R-18产鼠李糖脂的MALDI-TOF-MS分析结果对比Table 3 Comparation of MALDI-TOF-MS analysis of rhamnolipids produced by P.aeruginosa RG-14 and P.aeruginosa RG-18
从表3可以看出:NTG诱变前后鼠李糖脂各组分相对丰度均有很大变化。与P.aeruginosa R-14所产的鼠李糖脂相比,P.aeruginosa R-18所产鼠李糖脂中相对丰度最高的组分由Rha2-C10-C10变为Rha-C10-C10,同时多出了Rha-C8-C8和Rha-C8-C10 2种鼠李糖脂,并且少了组分Rha2C14。P.aeruginosa R-14所产鼠李糖脂中单鼠李糖脂相对丰度总和为19.8%,而P.aeruginosa R-18所产鼠李糖脂中单、双鼠李糖脂相对丰度总和分别达到了54.8%和45.2%。单鼠李糖脂含量的大幅度提高意味着P.aeruginosa R-18所产鼠李糖脂具有更低的临界胶束浓度。临界胶束浓度是表面活性剂分子在溶剂中缔合形成胶束的最低浓度,临界胶束浓度越小,说明该表面活性剂达到界面饱和吸附所需的浓度越低,因此,较低浓度的该表面活性剂即能发挥乳化、起泡、增溶、润湿等表面活性作用。临界胶束浓度下降,说明与P.aeruginosa R-14相比,P.aeruginosa R-18所产鼠李糖脂更加高效。
2.4 粗甘油发酵生产鼠李糖脂
在生物柴油的生产过程中,大量的粗甘油作为副产物积累下来。但是,由于甘油发酵生产鼠李糖脂产量较低以及过去甘油价格较高,关于利用粗甘油发酵生产鼠李糖脂的研究较少,粗甘油发酵生产鼠李糖脂的产量也较低。Syldatk等[14]利用粗甘油发酵生产鼠李糖脂产量仅为8.5 g/L。本研究中,笔者验证突变株P.aeruginosa RG-18利用粗甘油发酵生产鼠李糖脂的可能性,结果见图3。由图3可知:精甘油发酵生产鼠李糖脂的产量为16.5 g/L,而粗甘油发酵鼠李糖脂产量为14.2 g/L,粗甘油发酵生产鼠李糖脂时生物量只有4.6 g/L,而以精甘油为底物时生物量最高时达到5.2 g/L。生物柴油工业中作为副产物产生的粗甘油中除了甘油外还含有甲醇、未反应的脂肪酸等杂质,同时无机盐离子浓度也较高,这些均可能对微生物的生长及微生物合成鼠李糖脂产生抑制作用。想要进一步提高粗甘油发酵生产鼠李糖脂的产量,首先需要找出粗甘油中对微生物生长和鼠李糖脂合成产生抑制作用的成分,从而开发出去除这种有害成分的粗甘油处理工艺或者筛选出对这种有害物质不敏感的菌株,达到减少甚至消除这种抑制作用的目的。
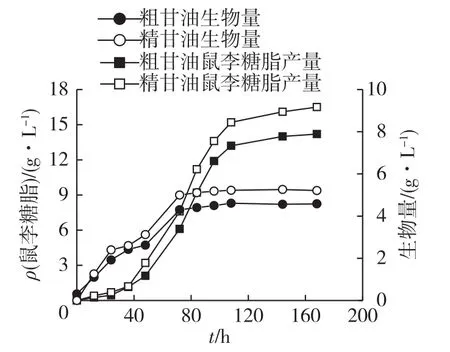
图3 P.aeruginosa RG-18利用精甘油与粗甘油发酵生产鼠李糖脂的过程曲线Fig.3 Time curves of rhamnolipids fermentation by P.aeruginosa RG-18 with pure glycerol and crude glycerol as subtrates
3 结论
对P.aeruginosa RG-14进行NTG诱变,通过蓝色凝胶平板初筛及发酵复筛,获得鼠李糖脂高产菌株RG-18,以甘油为C源发酵生产鼠李糖脂,产量由诱变前的13.6 g/L提高到16.5 g/L,这是目前以甘油为唯一C源发酵生产鼠李糖脂的最高产量。突变株以甘油为底物发酵的鼠李糖脂混合物中共含有9种鼠李糖脂,Rha-C8-C8、Rha-C8-C10、Rha-C10-C10、Rha-C10-C12∶1、Rha-C10-C12、Rha2-C8-C10、Rha2-C10-C10、Rha2-C10-C12∶1和Rha2-C10-C12,其中单、双鼠李糖脂的相对丰度分别为54.8%和45.2%。利用工业粗甘油代替精甘油发酵生产鼠李糖脂产量达到14.2 g/L,表明该菌株具有良好的实际应用的潜力。
[1]Lang S,Wullbrandt D.Rhamnose lipids biosynthesis,microbial production and application potential[J].ApplMicrobiol Biotechnol,1999,51:22-32.
[2]Sha R,Jiang L,Meng Q,et al.Producing cell-free culture broth of rhamnolipids as a cost-effective fungicide against plant pathogens[J].Basic Microbiol,2012,52:458-466.
[3]Abalos A,Pinazo A,Infante M R,et al.Physicochemical and antimicrobialproperties ofnew rhamnolipids produced by Pseudomonas aeruginosa AT10 from soybean oil refinery wastes[J].Langmuir,2001,17(5):1367-1371.
[4]Henkela M,Müllera M M,Küglera J H,et al.Rhamnolipids as biosurfactants from renewable resources:conceptsfornextgeneration rhamnolipid production[J].Process Biochem,2012,47(8):1207-1219.
[5]Zhu L,Yang X,Xue C,et al.Enhanced rhamnolipids production by Pseudomonas aeruginosa based on a pH stage-controlled fedbatch fermentation process[J].Bioresour Technol,2012,117:208-213.
[6]Monteiro S A,Sassaki G L,de Souza L M,et al.Molecular and structural characterization ofthe biosurfactantproduced by Pseudomonas aeruginosa DAUPE 614[J].Chem Phys Lipids,2007,147:1-13.
[7]Saikia R R,Deka S,Deka M,et al.Optimization of environmental factors for improved production of rhamnolipid biosurfactant by Pseudomonas aeruginosa RS29 on glycerol[J].J Basic Microbiol,2012,52:446-457.
[8]Silva S N R L,Farias C B B,Rufino R D,et al.Glycerol as substrate for the production of biosurfactant by Pseudomonas aeruginosa UCP0992[J].Colloids Surfaces B:Biointerfaces,2010,79:174-183.
[9]沈薇,杨树林,宁长发,等.铜绿假单胞菌(Pseudomonas aeruginosa)BS-03的诱变育种及产鼠李糖脂类生物表面活性剂的摇瓶工艺初探[J].食品与发酵工业,2004,30(12):26-30.
[10]Lotfabada T B,Abassi H,Ahmadkhaniha R,et al.Structural characterization of a rhamnolipid-type biosurfactant produced by Pseudomonas aeruginosa MR01:enhancement of di-rhamnolipid proportion using gamma irradiation[J].Colloids Surfaces B:Biointerfaces,2010,81:397-405.
[11]Benincasa M,Abalos A,Oliveira I,et al.Chemical structure,surface properties and biological activities of the biosurfactant produced by Pseudomonas aeruginosa LBI from soapstock[J]. Antonie Leeuwenhoek,2004,85:1-8.
[12]Price N P J,Ray K R,Vermillion K,et al.MALDI-TOF mass spectrometry of naturally occurring mixtures of monorhamnolipids and dirhamnolipids[J].Carbohydr Res,2009,344:204-209.
[13]Samadi N,Abadian N,Ahmadkhaniha R,etal.Structural characterization and surface activities of biogenic rhamnolipid surfactants from Pseudomonasaeruginosa isolate MN1 and synergistic effectsagainstmethicillin-resistantStaphylococcus aureus[J].Folia Microbiologica,2012,57:501-508.
[14]Syldatk C,Lang S,Matulovic U,et al.Production of four interfacial active rhamnolipids from n-alkanes or glycerol by resting cells ofPseudomonasspecies DSM 2874 [J].Z Naturforsch,1985,40:61-67.
(责任编辑 管 珺)
Mutating rhamnolipids high-yielding strain with glycerol as substrate
GU Shenghui,ZHU Li,ZHAN Xiaobei,WU Jianrong
(Key Laboratory of Carbohydrate Chemistry&Biotechnology of the Ministry of Education,School of Biotechnology,Jiangnan University,Wuxi 214122,China)
Through mutation,rhamnolipids yield of Pseudomonas aeruginosa RG-14 increased from 13.6 g/L to 16.5 g/L.After 5 rounds of subculturing,rhamnolipids yield of the mutant stayed stable. Subsequently,MALDI-TOF-MS was applied to analyze the composition of rhamnolipids produced by the mutant.The results showed that the rhamnolipids congener was comprised of Rha-C8-C8,Rha-C8-C10,Rha-C10-C10,Rha-C10-C12∶1,Rha-C10-C12,Rha2-C8-C10,Rha2-C10-C10,Rha2-C10-C12∶1 and Rha2-C10-C12.The relative abundance of mono-rhamnolipids and di-rhamnolipids were 54.8%and 45.2%,respectively.The mutant strain also could use crude glycerol besides refined glycerol,and the rhamnolipids yield reached 14.2 g/L,showing application potential of this strain.
Pseudomonas aeruginosa;rhamnolipid;NTG-induced mutation;crude glycerol
Q81
A
1672-3678(2015)01-0054-06
10.3969/j.issn.1672-3678.2015.01.010
2014-02-11
国家科技支撑计划(2011ABD23B00)
顾生辉(1988—),男,江苏镇江人,硕士研究生,研究方向:生物工程;吴剑荣(联系人),副教授,E-mail:kinowu@jiangnan.edu.cn

