铜绿假单胞菌半固态发酵生产鼠李糖脂
王盼盼,李成婕,何张兰,顾京赛,倪高玉,齐齐格,詹晓北,吴剑荣
(江南大学生物工程学院,工业生物技术教育部重点实验室,江苏无锡,214122)
鼠李糖脂是由铜绿假单胞菌(Pseudomonas aeruginosa)合成的一类阴离子生物表面活性剂,由1~2个鼠李糖和不同碳链长度的β羟基脂肪酸两部分连接组成[1],具有乳化、增溶、分散、凝聚、发泡等功能,而且毒性小、易于生物降解,因而在许多领域具有应用潜力[2]。鼠李糖脂发酵生产的碳源一般是植物油,例如Zhu等[3]以大豆油为底物,在5 L发酵罐中发酵生产鼠李糖脂,产量达到70.56 g/L。但由此得到的鼠李糖脂的纯化工艺复杂,形成的副产物如甘油单酯和甘油二酯会产生严重乳化现象[4],增加下游提取成本,这也是鼠李糖脂一直未能得到广泛应用的主要原因。研究表明,甘油也可以用于鼠李糖脂发酵,而且甘油是生物柴油副产物,其量大且价格便宜[5]。然而与植物油发酵相比,甘油生产鼠李糖脂产量较低,泡沫问题更严重,较难实现工业化规模生产[6-8]。
鼠李糖脂发酵过程是高好氧过程,其扩大生产需要在机械搅拌发酵罐中进行,但是发酵过程中会产生严重的泡沫问题,阻碍鼠李糖脂生产。而固态发酵可以避免这种问题,但是对于细菌来说,溶氧需求量大,要求的水分活度高,可采用半固态发酵形式进行发酵培养,解决由于较低水分活度导致产品产量降低的问题[9]。
我国是油菜籽生产大国,产量居世界首位,其榨油后的菜籽粕是十分重要的植物蛋白资源,但是由于菜籽粕含有芥子苷,加之菜籽粕中的植酸和单宁是抗营养成分,因此限制了菜籽粕在饲料中的应用[10],使部分菜籽粕被直接用于肥田。另外,菜籽粕中还含有部分油脂,是鼠李糖脂发酵优选底物。本研究采用菜籽粕和麸皮为固态基质,以甘油为碳源,采用半固态发酵的方式生产鼠李糖脂。这种方法获得的鼠李糖脂,可以应用于重金属或有机物污染土壤的修复,或者用作生物农药抑制农田病菌生长,另外还可促进页面肥料的吸收。
1 材料与方法
1.1 材料
1.1.1 菌种
铜绿假单胞菌(Pseudomonas aeruginosa)AB93066,由本实验室保藏。
1.1.2 培养基
斜面培养基(g/L):胰蛋白胨10,NaCl 5,酵母粉5,琼脂 20,pH 7.0。
种子培养基(g/L):甘油40,胰蛋白胨10,NaCl 5,酵母粉 5,pH 7.0。
初始发酵培养基(g/L):甘油 40,NaNO36,Na2HPO4·12H2O 1,KH2PO41,FeSO4·7H2O 0.01,MgSO4·7H2O 0.1,pH 7.0。
固态基质(g):菜籽粕和麸皮共10.0 g(250 mL摇瓶加入 10 g 基质)[9]。
1.1.3 主要试剂
蒽酮-硫酸试剂:取0.2 g蒽酮溶于100 mL体积分数85%H2SO4溶液,现配现用[11];乙酸乙酯。
1.2 实验方法
1.2.1 鼠李糖脂的半固态发酵
称取菜籽粕和麸皮按一定的比例共10.0 g,加到液态发酵培养基中,121℃灭菌20 min,待冷却后,接种,放到 37 ℃ 摇床 200 r/min 培养,发酵 12 d[6],测鼠李糖脂的含量。
1.2.2 鼠李糖脂的提取及测定
发酵液加入去离子水100 mL,纱布过滤,重复过滤3次,收集滤液。将滤液8 000 r/min离心15 min,取上清液2 mL,调上清液的pH为2,加入3倍体积乙酸乙酯分别萃取3次,收集乙酸乙酯相,蒸干乙酸乙酯后加水复溶即得到鼠李糖脂粗品。取稀释相应倍数的鼠李糖脂1 mL,加入4 mL的蒽酮硫酸试剂,沸水浴15 min,冷却,用分光光度计620 nm测吸光值[7]。
1.2.3 乳化能力(E24)的测定
在平底试管中加入5 mL被乳化物和5 mL的鼠李糖脂溶液(1 g/L),混合液37℃预热后高速漩涡振荡2 min,乳化液37℃放置24 h后测定乳化相体积,并以乳化相体积与总体积比值(%)表示乳化能力[12]。
1.2.4 鼠李糖脂组成结构的测定
本实验使用 MALDI-TOF MS(Ultrafle Xtreme,Bruker Daltonics,USA)测定发酵所得鼠李糖脂的组成[13]。使用基质为2,5-二羟基苯甲酸,控制软件为flex Control,分析软件为 flex Analysis versison3.3,采用氮气激光,波长337 nm,实验方法为RP200-1500(反射模式:正离子)。
2 结果与讨论
2.1 半固态发酵生产鼠李糖脂的发酵条件研究
2.1.1 装液量对鼠李糖脂发酵的影响
微生物发酵的主要媒质就是水,在固态发酵中,含水量较高,导致基质多孔性降低,减少了基质内气体的体积和气体交换,难以通风、降温,增加了杂菌污染的危险;而含水量低,造成基质膨胀程度低,微生物生长受抑制,尤其后期由于微生物生长及蒸发造成物料较干,微生物难以生长,产量降低[14]。利用铜绿假单胞菌生产鼠李糖脂是严格好氧发酵过程,因此采用菜籽粕为原料时,水分控制很重要。采用不同装液量进行半固态发酵,结果如图1所示。可以看出,鼠李糖脂随着装量的增加液有所提高,在装液量为50/250 mL时鼠李糖脂的产量最高,达到(14.3±0.29)g/L。随后鼠李糖脂产量下降,其原因可能是装液量太大,影响发酵液传氧过程。

图1 不同装液量对鼠李糖脂发酵的影响Fig.1 Effects of medium volumes on rhamnolipids fermentation in flasks
2.1.2 固态基质比例对鼠李糖脂发酵的影响
固态发酵的一个突出优点是培养基简单而且来源广泛,多为便宜的天然基质或工农业生产的下脚料。固态发酵的原料可分为两个部分:一是供给养分的营养料,如麸皮、豆粕等;二是促进通风的填充料,如稻壳、玉米皮、花生皮等[10]。麸皮,是小麦制面粉时的副产品,麸皮中不但含有淀粉、粗蛋白等营养物质,而且具有较大的面积,有利于固态发酵过程中增强微生物所分泌酶的活力,提高原料利用率[15]。选择不同的菜籽粕和麸皮的比例研究其对于鼠李糖脂的发酵的影响,结果如图2所示。可以看出,当菜籽粕与麸皮的比例为5∶5时,鼠李糖脂的产量最高,达到(15.0±0.30)g/L。

图2 不同的固态基质比例对鼠李糖脂发酵的影响Fig.2 Effects of the solid substrate ratio on rhamnolipids fermentation
2.1.3 接种量对鼠李糖脂发酵的影响
如图3所示,在接种量为10%时,半固态发酵的鼠李糖脂产量最高,达到(16.0±0.32)g/L。
2.1.4 甘油浓度对鼠李糖脂发酵的影响
鼠李糖脂发酵的碳源一般选用植物油,但是甘油作为一种低碳醇的碳源,比不溶于水的碳源更容易被菌体吸收。优化选取合适的甘油浓度,可以得到较高浓度的菌体和产物。本实验选取不同甘油浓度进行鼠李糖脂半固态发酵测试,结果如图4所示。
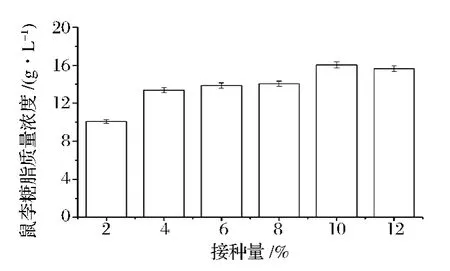
图3 接种量对鼠李糖脂发酵的影响Fig.3 Effects of inoculums volumes on rhamnolipids fermentation
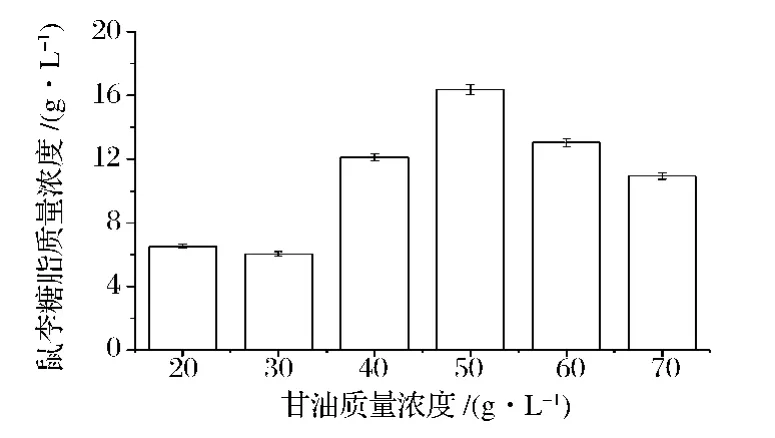
图4 甘油质量浓度对鼠李糖脂发酵的影响Fig.4 Effects of different glycerol concent ration on rhamnolipids fermentation
可以看出,甘油浓度较低时,鼠李糖脂浓度较低,随着甘油浓度的增加,鼠李糖脂的浓度也增加。当甘油质量浓度为50g/L时,鼠李糖脂的浓度最高,达到)(16.4±0.33)g/L。继续增加甘油的浓度,鼠李糖脂的质量浓度不但没有增加,反而下降,这可能是因为甘油浓度会增加培养基的渗透压,会抑制菌体的生长,从而影响鼠李糖脂的生成。
2.1.5 NaNO3质量浓度对鼠李糖脂发酵的影响
NaNO3是生产鼠李糖脂最好的氮源,如 Prieto等[16]在用P.aeruginosa LBM10生产鼠李糖脂研究中发现,尽管NH4NO3(0.4%)和NaNO3(0.85%)对生产鼠李糖脂没有显著差异,但是对鼠李糖脂乳化系数影响较大。尿素和铵硫酸盐作为氮源效果也不如NaNO3好。培养基中碳和氮的比例(C/N)对微生物的生长和产物形成常有很大的影响,碳氮比不当,会影响菌体吸收营养的平衡。如Lotfabad等[17]研究发现,以NaNO3为氮源时鼠李糖脂产量最高,并且当C/N在10/1~30/1之间时,鼠李糖脂产量维持在较高水平,而当碳氮比为40/1~50/1时,鼠李糖脂几乎不再合成。其他研究证实碳氮比(C/N)为12.5~12.8时有利于鼠李糖脂肪的合成[18-19]。本研究用NaNO3作为氮源,在碳源浓度确定的条件下,优化NaNO3的浓度,结果如图5所示。可以看出,NaNO3浓度为4 g/L,即 C/N比为19.22时,也在 C/N比10/1~30/1之间,此时鼠李糖脂的含量最高,达到(18.7±0.37)g/L。

图5 NaNO3质量浓度对鼠李糖脂发酵的影响Fig.5 Effects of different NaNO3 concentration on rhamnolipids fermentation
2.2 鼠李糖脂的性质
2.2.1 鼠李糖脂的结构测定
鼠李糖脂结构的测定方法有很多种,文中主要采用MALDI-TOF-MS图谱分析鼠李糖脂的结构,结果如图6所示。图6-a表示液态发酵的鼠李糖脂的质谱图,可以发现鼠李糖脂主要有一个明显的最高峰,在m/z 673.4处,代表了 Rha2-C10-C10的[M+Na]+,其他的小峰分别在 m/z 499.3、527.3、553.3、555.30、559.4、645.3、699.4、701.4、729.4 等,分别代表的结构 为 Rha-C8-C10、Rha-C10-C12∶1、Rha-C10-C12、Rha2-C14、Rha2-C8-C10、Rha2-C10-C12、Rha2-C10-C12、Rha2-C12-C12。另外,图6-b表示半固态发酵生产的鼠李糖脂的质谱图,发现鼠李糖脂在m/z 527.3有一个明显的最高峰,代表了 Rha-C10-C10的[M+Na]+,其他的小峰分别在 m/z 553.3、555.3、582.3、673.4、701.4等,分别代表的结构为 Rha-C10-C12∶1、Rha-C10-C12、Rha2-C14、Rha2-C10-C10、Rha2-C10-C12。
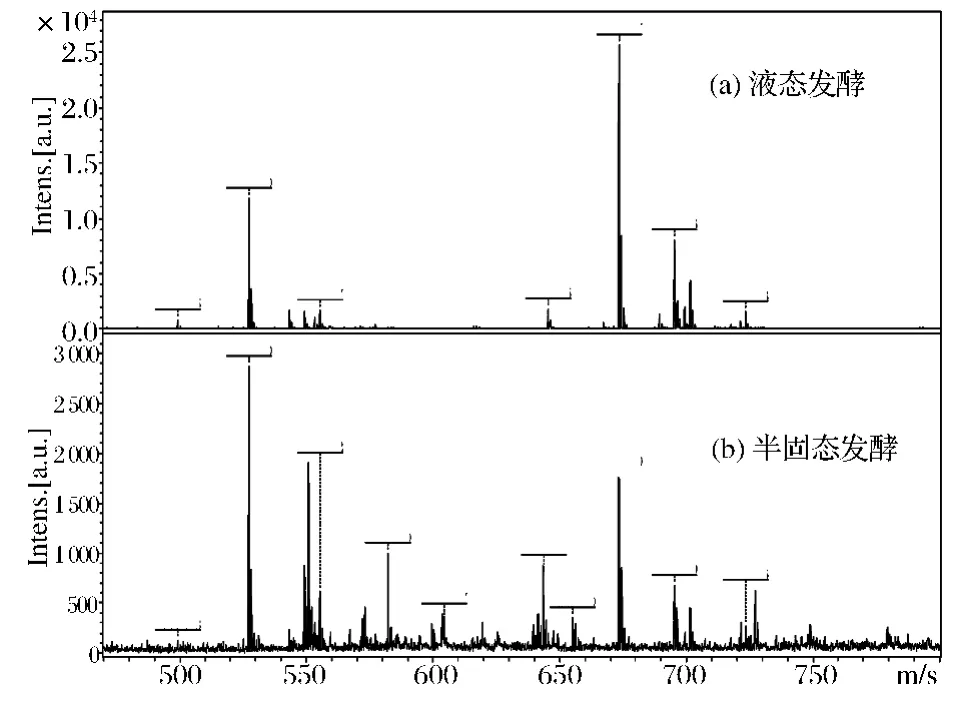
图6 两种不同发酵方式生产的鼠李糖脂MALDI-TOF质谱图Fig.6 MALDI-TOF mass spectrum of rhamnolipids produced by two different fermentation methods
对液态和半固态发酵获得鼠李糖脂的相对丰度进行分析,结果如表1所示。我们发现液态发酵和半固态发酵的鼠李糖脂主要的结构组成发生较大变化。半固态发酵的鼠李糖脂少了组分Rha-C8-C10、Rha2-C8-C10、Rha2-C10-C12∶1、Rha2-C12-C12,即双鼠李糖脂的结构组分减少了,液态发酵中的单鼠李糖脂所有结构的相对丰度之和为67.41%,双鼠李糖脂的所有结构的相对丰度之和为171.13%,说明在液态发酵产物中双鼠李糖脂所占的比重大。半固态发酵单鼠李糖脂所有结构的相对丰度之和为140.35%,双鼠李糖脂的所有结构的相对丰度之和113.2%,说明在半固态发酵产物中单鼠李糖脂所占的比重大。单鼠李糖脂的比重提高意味着鼠李糖脂更具有疏水性,形成胶束的能力变强,临界胶束浓度小,也表明半固态发酵的鼠李糖脂比液态发酵的鼠李糖脂的表面活性更强。

表1 两种不同发酵方式生产的鼠李糖脂MALDI-TOF质谱分析结果Table 1 Analysis of MALDI-TOF mass of rhamnolipids produced by two different fermentation methods
2.2.2 鼠李糖脂乳化能力(E24)测定
鼠李糖脂作为一种生物表面活性剂,具有乳化性、起泡性、浸湿等功能。测定鼠李糖脂的乳化能力能够代表鼠李糖脂表面性能指标。乳化能力的高低通过乳化系数来证明。通过对5种烃类物质进行乳化能力(E24)的测试,发现如图7所示,半固态发酵和液态发酵的鼠李糖脂的乳化系数一般在50%~70%左右,半固态发酵比液态发酵的鼠李糖脂乳化系数高,而且半固态发酵的鼠李糖脂对环己烷的乳化系数达到了86%。说明半固态发酵的鼠李糖脂稍高于液态发酵的鼠李糖脂的乳化能力,即表面活性要比液态发酵的好。Gudina等[20]研究鼠李糖脂农工业副产品在强化采油和生物修复应用时,测定鼠李糖脂的乳化系数(E24)为60%。本研究半固态发酵获得鼠李糖脂的乳化能力与文献报道接近。
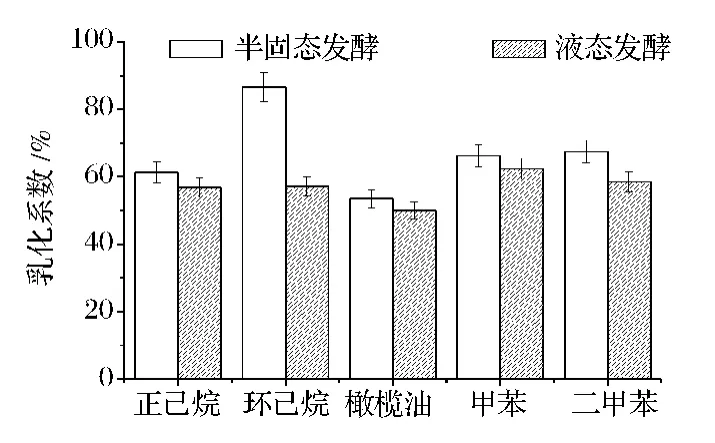
图7 两种不同发酵方式生产的鼠李糖脂对烃类物质的乳化能力Fig.7 Emulsification activity of rhamnolipids produced by two different fermentations on various hydrocarbons
3 结论
利用菜籽粕和麸皮,以甘油为唯一碳源,采用半固态发酵生产鼠李糖脂,通过单因素实验,优化发酵条件,将鼠李糖脂的产量从14.0 g/L提高到18.7 g/L,产量提高了33.4%。通过MALDI-TOF质谱进行相对丰度的分析,发现液态发酵单鼠李糖脂和双鼠李糖脂的相对丰度为67.41%和171.13%,即液态发酵中双鼠李糖脂所占的比重大;半固态发酵单鼠李糖脂和双鼠李糖脂相对丰度为140.35%和113.2%,即半固态发酵产物中单鼠李糖脂所占的比重变大,表面活性强。乳化能力测试(E24)表明半固态发酵的鼠李糖脂乳化系数在50%~70%之间,而且乳化系数比液态发酵的大,其乳化能力要强于液态发酵的鼠李糖脂。
[1] ZHAO F,SHI R,ZHAO J,et al.Heterologous production of Pseudomonas aeruginosa rhamnolipid under anaerobic conditions for microbialenhanced oil recovery[J].Journal of Applied Microbiology,2014,118(2):379-389.
[2] 吴虹,汪薇,韩双艳.鼠李糖脂生物表面活性剂的研究进展[J].微生物学通报,2007,34(1):148-152.
[3] ZHU L,YANG X,XUE C,et al.Enhanced rhamnolipids production by Pseudomonas aeruginosa based on a pH stage-controlled fed-batch fermentation process[J].Bioresource Technology,2012,117:208-213.
[4] Kumar C G,Mamidyala S K,Sujitha P,et al.Evaluation of critical nutritional parameters and their significancein the production of rhamnolipid biosurfactants from Pseudomonasaeruginosa BS-161R[J].Biotechnology Progress,2012,28(6):1 507-1 516.
[5] LENG L,YUAN X,ZENG G.Rhamnolipid based glycerolin-diesel microemulsion fuel:Formation and characterization[J].Fuel,2015,147:76-81.
[6] Saikia R R,Deka S,Deka M,et al.Optimization of environmental factors for improved production of rhamnolipid biosurfactant by Pseudomonas aeruginosa RS29 on glycerol[J].Journal of Basic Microbiology,2012,52(4):446 –457.
[7] Silva S N R L,Farias C B B,Rufino R D,et al.Glycerol as substrate for the production of biosurfactant by Pseudomonas aeruginosa UCP0992[J].Colloids and Surfaces BBiointerfaces,2010,79(1):174-183.
[8] 顾生辉,朱莉,詹晓北,等.以甘油为底物鼠李糖脂高产菌株的诱变选育[J].生物加工过程,2015,13(1):54-59.
[9] Camilios Neto D,Meira J A,de Araujo J M,et al.Optimization of the production of rhamnolipids by Pseudomonas aeruginosa UFPEDA 614 in solid-state culture[J].Applied Microbiology and Biotechnology,2008,81(3):441-448.
[10] 邱良伟,顾拥建,沙文锋,等.复合微生物固态发酵菜籽粕的研究[J].安徽农业科学,2015,43(3):209-211.
[11] 齐香君,徐婷婷.定量测定铜绿假单胞菌发酵液中鼠李糖脂的方法学研究[J].陕西科技大学学报,2010,28(6):39-55.
[12] Rahman K S M,Rahman T J,McClean S,et al.Rhamnolipid Biosurfactant Production by Strains of Pseudomonas aeruginosa Using Low-Cost Raw Materials[J].Biotechnology Progress,2002,18(6):1 277-1 281.
[13] Price N P J,Ray K R,Vermillion K,et al.MALDI-TOF mass spectrometry of naturally occurring mixtures of monorhamnolipids and dirhamnolipids[J].Carbohydrate Research,2009,344(2):204-209.
[14] 黄达明,吴其飞,陆建明,等.固态发酵技术及其设备的研究进展[J].食品与发酵工业,2003,29(6):87-91.
[15] 郭祯祥,李利民,温纪平.小麦麸皮的开发与利用[J].粮食与饲料工业,2003(6):43-45.
[16] PrietoLM.,MichelonM.,BurkertJFM.,et al.The production of rhamnolipid by a Pseudomonas aeruginosa strain isolated from a southern coastal zone in Brazil[J].Chemosphere,2008,71(9):1781–1785.
[17] Lotfabad T B,Shourian M,Roostaazad R,et al.An efficient biosurfactant-producing bacterium Pseudomonas aeruginosa MR01,isolated from oil excavation areas in south of Iran[J].Colloids and Surfaces B-Biointerfaces,2009,69(2):183-193.
[18] da Rosa C F C,Michelon M,Burkert J F D,et al.Production of a rhamnolipid-type biosurfactant by Pseudomonas aeruginosa LBM10 grown on glycerol[J].African Journal of Biotechnology,2010,53(9):9 012-9 017.
[19] Saikia R R,Deka S,Deka M,et al.Optimization of environmental factors for improved production of rhamnolipid biosurfactant by Pseudomonas aeruginosa RS29 on glycerol[J].Journal of Basic Microbiology,2012,52(4):446 –457.
[20] Gudina E J,Rodrigues A I,Alves E,et al.Bioconversion of agro-industrial by-products in rhamnolipids toward applications in enhanced oil recovery and bioremediation[J].Bioresource Technology,2015,177:87-93.

