微生物硫酸酯酶研究进展:来源、催化机制及应用
张丹平,何玉财
(常州大学 制药与生命科学学院 生物工程研究室,江苏 常州 213164)
微生物硫酸酯酶研究进展:来源、催化机制及应用
张丹平,何玉财
(常州大学 制药与生命科学学院 生物工程研究室,江苏 常州 213164)
手性醇是合成医药、农用化学品和其他精细化学品的关键中间体。硫酸酯酶可催化水解硫酸酯键裂解形成无机硫酸盐和相应的仲醇。笔者综述了硫酸酯酶微生物来源、催化反应机制及其应用,也介绍了固定化提高催化稳定性及通过添加金属离子或有机助溶剂提高硫酸酯酶选择性的方法。
硫酸酯酶;手性仲醇;生物转化;选择性
手性醇是医药、化妆品和农用化学品等领域不可缺少的中间体,也是不对称合成中重要的手性助剂,因此光学活性仲醇化合物的制备越来越受到人们的关注[1-3]。许多方法用于合成手性仲醇[4]。与传统化学合成法相比,生物催化合成具有立体选择性强、活性高及反应条件温和等优势。生物不对称还原潜手性酮、氧化拆分外消旋醇和水解拆分环氧化合物等技术实现了高光学纯手性醇的高效合成[3-5]。近些年研究发现,硫酸酯酶能够催化水解,使得硫酸酯键的裂解从而形成无机硫酸盐和相应的醇[6-7],并且可实现手性仲醇的高效合成,引起了许多专家和学者的极大兴趣。
笔者对硫酸酯酶微生物来源、催化反应机制及其应用进行了综述,也对固定化技术提高硫酸酯酶催化稳定性和通过添加金属离子或有机助溶剂提高硫酸酯酶选择性的方法进行了介绍,以期为相关领域的研究者提供参考。
1 硫酸酯酶的微生物来源
目前已经筛选到 Bacillus sphaericus FCC098、Gulosibacter molinativorax DSM13485、Paracoccus sp. DSM6392、Pseudomonas sp.S7、Rhodococcus ruber DSM-44541、Rhodopirellula baltica DSM10527、Sechococcus sp.RCC556和 Sulfolobus acidocaldarius DSM639等硫酸酯酶菌株[8-19],如表1所示。研究发现,大多数仲烷基硫酸酯酶对(ω-1)-烷基硫酸酯的对映体选择性与烷基的大小有关,它的映体选择性(E值)范围为21到200[13]。在催化过程中,硫酸酯酶能够对映体选择性催化底物发生立体构型反转或立体构型保留,从而催化外消旋硫酸酯水解生成同手性或异手性混合产物(图1)。
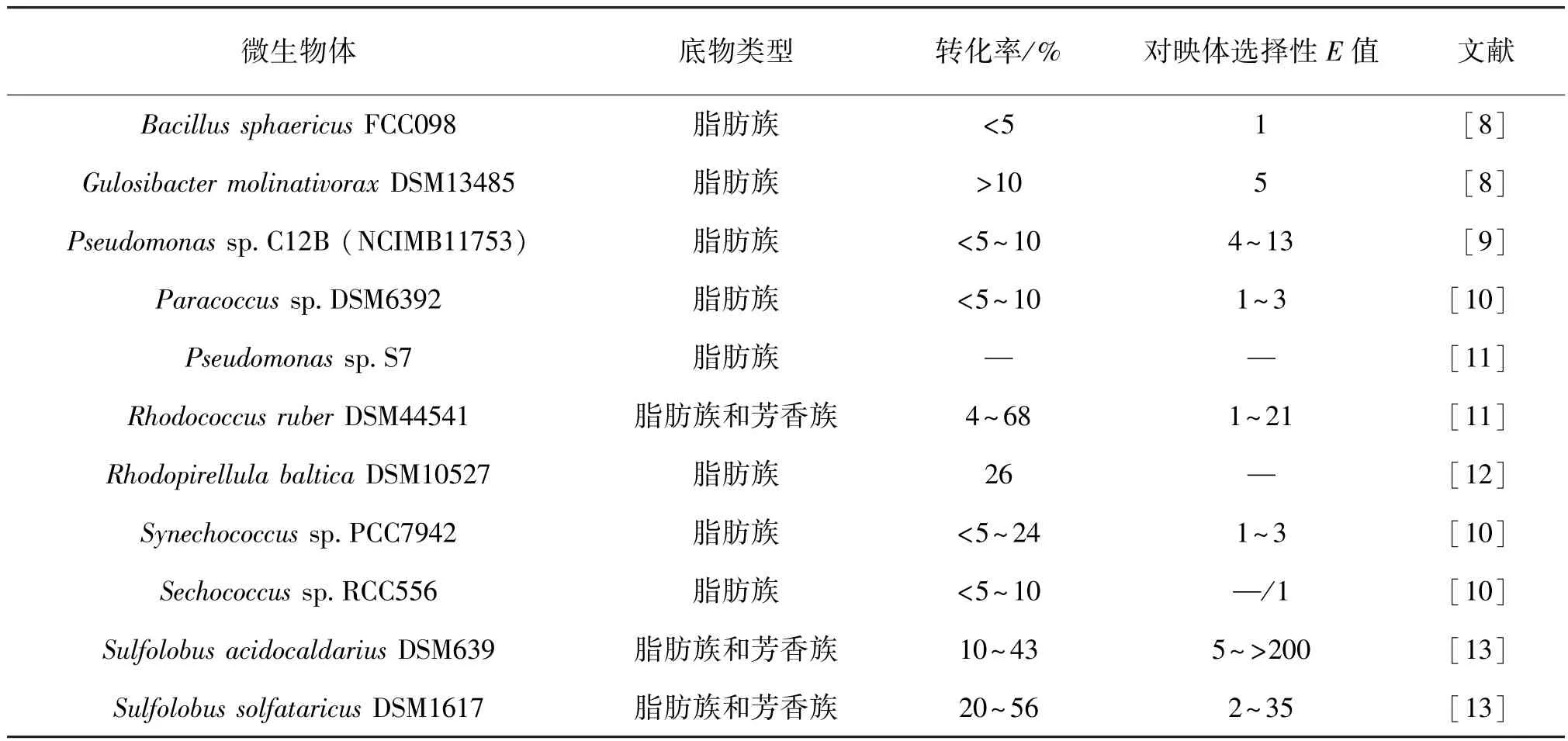
表1 立体和对映选择性烷基硫酸酯酶Table 1 Stereo-and enantioselectivities of microbial alkyl sulfatases
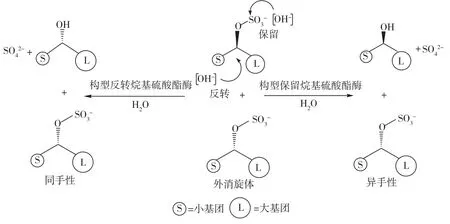
图1 生物催化外消旋仲烷基硫酸酯Fig.1 Biotransformation of rac-sec-alkyl sulfate esters
2 硫酸酯酶催化机制简介
迄今为止,对硫酸酯水解酶的研究主要集中在仲烷基硫酸酯的酶水解[14-18]:羟基负离子亲核进攻硫和碳使得S—O和C—O键被断开(图2)。进攻S原子断裂S—O键和进攻C原子断裂C—O键分别导致了底物的结构以碳原子为手性中心的保留和倒置反转。
催化裂解硫酸酯键的硫酸酯酶主要存在着以下的类型(图3):①真核芳基硫酸酯酶,这是目前研究最为透彻的一种硫酸酯酶,它的作用机制如图3(a)所示;②依赖Fe2+硫酸酯酶,属于能够氧化裂解硫酸酯为相应的醛和无机硫酸盐的双加氧酶(图3(b)),并且需要α-酮戊二酸作为电子受体。因为该反应伴随着碳手性中心的破坏,所以它对硫酸酯的生物转化的立体选择性是有限制的;③与金属-β -内酰胺有关的硫酸酯酶,活性中心需2个 Zn2+,Zn2+能够活化水分子形成OH-,进一步OH在底物上亲核攻击,从而形成无机硫酸盐和相应的醇(图3(c))。
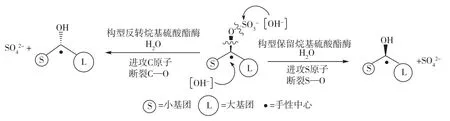
图2 酶催化水解烷基硫酸酯的立体化学途径Fig.2 Stereochemical pathways of enzymatic hydrolysis of alkyl sulfate esters

图3 可能的硫酸酯酶催化机制Fig.3 Possible catalytic mechanism of sulfatases
3 硫酸酯酶在生物转化中的应用
硫酸酯酶在生物转化的最早应用研究主要是利用它们对于烷基硫酸酯(例如,一些去污剂)的生物降解作用。首次发现烷基硫酸酯酶具有对映体选择性催化水解仲烷基硫酸酯的特性是偶然发现的。最近10年,人们才对仲烷基硫酸酯酶的立体和对映体选择性进行深入的研究[14]。硫酸酯酶在各生物进程中还有着关键的作用(例如,细胞信号传导、调节内分泌及发病机制),因此它们已经在生物医学研究领域做了深入的研究。这些是“生物医学技术”[15]的研究领域,本文不做深入探讨。
3.1 硫酸酯酶的扩大筛选
为了避免对于烷基硫酸酯酶选择性的低效和耗时的筛选,主要是在能代谢无机硫的微生物酶源中筛选硫酸酯酶。这些硫酸酯酶可催化包括所有的氧化态硫转化为硫酸盐,也可分解有机硫物质(如烷基硫酸盐)。许多硫酸酯酶菌株已筛选并应用于生物转化和生物降解。从洗涤剂污染的土壤中分离出的P.aeruginosa MTC 10311可在48 h内降解1.4 g十二烷基磺酸(SDS),并可在40℃条件下降解90%的表面活性剂[13]。菌株A.calcoaceticus和P.agglomerans可在 130 h完全降解 SDS[10]。Flavobacteriaceae sp.CZ1127对海参岩藻聚糖硫酸酯具有较好的活性,其硫酸酯酶活力可达 22.88 U/mL[9]。Sulfolobus acidocaldarius DSM639可转化直链和支链仲烷基硫酸酯,其对映体选择性E可高达200以上[13]。He等[19]首次利用Rhodococcus sp.CCZU10-1、Brevibacterium sp.CCZU12-1和Bacillus sp.CCZU11-1转化1,3-丙二醇环硫酸酯合成1,3-丙二醇,硫酸酯酶活力分别为4.8、1.6和1.3 U/g(干质量细胞)。
另外,从生物资源库中可以搜索出理想活性的硫酸酯酶。寻找这些酶的指导原则如下:与催化底物立体构型倒置的烷基硫酸酯酶相比,催化立体构型保留硫酸酯酶的催化机理及结构研究得较清晰[20],通过对从Pseudomonas aeruginosa和哺乳动物中获得的芳基硫酸酯酶A进行研究,几乎所有硫酸酯酶生成后都需经历一种翻译修饰后才能产生活性的过程,这个过程发生在硫酸酯酶多肽折叠成天然结构之前;若某种硫酸酯酶的翻译修饰出现异常,致使酶活性降低或缺乏,会造成各种硫酸酯酶的硫酸酯底物堆积在细胞溶酶体和其他细胞器中,损害细胞的正常功能,从而出现一系列复杂的临床表现[21],如芳基硫酸酯酶A被怀疑与人类乳腺癌的发病机制有关。在原酶中,一种丝氨酸或半胱氨酸残基的翻译后修饰提供1个醛基的Cα-甲酰甘氨酸。这种酶的催化循环从载入1个水分子开始,然后产生相应的醛水合物。作为一个强亲核试剂,后者对硫原子进行亲核进攻,它们的活性位点为二价金属离子Ca2+或Mg2+。因此,硫酸酯中S—O被破坏,并且其手性中心不受影响。虽然硫酸基团仍然是通过共价基团连接到催化水合醛基上,从而产生水解产物仲醇,并且其构型是不变的。硫酸氢从活性位点上消除后再生成醛基,然后催化循环停止(如图3(a))。
对于一固定硫酸酯酶的搜索主要可根据已知的硫酸酯酶作用机制即C/S-X-P-X-A-X4-T-G,这个机制可在哺乳动物以及低等真核生物和原核生物的硫酸酯酶中发现,但是Rhodococcus硫酸酯酶RS2的转化作用不遵循此机制。与基因组数据库的序列比较,发现在海洋菌属 Rhodopirellula baltica DSM10527中其在编码硫酸酯酶的基因含量是很高的[12]。研究表明,其静息细胞能够水解一系列的仲烷基硫酸酯,并且具有很高的对映体选择性(E>200),推测其具有严格的构型保留催化机制[22]。
尽管微生物来源的硫酸酯酶已经应用于手性醇的合成(表1),但是大部分硫酸酯酶主要作用于脂肪族的硫酸酯,芳香族硫酸酯酶源的扩大筛选及其用于芳香族手性醇的合成仍然是目前值得的研究工作。
3.2 纯化的硫酸酯酶的生物转化
与已报道的全细胞催化相比,只有极少的纯化烷基硫酸酯酶被证实其对于烷基硫酸酯有良好的底物耐受性(表2)。然而,利用全细胞催化表现出了较为低的对映体选择性,这可能主要由于全细胞中含有多种不同(或相反)对映选择性的烷基硫酸酯酶。利用纯化的硫酸酯酶可实现较为优秀的对映选择性。从纯化酶的来源来看,大部分分离纯化出的硫酸酯酶来自于原核生物,只有少数例外,例如Helix pomatia芳基硫酸酯酶[23]。但是,未发现有从古细菌中分离纯化硫酸酯酶的报道,尽管古细菌很可能对于烷基硫酸酯具有较高的催化活性[24]。大多数纯化硫酸酯酶是源自于变形细菌门,像Pisa1、PAS、SdsA1、Pseudomonas S1-3(NCIB11753)和SdsAP等硫酸酯酶有着很高的E 值 和 活 性。 Comamonasterrigena CS1 和Comamonas terrigena S2硫酸酯酶还可水解一些仲烷基硫酸酯,然而没有关于其具体E值的报道[25]。Coryneform sp.B1a硫酸酯酶对于碳链长度3~7个碳原子的伯烷基硫酸酯具有一定的活性。Aerobacter aerogenes ATCC 9621和 Helix pomatia硫酸酯酶底物谱较窄,它们仅仅对伯烷基硫酸酯酶表现 出 了 一 定 的 活 性[26]。Rhodococcus ruber DSM44541硫酸酯酶RS2是一种单体可溶性蛋白,在催化过程中无需辅助因子或金属离子的辅助参与,它的相对分子质量为4.3×104kDa。在催化反应过程中,RS2严格对映体选择地催化底物发生立体构型倒置。仲烷基硫酸酯酶对映选择性的高低范围是不同的。当催化外消旋2-辛基硫酸酯水解时,其对映选择率E值可达21。与全细胞相比,纯化酶的成本较高,但是其良好的对映选择性和催化特性,仍然在合成高附加值的手性醇方面具有潜在的应用价值。

表2 纯化硫酸酯酶的底物范围、活性和对映体选择性Table 2 Substrate scope,activities and enantioselectivities for purified sulfatases
3.3 外消旋sec-硫酸酯的化学-酶法去消旋化
化学-酶法组合催化也应用于去消旋化sec-硫酸酯的研究,如图4所示。第一步,外消旋仲醇硫酸酯的动力学拆分,然后通过Rhodococcus反转硫酸酯酶RS2催化,在生物水解过程中形成了同手性的仲醇以及未反应完的硫酸酯混合物;第二步,混合物利用叔甲基丁基醚、二烷和对甲苯磺酸的混合物进行处理,催化未转化的硫酸酯以保持原构型进行水解。通过以上步骤使得水解产物为单一立体构型的仲醇作为唯一的水解产物[6]。可见,外消旋sec-硫酸酯的化学-酶法去消旋化可实现手性醇的高效合成。

图4 化学-酶法去消旋化仲烷基硫酸酯Fig.4 Deracemization of rac-sec-alkyl sulfate esters using bio-and chemo-hydrolysis
3.4 硫酸酯酶选择性的强化
当使用全细胞或者纯化酶催化硫酸酯时,其对映体选择性经常会有一些不足,这主要是由于多种不同硫酸酯酶立体选择性的相互竞争或抑制作用。因此,研究人员研究了一些方法以解决硫酸酯酶在催化过程中所遇到的这些问题。例如,各种添加剂对酶对映体选择性的影响主要表现在促进剂或对映选择性抑制剂方面,这是众所周知的烷基硫酸酯酶手性识别调节因子[16]。研究发现聚合物、非离子洗涤剂以及多羟基化合物对于烷基硫酸酯酶的对映选择性的影响不明显。然而,离子型去污剂(例如,十六烷基三甲基溴化铵)对其表现出了较显著的影响。有机助溶剂可提高全细胞和纯化酶等生物催化剂 的 选择 性。对 于从 Pseudomonas sp.DSM6611纯化得到的硫酸酯酶Pisa1,在一个较广泛的范围内进行了极性和非极性有机溶剂的选择研究,发现二甲基亚砜(DMSO)可抑制含有活性烯丙基和苄基官能团的硫酸酯的水解。加入助溶剂DMSO后,硫酸酯酶Pisa1的选择性明显增加。在蓝藻全细胞催化中加入有机助溶剂,其对映体选择性也有了较为明显的提高,例如 Synechococcus elongatus PCC7942 和 Paracoccus denitrificans DSM6392可选择类似甲醇和乙醇等低碳醇作为有机助溶剂。加入低碳醇助溶剂后,尽管这2种菌株的转化成本有所提高,但是它们的E值可以提高到200 以上[10]。 在叔丁醇-水两相体系中,P.denitrificans DSM 6392催化获得的产物e.e.值>99%[10]。研究发现,几种烷基和芳基硫酸酯酶的催化反应依赖于金属离子。例如P.Aeruginosa芳基硫酸酯酶PAS主要依赖于Ca2+,引导酶与带负电荷的底物正确的结合[19],Pseudomonas sp.DSM6611烷基硫酸酯酶Pisa 1需要2个Zn2+激活水,从而为硫酸酯酶催化水解反应提供一个良好的亲核试剂[OH-]。Fe2+和Fe3+对Rhodococcus ruber DSM44541硫酸酯酶RS2的对映体选择性具有显著的影响,当加入5 mmol/L的FeCl3时,其对映体选择性从3.6提高到了200以上[17]。因为选择性的增加通常会使活性降低,所以这种选择性强化的技术并不适合大规模的生产[14]。
3.5 硫酸酯酶的固定化
生物催化制剂的可回收以及可重复利用的特性使其在工业上有着广阔的应用前景。目前固定化硫酸酯酶的研究较少。Thomas等[9]首次利用聚丙烯酰胺微球固定Pseudomonas C12B细胞,经研究发现固定化后的细胞对伯烷基硫酸酯盐的活性与游离酶相近。固定化后的细胞可在48 h内将硫酸酯盐催化水解完全,并且其经过13次的使用后仍然保留着13%的活性。He等[19]利用海藻酸钙固定化Rhodococcus sp.细胞转化1,2-和1,3-丙二醇环硫酸酯,固定化催化剂操作192 h,可合成高产率的(R)-1,2-丙二醇(e.e.>99%)和1,3-丙二醇。进一步研究发现,可以利用固定化的 Pseudomonas C12B和Comamonas terrigena N3H作为污水处理厂的生物膜[27]。C.terrigena N3H对SDS并没有表现出活性,但是Pseudomonas C12B作为众所周知的SDS降解器,其在固定化的形态下依然能够水解表面活性剂[27]。利用DEAE-和Ecteola-纤维素固定化Rhodococcus ruber DSM44541 RS2的粗酶,其残留活性分别约为100%和22%[17]。采用合适的固定化载体开发新型的硫酸酯酶固定化技术是值得研究的方向。由于烷基硫酸酯酶对底物构型的反转或者保留作用机制的发现[28-31],具有同样作用机制的酶很快被人们在其他的微生物中发现。
4 结语
在未来,可以有望利用转基因技术来大量表达产生一系列的重组硫酸酯酶,大规模用于催化各种硫酸酯发生去消旋化,产生相应的仲醇。另外,对环硫酸酯的酶法对映选择性水解也是目前研究的热点。可以预期,硫酸酯酶在生物转化中具有广阔的工业应用前景。
[1]何玉财,许建和.腈水解酶在羧酸合成中的研究进展[J].生物加工过程,2009,7(1):7-12.
[2]郁惠蕾,黄磊,倪燕,等.羰基生物还原法合成手性醇的研究进展[J].生物加工过程,2013,11(3):71-82.
[3]许建和,谢谚,赵丽丽,等.工业生物催化前线动态及名家观点[J].生物加工过程,2007,5(1):1-8.
[4]刘湘,潘争光,许建和.手性芳基邻二醇的不对称合成[J].化学进展,2011,23(5):903-913.
[5]Orru R V,Archelas A,Furstoss R,et al.Epoxide hydrolases and their synthetic applications[J].Adv Biochem Eng Biotechnol,1999,63:145-167.
[6]Wallner S R,Pogoreve M,Trauthwein H,et al.Biocatalytic enantioconvergent preparation of sec-alcohols using sulfatases[J]. Eng Life Sci,2004,4(6):512-516.
[7]Hagelueken G,Adams T M,Wiehlmann L,et al.The crystal structure of SdsAl,an alkylsulfatase from Pseudomonas aeruginosa,defines a third class of sulfarases[J].Proc Natl Acad Sci USA,2006,103(20):7631-7636.
[8]Gadler P,Faber K.Highly enantioselective biohydrolysis of secalkyl sulfate esters with inversion of configuration catalysed by Pseudomonas spp[J].Eur J Org Chem,2007,33:5527-5530.
[9]Thomas O R T,White G F.Immobilization of the surfactant degrading bacterium Pseudomonas C12B in polyacrylamide gel:III.biodegradation specificity for raw surfactants and industrial wastes[J].Enzyme Microb Technol,1991,13:338-343.
[10]Gadler P,Reiter T C,Hoelsch K,et al.Enantiocomplementary inverting sec-alkylsulfatase activity in cyano-and thio-bacteria Synechococcus and Paracoccus spp.:selectivity enhancement by medium engineering[J].Tetrahedron Asymmetry,2009,20:115-118.
[11]Yeldho D,Rebello S,Jisha M S.Plasmid-mediated biodegradation of the anionic surfactant sodium dodecyl sulphate by Pseudomonas aeruginosa S7[J].Bull Environ Contam Toxicol,2011,86:110-113.
[12]Glockner F O,Kube M,Bauer M,et al.Complete genome sequence of the marine planctomycete Pirellula sp.strain 1[J]. Proc Natl Acad Sci USA,2003,100(14):8298-8303.
[13]Wallner S R,Nestl B M,Faber K.Highly enantioselective stereoinverting secalkylsulfatase activity of hyperthermophilic Archaea[J].Org Biomol Chem,2005,3(14):2652-2656.
[14]Pogorevc M,Kroutil W,Wallner S R,et al.Enantioselective stereoinversion in the kinetic resolution of rac-sec-alkyl sulfate esters by hydrolysis with an alkylsulfatase from Rhodococcus ruber DSM44541 furnishes homochiral products[J].Angew Chem Int Ed,2002,41(21):4052-4054.
[15]Hanson S R,Best M D,Wong C H.Sulfatases:structure,mechanism,biologicaI activity,inhibition,and synthetic utility[J].Angew Chem Int Ed,2004,43(43):5736-5763.
[16]Faber S K,Ottolina G,Riva S.Selectivity-enhancement of hydrolase reactions[J].Biocatal Biotransform,1993,8(2):91-132.
[17]Pogorevc M,StraussU T,RiermeierT,etal.Selectivityenhancement in enantioselective hydrolysis of sec-alkyl sulfates by an alkyl sulfatase from Rhodococcus ruber DSM44541[J]. Tetrahedron Asymmetry,2002,13(13):1443-1447.
[18]Pogorevc M,Faber K.Enantioselective stereoinversion of sec-alkyl sulfates by an alkylsulfatase from Rhodococcus ruber DSM44541[J].Tetrahedron Asymmetry,2002,13(13):1435-1441.
[19]He Y C,Tao Z C,Zhang D P,et al.Biotransformation of 1,3-propanediol cyclic sulfate and itsderivativesto diols by Rhodococcus sp.[J].Biotechnol Lett,2014,DOI:10.1007/ s10529-014-1670-7
[20]Boltes I,Czapinska H,Kahnert A,et a1.1.3 A structure of arylsulfatase from Pseudomonas aeruginosa establishes the catalytic mechanism of sulfate ester cleavage in the sulfatase family[J].Structure,2001,9(6):483-491.
[21]孟岩,黄尚志,魏珉.多种硫酸酯酶缺乏症研究进展[J].医学研究杂志,2006,35(6):68-69.
[22]WallnerS R,Bauer M,Wurdemann C,etal.Highly enantioselective sec-alkyl sulfatase activity of the marine planctomycete Rhodopirellula baltica shows retention of configuration[J].Angew Chem Int Ed,2005,44(39):6381-6384.
[23]Thies W.Detection and utilization of a glucosinolate sulfohydrolase in the edible snail,Helix pomatia[J].Naturwissenschaften,1979,66(7):364-365.
[24]Wallner S R,Nestl B M,Faber K,et al.Highly enantioselective sec-alkylsulfatase activity of Sulfolobus acidocaldarius DSM639[J].Org Lett,2004,6(26):5009-5010.
[25]Barrett C H,Dodgson K S,White G F,et al.Further studies on the substrate specificity and inhibition of the stereospecific CS2 secondary alkylsulphohydrolase of Comamonas terrigena[J]. Biochem J,1980,191:467-473.
[26]Schrödinger,LLC.Schrödinger Release 2013-1[M].Maestro,version 9.4.New York:Schrödinger LLC,2013.
[27]Roig M G,Pedraz M A,Sanchez J M.Sorption isotherms and kinetics in the primary biodegradation of anionic surfactants by immobilized bacteria:I.Pseudomonas C12B[J].J Mol Catal B:Enzym,1998,4(5/6):253-270.
[28]Schober M,Toesch M,Knaus T,et al.One-pot deracemization of sec-alcohols: enantioconvergent enzymatic hydrolysis of alkylsulfates using stereocomplementary sulfatases[J].Angew Chem Int Ed,2013,52:3277-3279.
[29]Schober M,Knaus T,Toesch M,et al.The substrate spectrum of the inverting sec-alkylsulfatase pisa1[J].Adv Synth Catal,2012,354:1737-1742.
[30]Gadler,P,FaberK.New enzymes forbiotransformations:microbial alkyl sulfatases displaying stereo-and enantioselectivity[J].Trends Biotechnol,2007,25(2):83-88.
[31]吕吉祥,吴小飞,刘均洪.微生物中的烷基硫酸酯酶在生物转化中的应用研究进展[J].化学工业与工程技术,2007,28(4):16-22.
(责任编辑 荀志金)
Progress in microbial sulfatases:source,catalytic mechanism and application
ZHANG Danping,HE Yucai
(Laboratory of Biochemical Engineering,College of Pharmaceutical and Life Sciences,Changzhou University,Changzhou 213164,China)
Chiral alcohols are key intermediates in the synthesis of pharmaceutical,agrochemical,and other fine chemicals.Sulfatase can catalyze the hydrolytic cleavage of sulfate esters by liberating inorganic sulfate and the corresponding secondary alcohol.In this review,microbial sources,catalytic mechanisms,and applications of sulfatase were summarized.Moreover,methods for improving catalytic stability by immobilization and enhancing selectivity by addition of metal ions or organic cosolvents were introduced.
sulfatases;chiral secondary alcohol;biotransformation;selectivity
Q93;X703
A
1672-3678(2015)01-0106-07
10.3969/j.issn.1672-3678.2015.01.018
2014-07-08
国家自然科学基金(21102011);江苏省自然科学基金(BK20141172);常州市生物医药科技专项(CE20115051)
张丹平(1990—),男,江苏徐州人,硕士研究生,研究方向:生物催化;何玉财(联系人),副教授,E-mail:heyucai2001@163.com

