过表达miR-199-3p/5p诱导胰腺癌细胞BxPC-3、Panc-1铁死亡的作用机制
黎文涛, 伍小琼, 冯志鹏, 王正根
1.南华大学衡阳医学院附属第二医院消化内科,湖南衡阳 421001;2.湖南师范大学附属岳阳医院消化内科,湖南岳阳 414000
胰腺癌(pancreatic adenocarcinoma,PAAD)是恶性程度极高的肿瘤[1]。作为预后极差的消化系统肿瘤,胰腺癌具有早期诊断困难、手术切除率低、术后易复发、易转移等临床特点,总体5年生存率不足8%,临床诊治极具挑战性[2]。铁死亡是一种铁依赖性的脂质过氧化、活性氧过量产生所致的细胞死亡类型。目前研究发现,铁死亡参与了胰腺癌的发生发展过程[3]。
微小RNA(microRNA,miRNA)是一类内源性非编码RNA,广泛参与基因转录后调控活动,通过调控靶基因表达,参与肿瘤的发生发展,并参与铁死亡的调控[4]。本研究探讨miR-199过表达对胰腺癌细胞BxPC-3和Panc-1铁死亡的作用及其调控机制。
1 材料和方法
1.1 材料与试剂
人胰腺癌细胞株BxPC-3和Panc-1(中国科学院上海生命科学院生化细胞所),转染试剂Lipofectamine 2000(Invitrogen,美国),DMEM培养基(Sigma,美国),双荧光素酶活性检测试剂盒(Qiagen,美国),TRIzol荧光定量PCR仪(Thermo Fisher Scientific,美国),miRNA反转录试剂盒、UltraSYBR Mixture、DM2000 Plus DNA Marker(康为世纪,中国),谷胱甘肽(glutathione,GSH)(北京索莱宝,中国),脂质过氧化物(lipid peroxidation,LPO)(武汉伊莱瑞特,中国),Fe2+比色法检测试剂盒(广州沛瑜,中国),荧光素酶报告载体野生型(wild type,WT)-SLC7A11、突变型(mutant type,MT)-SLC7A11、WT-BTRC、MT-BTRC由上海吉玛基因公司构建。0.45 μm过滤膜(Millipore,美国),多功能酶标分析仪(汇松,中国),电泳仪(六一,中国),SCL7A11多克隆抗体(SAB#43437,美国),BTRC多克隆抗体(SAB#32369,美国),TFRC多克隆抗体(SAB#33101,美国),泛素化Ubiquitin多克隆抗体(武汉三鹰#10201-2-AP,中国),β-actin单克隆内参抗体(abcam#ab8226,美国),hsa-miR-199-3p模拟物(5′-ACAGUAGUCUGCACAUUGGUUA-3′)、hsa-miR-199-3p抑制物(5′-UAACCAAUGUGCAGACUACUGU-3′)、hsa-miR-199-5p模拟物(5′-CCCAGUGUUUAGACUAUCUGUUC-3′)、hsa-miR-199-5p抑制物(5′-GAACAGAUAGUCUAAACACUGGG-3′)(上海吉玛基因,中国)。
1.2 细胞培养及瞬时转染miR-199模拟物和抑制物
将细胞1×105个/mL接种于培养瓶中,加入10%血清的DMEM培养基,放置于37 ℃、5%CO2饱和湿度的细胞培养箱内培养。细胞进入对数生长期后,0.25%胰蛋白酶消化2~3 min,PBS洗涤细胞2次,再传代培养。加入转染试剂Lipofectamine 2000转染48 h后进行后续实验。胰腺癌细胞Panc-1和BxPC3实验分为对照组、miR-199-3p/5p模拟物组、miR-199-3p/5p抑制物组。
1.3 qRT-PCR检测miR-199-3p/5p的表达水平
收集细胞,用300 μL TRIzol裂解液提取总RNA。加入氯仿12 000 g,10 min低温离心。取氯仿层加入等量的异丙醇过夜沉淀。10 min低温离心,去除上清,用优级乙醇清洗沉淀。晾干后复溶,紫外分光光度计Nanodrop One检测总RNA的含量和纯度;按照High-Capacity cDNA反转录试剂盒说明书,反转录合成cDNA;依据SYBR Green试剂盒的说明书进行PCR扩增,以U6为内参,检测各样本中基因的表达水平,通过2-ΔΔCT方法计算各基因的相对含量。hsa-miR-199-3p上游引物为5′-ACACTCCAGCTGGGACAGTAGTCTGCACAT-3′,下游引物为5′-CTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGTAACCAAT-3′;hsa-miR-199-5p上游引物为5′-ACACTCCAGCTGGGCCCAGTGTTTAGACTAT-3′,下游引物为5′-CTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGGAACAGAT-3′;U6上游引物为5′-CTCGCTTCGGCAGCACA-3′,下游引物为5′-AACGCTTCACGAATTTGCGT-3′。
1.4 Western blotting检测蛋白水平
收集细胞,加入500 μL RIPA蛋白裂解液,12 000 g离心8 min,取上清液,用BCA蛋白试剂盒对样品中总蛋白质进行定量。加入适量蛋白上样缓冲液,放置于100 ℃干式恒温仪加热8 min,使蛋白充分变性,置于-80 ℃冰箱保存备用。运用SDS-PAGE凝胶电泳方法分离蛋白质样品,将其转移到PVDF膜上,4 ℃过夜孵育一抗,用辣根过氧化物酶标记法检测SLCTA11、BTRC、TFRC蛋白质表达水平。扫描后应用ImageJ软件分析目标条带的灰度值。
1.5 试剂盒检测胰腺癌细胞中GSH、Fe2+、LPO水平
收集细胞,加入裂解液裂解细胞,离心取上清备用。分别参照GSH、Fe2+、LPO检测试剂盒说明书进行样品溶液的配制及检测。
1.6 免疫共沉淀检测BTRC对TFRC泛素化的调节
在Panc-1和BxPC3细胞中分别转染过表达的BTRC(OE-BTRC组:NM_033637.4→Homo sapiens,Gene ID:8945,CDS:17—1834,1818 bp)和敲除的BTRC(KD-BTRC组,siRNA:5′-CCCAGGGACUGGCGCACUCdTdT-3′),对照组细胞不做任何处理。48 h后收集细胞,加入适量含蛋白酶抑制剂的细胞裂解缓冲液,冰上裂解30 min,离心30 min后取上清;加入1 μg相应的TFRC抗体,缓慢摇晃后4 ℃孵育过夜。取10 μL蛋白A琼脂糖珠,用适量裂解缓冲液洗3次,每次3 000 r/min离心3 min预处理,加入到和TFRC抗体孵育过夜的细胞裂解液中,缓慢摇晃后4 ℃孵育4 h,使TFRC抗体与蛋白A琼脂糖珠偶连。免疫沉淀IP反应后,在4 ℃环境下以3 000 r/min离心3 min,将琼脂糖珠离心至管底;将上清小心吸去,琼脂糖珠用1 mL裂解缓冲液洗4次后进行Western blotting相关检测(同时设置Input阳性对照组,即用IP前的样品做Western blotting排除假阳性干扰)。
1.7 荧光素酶活性检测miR-199-3p/5p与靶基因的相互作用
质粒转染培养48 h后加入细胞裂解液,室温下裂解15 min,移液枪反复吹打,吸取裂解产物至1.5 mL离心管中,14 000 g离心15 min,取上清。小心吸取20 μL细胞裂解上清(用细胞裂解液补至100 μL),与10 μL荧光素酶检测工作液迅速混匀,使用酶标仪检测双荧光素酶报告基因活性。
PAAD细胞Panc-1、BxPC3分为阴性对照组(WT/MT空报告质粒)、miR-199-3p/5p模拟物+WT/MT组(WT/MT SLC7A11-3UTR荧光素酶报告质粒或WT/MT BTRC-3UTR荧光素酶报告质粒,miR-199-3p模拟物对应加入SLC7A11-3UTR,miR-199-5p模拟物对应加入BTRC-3UTR)。
1.8 统计学分析
采用SPSS 12.0软件进行统计处理。计数资料采用方差分析,计量资料采用t检验。P<0.05为差异有显著性。
2 结 果
2.1 miR-199-3p/5p在胰腺癌Panc-1和BxPC3细胞中的表达水平
与对照组比较,miR-199-3p/5p模拟物组miR-199-3p和miR-199-5p的基因表达水平均显著上调,抑制物组显著降低(P<0.05;图1),提示转染成功。

图1 miR-199-3p/5p在胰腺癌Panc-1和BxPC3细胞中的表达水平a为P<0.05,与对照组比较。
2.2 miR-199-3p/5p调控胰腺癌细胞铁死亡GSH、Fe2+、LPO水平
与对照组比较,miR-199-3p/5p模拟物组GSH水平降低,Fe2+、LPO水平升高;抑制物组各指标则相反(P<0.05;图2)。
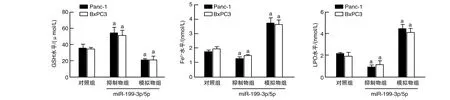
图2 miR-199-3p/5p调控胰腺癌细胞铁死亡相关GSH、Fe2+、LPO水平a为P<0.05,与对照组比较。
2.3 miR-199-3p/5p调控胰腺癌细胞铁死亡相关信号通路SLC7A11、BTRC、TFRC蛋白水平
与对照组比较,miR-199-3p/5p模拟物组SLC7A11、BTRC蛋白水平降低,TFRC蛋白水平升高;miR-199-3p/5p抑制物组则相反(P<0.05;图3)。

图3 miR-199-3p/5p调控胰腺癌细胞铁死亡相关信号通路SLC7A11、BTRC、TFRC蛋白水平a为P<0.05,与对照组比较。
2.4 BTRC调控TFRC泛素化水平
与对照组比较,Input中,OE-BTRC组BTRC蛋白水平显著上调,而KD-BTRC组BTRC蛋白水平显著降低,提示质粒构建和转染成功。OE-BTRC组显著降低TFRC蛋白水平,而KD-BTRC组提高TFRC本身蛋白水平。TFRC抗体IP沉淀后Western blotting检测Ubiquitin,OE-BTRC组能够显著降低TFRC蛋白泛素化水平,KD-BTRC组则提高TFRC蛋白泛素化水平(P<0.05;图4)。

图4 BTRC调控TFRC泛素化水平1为对照组;2为OE-BTRC组;3为KD-BTRC组。a为P<0.05,与对照组比较。
2.5 双荧光素酶报告结果
miR-199-3p与SLC7A1靶向结合,miR-199-5p与BTRC靶向结合(P<0.05;图5A)。与阴性对照组比较,miR-199-3p模拟物+WT-SLC7A11组荧光素酶活性明显降低(P<0.05);miR-199-5p模拟物+WT-BTRC组荧光素酶活性明显降低(P<0.05;图5B)。
3 讨 论
miRNA与特定靶mRNA的3′-非翻译区结合,在转录后调节多个基因的表达[5-6]。目前,miR-199a已被证明能抑制多种肿瘤生长,包括食管癌、肝癌和结直肠癌[7-9]。然而,关于miR-199对胰腺癌的调控作用仍未见报道。
本研究发现,胰腺癌细胞转染miR-199模拟物和抑制物结果表明,miR-199模拟物具有抗胰腺癌作用,其机制与诱导胰腺癌细胞发生铁死亡有关。另外,BTRC能调控TFRC的蛋白泛素化水平,抑制BTRC的表达能够诱导TFRC的蛋白泛素化降解,提高TFRC本身蛋白水平。
迄今为止,报道的miR-199a下游靶基因包括癌基因PHLPP1、E2F3、FZD6/7、HK2和MAP3K11,在各种癌症的发病机制中起作用[10]。SLC7A11是诱导细胞铁死亡的关键蛋白[11]。SLC7A11和SLC3A2是胱氨酸/谷氨酸逆向转运体(System Xc-)的重要组成部分,其在肿瘤细胞系集中表达,表明这些细胞中的System Xc-活性可能更高。Huang等[12]利用寡核苷酸芯片发现,9株肺癌细胞株中,A549、HOP-62、NCI-H226、NCI-H322M和NCI-H460这5株细胞中SLC7A11呈高表达;其中A549中SLC7A11和SLC3A2表达量最高。miR-199分为3p和5p,在本研究中,过表达miR-199-3p靶向抑制SLC7A11的表达,可能进一步通过抑制半胱氨酸转运进入细胞合成GSH,GSH是GPX4降解LPO的必需反应底物,当GSH合成通路受抑时,LPO积累,铁死亡发生[13]。此外,miR-199-5p靶向抑制BTRC诱导TFRC的泛素化降解,从而提升细胞内铁离子水平,促进LPO在胰腺癌细胞中的堆积,诱发胰腺癌细胞铁死亡。本实验采用双荧光素酶报告实验验证了miR-199与靶基因的相互作用。
综上所述,本实验首先用胰腺癌细胞转染miR-199模拟物和抑制物,结合生信分子生物学预测证实,miR-199-3p靶向抑制胰腺癌细胞中SLC7A11,进而降低GPX4表达和GSH水平;同时miR-199-5p靶向抑制胰腺癌细胞中BTRC,则能提高TFRC表达和Fe2+水平;两条信号通路最终均可促进LPO累积,诱导胰腺癌细胞发生铁死亡。

