黄芩苷通过激活JNK/p38 MAPK通路诱导ALL Reh细胞凋亡
肖李, 王广, 练高建, 李程悦, 龚慧芳, 王俊涵, 苏泽红
南华大学衡阳医学院 1.生物化学与分子生物学研究所,2.实验动物学部,湖南衡阳 421001
急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)是导致儿童死亡的常见恶性肿瘤之一,其治疗主要采用诱导肿瘤细胞凋亡。细胞凋亡也称为细胞程序性死亡,凋亡时其信号汇集在细胞线粒体膜上,使膜表面促凋亡蛋白Bax发生构象改变而被激活,活化的Bax促使线粒体膜结构与功能发生改变,线粒体内可溶性血红素蛋白细胞色素C、核酸内切酶G、活性氧(reactive oxygen species,ROS)及其他线粒体膜间隙蛋白被释放至胞质,激活下游Caspase-3、Caspase-7,从而引发细胞凋亡[1]。因此维持线粒体膜功能(mitochondrial membrane function,MMP)是抑制细胞凋亡的重要途径。c-Jun氨基蛋白激酶(c-Jun N-terminal kinase,JNK)和p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase,p38 MAPK)通路是丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)信号家族通路中两条至关重要的通路。MAPK通路调控细胞生长、增殖、分化、应激、迁移和死亡[2]。黄芩苷是中草药黄芩根部的多酚提取物,具有抗氧化、抗增殖及抗肿瘤等多种生物活性[3],但其对于ALL Reh细胞增殖和凋亡的影响及其分子机制尚未可知,基于此,本文对此进行了研究,旨在为黄芩苷应用于ALL临床治疗提供一定的理论参考。
1 材料和方法
1.1 主要试剂、仪器和细胞
黄芩苷购自索莱宝公司(Solarbio);AnnexinV-FITC/PI凋亡检测试剂盒和线粒体膜定位检测试剂盒(JC-1)购自江苏凯基生物公司;ROS检测试剂盒、一步法TUNEL凋亡检测试剂盒和细胞核DAPI染色液购自上海碧云天生物技术公司;多功能细胞成像仪购自美国BioTek公司;流式细胞仪购自美国BD公司;化学发光成像系统购自上海天能科技有限公司;高速冷冻离心机和EVOSTMM5000成像系统购自美国Thermo Fisher Scientific公司。
ALL细胞株Reh购自ATCC细胞库,Reh细胞株在RPMI1640培养基(含10%及1%青-链霉素双抗)37 ℃、5%CO2培养。
1.2 MTS法测定Reh细胞增殖
将Reh细胞以3×104个/孔接种于96孔细胞培养板培养24 h,用10、20、40、60、80、100 mg/L黄芩苷处理细胞,将细胞与20 μL MTS溶液共孵育4 h,490 nm波长处测定每孔光密度(optical density,OD),计算细胞存活率。设立对照组(Reh细胞)和DMSO组(0.1%DMSO+Reh细胞)。
1.3 流式细胞术和免疫荧光TUNEL染色法检测细胞凋亡
将Reh细胞以5×105个/孔接种于12孔细胞培养板中培养24 h,用20、40 mg/L黄芩苷处理细胞,收集细胞。重悬浮细胞沉淀后,依次加入Annexin V-FITC和PI染色液,流式细胞仪测定细胞凋亡情况。免疫染色固定液固定后,TUNEL染色液染色1.5~2.0 h;DAPI染色液染色5 min后,成像系统观察细胞凋亡情况。设立对照组(Reh细胞)。
1.4 DCFH-DA荧光探针检测细胞内ROS
将Reh细胞以5×105个/孔接种于12孔细胞培养板中培养24 h,用20、40 mg/L黄芩苷、20 mg/L黄芩苷+5 mmol/L NAC、40 mg/L黄芩苷+5 mmol/L NAC处理细胞,收获细胞。按照碧云天活性氧ROS检测试剂盒说明书稀释DCFH-DA探针,染色,流式细胞仪测定细胞内ROS水平。设立对照组(Reh细胞)。
1.5 JC-1荧光探针检测细胞内MMP
同1.4分组,收获细胞,加入JC-1染色工作液孵育染色后,流式细胞仪检测细胞内MMP。
1.6 Western blotting检测蛋白水平
将Reh细胞以1×106/孔接种于12孔细胞培养板中培养24 h,用20、40 mg/L黄芩苷、5 mmol/L NAC、40 mg/L黄芩苷+5 mmol/L NAC处理细胞,RIPA buffer裂解细胞,提取总蛋白,SDS-PAGE电泳分离蛋白条带后转膜,一抗4 ℃孵育过夜,二抗室温孵育1 h,化学发光成像系统显色。设立对照组(Reh细胞)。
1.7 统计分析

2 结 果
2.1 黄芩苷对Reh细胞增殖的影响
黄芩苷处理Reh细胞后能显著抑制细胞增殖,IC50为20 mg/L(P<0.01;图1)。后续实验均选择20、40 mg/L作为黄芩苷干预质量浓度。
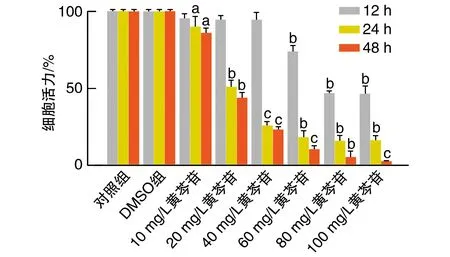
图1 黄芩苷对Reh细胞增殖的影响a为P<0.05,b为P<0.01,c为P<0.001,与对照组比较。
2.2 黄芩苷诱导Reh细胞凋亡
黄芩苷处理Reh细胞24 h后,20 mg/L和40 mg/L黄芩苷组细胞凋亡率分别为32.1%和85.53%。镜下观察经黄芩苷处理后,凋亡的Reh细胞数量明显增多,细胞膜皱缩变形,核内染色质凝聚,细胞核碎裂(图2A);细胞内抗凋亡蛋白Bcl-2和Survivin蛋白表达显著降低,而促凋亡蛋白Bax、Cleaved-Caspase-3/7及Cleaved-多聚ADP-核糖聚合酶(poly ADP-ribose polymerase,PARP)表达显著升高(P<0.05,P<0.01;图2B)。以上提示,黄芩苷诱导Reh细胞凋亡。
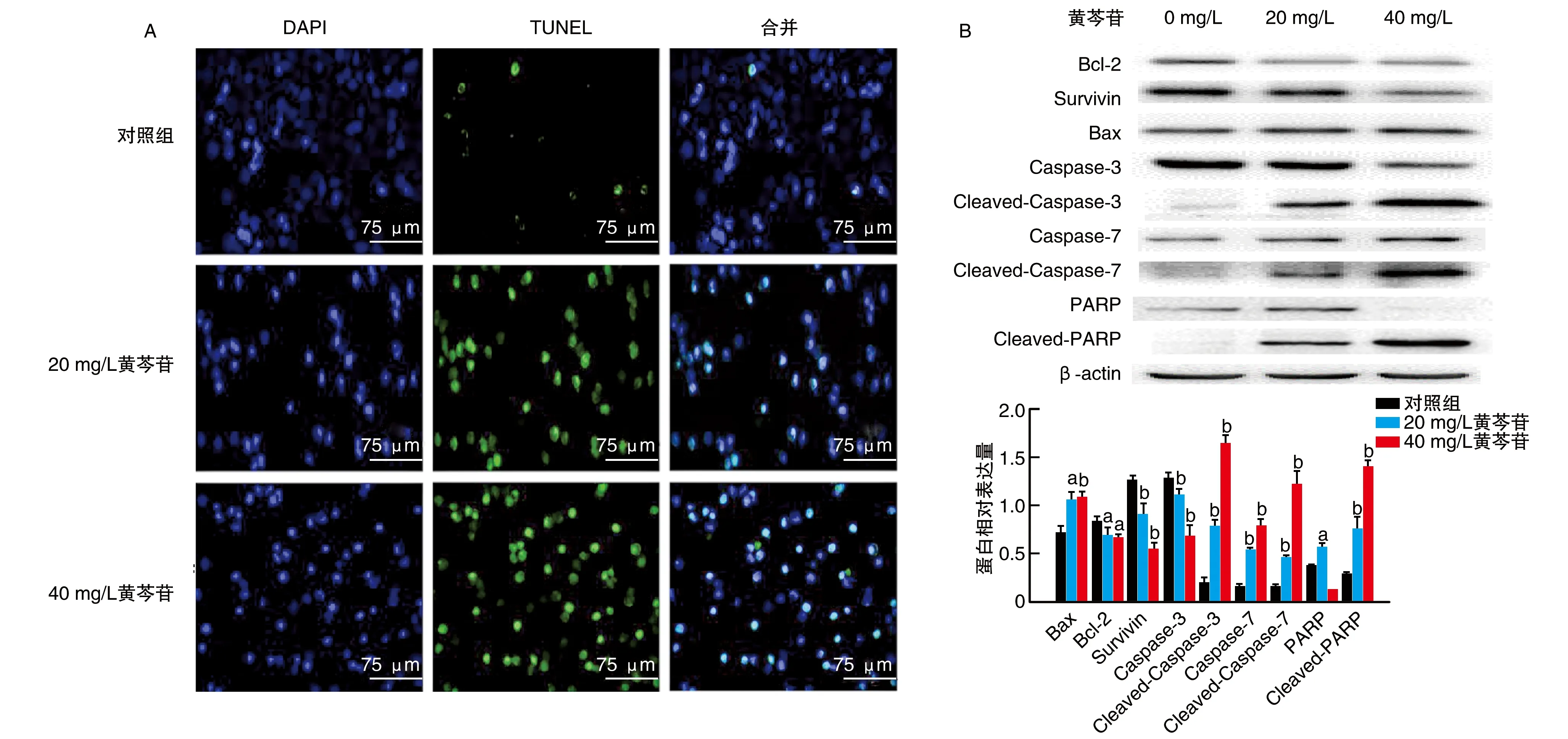
图2 黄芩苷诱导Reh细胞凋亡A为TUNEL染色结果; B为Western blotting结果。a为P<0.05,b为P<0.01,与对照组比较。
2.3 黄芩苷通过损伤MMP升高胞内ROS水平,从而诱导Reh细胞凋亡
黄芩苷诱导细胞MMP受损,ROS水平显著升高;黄芩苷联合NAC处理Reh细胞后,细胞内ROS水平、细胞凋亡率显著降低,细胞增殖明显恢复(P<0.01,P<0.05;图3)。以上结果表明,黄芩苷可通过损伤MMP提高胞质内ROS水平,从而诱导Reh细胞凋亡。
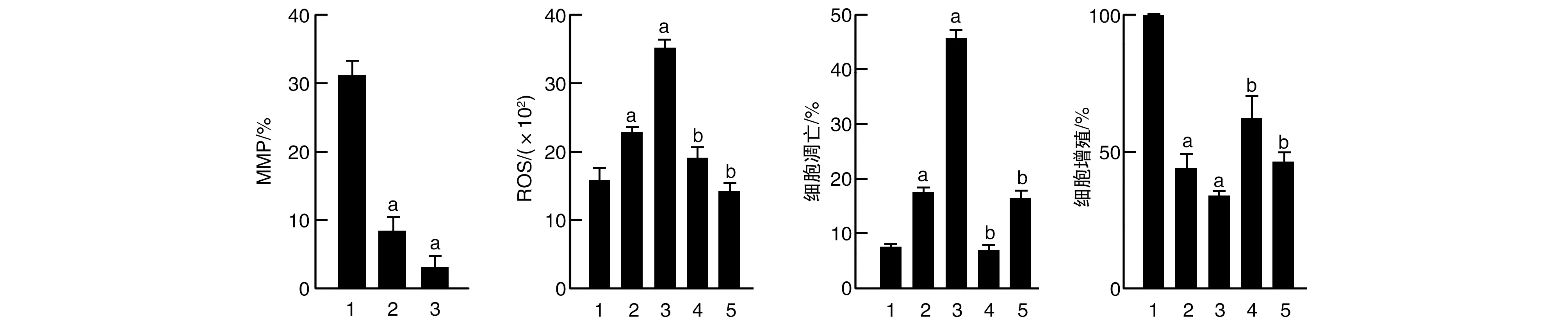
图3 黄芩苷损伤MMP从而升高胞内线粒体ROS,诱导Reh细胞凋亡1为对照组;2为20 mg/L黄芩苷;3为40 mg/L黄芩苷;4为20 mg/L黄芩苷+5 mmol/L NAC;5为40 mg/L黄芩苷+5 mmol/L NAC。a为P<0.05,与对照组比较;b为P<0.01,与同质量浓度黄芩苷组比较。
2.4 黄芩苷上调JNK/p38 MAPK通路诱导Reh细胞凋亡
JNK/p38 MAPK作为ROS下游靶蛋白[4-5],黄芩苷升高Reh细胞内ROS水平后明显激活了JNK/p38 MAPK通路;而清除ROS则显著抑制了JNK/p38 MAPK、Cleaved-Caspase-3及Cleaved-PARP的活化,而Survivin表达水平得以恢复(P<0.01,P<0.05;图4)。以上提示,黄芩苷通过升高胞内ROS水平激活JNK/p38 MAPK通路,从而诱导Reh细胞凋亡。

图4 黄芩苷激活JNK/p38 MAPK通路诱导Reh细胞凋亡a为P<0.05,与对照组比较;b为P<0.01,与40 mg/L黄芩苷+5 mmol/L NAC组比较。
3 讨 论
ALL是一种异质性血液系统恶性肿瘤,其主要致病机理是未发育成熟的淋巴母细胞在患者骨髓、外周血及其他外周器官异常增殖,导致血液中淋巴母细胞数量异常增多,外周器官病变。关于ALL治疗主要以化疗为主,常用的ALL化疗药物包括强的松龙、长春新碱、阿霉素、柔红霉素和I-天冬酰胺酶等[6]。然而,化疗常给患者带来较大不良反应,且在化疗治疗ALL进程中易产生对化疗药物的耐药性,亟需发掘新的不良反应较小的化疗药物。细胞凋亡主要是由机体内部或受到外部刺激引发,参与介导凋亡的途径有3类,一类是内质网应激诱导途径;一类是细胞表面信号介导转导途径;另一类是线粒体介导途径[7]。细胞凋亡归属于细胞正常性死亡,有助于清除体内衰老、损伤和多余的细胞,且对生物体内生理机能、免疫稳态维持和癌症防治至关重要。
黄芩苷是中草药黄芩根部多酚提取物,其亲脂性比较高,有助于提高穿透细胞的能力和有利于机体快速吸收;黄芩苷能够通过不同机制诱导细胞凋亡来抑制多种肿瘤细胞生长,比如可通过升高乳腺癌细胞内ROS水平在体内外抑制肿瘤生长和转移;可通过促进ROS产生、损伤MMP来抑制骨肉瘤和骨髓瘤细胞生长;也可通过增加促凋亡蛋白Bax的表达和下调抗凋亡蛋白Bcl-2的表达抑制肺癌细胞、鼻咽癌细胞、肝癌细胞以及结直肠癌细胞的生长[8-12]。
本研究发现,首先MTS结果表明黄芩苷抑制Reh细胞生长,随后流式细胞术、免疫荧光和Western blotting的结果均表明黄芩苷处理后Reh细胞发生凋亡、ROS水平上调以及MMP受到抑制。以上提示,黄芩苷可有效抑制Reh细胞增殖,并呈一定剂量依赖性;且黄芩苷是通过促使Reh细胞ROS产生增加来诱导细胞发生凋亡。
JNK/p38 MAPK属于MAPK家族,参与细胞增殖、分化和死亡等过程。例如,JNK/p38 MAPK也分别参与促进神经元细胞、少突胶质细胞祖细胞和神经干细胞增殖;JNK/p38 MAPK能参与诱导肺上皮-间质细胞的分化[13-14]。此外,在恶性间皮瘤细胞中,没食子酸通过激活p38通路诱导细胞凋亡来发挥抗肿瘤效果。虫草素通过活化JNK/p38 MAPK来抑制人结肠癌细胞增殖和促进细胞凋亡。瑞非尼通过活化JNK/p38 MAPK通路抑制肺癌的生长[15]。因此,靶向激活JNK/p38 MAPK可能为研发新的ALL化疗药物提供参考。本研究Western blotting结果表明,黄芩苷上调了磷酸化JNK和磷酸化p38蛋白表达,而NAC和黄芩苷合用后则下调了磷酸化JNK和磷酸化p38蛋白表达,且抗凋亡蛋白Survivin表达水平恢复。以上提示,黄芩苷经激活Reh细胞内JNK/p38 MAPK通路,促进细胞发生凋亡;而清除ROS后则可抑制JNK/p38 MAPK蛋白磷酸化,细胞凋亡得以抑制,表明黄芩苷升高胞内ROS水平来激活Reh细胞内JNK/p38 MAPK通路诱导细胞凋亡。
综上所述,黄芩苷经损伤Reh细胞MMP来升高胞内ROS水平,并靶向激活JNK/p38 MAPK通路,诱导Reh细胞凋亡。这些结果为进一步深入研究ALL发病机制及防治提供了一定的理论依据。

