过表达miR-23b-3p对甲状腺未分化癌FRO细胞侵袭和迁移的影响
张晶, 罗雯, 甘卓, 杨宇
湖南中医药大学第一附属医院 1.医务部,2.放射科,湖南长沙 410007;3.湖南省肿瘤医院核医学科,湖南长沙 410013;4.湖南中医药大学第一附属医院核医学科,湖南长沙 410007
甲状腺未分化癌(anaplastic thyroid cancer,ATC)具有恶性程度高、易转移等特点[1]。侵袭和转移是恶性肿瘤细胞的主要生物学特征,深入了解ATC肿瘤细胞的侵袭和迁移机制,寻找新的分子靶标,对诊断和治疗ATC具有重要意义。锌指E盒结合同源框1(zinc finger E-box-binding homeology box 1,ZEB1)参与调控肿瘤细胞的各种恶性行为,在甲状腺癌组织及甲状腺癌细胞中呈高表达状态,且可促进癌细胞的侵袭和迁移[2-3]。微小核糖核酸(microRNA,miRNA)在细胞增殖、黏附、分化等多种生物学进程中发挥着重要作用[4],miR-23b已被证实可作为抑瘤因子参与肺癌、宫颈癌、卵巢癌等多种肿瘤的病理发展过程[5-6],但miR-23b-3p在ATC中的表达如何及其是否通过靶向调控ZEB1对ATC的发生和发展产生影响,目前未见报道。本研究拟探讨miR-23b-3p与ZEB1的靶向关系以及对ATC FRO细胞侵袭和迁移的影响,为临床ATC的治疗提供潜在靶点。
1 材料和方法
1.1 ATC组织来源
取2017年8月—2020年2月于本院经确诊的52例ATC患者的癌组织及其癌旁组织,临床分期:Ⅰ期8例、Ⅱ期11例、Ⅲ期17例、Ⅳ期16例,其中男性27例,女性25例,年龄15~67岁,平均(41.4±12.1)岁,所有患者经病理组织学确诊,均签署知情同意书。
1.2 材料与仪器
甲状腺未分化癌细胞FRO购自美国典型培养物保藏中心;miR-23b-3p mimic及其阴性对照(miR-NC)由上海吉玛制药技术有限公司设计合成,miR-23b-3p mimic:5′-AUCACAUUGCCAGGGAUUACC-3′,miR-NC:5′-CAGUACUUUUGUGUAGUACAA-3′;RPMI 1640培养基和FBS购自美国Gibco公司;LipofectamineTM 2000购自美国Invitrogen公司;反转录试剂盒和荧光定量PCR试剂盒购自日本TaKaRa公司;基质胶Matrigel购自美国BD公司;双荧光素酶检测试剂盒购自美国Promega公司;ZEB1、血管内皮生长因子(vascular endothelial growth factor,VEGF)、基质金属蛋白酶(matrix metalloproteinase,MMP)-2、MMP-9和GAPDH抗体均购自美国Cell Signaling Technology公司;PCR扩增仪购自美国Thermo公司;凝胶成像系统购自美国Bio-Rad公司。
1.3 细胞培养、转染及分组
人甲状腺未分化癌细胞FRO复苏后培养于含1%青霉素-链霉素溶液和10% FBS的RPMI 1640培养基中,37 ℃、5% CO2孵育,每2~3天传代1次。取对数期生长细胞,接种于6孔板中,待细胞融合度达到80%时,按照LipofectamineTM 2000转染试剂说明书进行转染。细胞分为miR-23b-3p mimic组、miR-NC组和空白组,其中miR-23b-3p mimic组和miR-NC组分别转染miR-23b-3p mimic和阴性对照48 h,空白组不做任何处理。qRT-PCR检测细胞中miR-23b-3p表达水平。
1.4 qRT-PCR检测miR-23b-3p和ZEB1 mRNA
收集癌组织、癌旁组织和各组细胞样本,采用TRIzol法提取细胞总RNA,将RNA反转录为cDNA,然后以cDNA为模板,在荧光PCR扩增仪上进行mRNA扩增。引物序列:miR-23b-3p正向引物为5′-CTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGGGTAATC-3′,反向引物为5′-ACACTCCAGCTGGGATCACATTGCCAGGTGGTGTCGTGGAGTCG-3′;U6正向引物为5′-CTCGCTTCGGCAGCACATATACTA-3′,反向引物为5′-ACGAATTTGCGTGTCATCCTTGC-3′;ZEB1正向引物为5′-ACTGTTTGTAGCGACTGGATT-3′,反向引物为5′-TAAAGTGGCGGTAGATGGTA-3′;GAPDH正向引物为5′-AAGGTGAAGGTCGGAGTC-3′,反向引物为5′-GAAGATGGTGATGGGATTTC-3′。反应程序为:50 ℃反转录3 min,95 ℃预变性5 min,95 ℃变性15 s,60 ℃退火并延伸,循环40次,以U6作为miR-23b-3p的内参,GAPDH作为ZEB1的内参,采用2-ΔΔCt法计算miR-23b-3p和ZEB1的mRNA相对表达水平。
1.5 体外三维培养观察
将Matrigel铺于预冷的24孔板中,400 μL/孔,37 ℃避光静置30 min。收集各组细胞用胰蛋白酶消化成单细胞,接种于Matrigel上(1.5×105个/孔)培养24 h,共聚焦显微镜拍摄照片,高倍显微镜下随机选取5个视野,分别计数细胞所形成的管腔数目,取每个视野均值即为细胞血管生成拟态(vasculogenic mimicry,VM)形成能力。
1.6 Transwell法检测细胞侵袭和迁移能力
将Matrigel胶置于4 ℃冰箱溶解,同时将实验需要用到的试剂耗材全部放入冰箱预冷,防止胶过早凝固。按照说明书用无血清的培养基稀释Matrigel胶(侵袭实验需要提前在Transwell小室上层平铺30 μL稀释后的Matrigel胶,迁移实验不需要加胶)。细胞转染48 h后,胰酶消化细胞并计数,用无血清的培养基重悬细胞,以1×105个/孔接种于上层,下层加入含20%血清的培养基,连续培养48 h后,加入多聚甲醛固定20 min,再采用0.1%结晶紫室温染色30 min,PBS清洗小室3遍后,倒置显微镜下拍照,随机选取5个视野,对每个视野内穿透小室微孔膜的细胞进行计数。
1.7 Western blotting检测细胞中相关蛋白表达水平
收集各组细胞沉淀,用PBS冲洗细胞2~3次,于冰上充分裂解30 min,4 ℃条件下12 000 r/min离心20 min,收集上清,采用BCA法测定蛋白水平。取20 μg蛋白样品进行SDS-PAGE凝胶电泳,随后转移至PVDF膜,将转完的膜放入装有TBST的孵育槽中,快速涮洗1次,加上脱脂牛奶,放置于脱色摇床上,室温下封闭90 min,按照抗体说明书孵育一抗ZEB1、VEGF、MMP-2、MMP-9和GAPDH,配置好后,倒掉孵育槽中的封闭液,加入配置好的一抗,4 ℃孵育摇床过夜,次日加入辣根过氧化物酶标记的二抗,室温孵育1 h后显色。采用Image-Pro Plus 6.0软件进行灰度分析,以GAPDH为内参计算各蛋白相对表达量。
1.8 荧光素酶报告实验
TargetScan软件预测miR-23b-3p和ZEB1是否存在结合位点,确认存在结合位点后构建ZEB1野生型(wild type,WT)和突变型(mutant type,MUT)荧光素酶报告基因质粒并转染FRO细胞,同时转染miR-23b-3p mimic或miR-NC,转染48 h后按照双荧光素酶报告基因试剂盒说明书测定荧光素酶的相对活性。
1.9 统计学分析
2 结 果
2.1 ATC组织及癌旁组织中miR-23b-3p、ZEB1 mRNA表达及其相关性
与癌旁组织比较,ATC组织miR-23b-3p表达水平显著降低(P<0.01),ZEB1 mRNA水平显著升高(P<0.01;图1)。Pearson相关性分析结果显示,ATC组织中的miR-23b-3p与ZEB1 mRNA呈负相关(r=-0.802,P<0.01)。
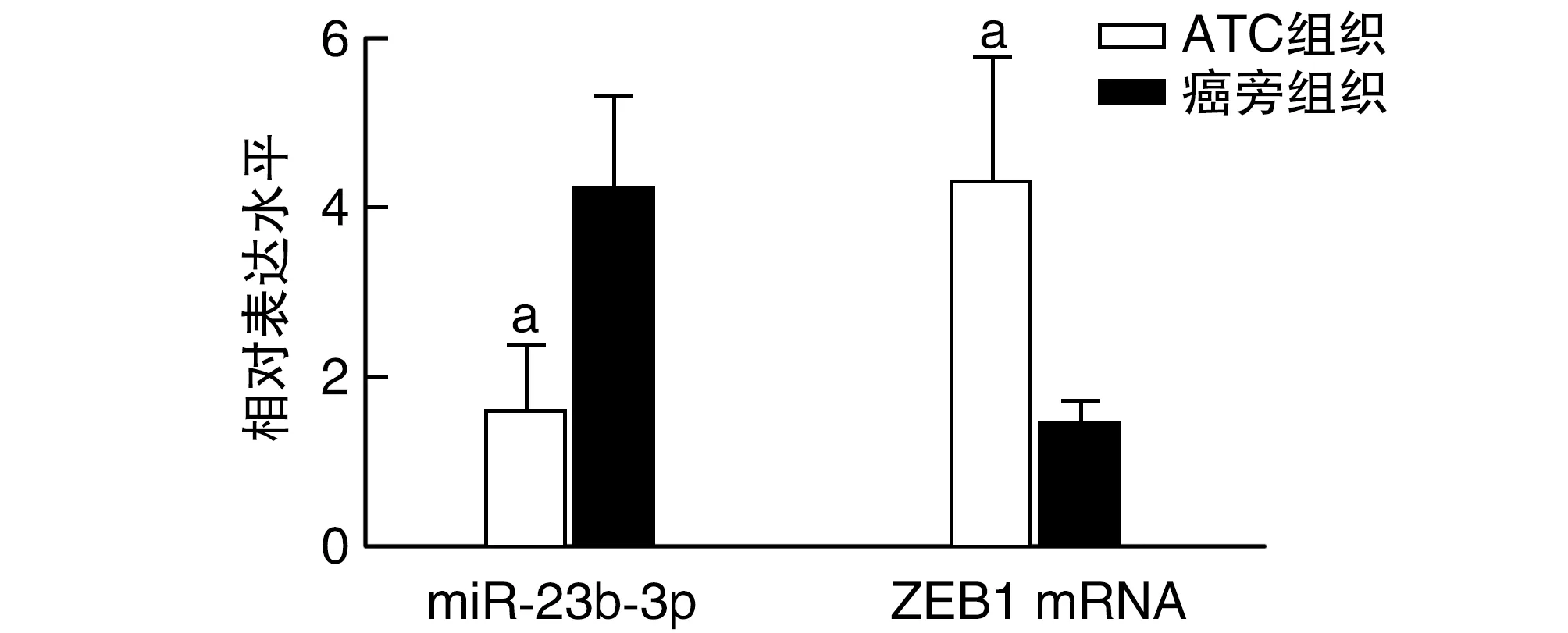
图1 ATC组织及其癌旁组织中miR-23b-3p、ZEB1 mRNA的比较a为P<0.01,与癌旁组织比较。
2.2 过表达miR-23b-3p对FRO细胞ZEB1表达的影响
与空白组和miR-NC组比较,miR-23b-3p mimic组miR-23b-3p表达水平升高(P<0.01;图2A),提示miR-23b-3p mimic转染成功。与空白组和miR-NC组比较,miR-23b-3p mimic组ZEB1蛋白及mRNA表达水平显著降低(P<0.01;图2B)。
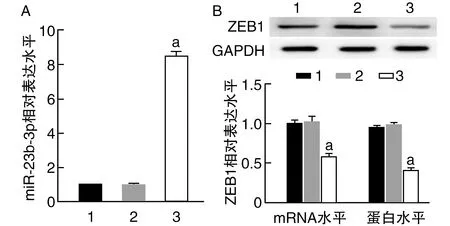
图2 FRO细胞中miR-23b-3p和ZEB1表达水平的比较1为空白组;2为miR-NC组;3为miR-23b-3p mimic组。A为miR-23b-3p表达水平;B为ZEB1蛋白及mRNA相对表达水平。a为P<0.01,与空白组和miR-NC组比较。
2.3 过表达miR-23b-3p对FRO细胞VM形成能力的影响
空白组和miR-NC组的FRO细胞相互融合连接形成血管样结构;与空白组和miR-NC组比较,miR-23b-3p mimic组细胞形成的管腔数目显著减少(P<0.01;图3),表明过表达miR-23b-3p可抑制FRO细胞的VM形成能力。
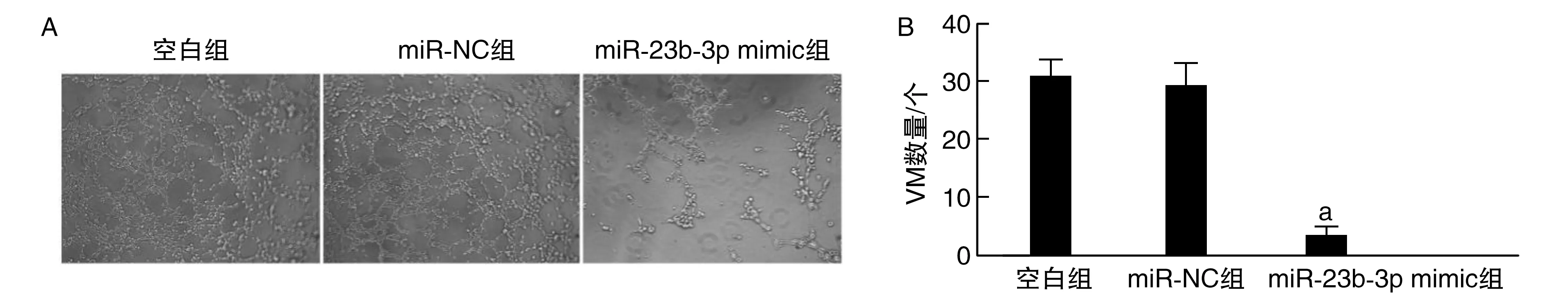
图3 过表达miR-23b-3p对FRO细胞VM形成能力的影响A为FRO细胞VM结果镜下图(100×);B为各组VM数量柱状图。a为P<0.01,与空白组和miR-NC组比较。
2.4 过表达miR-23b-3p对FRO细胞侵袭、迁移的影响
与空白组和miR-NC组比较,miR-23b-3p mimic组侵袭和迁移细胞数目均显著减少(P<0.01;图4)。过表达miR-23b-3p可抑制FRO细胞侵袭和转移。
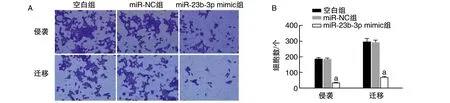
图4 过表达miR-23b-3p对FRO细胞侵袭和迁移能力的影响A为Transwell法检测结果镜下图(结晶紫染色,200×);B为FRO细胞侵袭、迁移数柱状图。a为P<0.01,与空白组和miR-NC组比较。
2.5 过表达miR-23b-3p对FRO细胞VEGF、MMP-2和MMP-9蛋白表达的影响
与空白组和miR-NC组比较,miR-23b-3p mimic组VEGF、MMP-2和MMP-9蛋白表达水平显著降低(P<0.01;图5)。

图5 miR-23b-3p对FRO细胞VEGF、MMP-2和MMP-9蛋白表达的影响1为空白组;2为miR-NC组;3为miR-23b-3p mimic组。a为P<0.01,与空白组和miR-NC组比较。
2.6 miR-23b-3p与ZEB1的靶向作用关系
结果显示,miR-23b-3p在ZEB1基因3′-UTR区域存在靶向结合位点(图6A)。双荧光素酶报告基因结果显示,miR-23b-3p mimic显著降低野生型ZEB1荧光素酶活性(P<0.01;图6B)。
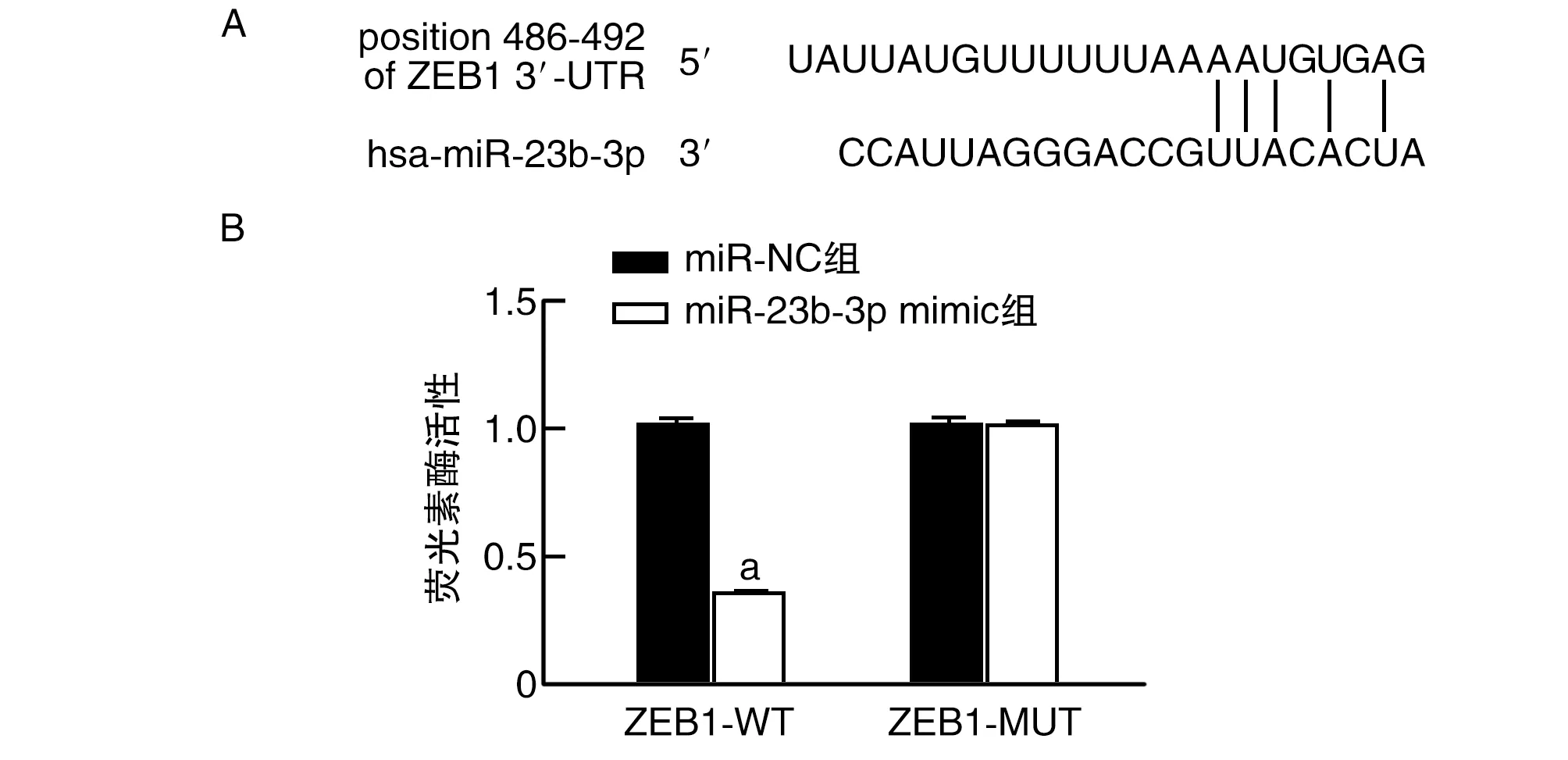
图6 miR-23b-3p与ZEB1的靶向关系A为TargetScan预测miR-23b-3p在ZEB1 3′-UTR区域的靶向结合位点;B为荧光素酶活性柱状图。a为P<0.01,与miR-NC组比较。
3 讨 论
近年来,与疾病相关的miRNA已成为恶性肿瘤重要的治疗靶点和诊断依据[7-9]。研究报道,ZEB1能促进癌细胞侵袭和迁移,且在甲状腺癌组织中高表达[8-10]。在ATC的发生发展中,miR-23b-3p与ZEB1具有靶向调控关系还未得到证实。本研究结果显示,miR-23b-3p可以通过靶向下调ZEB1表达调控ATC细胞FRO的侵袭和转移能力。
本研究结果显示,miR-23b-3p在ATC组织中的表达显著低于癌旁组织,而ZEB1在ATC组织中的表达显著高于癌旁组织。转染miR-23b-3p mimic后,FRO细胞的侵袭和转移能力显著降低,该结果与Yan等[6]的实验结果相一致。本研究结果显示,过表达miR-23b-3p能够显著抑制FRO细胞的VM形成,进一步明确miR-23b-3p参与了FRO细胞的侵袭、转移过程。
肿瘤间质中存在着大量的微血管,直接影响着肿瘤细胞的生长、侵袭和转移,肿瘤的生长和转移都依赖于新生血管的生成[10-12]。VEGF和MMP是公认的VM形成的信号转导枢纽分子,与肿瘤细胞通过VEGF塑形和MMP介导的细胞外基质重塑密切相关[13-15]。本研究结果显示,过表达miR-23b-3p能够显著抑制FRO细胞中VEGF、MMP-2和MMP-9蛋白表达,初步证实过表达miR-23b-3p抑制FRO细胞VM形成,其可能作用机制是通过下调VEGF和MMP-2、MMP-9表达实现的。为进一步明确miR-23b-3p和ZEB1在FRO细胞VM形成中的靶向作用关系,本研究在FRO细胞中过表达miR-23b-3p后,检测了细胞中ZEB1的表达水平,研究结果显示,细胞中ZEB1 mRNA水平和蛋白表达水平显著下降,随后通过生物信息预测发现,miR-23b-3p基因序列上存在ZEB1的结合位点,进一步通过荧光素酶报告实验证实ZEB1是miR-23b-3p的靶基因。
综上所述,过表达miR-23b-3p可能通过靶向下调ZEB1表达抑制FRO细胞的VM形成,从而抑制肿瘤细胞的侵袭和迁移能力。本研究可为ATC的靶向治疗提供思路和实验数据参考。