miR-122对脑缺血再灌注损伤小鼠脑梗死体积及胰岛素样生长因子-1受体通路的影响
廖晓斌 刘子彪 吕志成 康承湘
(郴州市第一人民医院,郴州 423000)
脑卒中在人群中的发病率逐年上升[1]。脑卒中溶栓治疗后可发生脑缺血再灌注损伤(ischemia/reperfusion,I/R),极易诱导脑神经细胞凋亡或多种脑组织损害。I/R 是由多因素参与的一种较为复杂的级联反应,包括氧自由基作用、炎症反应、钙浓度增加等[2-3]。miR-122 是机体组织特异性微小RNA,参与机体神经发育,在脑组织缺血、缺氧及脑梗死的发生过程中都有调节作用,与脑梗死的病情和预后直接相关[4]。miR-122 与缺血再灌注损伤的发生密切相关,如小鼠脑缺血再灌注中,miR-122 对降低胰岛素样生长因子-1 受体(insulin like growth factor-1 receptor,IGF-1R)表达起调控作用,降低脑细胞的损伤[5]。近年来,研究表明IGF-1R 通路紊乱与脑部各种损伤疾病,如糖尿病脑病、阿尔茨海默病、癫痫等也存在一定关联。IGF 包含3 类肽类激素,如IGF-1、IGF-2 等[6-7],而IGF-1 及其受体IGF-1R 在机体组织中存在较广,尤其是在脑组织中,IGF-1 可与受体结合,激活下游信号转导,从而抑制脑部神经细胞凋亡,促进存活,在改善动物和人脑损伤中有重要意义,有效控制IGF-1R 信号紊乱,能明显促进神经元损伤的恢复[8-9]。由此,本研究旨在探讨miR-122 对脑缺血再灌注损伤小鼠脑梗死面积及IGF-1R 通路的影响。
1 材料和方法
1.1 主要试剂和仪器
TRIzol 试剂(浙江AMEKO);逆转录试剂盒(武汉,赛维尔);RT-PCR 试剂盒(上海吉玛制药技术有限公司);SPF 级雄性 C57BL 小鼠(长沙,天勤生物),体质量23.51 g±1.47 g,11 周龄,自由饮食、饮水,温度24℃±1℃,湿度50%左右。
1.2 分组处理
40 只小鼠分为对照组(假手术组)、模型组(I/R 模型组)、模拟物组(I/R 模型+miR-122 模拟物)、抑制物组(I/R 模型+miR-122 抑制物)。用10% 水合氯醛腹腔注射麻醉模拟物组、抑制物组小鼠,麻醉后固定于脑定位仪上,取7 μL 的miR-122 模拟物、miR-122 抑制物混悬液分别注射至模拟物组、抑制物组小鼠左侧脑室,速度3 μL/min,留针5 min。
1.3 模型制备
线栓法制备I/R 模型。动物术前禁食12 h,可饮水,选用戊巴比妥钠30 g/L 进行腹腔注射麻醉。术区消毒切开颈部皮肤,左侧颈总动脉小切口,将0.18 mm 经处理过的线栓于颈总动脉深入颈内动脉,直至脑部中动脉,有轻微阻力即可停止深入。缺血1 h 后撤除线栓。术中保持小鼠肛温处于36℃~37℃。对照组分离颈动脉后缝合。
1.4 神经行为学检测
撤除线栓后,观察小鼠行为改变,行阿扑吗啡旋转诱导实验,统计用药30 min 内小鼠旋转圈数,计算平均旋转圈数。末次给药结束后行悬挂实验,将小鼠前肢悬挂于距地面30 cm 水平放置的金属丝上,记录从开始悬挂至落地时的时间并评分。评分标准为:持续0~5 s 记为0 分,6~10 s 记为1 分;11~15 s 记为2 分,16~20 s 记 为3 分,21~25 s 记为4 分,26~30 s 记为5 分,超过30 s 记为6 分。共检测3 次,取平均值,每次检测时间间隔约为2 min。
1.5 Morris 水迷宫实验
每组小鼠取10 只进行Morris 水迷宫实验。
记忆训练期(第1、2 天):将小鼠面朝池壁放入水中游泳60 s,第1 天引导小鼠登上平台,第2天若在60 s 内动物没有登上平台则继续引导其登上平台,停留15 s 后放入温暖干燥的笼子结束训练。
记忆增强期(第3、4、5 天):每只动物每天早、晚各1 次实验,每次分别从除平台所在方位外的3个方位各放1 次,每只动物放入水中的间隔时间为15 s。动物单次游泳时间为60 s,若小鼠在60 s 内不能上台则引导其登上平台适应15 s 后进行下次实验。最后,将小鼠擦干放入鼠笼。
空间探索实验(第6 天):撤出平台,将小鼠从与平台相对的方位面朝池壁放入水中,让小鼠自由游泳60 s 后将动物擦干放入鼠笼。观察小鼠在平台所有象限的距离百分比(PT%)和停留时间百分比(T%),以此来评价药物对小鼠神经行为学障碍的影响(PT%和T%值越大,表明大鼠的认知记忆能力越强)。
1.6 小鼠脑梗死体积检测
2 周后麻醉处死小鼠取脑,将取出的脑组织冷冻30 min,对脑组织间隔2 mm 做6 个冠状切片,并采用10%的2,3,5-三苯基氯化四氮唑(TTC)进行水浴染色,正常组织呈红色,缺血坏死呈白色,用NIS—Elements BR3.0 基础研究图像分析软件对切片脑梗死体积进行测定。采用单盲法,即盲图像分析,计算脑梗死灶体积。
1.7 H-E 染色
取各组小鼠脑组织,固定于多聚甲醛溶液中,用石蜡包埋脑组织,切成5 μm 的薄片,H-E 染色组织薄片,封片后显微镜下观察组织病理学变化。
1.8 RT-PCR 检测miR-122、IGF-1R 水平
将胰蛋白酶加入小鼠脑组织中进行消化反应,PBS 冲洗,然后滴入0.9%NaCl 溶液,总RNA 采用TRIzol 法来提取,总RNA 再反转录成 cDNA。实验步骤按试剂说明书操作,用DNA 荧光染料SYBR Green Ⅰ对miR-122、IGF-1R mRNA 表达水平进行检测,内参采用β-actin,60℃ 10 min,95℃ 72℃,各 30 s、95℃,5 min,循环次数40,用相对定量2-ΔΔCT计 算miR-122、IGF-1R mRNA 表 达 量。实验次数至少3 次。引物序列见表1。

表1 引物序列
1.9 免疫印迹检测IGF-1R 蛋白表达
取出各组小鼠脑组织,称重后剪碎组织,用裂解液裂解组织成组织悬液,13 000 r/min 离心15 min,收集上清液,用BCA 法对总蛋白浓度进行测定。完成配胶、电泳分离蛋白,以marker 确定目标蛋白位置、转膜、洗膜、封闭液室温封闭,分别孵育一、二抗,用ECL 发光剂显影曝光,分析目标蛋白灰度值,并用各自的内参校正。
1.10 流式细胞术检测神经元细胞凋亡情况
取脑组织加入裂解液,制备细胞悬液,对其进行洗涤2 次,离心5 min,选择100 μL 的1×结合缓冲液,进行重悬细胞操作,用5 μL 标记FITC的Annexin Ⅴ与5 μL PI 染色液混匀,避光孵育15 min 后加入400 μL 结合缓冲液,混匀,洗涤3 次后上机检测。
1.11 统计学处理
采用SPSS 17.0 统计学软件进行数据分析,计量资料以±s表示,组间比较采用单因素方差分析,两两组间比较采用LSD-t检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 小鼠神经功能比较
与对照组相比,模型组和模拟物组小鼠旋转圈数明显增多,悬挂实验评分降低,且模拟物组小鼠旋转圈数多于模型组,悬挂实验评分低于模型组(P<0.05);与模型组相比,抑制物组小鼠旋转圈数明显减少,悬挂试验评分明显升高(P<0.05)(表1)。
表1 各组小鼠旋转圈数和评分比较(n=10,±s)

表1 各组小鼠旋转圈数和评分比较(n=10,±s)
△P<0.05 vs 对照组;*P<0.05 vs 模型组;#P<0.05 vs 模拟物组
组别 旋转圈数(圈) 悬挂实验评分对照组 5.02±1.10 1.17±0.31模型组 12.35±3.24△ 0.53±0.16△模拟物组 15.37±4.46△* 0.32±0.13△*抑制物组 7.21±1.57△*# 0.93±0.28△*#
2.2 小鼠认知功能比较
与对照组相比,模型组和模拟物组小鼠PT%、T%值均降低,且模拟物组较模型组降低的更为显著(P<0.05);与模型组相比,抑制物组小鼠PT%、T%值显著升高(P<0.05)(表2)。
表2 各组大鼠PT%、T%比较(n=10,±s)

表2 各组大鼠PT%、T%比较(n=10,±s)
△P<0.05 vs 对照组;*P<0.05 vs 模型组;#P<0.05 vs 模拟物组
组别 PT(%) T(%)对照组 40.23±5.54 35.19±4.32模型组 26.14±3.01△ 25.51±3.68△模拟物组 21.56±2.72△* 20.23±2.71△*抑制物组 35.27±4.16△* 31.72±3.18△*
2.3 小鼠脑梗死体积
对照组小鼠脑组织无梗死。与对照组相比,模型组(45.13±5.22)mm3和模拟物组(61.08±10.31)mm3小鼠脑梗死体积显著增加,且模拟物组小鼠脑梗死体积大于模型组(P<0.05);与模型组相比,抑制物组(28.67±8.18)mm3小鼠脑梗死体积显著减少(P<0.05)(图1)。
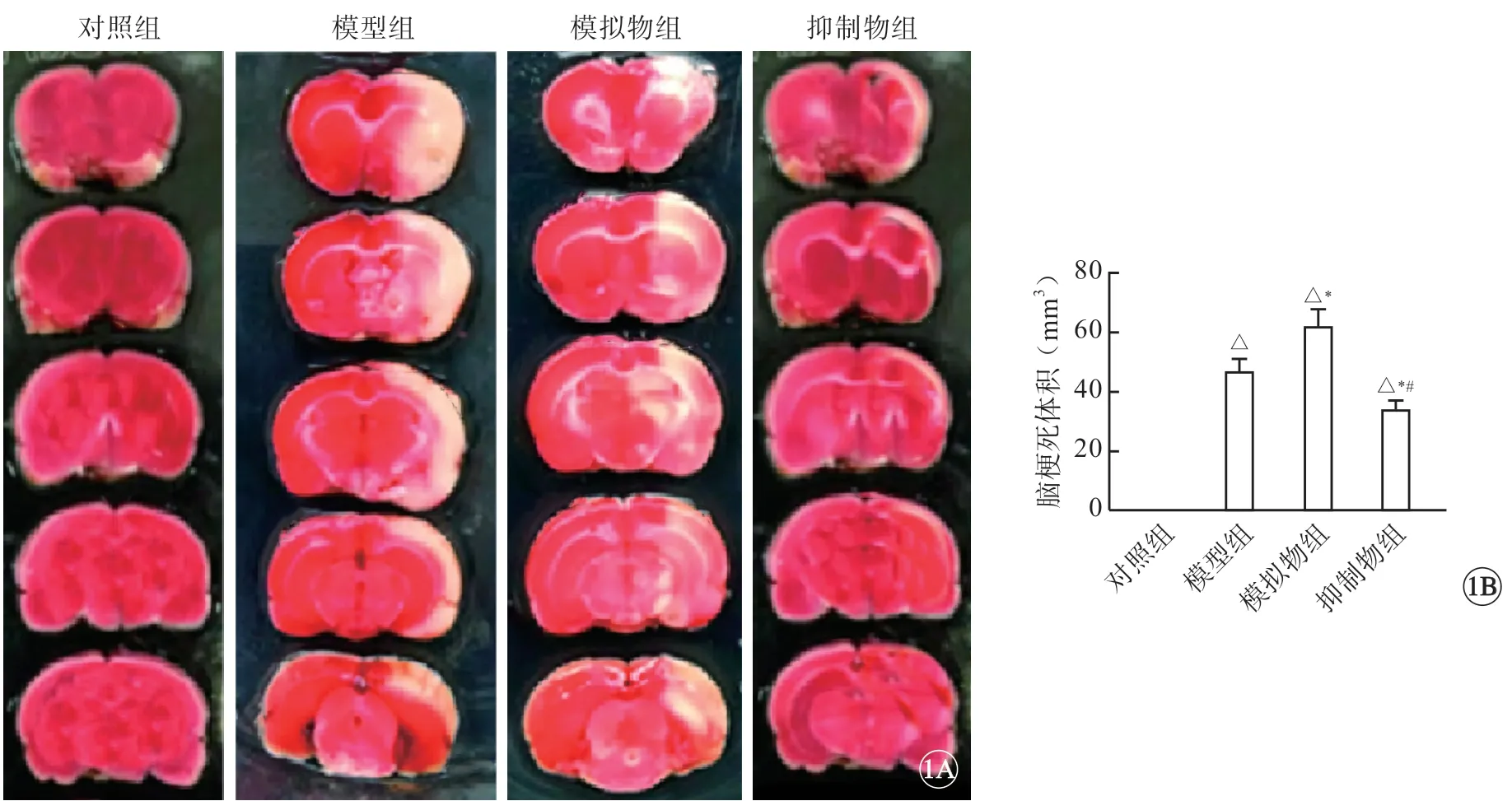
图1 小鼠脑梗死体积比较。
2.4 脑组织神经元形态
H-E 染色显示对照组脑组织结构完整,神经元排列紧密,无染色不匀现象;模型组脑组织神经元排列呈疏松状态,着色不匀,有大量空泡样病理结构改变;模拟物组脑组织结构改变较模型组严重;抑制物组脑组织损伤病理变化逐渐减弱,神经元排列较密,空泡样病理改变减少(图2)。
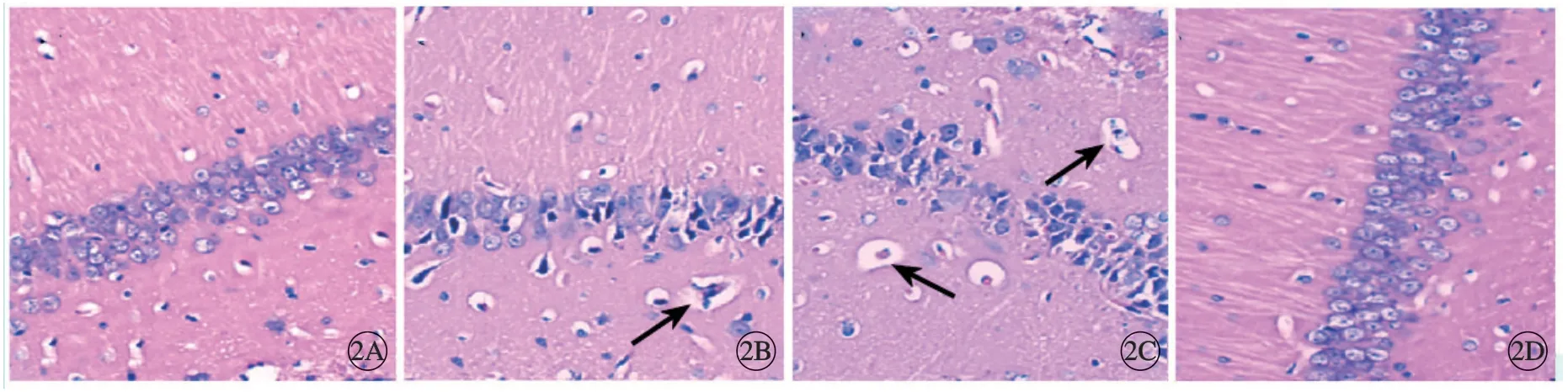
图2 脑组织H-E 染色,×200。
2.5 脑组织miR-122、IGF-1R mRNA 水平变化
与对照组相比,模型组和模拟物组miR-122 水平均显著增加,IGF-1R mRNA 水平均显著降低,且模拟物组中miR-122、IGF-1R mRNA 变化较模型组显著(P<0.05);与模型组相比,抑制物组miR-122 水平显著降低,IGF-1R mRNA 水平显著升高(P<0.05)(表3)。
表3 各组小鼠脑组织中miR-122、IGF-1R mRNA水平比较(n=10,±s)
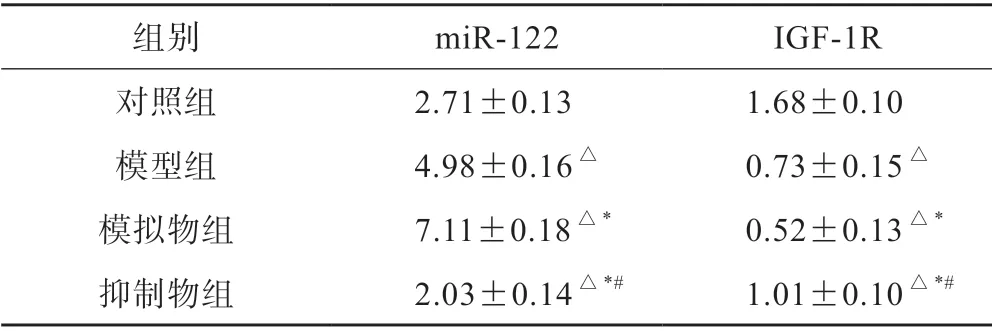
表3 各组小鼠脑组织中miR-122、IGF-1R mRNA水平比较(n=10,±s)
△P<0.05 vs 对照组;*P<0.05 vs 模型组;#P<0.05 vs 模拟物组
组别 miR-122 IGF-1R对照组 2.71±0.13 1.68±0.10模型组 4.98±0.16△ 0.73±0.15△模拟物组 7.11±0.18△* 0.52±0.13△*抑制物组 2.03±0.14△*# 1.01±0.10△*#
2.6 脑组织中IGF-1R 蛋白表达
与对照组相比,模型组和模拟物组中IGF-1R蛋白表达明显降低,且模拟物组中IGF-1R 蛋白表达低于模型组(P<0.05);与模型组相比,抑制物组中IGF-1R 蛋白表达显著增加(P<0.05)(图3)。
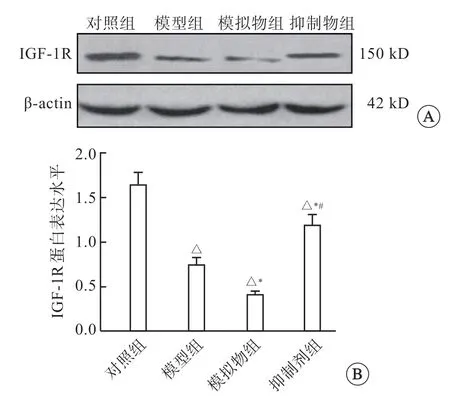
图3 大鼠组织IGF-1R 蛋白表达情况
2.7 神经元细胞凋亡情况
流式细胞术检测显示神经元细胞凋亡率从高到低依次为模拟物组、模型组、抑制物组、对照组组,4 组神经元细胞凋亡率比较差异有统计学意义(P<0.05)(图4)。

图4 大鼠神经元细胞凋亡情况
3 讨论
缺血性脑血管疾病多因血流突然停止或减少引起,或由于溶栓后,缺血区血流量正常却呈现更加严重的脑损伤即脑I/R,其发病机制较为复杂,涉及致病因素较广,给临床治疗带来阻碍[10]。近年来,miR-122 在临床研究、实践中得到更多关注,特别是在对I/R 功能恢复方面。IGF-1R 在脑内表达十分丰富,如大脑皮层、海马、下丘脑中均有表达,对乙酰胆碱产生有调控作用,可以抑制神经元凋亡,与认知功能异常密切相关[11-12]。根据病因和目标疗法的研究基础,miR-122 和IGF-1R 以及一些关联因子慢慢地被用于I/R 的治疗[13]。
本研究结果显示,4 组脑梗死体积大到小为模拟物组、模型组、抑制物组、对照组。对照组脑组织结构完整,神经元排列紧密,无染色不匀现象。模型组脑组织神经元排列呈疏松状态,着色不匀,有大量空泡样病理结构改变。模拟物组脑组织结构改变较模型组严重。抑制物组脑组织损伤病理变化逐渐减弱,神经元排列较密,空泡样病理改变减少。相关研究报道,miR-122 是I/R 发生的关键因素,在正常机体内的变化具有规律性,而在I/R患者体内会出现异常升高,因此,miR-122 对于维持机体血管功能和重要器官正常运转具有重要作用[14]。本研究结果显示,模型组和模拟物组小鼠旋转圈数增加,悬挂实验评分显著降低,干预后的抑制物组小鼠旋转圈数减少,悬挂实验评分升高,提示miR-122 可改善缺血再灌注小鼠神经功能。水迷宫实验通过PT%和T%指标评估小鼠的空间学习记忆能力,两者数值越大,说明小鼠的空间认知记忆越好。本研究结果显示,抑制物组小鼠PT%和T%值显著高于模型组,提示miR-122 能增强脑I/R 小鼠认知记忆能力,改善神经行为学障碍。有研究证实,miR-122 可抑制2-Ag 代谢的突触和认知改善,参与了I/R 的病理生理机制,是诱发I/R 造成脑梗死的潜在生物学标志[15]。miR-122 表达上升可抑制脑组织相关信号通路活性,如IGF-1R 通路等,对脑缺血后脑组织的修复产生抑制效果,神经元呈现缺血状态,患者脑出血病情加重,诱发I/R[16],这与本研究结果相符。
本研究结果显示,与对照组比较,模型组miR-122 水平呈显著升高状态,其余3 组miR-122水平从高到低依次为模拟物组、模型组、抑制物组。抑制物组IGF-1R 蛋白表达高于模型组、模拟物组;与对照组比较,模型组IGF-1R 蛋白表达明显下降。神经元细胞凋亡从高到低依次为模拟物组、模型组、抑制物组、对照组。相关文献报道,IGF-1R 是一种异常活跃的信号通路,通过激酶反应增加活性使其磷酸化,特定靶基因受到磷酸化影响,开始转录,并诱导相关蛋白表达,影响细胞增殖、分化和凋亡[17-18]。有研究报道,IGF-1R 信号通路与脑出血引起的脑水肿产生有关联,增强IGF-1R 活性能效减少脑神经细胞凋亡,对体内的炎症反应产生抑制效果,提高脑组织微循环及血流[19]。IGF-1R 活性增强可促进脑内血管分支的建立及全身血液循环,脑缺血区神经递质水平得到稳定调节,神经细胞凋亡被抑制,达到减缓疾病进程的目的[20]。
综上所述,miR-122 低表达可减少脑缺血再灌注损伤小鼠脑梗死体积,增加IGF-1R 通路活性,对脑缺血再灌注损伤小鼠脑组织有一定的保护作用。

