微小RNA-204在非小细胞肺癌中的表达及对H252癌细胞增殖及凋亡的影响
王启船,王 青,万里新,屈中玉,赵得堡,朱 昆
(1.南阳市中心医院 肿瘤1科,河南 南阳473009;2.南阳市中心医院 供应室二部,河南 南阳473009; 3.吉林大学中日联谊医院 药学部,吉林 长春130033)
肺癌是世界范围内发病率、死亡率最高的恶性肿瘤,其中非小细胞肺癌(non-small cell lung cancer,NSCLC)占到80%以上,且绝大部分确诊时已到晚期,5年生存率低于10%[1]。寻找一种高特异性与敏感性的分子标志物以提高NSCL早期诊断治疗、改善患者预后就显得尤为重要[2,3]。相关研究表明,微小RNA是一种高度保守的非编码单链小分子RNA,在NSCLC分化、浸润与转移中发挥着重要的作用[4]。微小RNA-204(miR-204)作为一种新的致癌基因或抑癌基因,在鼻咽癌、肝癌等肿瘤组织均为明显低表达状态,且与肿瘤分期及预后明显相关[5,6],也有学者报道miR-204可通过抑制肿瘤细胞A549的增殖发挥抗肿瘤作用[7],但目前还少有对癌细胞H252影响的文献报道。基于此种背景,本文通过细胞转染与细胞增殖实验的方法,分析miR-204在NSCLC中的表达及对H252癌细胞增殖与凋亡的影响。
1 材料与方法
1.1 一般资料
收集2016年1月-2016年12月医院手术治疗的NSCLC患者72例肺癌及相应癌旁组织(距肺癌组织>5 cm)标本,男38例,女34例;年龄43-72岁,平均(55.36±6.12)岁;TNM分期:Ⅰ期12例,Ⅱ期28例,Ⅲ期24例,Ⅳ期8例。排除术前放化疗或分子靶向治疗者,经医院伦理委员会批准,所有患者均签署知情同意书。标本切除后立即保存于液氮中,随后转入-80℃冰箱保存,整个操作过程遵循无酶原则。
1.2 细胞与主要试剂
人非小细胞肺癌H252细胞株:中科院上海生物研究所细胞库;F-12K培养基与胎牛血清:美国Gibco公司;RNA提取盒、逆转试剂盒:美国Omega公司;Marke、SYBR实时荧光定量聚合酶链反应(qRT-PCR)试剂盒:大连宝生物工程有限公司;Annexin V-FITC细胞凋亡检测试剂盒:美国BD公司;miR-204模拟物、miR-204抑制物、miR-204及U6 引物:上海英骏生物技术有限公司合成。
1.3 方法
1.3.1细胞培养与转染 非小细胞肺癌H252细胞细胞株使用含10%胎牛血清的F12K培养基常规培养,培养条件:370C、5%二氧化碳培养箱。参照Lipofectamine 3000说明书,转染分为对照组、阴性对照组、miR-204模拟组、miR-204抑制组,将各组转染物转染入H252细胞。
1.3.2细胞增殖实验 取转染48 h后细胞,按照100 μl/孔(约含1×104个细胞)接种到96孔培养板中,培养24、48、72 h、96 h后,每孔(每组6个平行孔)加入μlCCK-8试剂,继续培养4 h,于450 nm波长酶标仪上检测各孔吸光度,重复3次,取各孔平均值作为细胞相对增殖水平。
1.3.3细胞凋亡检测 细胞转染培养48 h,取1×105个细胞,800 r/min离心5 min弃上清液,加入0.5 ml结合液重悬细胞使细胞密度达到1×105个细胞/ml,随后加入Annxin V-FITC(5 μl)混匀,避光室温孵育15 min。加Propidium Iodide(5 μl)混匀,采用流式细胞仪检测细胞凋亡情况,重复3次,计算凋亡率。
1.3.4实时荧光定量聚合酶链反应(qRT-PCR) RNA提取采用Trizol法,将RNA反转录为cDNA,以cDNA为模板进行qRT-PCR。反应条件:95℃预变性30 s,95℃5 s,60℃ 60 s,共40个循环。采用2△△Ct法计算相对表达水平:△CtmiR-204-CtU6,△△Ct=△CtT-△CtN。miR-204、U6引物系列见表1。
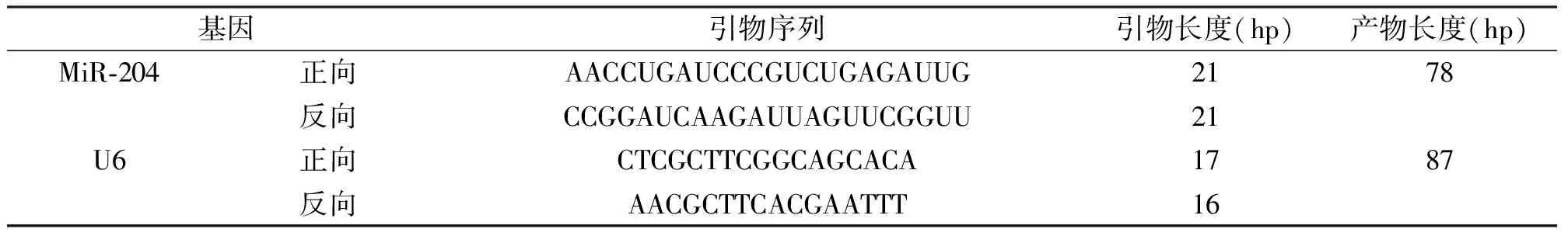
表1 miR-204、U6基因qRT-PCR引物系列
1.4 统计学方法
2 结果
2.1 肺癌组织及正常组织miR-204相对表达比较
肺癌组织miR-204的mRNA相对表达水平为(2.38±0.42),癌旁组织miR-204的mRNA相对表达水平为(5.46±0.54)。肺癌组织miR-204的mRNA相对表达水平明显低于癌旁组织mRNA相对表达水平(t=11.028,P<0.01)。
2.2 不同临床特征患者miR-204相对表达比较
不同性别、年龄患者miR-204相对表达比较,差异无统计学意义(P>0.05);Ⅲ-Ⅳ期、肿瘤直径≥3 cm、淋巴结发生转移肺癌患者miR-204相对表达明显低于Ⅰ-Ⅱ期、肿瘤直径<3 cm、淋巴结未发生转移者(P<0.05,P<0.01)。见表2。
2.3 miR-204对人H252细胞增殖与凋亡的影响
对照组、阴性对照组、抑制物组、模拟物组miR-204的mRNA相对表达水平为(2.36±0.45)、(2.21±0.42)、(1.02±0.24)、(4.01±0.54),四组间比较,差异有统计学意义(F=9.124,P<0.01);模拟物组miR-204的mRNA相对表达水平明显高于阴性对照组、抑制物组(t=6.299,11.619,P<0.05,P<0.01)。
24 h,对照组、阴性对照组、抑制物组、模拟物组4组H252细胞增殖水平比较,差异无统计学意义(P>0.05);48 h、72 h、96 h,与阴性对照组比较,抑制物组H252细胞增殖水平明显升高,模拟物组H252细胞增殖水平明显降低(P<0.05,P<0.01),与抑制物组比较,模拟物组H252细胞增殖水平明显降低(P<0.01)。见图1。
表2 不同临床特征患者miR-204相对表达水平比较
与阴性对照组比较,抑制物组H252细胞凋亡率明显降低,模拟物组H252细胞凋亡率明显升高(P<0.05,P<0.01);与抑制物组比较,模拟物组H252细胞凋亡率明显升高(P<0.01)。见图2。
3 讨论
随着蛋白组学与基因水平研究的不断深入,NSCLC发病机制、早期诊断、靶向治疗越来越受到学者的关注。表皮因子受体(EGFR)是公认有效抗癌靶点[8],Zhen等[9]研究认为miRNAs可能在靶向EGFR治疗中发挥着重要的作用。相关研究表明,miRNAs可通过抑制转录过程调控基因表达,参与肿瘤的发生、发展过程[10]。能够通过直接或间接方式抑制ERK1/2、AKT、STAT3表达,进而阻断EGFR信号通路[11];miR-134可竞争性结合EGFR3’-URT,抑制EGFR信号通路活性,促进癌细胞凋亡[12]。
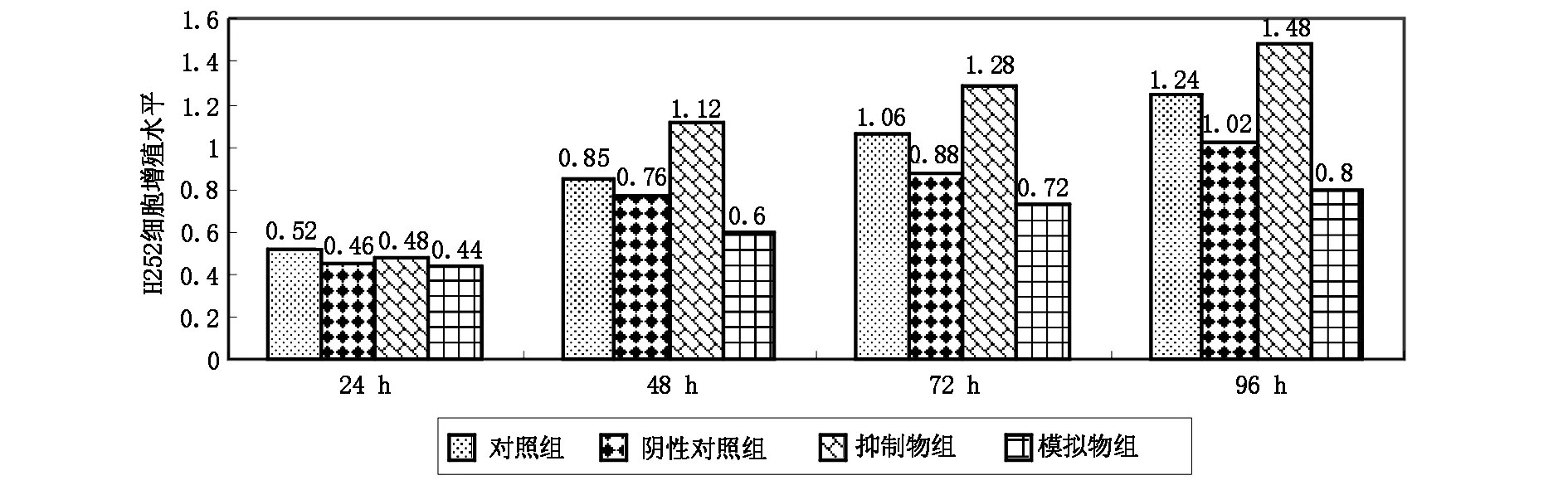
图1 miR-204对人H252细胞增殖的影响
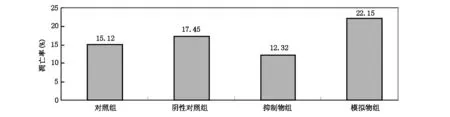
图2 miR-204对人H252细胞凋亡的影响
MiR-204编码基因位于人类染色体7q32,在脊椎动物中为一种高度保守的成熟序列[13],作为一种新的致癌基因与抑癌基因,广泛参与肿瘤发生、发展与侵袭过程[14]。如MiR-204高表达可诱导前列腺衍生上皮因子(PDEF)失控刺激前列腺癌发生[15],低表达与人肾黎明细胞癌(RCCC)恶性临床病理特征明显相关[16]。蒋义成等[17]研究发现,鼻咽癌患者肿瘤组织miR-204呈明显低表达状态,且与TNM分期、淋巴结转移明显相关。本文研究中,NSCLC肿瘤组织miR-204相对表达水平明显低于癌旁组织,且Ⅲ-Ⅳ期、肿瘤直径≥3 cm、淋巴结发生转移肺癌患者miR-204相对表达明显低于Ⅰ-Ⅱ期、肿瘤直径<3 cm、淋巴结未发生转移者,与李丽霞等[18]文献报道基本相似,提示miR-204的表达水平与NSCLC恶性病理行为明显相关。
许有忠等[19]等通过细胞转染与增殖实验报道,转染miR-204模拟物组A-549细胞增殖水平明显低于阴性对照组、抑制物组,认为miR-204作为一种抑癌基因可抑制NSCLC肿瘤细胞的增殖,促进肿瘤细胞凋亡。H252作为肿瘤细胞家族一员,也是反应NSCLC恶性程度的有效指标[20]。本文研究中,通过对照组、阴性对照组、抑制物组、模拟物组分组实验,48 h、72 h、96 h,模拟物组H252细胞增殖水平明显低于阴性对照组、抑制物组,H252细胞凋亡率明显高于阴性对照组、抑制物组。所得结论也支持上述文献观点。
本文研究结果表明,非小细胞肺癌组织miR-204呈明显低表达状态,与TNM分期、肿瘤直径、淋巴结转移等恶性病理行为明显相关。miR-204能抑制H252癌细胞增殖,促进细胞凋亡。但其作用机制尚不十分清楚,有待于更多的基础研究与临床研究去证实。
作者简介:王启船(1975-),男,硕士,副主任医师,主要从事肿瘤内科及肿瘤微创治疗。
参考文献:
[1]董秋萍,蒋湘俐,张连民,等.晚期非小细胞肺癌的内科一线及维持治疗[J].中国慢性病预防与控制,2016,24(4):314.
[2]Shao Y,Liang B,Long F,et al.Diagnostic MicroRNA Biomarker Discovery for Non-Small-Cell Lung Cancer Adenocarcinoma by Integrative Bioinformatics Analysis[J].Biomed Res Int,2017,2017:2563085.
[3]苏春霞,王 凌,孟秀清,等.人类软骨糖蛋白-39在非小细胞肺癌患者血清中的含量及临床意义研究[J].中国实验诊断学,2016,20(7):1081.
[4]Pileczki V,Cojocneanu-Petric R,Maralani M,et al.MicroRNAs as regulators of apoptosis mechanisms in cancer[J].Clujul Med,2016,89(1):50.
[5]Ma L,Deng X,Wu M,et al.Down-regulation of mirRNA-204 by LMP-1 enhances CDC42 activity and facilitates invasion of EBV- associated nasopharyngeal carcinom cells[J].FEBS Lett,2014,588(9):1562.
[6]李 扩,许秋然,刘 欣,等.miR-204通过下调Bl1-2和Sirt1表达抑制肝癌细胞生长[J].细胞与分子免疫学杂志,2015,31(2):168.
[7]吴 昊,梅闪闪,叶艺旺,等.微小RNA-204靶向抑制B淋巴细胞瘤-2影响非小细胞癌细胞的增殖、凋亡和迁移能力[J].中华实验外科杂志,2017,34(7):1160.
[8]Camidge DR,Pao W,Sequist LV.Acquired resistance to TKIs in solid tumours:learning form lung cancer[J].Nat Rev Clin Oncol,2014,11(8):473.
[9]Zhen Q,Liu J,Gao L,et al.MicroRNA-200a targets EGFR and c-Met to inhibit migration,invasion,and gefitinib resistance in non-small cell lung cancer[J].Cytogenet Genome Res,2015,146(10):1282.
[10]罗湘玉,罗卫民,张 军,等.miR-222基因转染对人非小细胞肺癌细胞增殖与侵袭的影响[J].山东医药,2015,55(31):14.
[11]Zhou XC,Hu Y,Dai L,et al.MicroRNA-7 inhibits tumor metastasis and reverses epithelial-mesenchymal transition through AKT/EFK1/2 inactivation by targeting EGFR in epithelial ovarian cancer[J].PloS One,2014,9(5):e96718.
[12]Chen Y,Meng L,Yu Q,et al.The miR-134 attenuates the expression of transcription factor FOXM1 druing pluripotent NT2/D1 embryonal carcinoma cell diffrentiation[J].Exp Cell Res,2015,330(2):442.
[13]Li T,Pan H,Li R.The dual regulatory role of miR-204 in cancer[J].Tumour Biol,2016,37(9):11667.
[14]周保贞,王大广,郑雷振,等.胃癌患者血清中miR-204水平变化及与幽门螺杆菌感染的关系[J].中国实验诊断学,2017,21(3):485.
[15]Turner DP,Findlay VJ,Moussa O,et al.Mechanisms and functional consequences of PDEF protein expression loss during prostate cnacer progression[J].Prostate,2011,71(16):7123.
[16]张林超,赵俊峰,孙继建.微小RNA204在人肾透明细胞癌中的表达及临床意义[J].重庆医学,2015,44(15):2034.
[17]蒋成义,汪洪涛,周 蕾,等.microRNA-204在鼻咽癌中的表达及生物学意义研究[J].中国免疫学杂志,2015,31(6):822.
[18]李丽霞,黎东明,袁亚连,等.miR-204在非小细胞肺癌患者中的表达及对SIRTI的靶向调控作用[J].广东医科大学学报,2017,35(3):266.
[19]许有忠,田作春,李 才.MicroRNA-204在非小细胞肺癌患者组织中的表达及对癌细胞增殖和凋亡的影响[J].中国现代医学杂志,2018,28(4):57.
[20]刘东利,贺小龙.miR-134靶向EGFR对非小细胞癌增殖的影响[J].临床肿瘤学杂志,2016,21(12):1063.

