姜黄素固体脂质纳米粒和微胶囊的制备、表征及体内药动学的比较研究
张心洁,廖洋样,廖 婉,李 锐
成都中医药大学 西南特色中药资源国家重点实验室,药学院,四川 成都 611137
姜黄为姜科植物姜黄Curcuma longaL.的干燥根茎,姜黄素是姜黄的主要活性成分之一,是一种以1,7-二芳基庚二烯为基本骨架的多酚类化合物[1],具有抑菌抗炎、抗氧化、抗肿瘤、护肝利胆、抗阿尔兹海默症和免疫调节肠道菌群等药理作用[2-9],且无明显不良反应,可广泛应用于医药领域和食品产业。然而,由于姜黄素水溶性差、口服吸收少、首过效应强、生物利用度低等缺陷[10-11],严重限制其临床应用与产品开发。因此,研制新型给药系统、开发前体药和联合佐剂[12],以期提高姜黄素口服吸收率和生物利用度,是近年来姜黄素的研究热点。
固体脂质纳米粒(solid lipid nanoparticles,SLN)是以天然或合成的固体脂质为载体材料,采用薄膜-超声分散、乳化蒸发-低温固化、高压均质等制备方法,将生理相容性较好的药物包裹或内嵌于类脂核中,制成粒径在1~1000 nm 的固态胶粒[13-14];微胶囊是采用复凝聚、界面聚合、喷雾干燥等方法,将芯材物质包裹在天然或合成高分子材料的壁材中,形成具有半透性或密封性囊膜的药库型微粒[15-16]。这2 种制剂方法都能较高程度地避免药物与外界环境的接触,提高药物的稳定性和水溶性,增加药物的靶向性和缓释性,是目前解决姜黄素等难溶性药物生物利用度低的重要手段。
本研究采用薄膜-超声分散法制备姜黄素固体脂质纳米粒(curcumin SLN,Cur-SLN),采用均质乳化-喷雾干燥法制备姜黄素微胶囊(curcumin microcapsules,Cur-MC),通过比较2 种姜黄素制剂的理化表征和SD 大鼠体内药动学行为,综合评价2 种制剂方法,对提高姜黄素生物利用度的作用,为姜黄素制剂方法选择提供依据。
1 仪器与材料
1.1 仪器
FA2204 型电子分析天平,上海衡平仪器仪表厂;YRE-201D 型旋转蒸发仪,予华仪器有限公司;SB-5200DT 型超声波清洗器、XHF-DY 型高速分散器,宁波新芝生物科技有限公司;TX-10 型超高压微射流均质机,加拿大ATS 有限公司;B-290 型喷雾干燥机,瑞士Buchi 有限公司;Regulus-8100 型场发射扫描电子显微镜(SEM)、H-7800 型透射电子显微镜(TEM),日本日立公司;Litesizer 500 型激光粒度仪,奥地利Anton Paar 公司;Ultimate 3000型高效液相色谱仪,美国Thermo 公司;3H16RI型冷冻离心机,湖南赫西仪器有限公司;QL-901 型涡旋混合机,其林贝尔仪器公司;DN-12A 型氮吹仪,上海比朗仪器有限公司;X500R QTOF 型质谱仪、Triple QuadTM3500 型质谱仪,美国Sciex 公司;UPLC LC-30A 型超高效液相色谱仪,日本岛津公司;Acquity UPLC H-Class 型超高效液相色谱仪,美国Waters 公司。
1.2 药品与试剂
姜黄素,质量分数≥95%,批号C12811019,成都麦克林生物科技有限公司;姜黄素对照品,质量分数≥99%,批号201902AD,成都普思生物科技有限公司;马钱苷对照品,批号DSTDM003802,质量分数≥98%,成都德思特生物科技有限公司;Cur-glu对照品,质量分数96.63%,批号LY-CH-20220217,广州珑莹生物科技有限公司;硬脂酸、大豆卵磷脂、二氯甲烷、丙酮、聚山梨酯-80、无水乙醇,分析纯,成都市科隆化学品有限公司;抗坏血酸钠棕榈酸酯、辛烯基琥珀酸淀粉钠、麦芽糊精,食品级,浙江一诺生物科技有限公司;乙腈、甲醇和甲酸,色谱纯,美国Sigma 公司;反渗透(reverse osmosis,RO)水,易普易达PLUS-E2-20TJ 纯水机制备。
1.3 实验动物
SPF 级雄性SD 大鼠,6 周龄,体质量200~220 g,购自成都达硕实验动物有限公司,实验动物生产许可证号SCXK(川)2020-030。饲养环境温度20~25 ℃,相对湿度40%~50%。动物实验由成都中医药大学动物伦理委员会标准,伦理批准号SYXK(川)2020-124。
2 方法与结果
2.1 Cur-SLN、Cur-MC 的制备与工艺对比
2.1.1 Cur-SLN 的制备 称取0.6 g 姜黄素溶于35 mL 丙酮,超声溶解,另取2.4 g 大豆卵磷脂和1.2 g硬脂酸溶于50 mL 二氯甲烷,将2 种溶液混合均匀,于40 ℃水浴旋转蒸发除去有机溶剂,待瓶壁形成均匀薄膜后,加入60 mL 1%聚山梨酯-80 溶液,超声40 min,即得Cur-SLN 混悬液[17]。
2.1.2 Cur-MC 的制备 称取2.0 g 姜黄素和0.1 g抗坏血酸棕榈酸酯溶于20 mL 无水乙醇,超声溶解,于50 ℃水浴旋蒸挥去溶剂,得到姜黄素-抗坏血酸棕榈酸酯共晶体,另取4.0 g 新烯基琥珀酸淀粉钠和3.0 g 麦芽糊精,溶于50 mL RO 水,65 ℃水浴搅拌至溶解,冷却至40 ℃,加入共晶体,以6000 r/min 高速乳化20 min 得到初乳,100 MPa 高压均质5 min,均质乳经喷雾干燥处理(进风温度为195 ℃,出风温度为95 ℃),即得Cur-MC 固体粉末[18-19]。
2.1.3 2 种制备工艺的对比 Cur-SLN 和Cur-MC制备工艺的对比见表1,其中,辅料的分类与最大添加量参考GB 2760-2014《食品安全国家标准食品添加剂使用标准》规定。

表1 Cur-SLN、Cur-MC 制备工艺的对比Table 1 Comparison of preparation techniques of Cur-SLN and Cur-MC
2.2 HPLC 法测定Cur-SLN 和Cur-MC 中姜黄素
2.2.1 供试品溶液的制备 将“2.1.2”项下制备得到的Cur-MC 按质量比1∶25 加入RO 水搅拌溶解,得到Cur-MC 复原乳。精密量取Cur-SLN 和Cur-MC复原乳各1 mL 置于10 mL 量瓶中,加入乙腈破乳并定容至刻度,摇匀,精密吸取上述溶液1 mL 置于10 mL 量瓶中,加乙腈定容,经0.45 μm 微孔滤膜过滤,即得供试品溶液。
2.2.2 色谱条件 色谱柱为YMC-Pack ODS-A 分析柱(250 mm×4.6 mm,12 nm);流动相为0.1%甲酸水溶液-乙腈(52∶48);体积流量1 mL/min;柱温30 ℃;检测波长425 nm;进样量10 μL。在该检测条件下,姜黄素色谱峰峰形稳定,无干扰,专属性佳。
2.2.3 线性关系考察 精密称取经干燥处理的姜黄素对照品适量,溶于50 mL 乙腈,即得质量浓度为443.8 μg/mL 的姜黄素对照品储备液。
取姜黄素储备液适量,配制系列质量浓度为177.50、88.75、44.38、22.19、11.09、5.55 μg/mL 的对照品溶液,按“2.2.2”项下色谱条件进样测定,以质量浓度为横坐标(X),峰面积为纵坐标(Y)进行线性回归分析,得回归方程为Y=1.430 5X+2.047 3,R2=0.999 2,结果表明姜黄素在5.55~177.50 μg/mL 线性关系良好。
2.2.4 精密度试验 取质量浓度为44.38 μg/mL 的对照品溶液,连续测定6 次,姜黄素峰面积的RSD为1.74%,表明仪器精密度良好。
2.2.5 稳定性试验 取Cur-SLN 和Cur-MC,按“2.2.1”项下方法处理,分别制备Cur-SLN 和Cur-MC 供试品溶液,于室温放置0、2、4、8、12、24 h 后进样测定,结果姜黄素峰面积的RSD 分别为1.32%和1.45%,表明供试品溶液在24 h 内稳定性良好。
2.2.6 重复性试验 分别取Cur-SLN 和Cur-MC,按照“2.2.1”项方法平行制备Cur-SLN 和Cur-MC供试品溶液各6 份,HPLC 法测定姜黄素含量,结果显示Cur-SLN 和Cur-MC 中姜黄素含量的RSD分别为1.83%和2.24%,表明该方法重复性良好。
2.2.7 加样回收率试验 分别取Cur-SLN 和Cur-MC 复原乳各0.5 mL,置于10 mL 量瓶中,以制剂中姜黄素含量的50%、100%、150%加入姜黄素对照品后,按“2.2.1”项下方法处理,测定姜黄素含量,计算回收率,结果显示Cur-SLN、Cur-MC 的平均加样回收率分别为99.68%、98.69%,RSD 分别为1.15%、1.27%,表明该方法准确度良好。
2.3 Cur-SLN 和Cur-MC 的性状表征
2.3.1 外观形态的观察 取姜黄素原料药、Cur-SLN(经干燥处理)、Cur-MC 适量,使用双面碳胶带将样品粘到样品台,吹去多余粉末后金属镀膜,在加速电压为15 kV 的SEM 下观察并拍照;另取姜黄素原料药、Cur-SLN 和Cur-MC 复原乳适量,加RO 水稀释30 倍后,滴加于覆盖碳膜的铜网上,采用1.0%磷钨酸负染2 min,静置晾干,在加速电压为120 kV 的TEM 下观察并拍照记录。SEM 结果见图1-A,姜黄素原料药多为柱状或块状结晶,Cur-SLN 多黏附聚集成不规则形状,Cur-MC 多呈表面光滑的圆球状,Cur-SLN 和Cur-MC 中均无姜黄素晶体的存在,表明姜黄素存在状态改变;TEM 结果见图1-B,游离姜黄素(free curcumin,Cur-F)无定形,大多聚集成团,分布不均,Cur-SLN 呈球状,形态圆整,Cur-MC 呈椭球状,外层可见囊壁结构,相较于Cur-F,二者粒子分散均匀,无聚集黏结现象。

图1 Cur-F、Cur-SLN 和Cur-MC 的SEM 图(×2500,A)与TEM 图(×50 000,B)Fig.1 SEM image(× 2500,A)and TEM image(× 50 000,B)of Cur-F,Cur-SLN and Cur-MC
2.3.2 粒径、ζ 电位的测定 按照“2.1”项下方法制备Cur-SLN 和Cur-MC,各3 批,RO 水溶解稀释30 倍后,测定Cur-SLN 和Cur-MC 复原乳的粒径分布及ζ 电位。Cur-SLN 和Cur-MC 复原乳的粒度分布见图2-A,Cur-SLN 的平均粒径为(184.3±7.9)nm,多分散指数(polydispersity index,PDI)为0.223±0.036,Cur-MC 复原乳的平均粒径为(415.3±10.3)nm,PDI为0.181±0.030;Cur-SLN 和Cur-MC 复原乳的ζ 电位分布见图2-B,Cur-SLN 的ζ 电位平均值为(-48.1±0.9)mV,Cur-MC 复原乳的ζ 电位平均值为(-16.4±0.4)mV。根据结果可知,Cur-SLN 体系的稳定性优于Cur-MC。

图2 Cur-SLN(I)、Cur-MC(II)的粒径分布(A)与ζ 电位(B)Fig.2 Particle size distribution(A)and ζ potential(B)of Cur-SLN(I)and Cur-MC(II)
2.3.3 包封率、载药量的测定 精密量取Cur-SLN和Cur-MC 复原乳各2 mL,置于超滤离心管,8000 r/min 离心(离心半径为9.21 cm)20 min,取续滤液1 mL 置于10 mL 量瓶,加乙腈定容至刻度,测定游离姜黄素的含量(W游离);另取Cur-SLN 和Cur-MC 复原乳各1 mL,按“2.2.1”项下方法处理,采用HPLC 法测定姜黄素的总含量(W总),计算包封率和载药量。经测定,Cur-SLN 和Cur-MC 的包封率和载药量结果见表2,Cur-SLN 和Cur-MC 的平均包封率分别为(92.33±1.04)%和(97.79±0.45)%,平均载药量分别为(10.03±0.40)%和(19.97±0.12)%,结果表明,Cur-MC 的包封率和载药量均大于Cur-SLN。
表2 Cur-SLN 和Cur-MC 的包封率和载药量(±s,n = 3)Table 2 Entrapment efficiency and drug-loading capacity of Cur-SLN and Cur-MC(±s,n = 3)
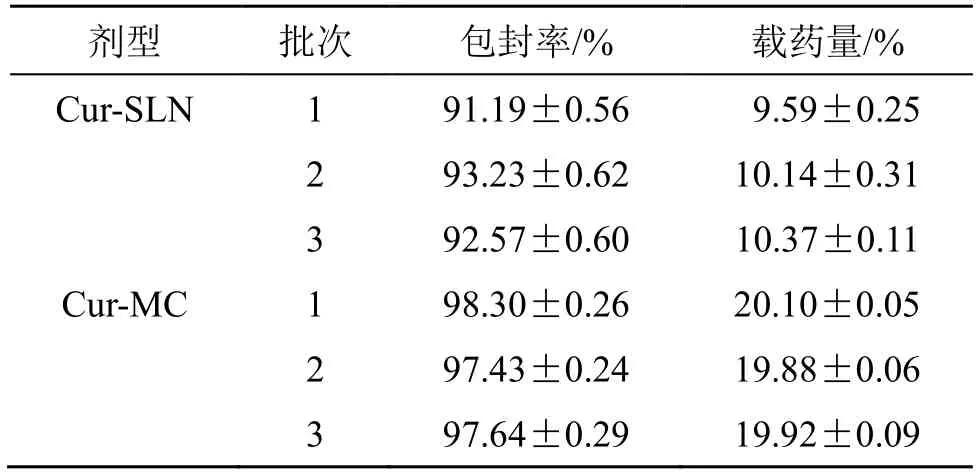
表2 Cur-SLN 和Cur-MC 的包封率和载药量(±s,n = 3)Table 2 Entrapment efficiency and drug-loading capacity of Cur-SLN and Cur-MC(±s,n = 3)
剂型 批次 包封率/% 载药量/%Cur-SLN 1 91.19±0.56 9.59±0.25 2 93.23±0.62 10.14±0.31 3 92.57±0.60 10.37±0.11 Cur-MC 1 98.30±0.26 20.10±0.05 2 97.43±0.24 19.88±0.06 3 97.64±0.29 19.92±0.09
包封率=(W总-W游离)/W总
载药量=(W总-W游离)/(W载体+W总-W游离)
2.3.4 Cur-SLN 和Cur-MC 在水中溶解度的测定采用平衡法考察Cur-SLN、Cur-MC 和姜黄素原料药在水中的溶解度。量/称取Cur-SLN、Cur-MC 和姜黄素原料药过量,分别加入RO 水适量,形成过饱和溶液,于(25±2)℃搅拌溶解,直至溶解平衡,静置后取上清液,照“2.2.1”项下破乳处理后经0.45 μm 微孔滤膜滤过,采用HPLC 法测定姜黄素含量。经测定,Cur-SLN 和Cur-MC 在水中姜黄素的溶解度分别为(0.23±0.02)、(0.17±0.01)g/L,而姜黄素原料药在水中几乎不溶,HPLC 无法检出姜黄素,Tabanelli 等[20]研究发现姜黄素的溶解度约为11 μg/L,表明Cur-SLN、Cur-MC 可显著提高姜黄素的水溶性。
2.4 体外释药性能的考察
采用透析法考察Cur-SLN 和Cur-MC 的释药特点,以含40%乙醇的生理盐水作为释放介质,温度为(37±1)℃,转速为150 r/min。精密量/称取Cur-SLN、Cur-MC 和姜黄素原料药适量(姜黄素含量均为5 mg),加入等量释放介质混匀后,分别装入预处理好的透析袋(截留相对分子质量12 000)内,置于200 mL 释放介质中,于1、2、3、4、6、8、10、12、24、36、48、60、72 h 分别取样5 mL,并及时补充空白介质5 mL。HPLC 法测定姜黄素含量,计算累积释放率,绘制体外释药曲线。
结果见图3,姜黄素原料药在12 h 内快速释药,此后释放介质中药物浓度无明显变化,累积释放率为51.12%,这可能是由于姜黄素混悬液中姜黄素主要以大颗粒形态存在,与释放介质的接触面积小,难以溶出。而Cur-SLN 和Cur-MC 在72 h 内的药物累积释放率分别为87.79%、83.02%,前12 h 释药迅速,累积释放率分别为68.69%、59.73%,属于突释阶段,这可能与制剂中存在少量游离姜黄素有关,12 h 后释药速率减慢,属于缓释阶段;采用零级、一级和Higuchi 释药模型对Cur-SLN、Cur-MC 的体外释药行为进行拟合,发现二者的体外释过程均符合一级释药模型,Cur-SLN 的拟合方程为Mt=83.911 2(1-e-0.1155t)(R2=0.987 4),Cur-MC 的拟合方程为Mt=76.894 8(1-e-0.1094t)(R2=0.986 6)。

图3 Cur-F、Cur-SLN 和Cur-MC 的体外释药曲线(±s,n = 3)Fig.3 In vitro release curve of Cur-F,Cur-SLN and Cur-MC(±s,n = 3)
2.5 动物给药、血样采集与预处理
将SD 雄性大鼠随机分为3 组,每组8 只。采用RO 水稀释姜黄素原料药、Cur-SLN 和Cur-MC,按200 mg/kg 的给药剂量(以姜黄素含量计),3 组大鼠分别ig Cur-F、Cur-SLN 和Cur-MC 后,于给药后0.5、1、2、4、6、8、12、24、48 h 经眼眶后静脉丛取血0.5 mL,血样置于1%肝素钠生理盐水离心试管,于4 ℃、10 000 r/min 离心(离心半径为8.5 cm)6 min,取上清液,-80 ℃冰箱保存备用。
2.6 体内代谢产物的结构鉴定(定性分析)
2.6.1 血浆样品的处理 取9 个时间点的血浆各50 μL 混合均匀,加入2 mL 乙腈沉淀蛋白,涡旋振荡2 min,10 000 r/min 离心(离心半径为8.5 cm)6 min,取上层有机相,于30 ℃氮气吹干,加入200 μL 甲醇,涡旋振荡1 min,超声处理2 min,10 000 r/min 离心(离心半径为8.5 cm)3 min,取上清液进行检测。
2.6.2 UPLC-QTOF-ESI-MS/MS 分析条件
(1)色谱条件:色谱柱为Perkin Elmer C18分析柱(50 mm×2.1 mm,1.9 μm);流动相为0.1%甲酸水溶液-乙腈,梯度洗脱:0~3 min,10%~30%乙腈;3~6 min,30%~50%乙腈;6~9 min,50%~70%乙腈;9~12 min,70%~90%乙腈;12~13 min,90%乙腈;13~14 min,90%~10%乙腈;体积流量0.3 mL/min;柱温35 ℃;检测波长425 nm;进样量5 μL。
(2)质谱条件:电喷雾离子源(ESI);负离子模式;离子源温度330 ℃;气帘气172.369 kPa(25 psi);离子化电压-4500 V;离子源气体1 344.738 kPa(50 psi);离子源气体2 344.738 kPa(50 psi);碰撞气体48.263 kPa(7 psi)。
2.6.3 姜黄素及其代谢产物Cur-glu 的质谱裂解与结构鉴定 姜黄素及其代谢产物Cur-glu 的提取离子流、二级质谱图与推测的裂解途径见图4,鉴定发现在该分析条件下,姜黄素的特征碎片离子为[M-H]-m/z367.112 4、217.067 8、149.072 6,Curglu 的特征碎片离子为[M-H]-m/z543.196 5、367.116 7、217.068 1。结合对照品的特征裂解质谱图分析鉴定,表明大鼠血浆代谢物中含有姜黄素原型成分及其II相葡萄糖醛酸代谢化产物Cur-glu。

图4 姜黄素(A)与Cur-glu(B)的提取离子流(I)、二级质谱(II)和裂解途径分析(III)Fig.4 XIC chromatograms(I),secondary mass spectrum(II)and fragmentation pathways analysis(III)of curcumin(A)and Cur-glu(B)
2.7 血浆中血药浓度的检测(定量分析)
2.7.1 对照品与内标储备液的制备 分取姜黄素对照品、Cur-glu 对照品和马钱苷对照品适量,精密称定,甲醇溶解,配制成姜黄素储备液(63.40 μg/mL)、Cur-glu 储备液(425.50 μg/mL)和内标储备液(32.34 μg/mL)。分取姜黄素储备液和Cur-glu 储备液稀释成质量浓度为0.20、0.40、0.79、1.58、3.17、6.34、12.68 μg/mL 的系列姜黄素对照品溶液和0.83、3.32、13.30、26.60、53.19、106.38、212.75 μg/mL 的系列Cur-glu 对照品溶液;姜黄素和Cur-glu 质控溶液的高、中、低质量浓度分别为10.14、2.03、0.40 μg/mL和170.20、17.02、1.70 μg/mL。
2.7.2 血浆样品的处理 取210 μL 血浆,加入20 μL 内标溶液(3.23 μg/mL),涡旋振荡2 min,超声处理1 min,加入1 mL 乙腈沉淀蛋白,10 000 r/min的转速离心(离心半径为8.5 cm)6 min,取上层有机相,于30 ℃氮气吹干,加入100 μL 甲醇,涡旋振荡1 min,超声处理2 min,10 000 r/min 离心(离心半径为8.5 cm)3 min,取上清液检测。
2.7.3 UPLC-ESI-MS/MS 分析条件
(1)色谱条件:色谱柱为Analytical DB C18色谱柱(50 mm×2.1 mm,1.9 μm);流动相为0.1%甲酸水溶液-乙腈,梯度洗脱:0~2 min,5%~30%乙腈;2~3 min,30%~40%乙腈;3~5 min,40%~50%乙腈;5~7 min,50%~95%乙腈;7~8 min,95%~5%乙腈;8~9 min,5%乙腈;体积流量0.3 mL/min;柱温40 ℃;检测波长425 nm;进样量5 μL。
(2)质谱条件:ESI源;负离子模式扫描;离子源温度330 ℃;气帘气241.317 kPa(35 psi);离子化电压-4500 V;离子源气体1 110.316 kPa(16 psi);离子源气体2 124.106 kPa(18 psi);碰撞气体48.263 kPa(7 psi);定量分析的离子反应对为姜黄素m/z367.1→217.1,碰撞能-20 V;Cur-glum/z543.0→217.1,碰撞能-27 V;马钱苷m/z389.1→226.7,碰撞能-15 V。
2.7.4 方法学考察
(1)专属性:将适量姜黄素、Cur-glu 和马钱苷对照品溶液加入空白血浆样品中作为加标样品,在多反应监测(multi-reaction monitoring,MRM)模式下检测,通过对比空白血浆样品、加标血浆样品与给药组血浆样品的质谱图,确定分析方法的专属性。结果见图5,2 个待测物与内标物相互之间无检测干扰,且血浆基质不会对检测造成内源性干扰,表明分析方法的专属性良好。

图5 姜黄素、Cur-glu 和马钱苷的提取离子色谱图Fig.5 MRM ion chromatograms of curcumin,Cur-glu and loganin
(2)线性关系考察与定量限:取210 μL 血浆,加入“2.7.1”项下系列对照品溶液各10 μL,按“2.7.2”项下方法处理,制备分别含0.02、0.04、0.08、0.16、0.32、0.63、1.27 μg/mL 姜黄素和0.08、0.33、1.33、2.66、5.32、10.64、21.28 μg/mL Cur-glu 以及3.23 μg/mL 马钱苷内标物的血浆样品,以待测物与内标物的峰面积比值为横坐标(X),待测物的质量浓度为纵坐标(Y),进行线性回归分析;另取姜黄素、Cur-glu 对照品溶液逐渐稀释,按“2.7.2”项下方法处理后进样测定,以信噪比为10 的质量浓度作为定量限。得到姜黄素的标准曲线回归方程为Y=0.088 6X-0.025 0,R2=0.995 1,表明姜黄素在0.02~1.27 μg/mL 线性关系良好,定量限为19.81 ng/mL;Cur-glu 的标准曲线回归方程为Y=0.140 3X-0.065 8,R2=0.998 8,表明Cur-glu 在0.08~21.28 μg/mL 线性关系良好,定量限为20.78 ng/mL。
(3)精密度与准确度:取210 μL 空白血浆和10 μL 质控溶液,按“2.7.2”项下方法处理,制备高、中、低3 个质量浓度的质控样品(姜黄素:1.01、0.20、0.04 μg/mL;Cur-glu:17.02、1.70、0.17 μg/mL),各质量浓度平行制备6 份,分别在1、3 d 内连续测定,结果见表3,待测物的日内精密度和日间精密度均小于15%,准确度在±15%以内,符合生物样品的分析要求,该方法适用于大鼠血浆中姜黄素和Cur-glu 的含量测定。
表3 姜黄素和Cur-glu 的日内、日间精密度及准确度(±s)Table 3 Intra-and inter-day precision and accuracy of curcumin and Cur-glu(±s)

表3 姜黄素和Cur-glu 的日内、日间精密度及准确度(±s)Table 3 Intra-and inter-day precision and accuracy of curcumin and Cur-glu(±s)
待测物 质量浓度/(μg·mL-1)日内(n=6)日间(n=3)平均值/(μg·mL-1)准确度/% 精密度/% 平均值/(μg·mL-1)准确度/% 精密度/%姜黄素 0.04 0.041±0.004 2.08 8.68 0.039±0.003-3.33 7.47 0.20 0.205±0.008 2.50 4.12 0.204±0.009 1.83 4.46 1.01 1.033±0.031 2.24 3.02 0.990±0.032-1.98 3.27 Cur-glu 0.17 0.172±0.011 1.47 6.43 0.176±0.007 3.33 4.00 1.70 1.727±0.076 1.57 4.41 1.653±0.081-2.75 4.89 17.02 17.197±0.333 1.04 1.94 16.823±0.631-1.16 3.75
(4)加样回收率和基质效应:按“2.7.2”项下方法处理制备高、中、低质量浓度的质控样品(A);取空白血浆按“2.7.2”项下方法处理后取上清液,每90 μL 上清液加入10 μL 质控溶液,制备高、中、低质量浓度质控样品(B);取甲醇制备与质控样品等质量浓度的质控溶液(C)。计算A 与C 溶液、B与C 溶液的峰面积比值,分别确定回收率和基质效应。姜黄素各质量浓度的回收率为 89.65%~96.27%,RSD 小于9.34%,基质效应为86.28%~97.52%,RSD 小于5.68%;Cur-glu 各质量浓度的回收率为91.73%~98.15%,RSD 小于6.96%,基质效应为90.59%~97.36%,RSD 小于4.21%,符合生物样品分析对回收率和基质效应的要求。
(5)稳定性:平行制备高、中、低质量浓度的质控样品各6 份,分别于室温储存6 h、-80 ℃储存30 d、-20 ℃至室温反复冻融3 次后进样分析,计算各成分的质量浓度,进行短期、长期和冻融稳定性的考察。3 个质量浓度的姜黄素和Cur-glu 质控样品短期稳定性的准确度为-6.57%~1.53%,长期稳定性的准确度为-6.21%~2.34%,冻融稳定性的准确度为-11.89%~0.56%。准确度均在±15%范围内,表明样品稳定性好,符合生物样品分析要求。
2.7.5 体内药动学研究 取Cur-F 组、Cur-SLN 组和Cur-MC 组的血浆样品,照“2.7.2”项下方法处理后进行含量测定,绘制血药浓度-时间曲线见图6,采用PK Solver 2.0 软件对所得数据进行非房室模型进行分析,计算得出相关的药动学参数,并对各组主要的药动学参数应用SPSS 26.0 进行独立样本t检验,结果见表4。
表4 ig 后大鼠血浆中姜黄素和Cur-glu 的药动学参数(±s,n = 8)Table 4 Pharmacokinetic parameters of curcumin and Cur-glu in rat plasma after ig(±s,n = 8)
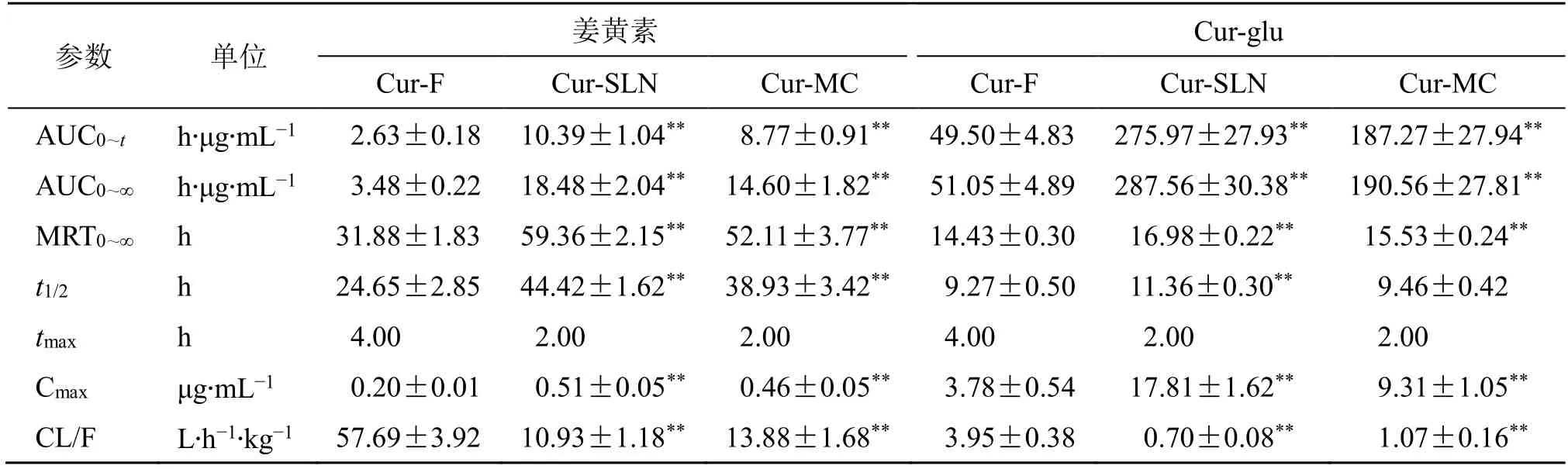
表4 ig 后大鼠血浆中姜黄素和Cur-glu 的药动学参数(±s,n = 8)Table 4 Pharmacokinetic parameters of curcumin and Cur-glu in rat plasma after ig(±s,n = 8)
与Cur-F 组比较:**P<0.01**P < 0.01 vs Cur-F
参数 单位 姜黄素 Cur-glu Cur-F Cur-SLN Cur-MC Cur-F Cur-SLN Cur-MC AUC0~t h·μg·mL-1 2.63±0.18 10.39±1.04** 8.77±0.91** 49.50±4.83 275.97±27.93** 187.27±27.94**AUC0~∞ h·μg·mL-1 3.48±0.22 18.48±2.04** 14.60±1.82** 51.05±4.89 287.56±30.38** 190.56±27.81**MRT0~∞ h 31.88±1.83 59.36±2.15** 52.11±3.77** 14.43±0.30 16.98±0.22** 15.53±0.24**t1/2 h 24.65±2.85 44.42±1.62** 38.93±3.42** 9.27±0.50 11.36±0.30** 9.46±0.42 tmax h 4.00 2.00 2.00 4.00 2.00 2.00 Cmax μg·mL-1 0.20±0.01 0.51±0.05** 0.46±0.05** 3.78±0.54 17.81±1.62** 9.31±1.05**CL/F L·h-1·kg-1 57.69±3.92 10.93±1.18** 13.88±1.68** 3.95±0.38 0.70±0.08** 1.07±0.16**

图6 ig 后大鼠血浆中姜黄素(A)和Cur-glu(B)的血药浓度-时间曲线(±s,n = 8)Fig 6 Concentration-time curves of curcumin(A)and Curglu(B)in rat plasma after ig(±s,n = 8)
与Cur-F 组相比,Cur-SLN 组与Cur-MC 组姜黄素的达峰浓度(Cmax)分别由(0.20±0.01)μg/mL显著提高至(0.51±0.05)、(0.46±0.05)μg/mL,且半衰期(t1/2)、平均滞留时间(MRT0~∞)显著延长,达峰时间(tmax)由4 h 提前至2 h,相对生物利用度分别提高了4.31 和3.19 倍;与Cur-F 组相比,Cur-SLN 组与Cur-MC 组Cur-glu 的Cmax分别由(3.78±0.54)μg/mL 显著提高至(17.81±1.62)、(9.31±1.05)μg/mL,MRT0~∞显著增加,Cur-SLN 组的t1/2显著延长,而Cur-MC 组的t1/2有所延长,但无显著性差异,口服相对生物利用度分别增加4.63和2.73 倍。
3 讨论
姜黄素作为中药姜黄含量丰富的有效成分,药理作用广泛、安全范围大,医药、大健康及食品产业等领域对其的需求日益增加,然而受制于溶解度差、生物利用度低等缺陷,姜黄素相关产品的开发与应用十分有限[21],因此,寻求有效提高姜黄素水溶性和生物利用度的方法是推动姜黄素产业发展亟待解决的关键。
采用薄膜-超声分散法制备得到的Cur-SLN 微粒圆整均一、分布均匀,粒径在200 nm 左右,可显著提高姜黄素在水溶液中的溶解度,体外释药行为符合一级释药模型,具有一定的缓释效果;SD 大鼠给药Cur-SLN 后,相较于游离姜黄素,血浆中姜黄素及葡萄糖醛酸代谢物Cur-glu 的药动学参数有了显著提升,姜黄素的口服相对生物利用度提高了4.31 倍,Cur-glu 提高了4.63 倍。采用均质乳化-喷雾干燥法制备得到的Cur-MC 微粒表面光滑、囊壁无破损皱缩,复原乳粒径在400 nm 左右,可有效提高姜黄素的水溶性,体外释药行为同样符合一级释药模型且具有缓释效果;口服给药后,SD 大鼠血浆中姜黄素与Cur-glu 的相关药动学参数,较Cur-F 组均显著提高,相对生物利用度分别增加了3.19 和2.73 倍。
依据药物溶出度和肠道渗透性原理,生物药剂学分类系统(biopharmaceutics classification system,BCS)将姜黄素归于低溶解性、低渗透性的第IV 类药物,姜黄素水溶性差、代谢快,能与多药耐药蛋白转运体相结合致使药物外排[22],从而导致其口服生物利用度低,药效难以发挥。Cur-SLN 和Cur-MC通过降低姜黄素颗粒粒径达到纳米级,增加比表面积,提高其在水中的溶解度,还能提高在黏膜上皮细胞中的溶解度和通透性,促进胃肠道吸收进入机体循环,从而提高姜黄素的口服生物利用度;此外,Cur-SLN 的表面活性剂可抑制P-糖蛋白的外排作用,脂质成分可促使肠道内形成乳糜颗粒[23-24],进一步提高姜黄素的生物利用度。
2 种制剂方法均能显著提高姜黄素的溶解度和生物利用度,其中,Cur-SLN 的制备方法简单便捷,对设备仪器的需求不高,但该方法使用丙酮、二氯甲烷作为分散溶剂,存在有机残留的风险,安全性难以保证,且载药量较低,目前难以实现单分散产品的商业化生产,多适用于实验室阶段的小试试验。Cur-MC 的制备选用乳化性和成膜性俱佳的辛烯基琥珀酸淀粉钠作为壁材,辅以麦芽糊精改善其氧化稳定性[19],绿色环保、安全性高,成品为固体粉末,载药量较高,具有性质稳定、可长期储存、运输携带方便等优势,且喷雾干燥法操作简单、成本低廉,易于实现工业自动化连续生产[25-26]。
综上所述,固体脂质纳米粒和微胶囊均能显著改善姜黄素水溶性和生物利用度,且固体脂质纳米粒略优于微胶囊,是目前实验室初步试验的优选,但由于其辅料的安全性、制剂的局限性等多重因素的限制,还需进一步改善制备方法以适应食品健康行业的大生产。姜黄素微胶囊的辅料安全性高、载药量大,可优化其工艺条件以减小粒径,进而更好地提高姜黄素的生物利用度。
利益冲突所有作者均声明不存在利益冲突

