不同附子炮制品四逆汤化学成分及毒性差异分析
刘 洪,钟凌云,邓延文,童恒力,陈 浩,王 硕,卢兴美
江西中医药大学,江西 南昌 330004
四逆汤为汉代张仲景所著《伤寒论》中用于治疗心肾阳衰寒阙证的主方,由附子、干姜、炙甘草组成。四逆汤原始方以生附片入方[1],借生附子的峻烈强心作用发挥回阳救逆的作用,但因其主成分双酯型生物碱过高极易使机体中毒,难以把握其用药剂量,故后续各种校订本中多以炮制品入药[2]。附子经不同方法炮制后,不仅可以降低其毒性,还能改变其药性,便于临床根据病症发展程度以及个体的差异选择合适的炮制品,体现了中医方剂因病而异、因人而异的治疗特点。
《中国药典》2020年版[3]中四逆汤单以淡附片入方,而林美斯等[4]使用了生附片、淡附片、白附片、黑顺片、炮附片5 种附子炮制品四逆汤用于急性脑缺氧治疗,结果表明淡附片入方的四逆汤在该病中疗效更佳。同时,吴文笛等[5]在《伤寒论》《中国药典》和地方名中医使用的四逆汤治疗脓毒症的药效学研究和急性毒性研究中,发现与《伤寒论》和药典法四逆汤处方相比,地方名中医的经验方四逆汤不仅具有更好的治疗脓毒症作用且毒性最小。上述研究说明,临床在使用四逆汤用于不同病症治疗时,应选择合适附子炮制品入方,以最大限度的提高四逆汤的疗效并减少其不良作用。
四逆汤中成分是其发挥疗效和产生不良反应的主要物质基础。在煎煮过程中,四逆汤中不同附子炮制品可能会与方中其他药物发生不同的反应,导致汤剂中效毒成分含量存在差异。同时,课题组前期研究发现江西建昌帮的单味阴附片、阳附片不仅存在效毒差异,且在改善慢性心衰大鼠的心功能时,还存在一定性别差异[6]。故以阴附片、阳附片入方四逆汤后可能会对方中的毒效成分含量产生不同的变化,进而影响该方临床用药的安全性。因此本研究首先分析了建昌帮阴附片、阳附片单药及其入方后的效/毒成分含量差异,同时对比了阴附片四逆汤、阳附片四逆汤、生附片四逆汤和淡附片四逆汤之间的毒性差异,以期为经典名方四逆汤扩大附子用药品种及用药安全提供科学依据。
1 仪器与材料
1.1 仪器
Acquity UPLC 超高效液相色谱仪,美国Waters公司;AE240 电子分析天平,十万分之一,梅特勒-托利多仪器上海有限公司;RE-52A/52AA 旋转蒸发仪、SZ-93 自动双重纯水蒸馏器,上海亚荣生化仪器厂;多功能煎药壶,潮州市潮安区顺电有限公司;Konelab PRIME 30 全自动生化分析仪,美国Thermo公司;小动物超声成像系统,富士胶片(中国)投资有限公司。
1.2 试剂与药品
乙腈、甲醇为色谱纯,澳大利亚Besto N 公司;水为娃哈哈纯净水;乌头碱(批号CHB201226)、新乌头碱(批号CHB201201)、次乌头碱(批号CHB201109)、苯甲酰乌头原碱(benzoylaconine,BAC,批号 CHB180309)、苯甲酰新乌头原碱(benzoylmesaconine,BMA,批号CHB180310)、苯甲酰次乌头原碱(bnzoylhypaconine,BHC,批号CHB180307)、甘草酸(批号CHB201104)、6-姜酚(批号CHB201111)对照品均购于成都克洛玛生物科技有限公司;甘草苷(批号wkq19030708)对照品购于四川维克奇生物科技有限公司;所用对照品质量分数均≥98%。盐附子(批号210315)、干姜(批号210122)、炙甘草(批号200826)均购于江西江中中药饮片有限公司,产地分别为四川江油、犍为及内蒙古阿拉善左旗,经江西中医药大学药学院龚千锋教授分别鉴定为毛茛科乌头属植物乌头Aconitum carmichaeliiDebx.的子根的加工品,姜科植物姜Zingiber officinaleRosc.的干燥根茎,豆科植物甘草Glycyrrhiza uralensisFisch.的干燥根和根茎炮制加工品,符合《中国药典》2020年版鉴定标准。
盐酸阿霉素,南京凯基生物科技发展有限公司,批号20210525;卡托普利,山西振东安欣生物制药有限公司,批号20211102;生理盐水,江西科伦药业有限公司,批号D22070306。
1.3 动物
ICR 小鼠雌雄各半共120 只,SPF 级,体质量18~22 g,购于河南斯克贝斯生物科技股份有限公司,动物合格证号:SCXK(豫)2020-0005。SD 大鼠雌雄各半共160 只,SPF 级,体质量180~200 g,购于江西中医药大学,动物合格证号:SCXK(赣)2018-0003。饲养条件:温度20~24 ℃,相对湿度40%~70%,人工光照,12 h 明暗周期。动物饲料为大小鼠维持颗粒配合饲料,武汉市万千佳兴生物科技有限公司。本实验获得江西中医药大学实验动物伦理委员会批准,伦理审批号为 JZSYDWLL-20201220。
2 方法与结果
2.1 附子饮片的制备
2.1.1 生附片[1]取盐附子,刮去外皮,用清水浸漂,每日换水2~3 次,至盐分漂尽,取出,切薄片,晒干,即得生附片(unprocessedAconitepiece,UAP)。
2.1.2 淡附片[3]取盐附子,用清水浸漂,每日换水2~3 次,至盐分漂尽,与甘草、黑豆加水共煮透心,至切开后口尝无麻舌感,取出,除去甘草,黑豆,切薄片,晒干,即得淡附片(GlycyrrhizacookedAconitepiece,GCAP)。
2.1.3 阴附片[7]取盐附子,用清水浸漂,漂至口尝微咸为度,取出晒干。用生姜汁闷润,以透心为度,取出。入木甑内,待锅中水沸,隔水坐锅,用武火蒸至药材熟透,口尝无或微有麻舌感时,停火取出,日摊夜闷至约七成干,内外水分均匀时,切成薄片,晾晒至干,筛去灰屑,即得阴附片(dried ginger steamedAconitepiece,DGSAP)。
2.1.4 阳附片[7]取盐附子,刮去外皮,切成3 mm厚片,用清水浸漂,漂至口尝味淡为度,捞起。摊开翻晒至全干。取净砂至锅内炒至滑利,倒入药片,不断翻炒,至药片断面鼓起,变白黄色为度,取出,筛去砂子及灰屑,摊凉,即得阳附片(sand friedAconitepiece,SFAP)。
2.2 汤剂的制备
2.2.1 附子单煎汤剂的制备[8]取单味附子饮片15 g,加饮片8 倍质量水浸泡30 min,武火(170 ℃)煮沸后改文火(120 ℃)煎煮30 min,滤出药渣。药渣加饮片7 倍质量水二次煎煮20 min,滤出药渣。合并2 次滤液,抽滤后浓缩定容。
2.2.2 不同附子炮制品四逆汤汤剂的制备 取四逆汤处方饮片(附子15 g、炙甘草15 g、干姜10 g),按上法制备不同附子炮制品四逆汤汤剂(Sini Decoction ,SND),分别为生附片四逆汤(UAPSND)、淡附片四逆汤(GCAPSND)、阴附片四逆汤(DGSAPSND)、阳附片四逆汤(SFAPSND)。
2.3 供试品、对照品溶液的制备
2.3.1 供试品溶液的制备 取“2.2”项下所制汤剂10 mL 于50 mL 圆底烧瓶中,减压挥干溶剂,乙腈溶解残渣,转移、定容于10 mL 量瓶,摇匀。0.25 μm微孔滤膜滤过,取续滤液,即得各汤剂供试品溶液。
2.3.2 对照品溶液的制备 分别精密称定乌头碱0.865 mg、新乌头碱0.345 mg、次乌头碱2.02 mg、BAC 2.25 mg、BMA 4.50 mg、BHC 1.65 mg、甘草苷7.26 mg、甘草酸7.88 mg、6-姜酚2.32 mg,置于棕色量瓶中,溶于2 mL 乙腈中,摇匀,即得各对照品母液。
2.4 色谱条件
色谱柱为Waters BEH C18(50 mm×2.1 mm,1.7 μm);流动相为乙腈-0.1%磷酸水溶液,梯度洗脱:0~8 min,10%~20%乙腈;8~15 min,20%~25%乙腈;15~20 min,25%~30%乙腈;20~30 min,30%~50%乙腈;30~40 min,50%~90%乙腈;体积流量0.2 mL/min;检测波长为235 nm;柱温为26 ℃;进样量为2 μL。混合对照品溶液及4 种四逆汤供试品溶液的色谱图见图1。

图1 混合对照品溶液及4 种四逆汤供试品溶液的UPLC 图Fig.1 UPLC of mixed reference substances solution and four kinds of Sini Decoction
2.5 方法学考察
2.5.1 精密度试验 取“2.3.2”项下各对照品母液适量配成混合对照品溶液,按“2.4”项下色谱条件连续进样测定6 次,计算得到乌头碱、新乌头碱、次乌头碱、BAC、BMA、BHA、甘草苷、甘草酸、6-姜酚峰面积的RSD 分别为0.88%、1.67%、0.61%、0.99%、1.42%、0.95%、1.06%、0.72%、0.37%,表明仪器精密度良好。
2.5.2 稳定性试验 取“2.3.1”项下淡附片四逆汤供试品溶液,分别于0、2、4、8、12、24 h 按“2.4”项下色谱条件重复进样3 次,计算得到乌头碱、新乌头碱、次乌头碱、BAC、BMA、BHA、甘草苷、甘草酸、6-姜酚峰面积的RSD 分别为0.35%、0.24%、0.43%、0.27%、0.30%、0.24%、0.23%、0.22%、0.27%,表明供试品溶液在24 h 内稳定性。
2.5.3 重复性试验 取6 份淡附片四逆汤处方重复制备6 份淡附片四逆汤供试品溶液,按“2.4”项下色谱条件重复进样3 次,计算得到乌头碱、新乌头碱、次乌头碱、BAC、BMA、BHA、甘草苷、甘草酸、6-姜酚质量分数的RSD 分别为1.81%、0.71%、1.96%、1.75%、0.90%、1.05%、0.28%、0.88%、1.58%,表明本方法具有可重复性。
2.5.4 线性关系考察 精密吸取“2.3.2”项下各对照品母液适量,乙腈定容至刻度线,即得系列对照品混合对照品溶液,其中乌头碱质量浓度梯度为173.0、86.5、51.9、34.6、17.3、4.3 μg/mL,新乌头碱质量浓度梯度为172.5、86.3、60.4、43.1、25.9、8.6 μg/mL,次乌头碱质量浓度梯度为303.0、202.0、121.2、80.8、40.4、20.2 μg/mL,BAC 质量浓度梯度为225.0、112.5、78.8、56.3、33.8、11.3 μg/mL,BMA质量浓度梯度为337.5、225.0、112.5、67.5、45.0、11.3 μg/mL,BHA 质量浓度梯度为165.0、82.5、57.8、41.3、33.0、8.3 μg/mL,甘草苷质量浓度梯度为2 904.0、1 452.0、726.0、435.6、290.4、145.2 μg/mL,甘草酸质量浓度梯度为7 880.0、1 576.0、788.0、472.8、315.2、157.6 μg/mL,6-姜酚质量浓度梯度为928.0、464.0、232.0、139.2、92.8、46.4 μg/mL。分别按“2.4”项下色谱条件下重复进样3 次,测定峰面积,以对照品质量浓度为横坐标(X),峰面积积分值为纵坐标(Y)进行线性回归,得回归方程:乌头碱Y=4 833 273X-4815,R2=0.999 2,线性范围4.3~173.0 μg/mL;新乌头碱Y=7 219 118X-22 610,R2=0.999 4,线性范围8.6~172.5 μg/mL;次乌头碱Y=10 886 051X-969 865,R2=0.999 1,线性范围20.2~303.0 μg/mL;BACY=8 275 542X-32 905,R2=0.999 1,线性范围11.3~225.0 μg/mL;BMAY=8 377 833X-27 689,R2=1.000 0,线性范围11.3~337.5 μg/mL;BHAY=7 820 481X-32 430,R2=0.999 2,线性范围8.3~165.0 μg/mL;甘草苷Y=15 955 936X+24 414,R=0.999 5,线性范围145.2~2 904.0 μg/mL;甘草酸Y=3 574 140X+294 369,R2=0.999 4,线性范围157.6~7 880.0 μg/mL;6-姜酚Y=6 217 676X-5000,R2=1.000 0,线性范围46.4~928.0 μg/mL;结果表明9 个对照品在各自范围内线性关系良好。
2.5.5 加样回收率试验 取半份淡附片四逆汤处方饮片(附子7.5 g,炙甘草7.5 g,干姜5 g),加入各等量对照品粉末,按“2.2.2”项制备淡附片四逆汤加样溶液,并按“2.3.1”项下制备淡附片四逆汤加样供试品溶液,经0.25 μm 微孔滤膜滤过。按“2.4”项下色谱条件进样测定,计算得到乌头碱、新乌头碱、次乌头碱、BAC、BMA、BHA、甘草苷、甘草酸、6-姜酚的平均加样回收率分别为100.18%、93.45%、101.29%、102.89%、101.40%、91.97%、102.80%、94.21%、103.06%,RSD 分别为1.69%、0.99%、1.08%、1.73%、1.11%、1.56%、1.28%、1.68%、1.87%,说明本方法具有良好的回收率。
2.6 含量测定结果
4 种附子炮制品单煎汤剂及四逆汤处方汤剂含量测定结果见表1。在附子单煎汤剂中双酯型生物碱含量方面,乌头碱、新乌头碱、次乌头碱含量及其总量高低排序为生附片>阴附片>阳附片>淡附片;单酯型生物碱含量方面,苯甲酰乌头原碱、苯甲酰新乌头原碱、苯甲酰次乌头原碱含量及其总量高低为阴附片>阳附片>淡附片>生附片。在四逆汤全方汤剂中双酯型生物碱含量方面,乌头碱、新乌头碱、次乌头碱含量及其总量高低排序为生附片四逆汤>阴附片四逆汤>阳附片四逆汤>淡附片四逆汤;单酯型生物碱含量方面,苯甲酰乌头原碱、苯甲酰新乌头原碱、苯甲酰次乌头原碱含量及其总量高低为阴附片四逆汤>阳附片四逆汤>淡附片四逆汤>生附片四逆汤。4 种附子炮制品单煎汤剂和四逆汤全方汤剂含量比较发现,四逆汤全方汤剂中3 种双酯型生物碱含量要显著性低于相应附子单煎汤剂,单酯型生物碱含量却要显著性高于相应附子单煎汤剂。
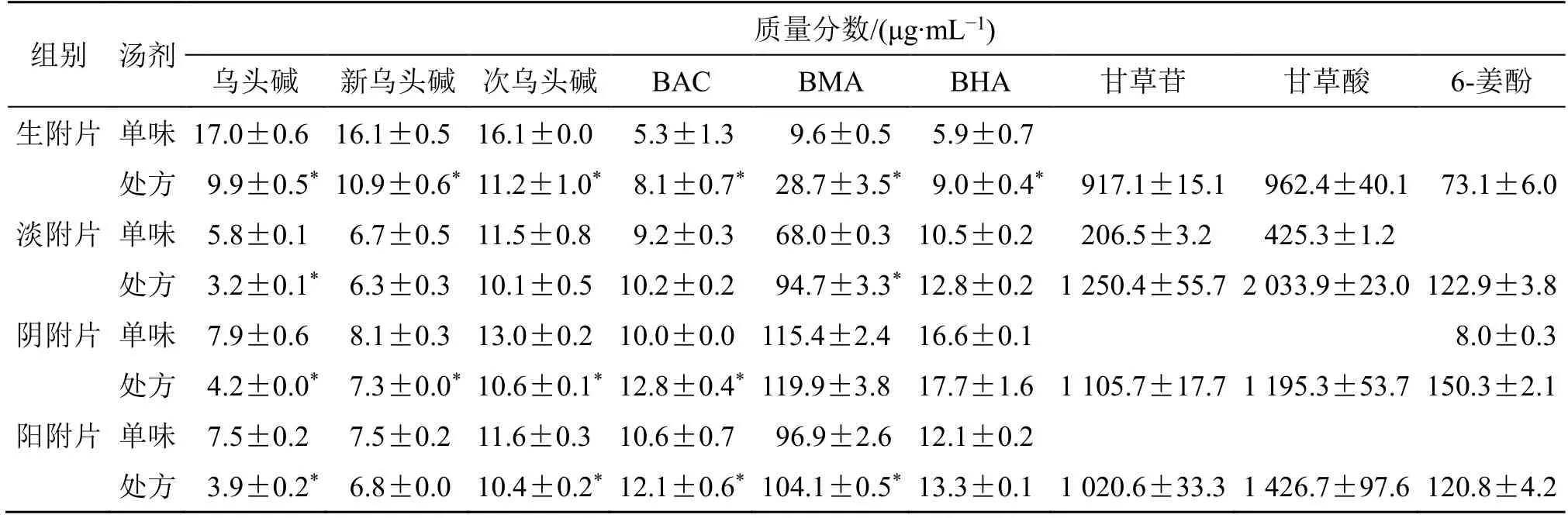
表1 不同附子炮制品四逆汤汤剂中含量测定结果Table 1 Results of content determination of components in different Aconite processed products Sini Decoction
2.7 化学计量学分析
2.7.1 系统聚类分析(hierarchical cluster analysis,HCA) 液相可以测定4 种附子炮制品四逆汤9 种化学成分含量,进行差异性分析,HCA 分别以双酯型生物碱和单酯型生物碱为分类点,进行宏观类别差异性分析,二者互相补充。
运用SPSS 21.0 统计软件进行HCA,其中样本1~3 为生附片四逆汤3 次数据,4~6 为淡附片四逆汤3 次数据,7~9 为阴附片四逆汤3 次数据,10~12 为阳附片四逆汤3 次数据,共12 样本量。分别以12 样本量中双酯型生物碱(乌头碱、新乌头碱、次乌头碱)和单酯型生物碱(苯甲酰乌头原碱、苯甲酰新乌头原碱、苯甲酰次乌头原碱)峰面积为变量,采用组间联接法及皮尔逊相关性作为分类依据,进行个案HCA[9],结果分别见图2、3。结果显示,以双酯型生物碱(乌头碱、新乌头碱、次乌头碱)进行分类时,12 个样本中分为生附片四逆汤3个样本可单为一类,淡附片四逆汤、阴附片四逆汤和阳附片四逆汤共9 个样本可归为同一类。以单酯型生物碱(苯甲酰乌头原碱、苯甲酰新乌头原碱、苯甲酰次乌头原碱)进行分类,12 个样本中生附片四逆汤3 个样本可单为一类,淡附片四逆汤、阴附片四逆汤和阳附片四逆汤共9 个样本可归为同一类。表明无论是以双酯型生物碱总量还是以单酯型生物碱总量进行分类分析时,生附片四逆汤与淡附片四逆汤、阴附片四逆汤、阳附片四逆汤三者成分差异较大,淡附片四逆汤、阴附片四逆汤、阳附片四逆汤成分含量差异相对较小。
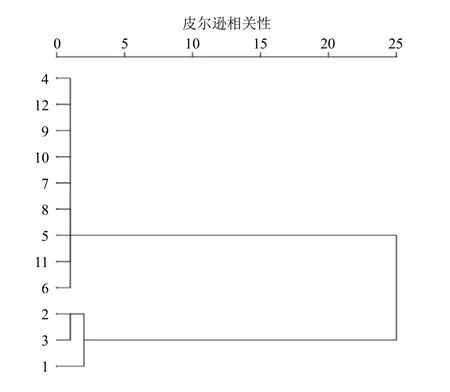
图2 4 种四逆汤以双酯型生物为变量聚类分析树状图Fig.2 Dendrogram of cluster analysis of four kinds of Sini Decoction with diester alkaloids as variable

图3 4 种四逆汤以单酯型生物为变量聚类分析树状图Fig.3 Dendrogram of cluster analysis of four kinds of Sini Decoction with monoester alkaloids as variables
2.7.2 主成分分析(pricipal component analysis,PCA)和正交偏最小二乘-判别分析(orthogonal partial least squares discriminant analysis,OPLS-DA)为了印证HCA 的结果,进行PCA。将3 批4 种四逆汤汤剂中9 个指标成共有峰峰面积导入SIMCA 14.1 软件,施行无监督模式的PCA[10],观察样品间自然聚集,结果见图4。PCA 得分图显示,4 种四逆汤汤剂各自聚集,可分为生附片四逆汤、淡附片四逆汤、阴附片四逆汤和阳附片四逆汤4 类,其中生附片四逆汤与其他四逆汤相聚较远,可自为一类,淡附片四逆汤、阴附片四逆汤与阳附片四逆汤的点较接近,可归为一类。PCA 与HCA 结果一致。

图4 不同附子炮制品四逆汤PCA 得分图Fig.4 PCA scores of different Aconite processed products Sini Decoction
为了进一步印证PLS-DA 的结果。在PCA 的基础上,将4 种四逆汤3 次数据结果中9 个指标成分共有峰峰面积导入SIMCA 14.1 软件进行OPLSDA[10],进一步分析4 种附子炮制品四逆汤的差异性,样本得分矩阵见图5。该模型解释率参数RY2为0.969,预测能力参数Q2为0.959,表明建立的数学模型稳定且预测能力较强。OPLS-DA 得分图显示,4 种四逆汤聚类效果较好,其中阴附片四逆汤和阳附片四逆汤相距较近,生附片四逆汤、淡附片四逆汤相聚较远。与HCA 和PCA 距离为2 时结果一致,进一步印证HCA 和PCA 的结果。同时根据变量重要性投影(variable importance projection,VIP)值>1 的原则,筛选差异组分,见图6。结果显示,共找到了4 个关键差异成分,VIP 值大小排序依次为8(甘草酸)、1(乌头碱)、2(新乌头原碱)、9(6-姜酚)号峰是引起不同附子炮制品四逆汤成分差异的主要标志性成分。
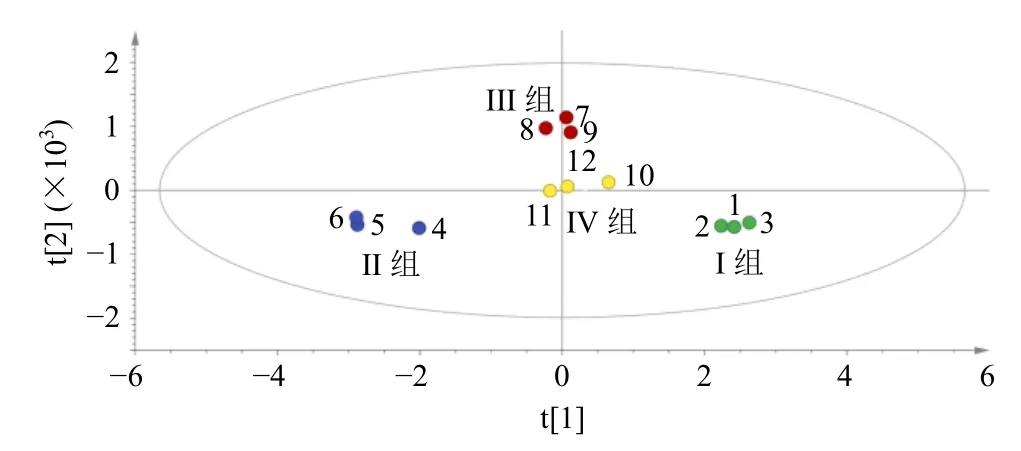
图5 不同附子炮制品四逆汤OPLS-DA 得分图Fig.5 OPLS-DA score chart of different Aconite processed products Sini Decoction

图6 不同附子炮制品四逆汤OPLS-DA VIP 图Fig.6 OPLS-DA VIP Chart of different Aconite processed products Sini Decoction
2.8 毒性实验
2.8.1 小鼠急性毒性实验 4 种附子单煎汤剂小鼠急性毒性预试验显示,小鼠给予4 种附子单煎生药量梯度120、100、80、60、40 g/kg 后,发现仅有生附片单煎组中小鼠出现死亡,尤其是给药量为120 g/kg 时小鼠100%死亡。其他单味附子炮制品未见小鼠死亡情况,未找到小鼠100%死亡剂量。故只进行生附片半数致死量(median lethal dose,LD50)实验。取健康ICR 小鼠50 只,雌雄各半,根据体体质和性别随机分为5 组,每组雌雄各5 只。实验前小鼠禁食不禁水16 h,按体质量ig,各组小鼠分别给予剂量140.0、98.0、68.8、48.0、33.6 g/kg 生药量生附片汤剂。连续观察24 h,并记录小鼠死亡数。给药后小鼠自发活动减少,静伏,少动,死亡之前抽搐。死亡时间主要集中在给药后0.5~1 h 内,4 h 后动物再无死亡。
动物反应及死亡情况见表2,按Bliss 法计算生附片单煎汤剂LD50值为71.3 g/kg 生药量,95%置信区间为60.0~84.6 g/kg 生药量。

表2 生附片汤剂小鼠ig 动物反应及死亡情况Table 2 Animal response and death of UAP decoction rats by gavage
2.8.2 小鼠最大给药量实验 经4 种四逆汤小鼠急性毒性预试验结果显示,小鼠给予4 种四逆汤生药量梯度120、100、80、60、40 g/kg 后,发现4 种四逆汤小鼠在给药体积最大量,给药梯度达120 g/kg时,4 种四逆汤均无小鼠死亡情况发生,仅有生附片四逆汤组小鼠有轻微毒性反应,但均未找到4 种四逆汤给药后小鼠100%死亡剂量,无法测出LD50。故改测4 种四逆汤小鼠1 d 最大给药量实验。
当小鼠给药120 g/kg 时,四逆汤质量浓度为3.0 g/mL,四逆汤已接近浸膏状态,难以再次浓缩,故以3.0 g/mL 作为最大质量浓度。
(1)动物分组及给药:取健康ICR 小鼠50 只,雌雄各半,根据体质量和性别随机分为空白组、生附片四逆汤组、淡附片四逆汤组、阴附片四逆汤组、阳附片四逆汤组,每组雌雄各5 只。取4 种四逆汤饮片制备四逆汤汤剂,并浓缩至3.0 g/mL。实验前小鼠禁食不禁水16 h,按体质量ig,各组小鼠分别给予剂量120 g/kg 生药量,空白组给予等体积生理盐水。
(2)观察及脏器指数:各组小鼠经ig 后即刻观察小鼠毒性反应情况,包括外观体征、行为活动、精神状态、食欲、大小便及颜色、被毛、肤色、呼吸,以及鼻、眼、口腔、生殖器等有无异常分泌物。并给药当天记录小鼠恢复自由活动、饮水、饮食时长。此后每天观察1 次,每日称定质量,记录期间动物死亡情况,并进行尸体解剖,观察心、肝、脾、肺、肾等重要脏器有无病变。实验第14 天处死、解剖小鼠,观察其心、肝、肾、肺及脾等脏器和组织的体积、颜色和质地等变化,肝脏和肾脏拍照称定质量,计算脏器指数。
(3)最大给药量测定:按公式计算该剂量下小鼠给药相当于人临床每日推荐用药量的倍数。
小鼠的最大给药量倍数=每只小鼠最大给药量×成人平均体质量/(小鼠平均体质量×成人每日用量)
(4)结果:给药后14 d 内各组小鼠均无死亡现象,各组小鼠给药过程具体体态情况见表3。第14天进行小鼠称定质量,4 种附子炮制品四逆汤小鼠在给药14 d后和空白组比较雌雄体质量增长均无显著性差异。脏器指数结果显示,第14 天处死、解剖小鼠,观察其心、肝、肾、肺及脾等脏器,发现4 种附子炮制品四逆汤均不会引起小鼠肝脏、肾脏肿大以及病理学改变。经计算,4 种四逆汤组小鼠给药后雌雄肝脏、肾脏器指数和空白组比较均无显著性差异,见表4,说明4 种附子炮制品四逆汤均系属无毒。

表3 各组小鼠体态情况Table 3 Body posture of rats in each group

表4 各组雌雄小鼠体质量变化及脏器指数Table 4 Weight change and organ index of male and female rats in each group
四逆汤人1 d 用量36 g 生药量,生附片四逆汤、淡附片四逆汤、阴附片四逆汤、阳附片四逆汤组小鼠最大给药量分别为2.28、2.28、2.28、2.27 g 生药量,平均体质量分别为19.0、19.0、19.0、18.9 g。生附片四逆汤、淡附片四逆汤、阴附片四逆汤、阳附片四逆汤小鼠最大给药量倍数经公式计算均相当于人临床每日用药量的200 倍。
2.8.3 大鼠长期毒性实验 根据《中国药典》2020年版规定四逆汤人口服量为30~60 mL/d,剂量范围为342.9~685.7 mg/(kg·d)。以药典人口服剂量中间值45 mL 为中剂量,3∶6∶12 设置低、中、高剂量,按等效体表面积折算大鼠给药低、中、高剂量分别为1.586 5、 3.173 2、6.346 4 g/kg。经预实验发现大鼠给药剂量为6.346 4 g/kg,大鼠体态恢复及心衰指标恢复效果最佳。故在后续试验中以高剂量作为大鼠给药剂量。
(1)造模:大鼠适应性喂养1 周。按课题组前期研究[6]造模,阿霉素用生理盐水溶液稀释,按体质量进行ip,大鼠给药梯度剂量及频率分别为1 mg/kg 第1 天,2 mg/kg 第4 天,3 mg/kg 第7 天,4 mg/kg 第11 天,3 mg/kg 第15 天,模型组注射阿霉素,空白组注射生理盐水,每次造模后1 d 应用小动物专用彩色超声影像系统检测各组大鼠心功能。M-Mode 模式测量3 个心动周期的左室射血分数(left ventricular ejection fraction,LVEF),取均值计算LVEF≤40%为模型成功。
(2)分组及给药:将心衰模型成功的大鼠按体质量随机分为模型组、 生附片四逆汤组(UAPSND)、淡附片四逆汤组(GCAPSND)、阴附片四逆汤组(DGSAPSND)、阳附片组四逆汤组(SFAPSND)、阳性药组(卡托普利)。每组12 只,雌雄各半。各给药组按体质量6.346 4 g/kg 给予相应汤剂,阳性药组给予成人临床等效剂量10 mg/kg卡托普利,空白组和模型组给予等体积生理盐水。连续给药2 周。
(3)生物样本采集:最后1 次给药结束后,禁食不禁水12 h,2%戊巴比妥钠(3 mL/kg)ip 麻醉,腹主动脉取血,室温静置40 min,于3000 r/min 离心10 min 取上清液得血清样本,并置于-80 ℃保存备用。取血结束后取心脏、肾脏和肝脏,用生理盐水冲洗表面并用滤纸吸干多余的水分,称定质量后泡于10%多聚甲醛中,室温保存。
(4)肝肾损伤生化指标测定:采用全自动生化仪测定血清中肝肾功能指标,包括总胆红素、丙氨酸氨基转移酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)、尿素、肌酐。
(5)HE 染色观察组织病理:肝肾组织经10%多聚甲醛固定24 h,乙醇梯度脱水,二甲苯透明,石蜡包埋,切片,二甲苯I和II脱蜡,梯度水化,苏木素染色,蒸馏水冲洗,含1%盐酸的70%乙醇水化,蒸馏水漂洗,70%和80%乙醇浸泡后,90%伊红醇溶液染色,脱水,透明,中性树胶封片,显微摄影成像系统×200 下拍片,记录结果。
(6)大鼠体质量变化:在造模及给药过程中正常组小鼠体质量呈稳步上升趋势,而模型组大鼠在第3 次造模后体质量逐步下降,直至第3 天给药后各给药组大鼠体质量恢复,雄性大鼠升高趋势更加明显。其中淡附片四逆汤组大鼠体质量上升趋势远低于其他给药组。各组大鼠造模及给药过程体质量见表5、6。

表5 大鼠造模期间体质量变化Table 5 Changes in body weight of rats during modeling

表6 大鼠给药期间体质量变化Table 6 Changes in body weight of male rats during administration
(7)脏器指数:与空白组比较,模型组肝、肾脏器指数显著增加;与模型组相比,4 种四逆汤可显著降低肝、肾脏器指数,其中雌性大鼠中以阴附片四逆汤作用效果最为显著,雄性大鼠中以淡附片四逆汤和阳附片四逆汤作用效果更为显著。各组雌雄大鼠脏器指数见表7。

表7 各组雌雄大鼠脏器指数Table 7 Organ index of male and female rats in each group
(8)大鼠血清肝、肾功能指标的影响:与空白组比较,模型组大鼠血清中总胆红素、ALT、AST、尿素、肌酐指标有升高趋势。与模型组相比,4 种四逆汤大鼠血清中总胆红素、ALT、AST、尿素、肌酐有下降趋势,总体与空白组相比没有显著性差异。见表8。

表8 各组雌雄大鼠血清肝肾功能指标含量Table 8 Indexes of liver and kidney function in serum of male and female rats in each group
(9)对大鼠肝、肾组织病理的影响:各组大鼠肝脏组织HE 染色并无明显区别,见图7。其中各组肝组织整体结构均基本正常,组织肝细胞结构饱满,未见肝细胞明显疏松水肿坏死等变性,肝细胞如黄色箭头所示,组织中央静脉清晰,肝窦沿着中央静脉呈放射状排列,红色箭头所示为肝窦巨噬细胞,组织未见明显炎症细胞浸润。

图7 各组雌雄大鼠肝脏HE 染色图(♀雌性,♂雄性,×200)Fig.7 HE staining of liver of male and female rats in each group(♀female,♂male,× 200)
各组大鼠肾脏组织HE 染色并无明显区别,见图8。其中各组肾组织整体结构均基本正常,肾小球结构清晰未见明显萎缩坏死等变性,黄色箭头所示为肾小球,组织肾小管上皮细胞未见明显水肿脱落坏死,肾小管未见明显扩张管型等变性,红色箭头所示为肾小管,组织未见明显炎症细胞浸润。
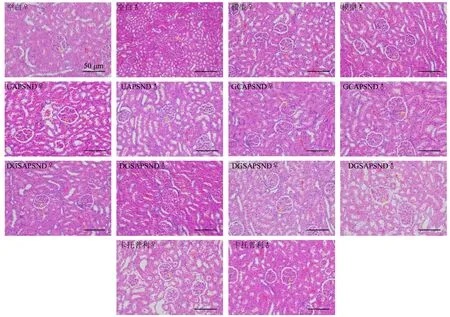
图8 各组大鼠肾脏HE 染色图(♀雌性,♂雄性,×200)Fig.8 HE staining of kidney of male and female rats in each group(♀female,♂male,× 200)
2.9 统计方法
采用SPSS 25.0 统计软件对数据进行单因素方差分析和系统聚类分析,实验结果以±s表示,P<0.05 表示有显著性差异;采用SIMCA 14.1 软件对数据进行PCA 和OPLS-DA。
3 讨论
3.1 成分差异性分析
研究认为4 种附子炮制品四逆汤其化学成分差异性的原因主要与附子的炮制方法有关。一方面4种四逆汤在仅改变附子饮片种类的前提下,其汤剂中9 个指标成分含量高低顺序与4 种附子炮制品单煎汤剂一致;另一方面,4 种附子炮制品由同一批盐附子炮制而成,4 种附子因其炮制方法的不同而致使4 种附子炮制品单煎汤剂中9 个指标成分存在差异。
4 种附子炮制品均有浸漂流程,不同的是生附片仅浸漂流程,淡附片经浸漂后有加甘草黑豆的煮制过程,阴附片有浸漂后加干姜的蒸制过程,阳附片则是浸漂后加砂的炒制过程。在本实验中控制4种附子炮制品的浸漂时间一致,浸漂过程对附子中双酯型生物碱影响程度相当。而淡附片、阴附片和阳附片的后续煮制、蒸制、炒制过程均可促使附子中双酯型生物碱酯键水解断裂使其含量下降[7,11-12],故阴附片、阳附片、淡附片中的双酯型生物碱均要显著性低于生附片。
同时由于生附片仅有浸漂过程,对单酯型生物碱的生成影响较小,难以促使双酯型生物碱转化为单酯型生物碱,所以生附片中单酯型生物碱含量极低;阳附片的高温炒制环境易使附子中的双酯型生物碱转化为中间产物焦乌头碱类[12],再进一步酯键断裂转化为单酯型生物碱量和胺醇型生物碱[13],进而提高单酯型生物碱含量作用;阴附片的高温蒸制环境在促进双酯型生物碱水解为单酯型生物碱的同时,干姜中6-姜烯酚、6-姜酚等成分还具有增加单酯型生物碱溶出的作用[7],进而提高单酯型生物碱含量作用;而淡附片在其炮制过程中辅料甘草中含有大量甘草酸、甘草次酸等酸性成分,营造一个酸性环境,使附子中6 种生物碱指标成分断裂酯键,还通过生成络合物或“酸碱中和成盐”沉淀的形式降低附子生物碱含量作用[14],同时高温煮制环境也可促进双酯型生物碱的水解转化,在水解双酯型生物碱的同时,单酯型生物碱也会被水解为毒性最低的胺醇型生物碱[15],所以淡附片中双酯型生物碱和单酯型生物碱均要低于其他炮制品。故在本研究单味附子煎剂比较部分,阴附片中单酯型生物碱苯甲酰乌头原碱、苯甲酰新乌头原碱、苯甲酰次乌头原碱含量及其总量>阳附片>淡附片>生附片。
当四种附子炮制品应用于四逆汤时,因4 种附子四逆汤仅改变附子种类,煎煮过程以及方剂处方对指标成分的影响程度一致,故4 种附子炮制品四逆汤汤剂中指标成分含量高低与4 种附子单味煎液中指标成分含量高低一致。表现为双酯型生物碱含量在生附片四逆汤中最高,单酯型生物碱含量在阴附片四逆汤中最高。
3.2 分类差异性分析
4 种附子炮制品四逆汤在进行HCA、PCA 和PLS-DA 时,虽分析方法不同,但结果一致。无论是以双酯型生物碱进行分类分析,还是以双酯型生物碱进行分类分析,亦或者以全体指标成分含量进行分析,生附片四逆汤与其他3 种四逆汤差异较大,常单为一类;淡附片四逆汤、阴附片四逆汤、阳附片四逆汤差异较小,可归为同一类。导致4 种四逆汤主要分为两类的原因可能与4 种四逆汤9 个指标成分含量有关,尤其是双酯型生物碱和单酯型生物碱。因生附片仅有浸漂流程,对双酯型生物碱和单酯型生物碱影响相对较小,而淡附片、阴附片、阳附片在浸漂后还有后续加工炮制过程,对双酯型生物碱和单酯型生物碱影响较大,故生附片单为一类。同时与生附片相比,淡附片、阴附片、阳附片此三种炮制品影响程度相差无几,故在本研究中淡附片、阴附片、阳附片可归为同一类。
同时研究发现甘草酸、乌头碱、新乌头原碱和6-姜酚是引起不同附子炮制品四逆汤成分差异的主要标志性成分。分析其原因主要为甘草酸在四逆汤中主要发挥解毒作用,常水解为2 分子葡萄糖醛酸与1 分子甘草次酸,营造一个酸性环境,可以和双酯型生物碱过生成络合物或“酸碱中和成盐”沉淀的形式降低附子生物碱含量作用,降低其含量以达解毒作用[16],同时甘草中甘草次酸具有肾上腺皮质激素样作用,可降低机体对各种有毒物质的反应,提高机体对毒性物质的耐受力[17],在体内也可发挥拮抗乌头碱所致心律失常作用[18],同时甘草次酸亦可减少由附子生物碱所致的氧自由基(reactive oxygen species,ROS)蓄积,增强机体清除自由基的能力,降低氧化损伤[19],降低四逆汤中附子毒性作用,可作为四逆汤中解毒标志物;而乌头碱、新乌头碱为四逆汤中主要引起毒性反应的成分,通过抑制机体细胞色素P450 2J3(cytochrome P450 2J3,CYP2J3)的表达水平,使心肌细胞钠钙交换异常[20],改变细胞中钠、钾、钙离子浓度进而影响细胞内环境稳态,脂质过氧化反应致细胞能量代谢障碍[21],诱导心肌细胞凋亡[22],从而致使机体出现中毒反应,甚至心律不齐导致死亡,其含量高低与四逆汤致死性息息相关,二者可作为四逆汤中毒性标志物;6-姜酚在四逆汤中主要发挥增效作用,通过提高四逆汤中主要功效成分单酯型生物碱的含量,与单味附子煎剂能显著增加实验心衰大鼠的心输出量、增强心肌舒缩力、改善其血液动力学[23],增强四逆汤中附子强心作用,其可作为四逆汤中增效标志物。
3.3 毒性差异性分析
在4 种附子炮制品小鼠急性毒性试验中:生附片单味煎液LD50值为71.3 g/kg 生药量,95%可信区间为60.0~84.6 g/kg 生药量。其他3 种炮制品单味煎液未发现100%死亡率,无法计算LD50值。双酯型生物碱为附子中主要毒性成分,单酯型生物碱为附子中主要功效成分[21],当小鼠给予生附片LD50值时,双酯型生物碱摄入含量为28.8 μg/mL。生附片单味煎液中毒性成分双酯型生物碱含量为48.5 μg/mL,远高于生附片LD50值,表现出生附片的毒性和致死性。而淡附片、阴附片、阳附片中双酯型生物碱总量与生附片LD50双酯型生物碱含量相近,小鼠理应有毒性反应和死亡现象,但在观察中淡附片、阴附片、阳附片组小鼠仅有轻微毒性反应但却无死亡现象,推断其原因为淡附片、阴附片、阳附片中双酯型生物碱含量虽和生附片LD50值双酯型生物碱含量相近,但淡附片中中甘草酸、阴附片中6-姜酚等在体内也发挥着减毒作用,故淡附片、阴附片、阳附片组小鼠仅有轻微毒性反应,却无致死性,很好的体现炮制减毒特性。
在4 种附子炮制品四逆汤最大给药量试验中:当4 种四逆汤给予最大给药体积和最高浓度时,4种四逆汤均不会对小鼠产生致死性,有且仅有生附片四逆汤组小鼠产生轻微毒性反应。出现这一结果的原因可能是淡附片四逆汤、阴附片四逆汤和阳附片四逆汤中双酯型生物碱总量均要低至 19.6 μg/mL,毒性成分含量很低,使得小鼠无毒性反应,更无致死性。而生附片四逆汤中毒性成分双酯型生物碱总量为31.9 μg/mL,毒性成分含量相对较高,小鼠理应有毒性反应和死亡现象。但四逆汤是一种处方汤剂,汤剂中除含有毒性成分双酯型生物碱外,还含有一些解毒成分,各成分之间相互影响,相互制约,可以制约降低生附片四逆汤的毒性,如6-姜酚可以减少附子次乌头碱的吸收[24],甘草次酸可以上调核因子E2 相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)和血红素加氧酶-1(heme oxygenase-1,HO-1)信号通路抑制氧化应激、线粒体功能障碍和细胞凋亡[25],上调细胞色素P450 酶3A(cytochrome P450 3A,CYP3A)的表达,促进乌头类成分的代谢,降低脑利钠肽(b-type natriuretic peptide,BNP)、血管紧张素II(angiotensin II,AngII)、醛固酮(aldosterone,ALD)的含量[26],减少机体心脏毒性,使得生附片四逆汤仅表现出轻微毒性反应,没有死亡现象发生。同时受试物浓度和体积限制,当小鼠给予相当于人临床每日用药量的200 倍四逆汤剂量时,小鼠仍均无明显毒性反应和致死性。表明古籍和现代四逆汤处方中以生附片和淡附片入方具有合理性和可行性,同时也表明阴附片、阳附片入方四逆汤也具有合理性和可行性。
在4 种附子炮制品四逆汤长期毒性试验中:4种四逆汤可恢复因造模而致体质量下降,与模型组相比,4 种四逆汤给药组多可显著降低肝肾脏器指数,其中雌性大鼠中以阴附片四逆汤作用效果最为显著,雄性大鼠中以淡附片四逆汤和阳附片四逆汤作用效果更为显著。同时与模型组和空白组相比,4 种四逆汤有降低肝肾功能指标总胆红素、ALT、AST、尿素、肌酐含量趋势,4 种四逆汤组大鼠HE染色肝组织整体结构均基本正常,组织肝细胞结构饱满,未见肝细胞明显疏松水肿坏死等变性,组织未见明显炎症细胞浸润;肾组织整体结构均基本正常,肾小球结构清晰未见明显萎缩坏死等变性,组织肾小管上皮细胞未见明显水肿脱落坏死,肾小管未见明显扩张管型等变性,组织未见明显炎症细胞浸润。说明慢性心衰大鼠长期给药4 种四逆汤后不会引起肝肾损伤,无肝肾毒性,甚至在脏器指数方面有一定的保肝护肾作用。
4 结论
毒性实验是评价临床用药安全性的重要方法之一。归纳急性毒性试验、最大给药量试验、长期肝肾毒性试验结果,证实阴附片和阳附片入方四逆汤均系安全无毒,可行,可安全开展后续阴附片四逆汤和阳附片四逆汤对慢性心衰大鼠的药效学研究。
含量测定是4 种附子炮制品四逆汤研究基础,毒性实验是评价临床用药安全性的重要方法。综合分析4 种附子炮制品四逆汤成分差异性、分类差异性以及急性毒性试验、最大给药量试验、长期肝肾毒性差异性,证明《伤寒论》中四逆汤原始方选择生附片以及《中国药典》四逆汤选择淡附片入方四逆汤的合理可行性,证实在以建昌帮法阴附片、阳附片入方四逆汤亦具有合理可行性,甚至相比淡附片和生附片在降低毒性成分含量、增加功效成分含量上要更具优势,其中阴附片最佳,可安全开展后续阴附片四逆汤和阳附片四逆汤对慢性心衰大鼠的药效学研究。因此下一阶段将开展不同附子炮制品四逆汤的抗心衰药效学研究,为阴附片、阳附片入方四逆汤用于慢性心衰治疗提供一定的科学依据。
利益冲突所有作者均声明不存在利益冲突

