肿瘤抗原MAGEA4表达及其长肽疫苗的免疫活性
贾明璐 王瑞 陈雪平 李玉伟 田会东 王辙远
(漯河市中心医院,河南 漯河 462000)
恶性肿瘤是威胁人类健康的主要疾病,其发病率和死亡率近年来一直呈上升趋势〔1,2〕,在肿瘤治疗领域寻找安全、合理、有效的治疗手段已成为迫切需要解决的问题〔3〕。设计有效的肿瘤疫苗主要通过主动免疫来扩大肿瘤特异性T细胞反应,长期以来一直被视为肿瘤免疫治疗的有效工具〔4〕。黑色素瘤相关抗原(MAGEA)4是睾癌(CT)抗原,它在多种不同的恶性肿瘤中表达,但仅在正常成人组织的睾丸生殖细胞中表达〔5〕。CT抗原具有高度的免疫原性。通过在线数据库分析我们发现高表达MAGEA4对乳腺癌、卵巢癌、肺癌、胃癌、头颈鳞状细胞癌、子宫内膜癌患者的预后较差,所以MAGEA4是一个潜在的理想抗原〔6,7〕。长肽疫苗包含多个能被主要组织相容性复合体(MHC)-Ⅰ、Ⅱ分子提呈的表位天然肽段〔8〕。其优点是长肽能被专职抗原提呈细胞树突细胞(DC)有效加工和提呈,能够有效激起体内的免疫反应,所以合成的长肽能够成为很有潜力的多肽疫苗。本研究旨在设计针对肿瘤抗原MAGEA4的长肽,体外验证长肽的免疫原性。
1 材料和方法
1.1材料 人结直肠癌细胞系SW620,在实验室中使用37℃、体积分数5% CO2的饱和湿度培养条件保存,常规培养于10%胎牛血清(FCS)的RPMI1640培养基。外周血单个核细胞由医院血站健康供者血液分离所得。长肽由上海生工生物工程有限公司合成。
1.2方法
1.2.1利用数据库查询MAGEA4的表达情况 分析癌症基因组图谱(TCGA)数据库相关数据,借助于数据库肿瘤免疫评估资源(TIMER)〔9〕(https://cistrome.shinyapps.io/timer/)分析MAGEA4在不同肿瘤患者中的表达情况及比较肿瘤患者与正常健康病人MAGEA4的表达差异,利用The Human Protein Atlas〔10〕(https://www.proteinatlas.org)数据库分析MAGEA4在肿瘤组织中表达情况。利用The Kaplan Meier plotter(http://kmplot.com/analysis/)分析MAGEA4在不同肿瘤中对肿瘤患者预后的影响〔11〕。
1.2.2设计包含已知细胞毒性T淋巴细胞(CTL)表位的长肽疫苗 利用免疫表位数据库(IEDB)数据库(http://www.iedb.org/)〔12〕查询已经鉴定的MHC-Ⅰ类抗原表位,设计包含有效抗原表位的长肽。MAGEA4的氨基酸序列参照 GenBank: NP_001011549.1 所提供的序列。根据筛选出的CTL表位设计MAGEA4抗原来源的长肽,分别为: MAGEA4 P102-121、P156-177、P224-239、P280-294。
1.2.3分离外周血单个核细胞(PBMCs) 加肝素钠至50 ml离心管,预防凝血。取外周血20 ml与生理盐水1∶1混匀;加入室温淋巴细胞分离液,离心2 000 r/min,30 min;吸取中间白膜层加入生理盐水30 ml进行清洗,离心后用10%胎牛血清IMDM培养基重悬细胞,即可获得单核细胞。
1.2.4体外诱导肽特异性的CTLs 将分离出的PBMCs进行重悬,于1×106个/ml培养于6孔板中,置于培养箱中培养2 h;轻轻洗脱尚未黏附的T细胞冻存于液氮中,加入IMDM培养基2 ml,并补加粒细胞-巨噬细胞集落刺激因子(GM-CSF,100 ng/ml)、白细胞介素(IL)-4(50 ng/ml);每隔1天进行半量换液,并补充GM-CSF(100 ng/ml)和IL-4(50 ng/ml);第5天加入脂多糖(100 ng/ml)以诱导DC成熟。 48 h后收集成熟的DC细胞〔13〕。 加入长肽 20 μg/ml,培养4 h;重悬后加入100 μg丝裂霉素C,添加20 μg/ml的长肽,孵育24 h;用10% FCS重悬IMDM培养基并计数2×105个/ml;取前期复苏冻存的T细胞和诱导成熟的DC细胞重悬并计数2×106个/ml,共孵育加入24孔板中;在第2天添加人IL-2(50 U/ml),并且每3天换液并补充人 IL-2。 1 w后将细胞与负载肽的DC共孵育,进行第2轮刺激。3轮刺激后3 d收集细胞,用于后续的活性实验〔14〕。
1.2.5检测细胞因子的干扰素(IFN)-γ分泌水平 取出酶联免疫斑点实验(ELISPOT)板条。最初,添加200 μl无血清IMDM培养基进行封闭;将前期实验中诱导的CTLs用作效应细胞,并将细胞浓度调整为2×106个/ml。摄取多肽的成熟DC作为刺激细胞,孵育18 h;每孔加入200 μl无菌的去离子水,4℃裂解细胞10 min;加入200 μl 1×洗涤缓冲液洗涤6次;加入100 μl生物素标记的抗体,并在37℃下孵育1 h。 倒出孔中的液体,加入200 μl 1×洗涤缓冲液并洗涤。 孵育后,加入100 μl 3-氨基-9-乙-基咔唑(AEC)显色溶液,在室温下于25℃干燥30 min;使用图像分析仪对96孔板中每孔的斑点数进行计数。
1.2.6细胞毒性实验检测 离心收集靶细胞SW620(MAGEA4+,HLA-0201+),将细胞浓度调节至1×106个/ml。1 ml细胞悬浮液加入0.5 μl 5 mmol/L羧基荧光素琥珀酰亚胺酯(CFSE)作为致敏靶细胞。1 ml细胞悬液中加入0.5 μl 100 μmol/L CFSE作为对照靶细胞。将细胞用5% FCS-磷酸盐缓冲液(PBS)洗涤一次,离心去除上清。将效应细胞(前期诱导的CTLs)以5×106个/ml的浓度重悬,将不同效靶比的效应细胞与致敏靶细胞混合,靶细胞数为2×104个,4 h后,用含有1% FCS 0.1%叠氮化钠的PBS处理上述两种细胞,使用含有4%多聚甲醛的PBS溶液重悬细胞,流式细胞仪进行检测。杀伤率=(对照样品中致敏靶细胞的数量-测试样品中致敏靶细胞的数量)/对照样品中致敏靶细胞的数量×100%。
1.2.7胞内因子染色法检测T细胞释放IFN-γ水平 前期诱导的CTLs作为效应细胞,诱导的成熟DC作为刺激细胞;加入阻断剂BFA 5 μg/ml到离心管中,孵育4 h,充分混匀。将细胞重悬于含有1%FBS溶液的PBS中。 加入细胞表面抗体,并在避光条件下于4℃孵育30 min。 以1 500 r/min离心5 min。 向每个孔中添加200 μl破膜剂,并在4℃下孵育30 min。 收集上述处理过的细胞,加入抗IFN-γ抗体,并在4℃下避光保存30 min。使用PBS重悬后进行流式细胞仪上机检测表位肽诱导的特异性T细胞亚群产生IFN-γ的比例。
1.3统计学处理 采用GraphPad Prism软件绘图,采用SPSS22.0标准版统计软件进行单因素方差分析。
2 结 果
2.1MAGEA4 在不同肿瘤之间的表达 MAGEA4在很多恶性肿瘤中均有表达,尤其是头颈鳞状细胞癌、肺鳞癌和胃癌中的表达,并且癌与癌旁中表达是有差异存在的。见图1。
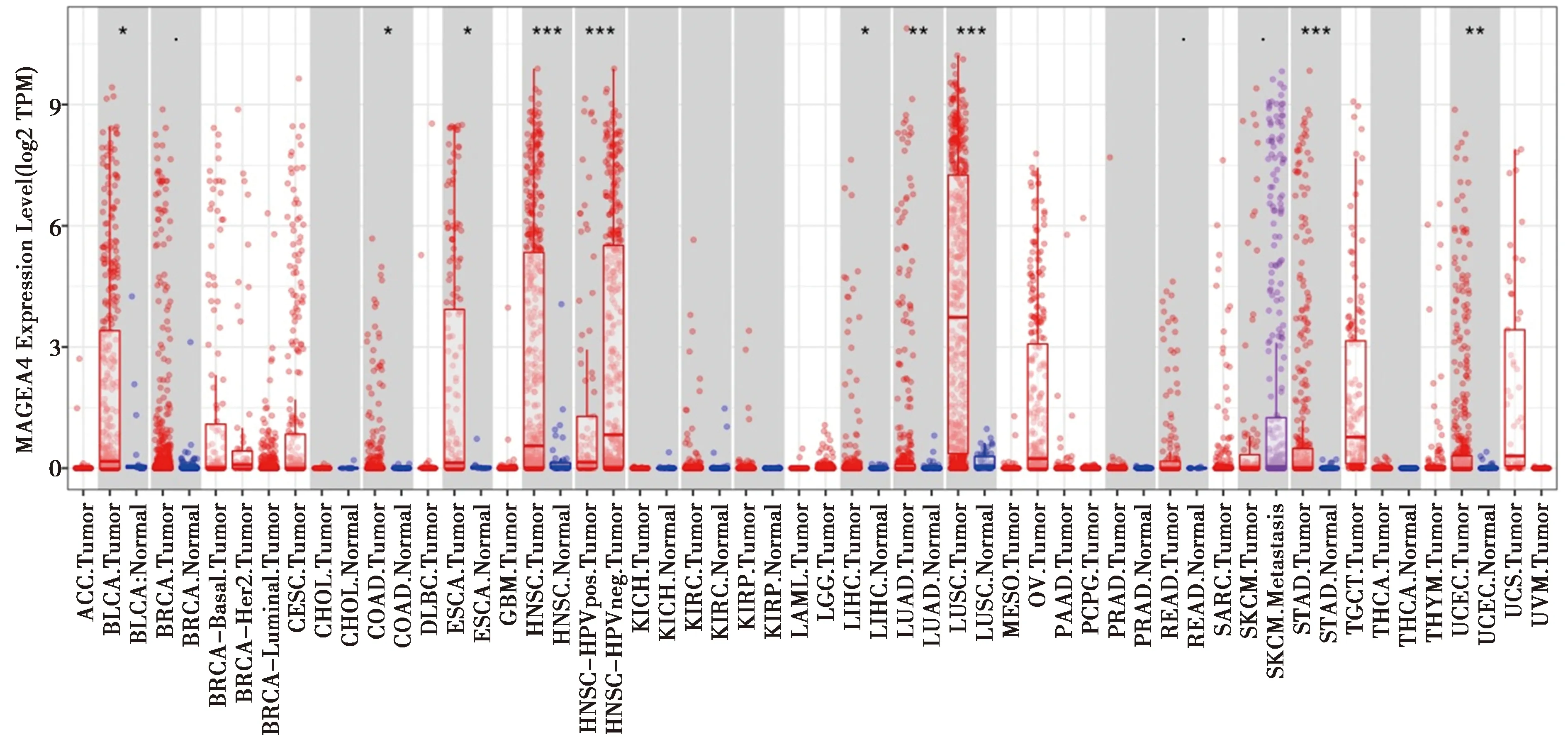
图1 MAGEA4在各种癌症病人中的表达情况
2.2MAGEA4 在不同肿瘤组织中的表达情况 利用The Human Protein Atlas(https://www.proteinatlas.org/)数据库验证MAGEA4在肿瘤病理组织中的表达情况,结果发现,MAGEA4高表达于结直肠癌、肺癌、皮肤癌、宫颈癌、乳腺癌中。见图2。

图2 MAGEA4在不同肿瘤组织中的表达(免疫组织化学染色,×50)
2.3ELISPOT结果显示IFN-γ的分泌水平 与PBS组〔(8.78±1.88)个〕相比,P102-121组和P280-294组分泌IFN-γ的T细胞斑点数量较多,差异有统计学意义〔(112.66±3.51)个、(169.66±7.82)个,P<0.05〕。P156-177组、P224-239组分泌IFN-γ的T细胞斑点数量〔(37.00±14.36)个、(26.33±8.62)个〕与PBS组比较差异无统计学意义(P>0.05)。见图3。

图3 ELISPOT检测长肽在健康志愿者中诱导的CTLs中IFN-γ分泌(AEC显色)
2.4MAGEA4在不同肿瘤中与预后的关系 利用 The Kaplan Meier plotter 数据库,对肿瘤组织样本的MAGEA4进行生存分析。结果表明,MAGEA4在乳腺癌、卵巢癌、肺癌、胃癌、头颈鳞状细胞癌、子宫内膜癌患者生存率的差异较为明显,高表达的MAGEA4患者预后较差。足以说明,MAGEA4是一个潜在的肿瘤靶点。见图4。

图4 MAGEA4基因表达高、低与肿瘤患者预后的关系
2.5胞内因子染色法检测长肽体外免疫刺激后细胞因子的分泌 PBS组、P102-102组、P280-294组IFN-γ比例分别为(0.72±0.09)%、(2.79±0.19)%、(3.05±0.21)%。P102-121和P280-294长肽疫苗能够很好地诱导CTL分泌IFN-γ。见图5。

图5 流式细胞仪检测长肽特异性CTLs分泌IFN-γ的能力
2.6细胞毒性实验检测结果 P102-121和P280-294两条候选肽诱导的CTLs在不同效靶比对靶细胞的杀伤情况见表1。结果显示:P102-121、P280-294组诱导的CTLs在效靶比为12.5∶1、25∶1、50∶1时对靶细胞的杀伤率均显著高于PBS组(P<0.05),且以50∶1效靶比最高。

表1 长肽诱导的CTLs不同效靶比对SW620的杀伤率
3 讨 论
肿瘤免疫治疗提供了免疫系统对恶性肿瘤细胞的特异性和记忆性,不良反应较小,治疗效果持久。从骨髓移植治疗血液性癌症的成功开始,各种肿瘤的单克隆抗体疗法的发展,到针对免疫检查点的抗体疗法已经成为较成功的癌症治疗方法〔15〕。随着对免疫调节机制的深入了解及对免疫细胞的工程化技术改进,越来越多的科学家去关注和开放新的肿瘤疫苗。随着这些技术的不断改进,免疫疗法将在癌症治疗中发挥越来越重要的作用〔16〕。
多肽疫苗治疗的目的是刺激和激活肽特异性T细胞来杀伤肿瘤细胞。T细胞识别的肿瘤相关抗原的发现促进了这一策略的实施〔17〕。多肽疫苗诱导部分癌症患者产生免疫应答,但客观的临床应答率仍然较低。为了提高多肽疫苗治疗的效果:①需要在肿瘤细胞中特异表达而在正常细胞中不表达的肿瘤抗原;②在多肽疫苗治疗的早期阶段进行治疗;③应调节记忆T干细胞以维持对多肽疫苗的长期免疫应答〔18〕。已经有很多长肽有较好的效果,黑色素瘤抗原(MELOE-1)的长肽,包含了一个人类白细胞抗原(HLA)-A*0201 表位和多个 HLA classⅡ T 细胞表位,是很好的黑色素瘤疫苗候选肽〔19〕。Michael Pfreundschuh在癌睾抗原 SSX2 中找到一个核心优势表位,既能诱导CD8+T细胞反应和CD4+T细胞反应,也能产生抗体〔20〕。乙型肝炎病毒(HBV)来源的长肽能增强慢性乙型肝炎患者体内CD4+和CD8+T细胞应答。由此表明,长肽疫苗有望成为肿瘤免疫治疗的新策略〔13,21〕。
本研究设计了一种基于MAGEA4抗原的长肽疫苗,该疫苗包含了已经鉴定过的CD8+T细胞表位。本研究证明P102-121和P280-294有很好的分泌IFN-γ及杀伤靶细胞的能力。当长肽被树突细胞加工时,其诱导T细胞分泌IFN-γ的能力增强。由于其长度不能直接与抗原结合槽结合,因此必须被抗原呈递细胞吞噬并加工。树突细胞在抗原加工中更有效。长肽疫苗具有多个表位,能诱导多克隆CD8+T细胞反应。此外,与短肽不同,长肽疫苗可以包含多个HLA等位基因的表位。因此,长肽疫苗适应大多数人群。除CD8+表位外,长肽疫苗还可以覆盖多种HLA等位基因的CD4+表位。同时诱导CD4+T细胞,有助于产生持久的CD8+T细胞反应。体外实验可能有利于放大现有的记忆T细胞反应,这将使免疫反应更快,并胜过幼稚T细胞的反应。在未来的研究中,可以考虑长肽和佐剂联合使用,以增强长肽触发的免疫反应。在肿瘤免疫治疗中,联合治疗经常会在临床上起到不错的效果,长肽疫苗的设计也可以包含来源于不同抗原的CD8+和CD4+T细胞表位,也可以针对不同的肿瘤设计独特的长肽疫苗,这些都是值得思考和探索的。

