CXCL8表达水平与非小细胞肺癌患者MVD及术后预后的关系
王志华 李叙 魏小东
(解放军联勤保障部队第904医院心胸外科,江苏 无锡 214000)
肺癌(LC)是世界上最常见的癌症之一〔1〕。据世界卫生组织预测,2025年后,我国每年将有超过百万的新增LC病例,抗癌形势严峻〔2〕。LC中约85%为非小细胞肺癌(NSCLC),主要细分为鳞状细胞癌和腺癌〔3〕。大多数NSCLC患者早期临床症状不明显,而确诊时已处于晚期,且因对其分子病理学的认识有限,缺乏可靠的早期检测生物标志物,预后较差〔4〕。血管生成几乎是全部实体恶性肿瘤发病机制的关键,并且肿瘤的侵袭和转移与其血管形成密切相关〔5〕。肿瘤微环境中存在着多种血管生成因子可调控肿瘤血管生成,故研究抗肿瘤血管形成的方法有望成为治疗肿瘤的新策略,而迄今为止,许多血管生成因子已被证实由肿瘤细胞产生,其中,CXC趋化因子配体(CXCL)8作为一种重要的多功能细胞因子,通过自分泌或旁分泌的方式调节肿瘤细胞增殖、侵袭和迁移〔6,7〕。研究表明,CXCL8表达增加,能够加速肿瘤生长、血管生成和侵袭〔8〕;其过度表达对肺腺癌的发生及发展都会产生重要影响〔9〕。然而,关于CXCL8与NSCLC血管生成关系的研究并不多见。本研究探讨CXCL8表达与NSCLC患者血管生成及预后的关系。
1 对象和方法
1.1研究对象 选择2012年1月至2015年6月在解放军联勤保障部队第904医院进行手术治疗NSCLC患者为研究对象,收集其病理标本及病理资料。纳入标准:(1)依据国际抗癌联盟的TNM分期标准(第七版)对NSCLC进行分期〔10〕;(2)患者术前未进行抗肿瘤治疗;(3)病例随访资料完整,未出现失访。共有87例NSCLC患者入组,其中男51例,女36例,平均年龄(66.47±16.38)岁;TNM分期:Ⅰ期31例(35.63%),Ⅱ期26例(29.89%),Ⅲ期30例(34.48%);肿瘤高分化24例(27.59%),中分化41例(47.13%),其他22例(25.29%)为低分化。截至2020年12月31日,33例患者存活,其他54例均因肿瘤转移或复发而死亡。
1.2免疫组化法检测CXCL8〔11〕将癌旁和癌症组织的蜡块制成石蜡切片,厚度为4 μm,65℃条件下加热2 h后制备涂胶白片;对石蜡切片进行脱蜡脱苯处理,之后采用乙二胺四乙酸(EDTA)修复抗原;之后用过氧化氢溶液浸泡15 min,以使内源性过氧化物酶失活,用磷酸盐缓冲液(PBS)冲洗3次,3 min/次,但不能直接冲刷组织;山羊血清封闭,滴加一抗后,于4℃条件孵育过夜;用PBS再次洗涤,滴加生物素化二抗孵育,所有切片在室温下用二氨基联苯胺(DAB)显色液处理约5 min,再次用PBS洗涤后,用苏木素进行复染;最后脱水处理,封片,显微镜阅片并拍照。
1.3CXCL8表达〔12〕每张切片以细胞染色强度及染色比例作为评分标准,并由至少2名病理学领域专家进行评分,评判结果一致则接受,否则重新判片。(1)染色强度评分标准:无染色为0分,弱染色(淡黄色)为1分,中等染色(棕黄色)为2分,强染色(棕褐色)为3分。(2)癌症细胞比例评分标准:阳性细胞<10%为0分,10%~25%为1分,>25%且≤50%为2分,>50%且≤75%为3分,>75%为4分。最后以染色强度评分和比例评分的乘积进行综合评价,分数介于0~12分,0~4分则判定为低表达(+),5~8分判定为中表达(),9~12分则为高表达()。
1.4微血管密度(MVD)计数〔13〕采用CD34对肿瘤组织微血管进行标记。首先,在低倍视野下找到3个生成最明显的区域;然后高倍视野下分别计数,取其平均值作为MVD计数结果。计数标准:(1)血管内皮细胞:阳性染色(棕黄色)为1个微血管;(2)内皮细胞簇:明显区别于邻近组织,之间无连接,为1个微血管;(3)排除肌层较厚、血管腔内超过8个红细胞的血管。
1.5统计学处理 采用SPSS25.0软件进行t检验、χ2检验、方差分析及Spearman相关性分析,应用Kaplan-Meier生存曲线分析CXCL8表达与NSCLC患者预后的关系。
2 结 果
2.1CXCL8表达 在癌症组织和癌旁组织中均可见CXCL8表达,且主要表达于细胞质内,在细胞核内有少量表达,呈棕褐色。见图1。87例标本中,癌症组织中共53例(60.92%)CXCL8阳性表达;而癌旁组织中有38例(43.68%)阳性表达,二者具有统计学差异(χ2=5.183,P=0.023)。
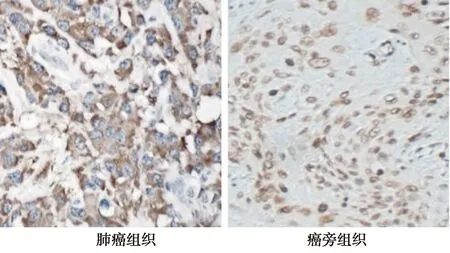
图1 肺癌组织和癌旁组织CXCL8表达免疫组化(×20)
2.2CXCL8表达与病理参数的关系 在癌症组织中,CXCL8阳性表达与肿瘤分化程度、淋巴结发生转移及TNM分期明显相关(P<0.05),而患者性别、年龄和肿瘤直径对其表达无明显影响(P>0.05)。见表1。
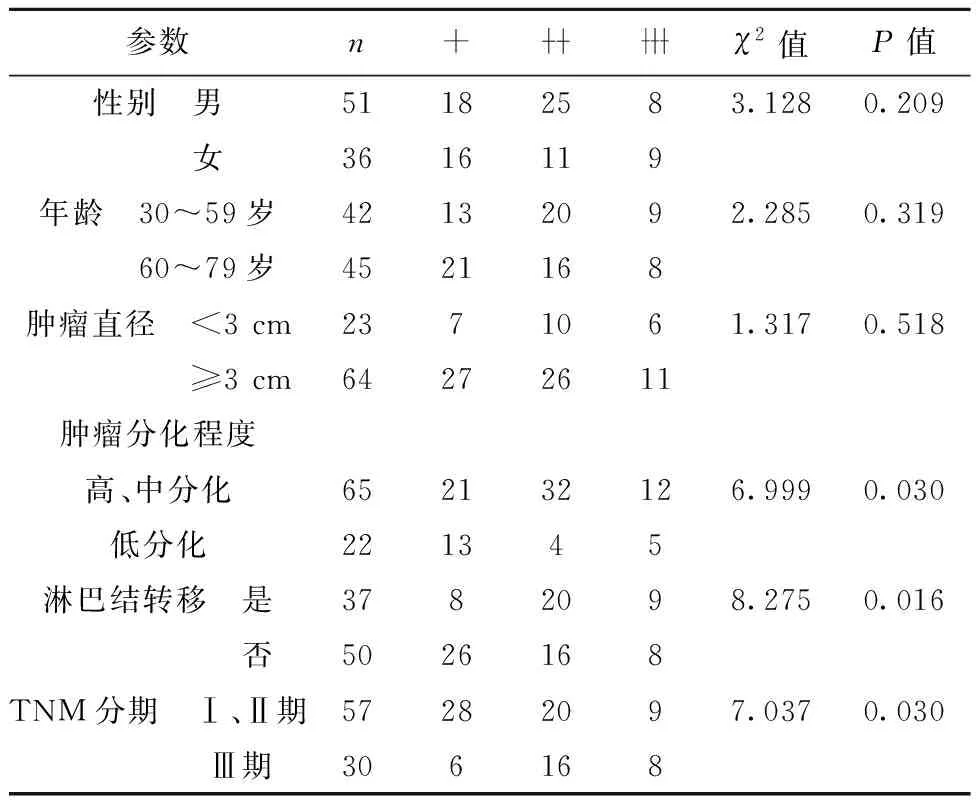
表1 CXCL8阳性表达与NSCLC患者病理参数的关系(n)
2.3MVD计数与病理参数的关系 CD34在血管内皮细胞中高表达,肿瘤新生血管主要位于肿瘤间质中;肿瘤直径、分化程度、淋巴结转移及TNM分期对MVD计数具有显著影响(P<0.05),表现为肿瘤越大、分化越高、发生淋巴结转移及TNM分期越高,MVD计数越多;而患者性别和年龄对MVD计数无显著影响(P>0.05)。见图2、表2。

表2 MVD计数与病理参数的关系
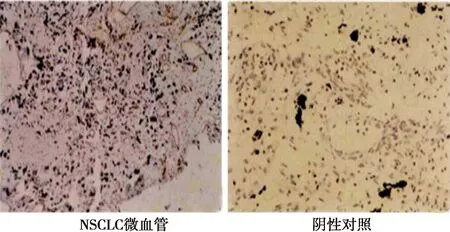
图2 CD34蛋白标记的MVD(HE染色,×200)
2.4CXCL8表达与MVD关系 癌症组织中CXCL8阳性表达患者的MVD计数〔(39.97±12.51)个〕显著高于阴性表达患者〔(31.95±9.48)个;P<0.05〕;相关性分析显示,CXCL8表达与MVD计数呈正相关(r=0.563,P<0.001)。
2.5患者生存分析 Kaplan-Meier生存曲线进一步评估CXCL8表达与NSCLC患者生存时间的关系。结果表明CXCL8阳性表达患者的生存率低于阴性表达患者,即CXCL8阳性表达患者预后较差。见图3。
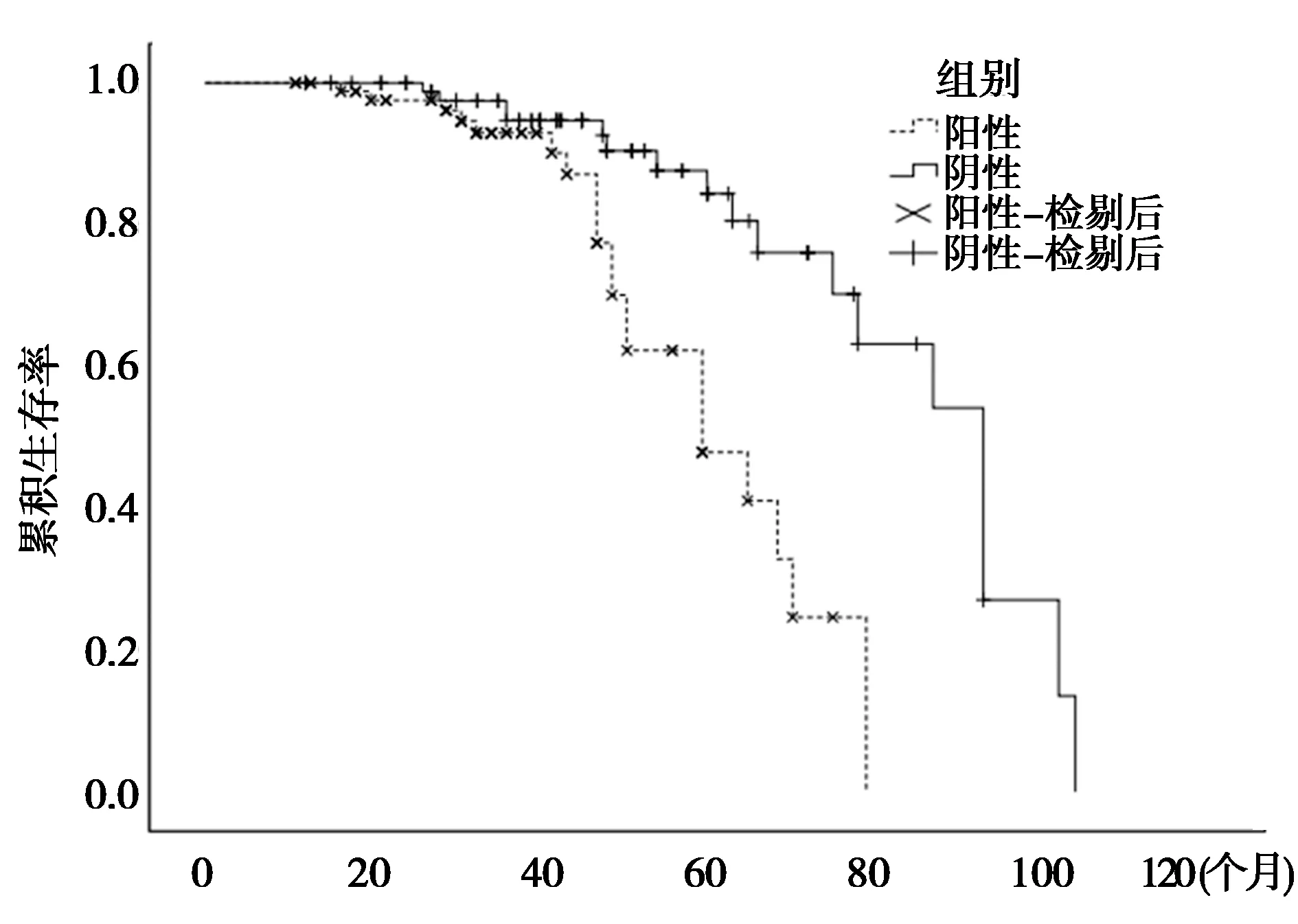
图3 CXCL8表达与NSCLC患者预后的关系
2.6COX回归分析 以NSCLC患者是否存活为因变量,自变量包括CXCL8表达(阳性=1,阴性=0)、性别(男=1,女=0)、年龄(60~79岁=1,30~59岁=0)、肿瘤直径(≥3 cm =1,<3 cm =0)、肿瘤分化程度(高、中分化=1,低分化=0)、淋巴结转移(是=1,否=0)及TNM分期(Ⅲ期=1,Ⅰ、Ⅱ期=0),进行COX回归分析,结果CXCL8阳性表达、肿瘤高、中分化、淋巴结转移、TNM分期均是影响NSCLC患者预后的独立危险因素。见表3。
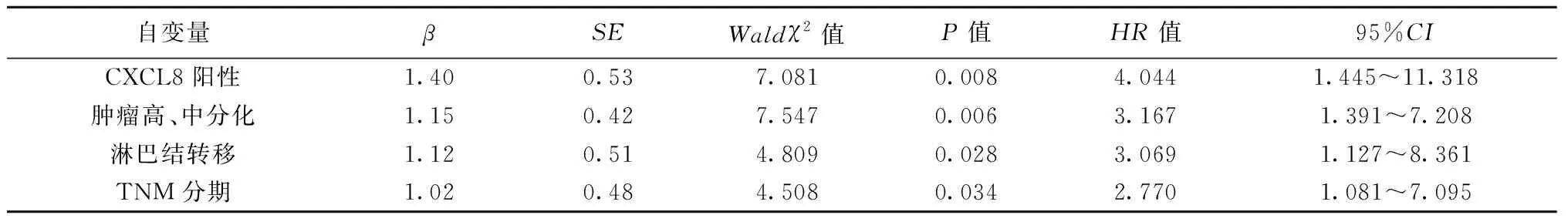
表3 COX回归分析
3 讨 论
尽管放疗、化疗及手术治疗等多种手段用于NSCLC,然而,肺癌的5年生存率仅为60%~80%,总体预后较差,因为多数LC患者在确诊时已是局部晚期或病灶转移〔14〕。因此,寻找新的治疗靶标对于LC预后改善及其生存率提高均意义重大。肿瘤的生长和转移受到一系列生物学行为的影响,包括癌症细胞的迁移、微血管形成及与肿瘤微环境间的相互作用等;趋化因子被认为是这些生物学过程中的主要调节因子,是一类分泌到血液循环中的蛋白质,通过与靶细胞上的受体结合发挥作用,介导与细胞归巢和迁移相关的许多生理和病理过程,肿瘤细胞上趋化因子受体的过度表达可能促进肿瘤的侵袭和转移〔15〕。
CXC趋化因子分为ELR(+)和ELR(-)两个亚组,发挥着不同的功能作用;人类有7种ELR(+)趋化因子,而CXCL8是其中最突出的成员。CXCL8与细胞表面糖胺聚糖(GAG)结合并通过激活两个G蛋白偶联受体(GPCR)CXCR1和CXCR2来调节其功能〔16〕。其对多种已知的免疫细胞具有趋化性,在血管生成、伤口愈合和炎症等方面起重要作用〔17〕。研究可知,CXCL8的异常表达与慢性阻塞性肺疾病、人类阻塞性胰腺炎、银屑病、类风湿关节炎、囊性纤维化和许多癌症等病理状态有关〔18〕。CXCL8是最常见的促炎因子,而炎症反应失控会加速肿瘤发生;肿瘤细胞增殖和转移是影响该类患者预后及术后复发的关键因素,而CXCL8与肿瘤细胞的增殖和转移关系密切〔19〕,可见CXCL8在多种癌症的发生和发展过程中起重要作用。
关于NSCLC中CXCL8的表达目前仍存在一定争议。杨正斌等〔20〕通过免疫组化法检测到CXCL8在LC患者癌症组织及癌旁组织中的表达并无显著差别;Cury等〔21〕则发现,NSCLC组织中CXCL8高表达与预后不良有关;邬志勇等〔22〕研究认为CXCL8对肿瘤的作用可能具有双面性,可能还存在一定的抗肿瘤作用,至于在患者体内哪个为主导,有待进一步研究予以确认。本研究结果说明,CXCL8在癌症组织中高表达,这与Cury等〔21〕研究结论相符。本研究结果提示,CXCL8的表达与NSCLC进展有关,这可能与其促肿瘤血管生成脱不开关系。
血管生成是指由现有血管中生成新的血管,是由多种促血管生成和抗血管生成因子的复杂相互作用决定的;血管生成是肿瘤生长超过1~2 mm直径的先决条件,当肿瘤细胞不能再通过简单的扩散提供氧气和营养时,为了增大肿瘤的体积,肿瘤经历了血管生成开关,促血管生成因子的作用导致血管生成和肿瘤生长。肿瘤血管形状不规则,分支不规则,基底膜断裂,使其通透肿瘤细胞,从而发生转移,故肿瘤的发展离不开血管生成〔23〕。在这种情况下,MVD作为新生血管的直接表达及肿瘤血管的浸润被认为是许多肿瘤,特别是肺癌的危险进展的标志〔24〕。本研究结果提示,NSCLC形成新的血管后,可能促进其肿瘤增大及分化,进一步发生恶化,发生淋巴结转移,影响预后。
本研究结果提示,CXCL8与肿瘤血管微血管形成有关。可能是NSCLC组织通过分泌通过CXCL8,加速其与受体CXCR1和CXCR2结合,直接诱导肿瘤内皮细胞增殖,进而加速微血管生成并使肿瘤细胞发生转移,疾病更加恶化,影响患者预后〔25〕。Kaplan-Meier生存曲线结果提示,CXCL8阳性表达患者预后较差;COX回归分析也证实,除肿瘤高、中分化、淋巴结转移、TNM分期等因素外,CXCL8阳性表达也是NSCLC预后不良的独立危险因素,验证了以上结论。
综上,CXCL8在NSCLC组织中的阳性表达与NSCLC患者MVD计数、病理参数及预后密切相关,可能通过促进微血管的生成而影响NSCLC进程,提示临床可通过检测CXCL8表达用于NSCLC诊疗。但是,癌症的发病机制复杂,CXCL8表达对NSCLC预后的实际影响,仍需更加深入的研究予以证实。

