流式细胞术检测NK细胞的细胞毒作用的两种方法比较①
蔡思齐 邓志辉
(南方医科大学检验与生物技术学院输血医学系,广州510515)
自然杀伤细胞(Natural killer cell,NK cell)是机体天然免疫系统的重要组成部分,与抗病毒免疫、移植免疫、自身免疫疾病及肿瘤免疫密切相关。在多种细胞因子(如IL-2、IL-15等)、饲养细胞(Feeder cells)的作用下,NK细胞可发生增殖和活化,分泌细胞因子和增强细胞毒功能。目前,NK细胞免疫治疗已成为细胞免疫治疗的重要方法,准确评价NK细胞的细胞毒活性,对评估病患免疫水平及细胞免疫治疗效果具有重要意义。
检测外周血或体外培养NK细胞介导的细胞毒效应,是评估NK细胞活性的主要方法,也是了解NK细胞功能最直接的方法。目前NK细胞活性检测的主要方法有:“金标准”51Cr释放法、LDH释放法、MTT法等。这些方法或存在放射性污染,或易受实验条件、操作者熟练程度干扰,重复性差;或者无法区分靶细胞和效应细胞死亡,不能很好地反映NK细胞的细胞毒功能水平。本文在已有方法的基础上,采用流式细胞术比较钙黄绿素乙酰甲酯(Calcein-AM)释放法,及羧基荧光素二醋酸盐琥珀酰亚胺酯/7-氨基-放线菌素 D(CFSE/7-AAD)双染色法检测体外培养后的NK细胞对K562细胞及白血病原始细胞的细胞毒活性,并对检测结果进行分析,为NK细胞毒活性检测提供一种较为稳定可靠、重复性好、灵敏度高的方法。
1 材料与方法
1.1材料
1.1.1样本来源 K562细胞株(深圳市汉科生物工程有限公司张明杰教授赠送),白血病原始细胞留取自在深圳市血液中心进行骨髓移植HLA配型的白血病患者,NK细胞采自健康志愿献血者。按知情同意原则,所有研究对象均签署知情同意书。
1.1.2主要试剂和仪器 X-vivo15培养液(瑞士Lonza公司),RPMI1640完全培养液(美国Gibco公司),人外周血淋巴细胞分离液[生工生物工程(上海)股份有限公司],抗人 CD56、CD3抗体(美国BD Pharmingen公司),HANK细胞体外培养试剂盒(深圳汉科生物工程有限公司),Calcein-AM(美国Thermo Fisher公司),CFSE、7-AAD(美国BD Pharmingen公司),恒温二氧化碳培养箱HF240(上海力申科学仪器厂),TDL-400低速台式大容量离心机(上海安亭科学仪器厂),BD ACCURI C6流式细胞仪(美国BD Pharmingen公司)。
1.2方法
1.2.1外周血单个核细胞分离与NK细胞培养 采集7名健康志愿献血者静脉血10 ml/人份,密度梯度离心分离外周血单个核细胞(PBMC),用X-vivo15培养液重悬细胞,调整细胞密度为(1~2)×106ml-1,于37.5℃、5% CO2培养箱中平置培养13~14 d(HANK细胞体外培养试剂盒,按说明书使用)。使用抗人CD56、CD3抗体在BD ACCURI C6流式细胞仪上测定NK细胞(CD3-CD56+)含量。
1.2.2白血病原始细胞的分离与处理 4例初诊、未经治疗的白血病患者的骨髓样本,采用人外周血淋巴细胞分离液分离获得白血病原始细胞,液氮保存备用。
1.2.3两种方法检测7例NK细胞对不同靶细胞的细胞毒作用
1.2.3.1Calcein-AM释放法检测NK细胞毒作用 取培养13~14 d的NK细胞及靶细胞,洗涤去除培养液,RPMI1640培养液调整NK细胞密度,备用。
Calcein-AM标记靶细胞:取PBS以24℃、300 g离心10 min,洗涤细胞2次,调整细胞密度为1×107ml-1;加入终浓度为5 μmol/L的Calcein-AM,混匀,置于25℃、避光处孵育30 min。取出细胞,用RPMI1640完全培养液充分洗涤,并调整靶细胞密度为4×105ml-1,备用。
效-靶细胞共培养:将处理好的效应细胞与靶细胞按不同的效靶比(20∶1、10∶1)加入U形底96孔培养板中,在25℃下100 g离心1 min使细胞密切接触。5%CO237℃培养箱,共培养4 h。设置仅NK细胞或仅靶细胞孔作为阴性对照,计算自然死亡率。
Calcein-AM释放法靶细胞死亡率检测:收集96孔细胞培养板中的细胞,PBS液洗涤细胞并重悬细胞。首先根据FSC和SSC确定靶细胞群,在FL-1通道,记录共培养前后靶细胞MFI(Mean fluorescence intensity)值(MFI自发荧光、MFI标记),再记录效靶细胞群及阴性对照在共培养后的MFI(MFI共培养、MFI对照);计算共培养后MFI变化值占初始荧光强度的比例,再扣除自然死亡率,即为靶细胞死亡率[1]。计算公式为:靶细胞死亡率=(MFI共培养-MFI自发荧光)/(MFI标记-MFI自发)-(MFI对照-MFI自发荧光)/(MFI标记-MFI自发)。
1.2.3.2CFSE/7-AAD双染法检测NK细胞毒作用 NK细胞准备同步骤1.2.3.1。CFSE/7-AAD法标记靶细胞:用DPBS液洗涤细胞2次,调整细胞数量为1×107个/ml。加入CFSE(美国BD Pharmin-gen公司),终浓度为2.5 μmol/L,混匀后置于37℃水浴箱中,避光孵育10 min。取出细胞,用含有10%FBS的冷 RPMI1640充分洗涤。RPMI1640完全培养液重悬细胞,调整靶细胞密度为4×105ml-1,备用。效靶细胞培养及阴性对照设置同步骤1.2.3.1。
CFSE/7-AAD法靶细胞死亡率检测:收集96孔细胞培养板中的细胞,PBS液洗涤细胞2次,重悬细胞,加入4 μl 7-AAD标记死亡细胞,混匀,室温避光孵育20~25 min。PBS液洗涤1次。根据FSC和SSC确定靶细胞群,对CFSE+细胞进行设门,分析该细胞群中 CFSE+/7-AAD+双阳性细胞所占比率即为靶细胞死亡率。计算公式:靶细胞死亡率=杀伤后靶细胞死亡率-靶细胞自然死亡率。
1.3统计学处理 采用SPSS22.0对实验结果进行独立样本t检验分析,方差不齐时使用Cochran&Cox近似t检验(t′检验)。P<0.05为差异具有统计学意义。
2 结果
2.1NK细胞培养结果 初始培养时NK细胞占PBMC的比例仅为(11.76±3.55)%,自第5天开始增加,至培养第13天,NK细胞比例增至(83.65±3.18)%(表1)。对培养过程中的NK细胞比例变化进行线性回归分析,决定系数R2=0.928,经F检验P=0.000 5,差异具有统计学意义;回归系数b=0.644,对b进行t检验,P=0.000 5,NK细胞纯度与培养时间存在直线关系,随着培养时间的增加,其NK细胞比例随之增加。
2.2Calcein-AM及CFSE对靶细胞的标记结果 在前述工作浓度下,Calcein-AM及CFSE均能对密度为1×107ml-1的靶细胞进行有效标记,二者对靶细胞的标记率均可达99%以上。在FL-1通道上能够显著地与NK细胞的自发荧光峰进行区分(图1)。
2.3培养第13天的NK细胞对靶细胞的细胞毒活性 NK细胞对K562细胞的细胞毒活性(表2):在对K562细胞的杀伤中,随着效靶比的增高,两种方法检出NK细胞的细胞毒活性均增高。但在效靶比20∶1时,CFSE/7-AAD法检出的靶细胞死亡率高于Calcein-AM释放法(图2),但差异无统计学意义(P>0.05);在效靶比10∶1时,NK的细胞毒作用减弱,CFSE/7-AAD法(图3A~C)所检测出的细胞毒性高于Calcein-AM释放法(图2A~D),差异具有统计学意义(P<0.05)。
NK细胞对白血病原始细胞的细胞毒活性(见表2):本文从4名白血病患者中分离的白血病原始细胞占有核细胞的比例为(91.00±1.83)%。在对白血病原始细胞的杀伤实验中,CFSE/7-AAD检出的细胞毒性显著高于Calcein-AM释放法(P<0.05)。 在对3、4号患者白血病原始细胞的实验中,NK细胞的细胞毒作用弱,Calcein-AM释放法中FL-1上MFI改变不显著,尽管能够计算靶细胞死亡率,但结果不准确、误差大(图2E~H),而CFSE/7-AAD能够灵敏地检出较弱的细胞毒作用(图3D~F),与Calcein-AM法比较,差异具有统计学意义(P<0.05)。两种方法所检测的各组靶细胞自然死亡率差异不具有统计学意义(P=0.45,P=0.81)。
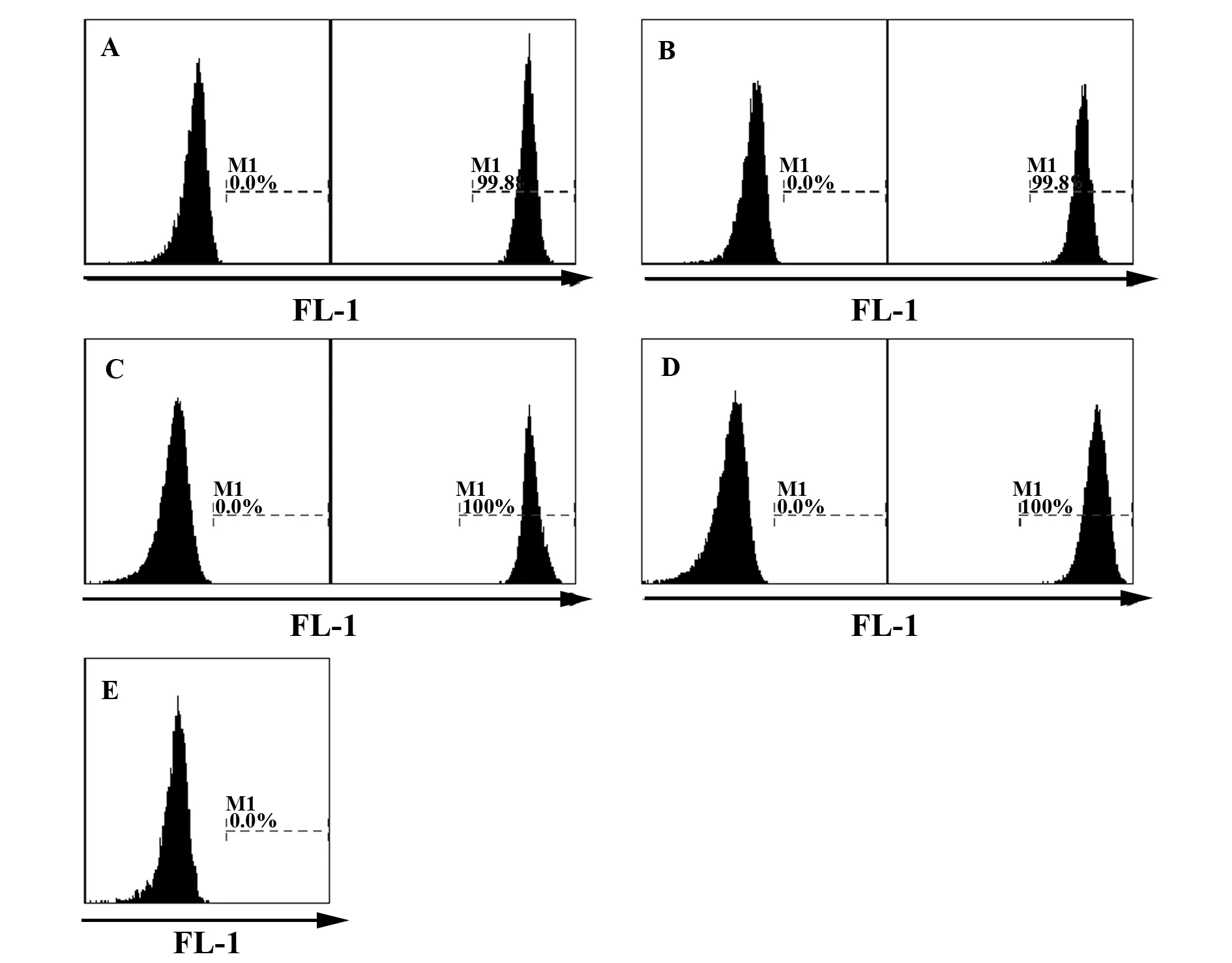
图1 靶细胞经Calcein-AM或CFSE标记前后FL-1通道上荧光强度变化及NK细胞自发荧光
表1NK细胞体外培养的纯度变化(n=7)
Tab.1PurityofNKcellsduringvitroexpansion(n=7)

Duration of NK cells vitro expansion0 d3 d5 d7 d9 d11 d13 dParameters of linear regressionbPPurity of NK cells(%,x±s)11.76±3.556.22±2.8926.05±5.5638.40±7.5761.20±10.3573.91±6.7083.65±3.180.6440.0005


Target cellsDiagnosisK562-1#ALL2#AML3#AML4#AML10∶1Calcein-AM44.29±9.189.50±3.5014.16±6.552.07±0.692.96±1.81CFSE/7-AAD55.59±5.2528.22±5.4331.67±5.015.72±1.3111.59±4.63P-value0.010.000 010.000 10.000 30.000 220∶1Calcein-AM55.40±11.4023.16±4.8122.32±5.903.44±0.954.65±2.24CFSE/7-AAD61.14±7.6633.66±3.5237.30±2.409.69±2.5514.63±4.46P-value0.200.00 10.000 040.000 10.001

图2 Calcein-AM 法释放法检测NK细胞对K562细胞和白血病原始细胞的细胞毒作用
Note:1#,2#,3#,4# represent the leukemia blast isolated from 4 different leukemic patients at diagnosis.
3 讨论
本文中,随机健康献血者外周血PBMC中NK细胞含量仅有(11.76±3.55)%。其他针对不同地区中国人群外周血NK细胞含量的研究表明,随机人群外周血PBMC中NK细胞含量仅有(7.35~15.21)%[2-4]。本文对PBMC进行扩增,可获得纯度较高的NK细胞群,既满足本实验对细胞数量的要求,也可避免大量采血,减少对患者的负担。
Calcein-AM被用于真核细胞活力测定、细胞示踪,近年有文献报道将其用于细胞毒作用检测,能够替代51Cr释放法,重复性好、操作简便且更加精确[5-7]。 Calcein-AM能够透过细胞膜,在酯酶水解作用下产生Calcein并发出荧光。由于凋亡细胞和死细胞的细胞膜被破坏,Calcein释放,细胞群荧光强度减弱,MFI减低,因而能用于细胞毒作用的检测。但Calcein-AM释放法原理与51Cr释放法相似,因此存在一些51Cr释放法的缺陷。51Cr释放法及Calcein-AM都是基于整体水平的检测,无法检出单细胞水平的杀伤。并且二者标记细胞都依赖于细胞质的作用,难以标记一些细胞质含量少的细胞,如Daudi细胞和Raji细胞,且从细胞死亡至标记物从释放有时间差[8]。前述因素导致了51Cr释放法及Calcein-AM的适用范围受到限制、灵敏度降低。
CFSE广泛地用于细胞示踪和细胞增殖研究,同时也用于细胞毒活性的测定[9-11]。CFSE能够穿过完整的细胞膜,在胞内产生羧基荧光素分子,发出荧光。因此CFSE能够非特异性地标记整群活细胞,不需要依赖特异性抗原-抗体反应,适用的靶细胞范围广,且在细胞中荧光维持时间长、不易衰减。7-AAD是一种核酸染料,正常情况下,它不能通过正常细胞膜。随着细胞凋亡、死亡,细胞膜对7-AAD的通透性逐渐增加,使之结合细胞凋亡中的DNA,在合适波长激发光的激发下发出明亮的红色荧光。且7-AAD具有发射波谱较窄,对其他检测通道的干扰小的特点,适于多色荧光分析。CFSE及7-AAD二者联合使用,能够在单细胞水平上检测效应细胞的死亡率,实验灵敏度高,稳定性好。
在两种方法对靶细胞标记上,Calcein-AM及CFSE均能非特异性地快速标记靶细胞,对靶细胞的标记率高,荧光强度强,在FL-1通道上能显著地与效应细胞区分。在检出NK细胞对不同靶细胞的细胞毒作用实验中,靶细胞死亡率随着效靶比的增加而升高。但CFSE法检出在不同效靶比、不同靶细胞的死亡率高于Calcein-AM释放法。
在对K562细胞的实验中,20∶1的效靶比下,Calcein-AM与CFSE法检出的死亡率分别为(55.40±11.40)%和(61.14±7.66)%,CFSE法检出率高于前者,差异不具有统计学意义(P=0.20);但在10∶1组中,二者检出的死亡率则为(44.29± 9.18)%和(55.59±5.25)%,差异具有统计学意义(P=0.01),CFSE/7-AAD法较为敏感。
HLA Ⅰ 类抗原与NK细胞表面的杀伤细胞免疫球蛋白样受体(Killer cell immunoglobulin-like receptor,KIR)分子相配位,共同调节NK细胞的活性。由于K562细胞缺乏与KIR相配位的HLA Ⅰ类抗原表达[12,13],KIR分子对NK细胞的抑制作用完全被解除,NK细胞被激活。文献报道从白血病患者体内新分离的白血病原始细胞表面的HLA Ⅰ类抗原选择性下调[14,15],NK细胞的抑制作用部分解除。因此NK细胞对K562细胞株的细胞毒作用较强,而对白血病原始细胞的细胞毒作用则受HLA Ⅰ类抗原下调水平的影响,不同程度地减弱。本实验中,两种方法所检出的NK细胞对不同白血病原始细胞的细胞毒作用,均较K562弱。在检测4株不同患者来源的白血病原始细胞中,CFSE法在10∶1和20∶1的效靶比下,检出的靶细胞死亡率均高于Calcein-AM释放法,各组中差异均具有统计学意义 (P<0.05),详见表2。但在细胞死亡率较低时,Calcein-AM释放法的MFI变化微弱,不能准确地计算出相对变化值,对靶细胞死亡率的计算不准确。但CFSE法则可以通过对实验细胞群中对CFSE+7/AAD+细胞进行分析,直观的呈现靶细胞死亡率,不依赖MFI变化。
以往研究者报道的靶细胞标记方法,如:张嘉等[16,17]对靶细胞进行增强荧光蛋白(Enhanced Green Fluorescent Protein,EGFP)标记,借由EGFP在FL-1通道的荧光来区别靶细胞与效应细胞。但该法需要预先对细胞进行转染,使靶细胞携带有EGFP基因,进而表达荧光蛋白。此法延长了实验周期,对于新分离的白血病原始幼稚细胞而言,体外培养则可能引发表型改变,与患者体内的白血病原始幼稚细胞存在差异。Ozdemir等[18]利用K562白血病原始幼稚细胞系表达CD33这一细胞表面抗原,使用抗CD33特异性荧光抗体对靶细胞进行标记,进而在CD33+细胞群中分析靶细胞死亡率。但对于一些不表达细胞表面特异性标志物的肿瘤细胞,抗体标记法并不适用;且抗体标记法的标记强度取决于靶细胞表面抗原表达密度,标记某些在细胞表面表达较少的特异性抗原时,则难以很好地标记靶细胞。
综上所述,本文比较了Calcein-AM释放法及CFSE/7-AAD双染色法,在不同效靶比分别对K562细胞株和不同患者来源的白血病原始细胞进行了细胞毒实验结果。两种染色方法均能对不同的靶细胞进行有效标记和区分;在较高的效靶比和较强的细胞毒作用(如:对K562细胞)下,两种方法对靶细胞死亡率检出的差异不具有统计学意义;但在细胞毒作用较弱的情况下,CFSE/7-AAD双染法检测白血病原始细胞的死亡率优于Calcein-AM单染法,具有重复性好、操作简便、灵敏度高等特点。